Duálně působící antidepresiva
Článek nejprve krátce uvádí historii vývoje antidepresiv. Duálně působící antidepresiva jsou relativně novou skupinou. Patří k nim inhibitory zpětného vychytávání serotoninu a noradrenalinu (SNRI), tj. venlafaxin, milnacipran a duloxetin. Jsou uvedeny jejich farmakodynamické vlastnosti, farmakokinetika, účinnost a profil vedlejších účinků. SNRI jsou srovnány s nejčastěji předepisovanými antidepresivy, selektivními inhibitory zpětného vychytávání serotoninu (SSRI). SNRI vedou v léčbě depresivní poruchy častěji než SSRI k remisi, jsou účinnější u závažných depresí a některé studie naznačují i rychlejší nástup účinku. Jejich snášenlivost je podobná jako v případě SSRI. Jsou uvedeny i další indikace SNRI, tj. prolomení farmakorezistence, úzkostné poruchy, bolestivé syndromy včetně bolesti v rámci depresivní poruchy a léčba deprese u somatických onemocnění. Krátce je zmíněno další duální antidepresivum mirtazapin, zástupce skupiny noradrenergních a specifických serotoninergních antidepresiv (NaSSA), pro něž platí ve srovnání se SSRI v podstatě totéž co pro SNRI.
Náhodný objev antidepresiv (AD) znamenal nejen nesmírný pokrok v léčbě, ale také podnět pro výzkum možných příčin depresivní poruchy. Byla formulována monoaminová hypotéza deprese, která přes řadu sofistikovaných změn zůstala základem pro vývoj dalších AD. Dostupnost nových, specifických a bezpečnějších AD vedla k přesunu diagnostiky a léčby deprese do ambulantní péče a na úroveň lékařů prvního kontaktu. Deprese se stala společensky akceptovatelnou chorobou.
Poněkud zjednodušeně lze říci, pomineme-li inhibitory monoaminooxidázy (IMAO), že AD zvyšují dostupnost základních monoaminů dvěma způsoby – inhibicí jejich zpětného vychytávání a modifikací příslušných receptorů. Selektivní inhibitory zpětného vychytávání serotoninu, noradrenalinu a/nebo dopaminu nebo obou uvedených látek (duální AD) mají velký význam teoretický i praktický. Jednotlivým neurotransmiterům se přičítá poněkud rozdílná funkce, a proto specifická AD umožňují cílenou léčbu deprese dle klinického obrazu a cílené ovlivnění reziduálních příznaků.
Podnětem pro vývoj duálních AD byly údaje o vyšší účinnosti kombinace serotonergně a noradrenergně působících AD, konkrétně fluoxetinu a desipraminu, ve srovnání s monoterapií a údaje o vyšší účinnosti klomipraminu než paroxetinu a citalopramu u závažných depresí [1, 2]. Od počátku 90. let, kdy vstoupila do klinické praxe první duální AD, bylo publikováno velké množství prací zabývajících se různými aspekty této nové skupiny AD. Přehledové práce o problematice duálních AD byly publikovány i v české odborné literatuře [3, 4].
Inhibitory zpětného vychytávání serotoninu a noradrenalinu (SNRI)
Prezentují relativně novou třídou AD. Bazálním mechanismem účinku je inhibice zpětného vychytávání serotoninu (5-HT) a noradrenalinu (NA), odtud název SNRI (serotonin and noradrenaline reuptake inhibitors, inhibitory zpětného vychytávání serotoninu a noradrenalinu). Patří sem venlafaxin, první dostupné léčivo z této nové skupiny, milnacipran a duloxetin. Čtvrtý SNRI, sibutramin, byl exkluzivně vyvinut pro léčbu obezity [5].
Farmakodynamika
Venlafaxin, milnacipran a duloxetin se liší v selektivitě zpětného vychytávání 5-HT a NA [6]. SNRI nevykazují žádnou nebo vykazují jen minimální afinitu k muskarinovým, histaminovým a a-adrenergním receptorům, a nemají proto řadu vedlejších účinků, které jsou limitujícím faktorem u nemocných léčených tricyklickými antidepresivy (TCA) nebo inhibitory monoaminooxidázy (IMAO).
In vitro má venlafaxin vysokou afinitu k 5-HT transportéru, milnacipran má dokonce vyšší afinitu k NA transportéru. Venlafaxin a duloxetin, na rozdíl od milnacipranu, mají nízkou afinitu k dopaminovému transportéru, což může být ve vyšších dávkách klinicky významné. Extracelulární hladiny monoaminů v mozku mohou být měřeny mikrodialýzou. Po podání SNRI bylo prokázáno zvýšení extracelulární koncentrace 5-HT a NA v různých oblastech mozku u různých animálních druhů. V lidském organismu inhibují SNRI vychytávání serotoninu v krevních destičkách a ovlivňují presorickou odpověď na tyramin (marker zpětného vychytávání NA) [5].
Pro klinickou praxi z těchto údajů vyplývá, že při léčbě venlafaxinem je při užití nižších dávek (přibližně do 150 mg denně) inhibice zpětného vychytávání 5-HT výraznější než NA; venlafaxin v nízkých dávkách působí obdobně jako SSRI. Milnacipran je naopak účinnějším inhibitorem zpětného vychytávání NA v jakékoli dávce, zatímco efekt duloxetinu je v tomto ohledu vyrovnanější.
Farmakokinetika
SNRI jsou po perorálním podání rychle absorbovány. Ve srovnání se SSRI mají relativně krátké vylučovací poločasy, v délce trvání od 4 hodin u venlafaxinu (vylučovací poločas jeho hlavního metabolitu O-desmethylvenlafaxinu, ODV, je 10 hodin), přes 8 hodin u milnacipranu do 12 hodin po podání duloxetinu. Po stabilizaci hladin jsou většinou podávány jednou denně. Aktivní metabolit venlafaxinu dosahuje 2–3krát vyšších hladin v krevní plazmě než mateřská látka [6]. U venlafaxinu a milnacipranu je nízká vazba na plazmatické proteiny. Udávaná rozmezí distribučního objemu jsou široká.
Většina psychotropních látek je metabolizována v játrech enzymatickým systémem cytochromu P-450. Kromě toho mohou AD některé z těchto enzymů inhibovat. Lékový metabolismus může být dále ovlivněn genetickým polymorfismem (pomalí a extenzivní, resp. ultrarychlí metabolizátoři). Genetická analýza důležitých metabolizačních enzymů je nyní dostupná v některých zemích včetně ČR [7].
Venlafaxin a duloxetin jsou metabolizovány izoenzymem CYP 2D6. Inhibice tohoto izoenzymu venlafaxinem je nižší než v případě některých SSRI, i když může být klinicky relevantní. Efekt duloxetinu je v tomto směru přibližně stejný jako u sertralinu. Pouze milnacipran je minimálně metabolizován a neinterferuje s cytochromem P-450, proto terapie tímto léčivem není provázena rizikem farmakokinetické lékové interakce [8].
Venlafaxin je kromě klasické formy dostupný v lékové formě s pozvolným uvolňováním (extended release form, ER). Potenciální výhody spočívají v prolongaci účinku a menší fluktuaci hladin. Toto může vést k lepší snášenlivosti a lepší compliance, což bylo potvrzeno ve dvojitě slepé placebem kontrolované studii [9].
Antidepresivní účinnost
Srovnání SNRI s ostatními antidepresivy
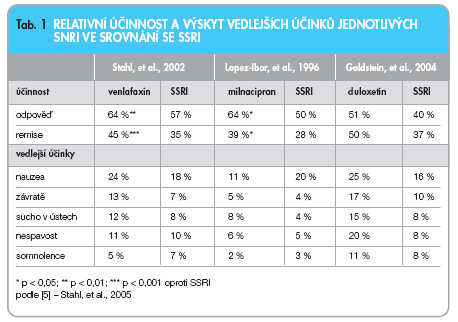
Duální AD mohou mít u některých pacientů vyšší účinnost než AD ovlivňující jeden neurotransmiterový systém díky komplementaritě serotonergního a nor-adrenergního systému. U všech byla prokázána v dávkách, které inhibovaly zpětné vychytávání obou neurotransmiterů, stejná účinnost jako u TCA; při srovnání se SSRI minimálně stejná, často však vyšší účinnost, zvláště u závažné deprese. Rozdíly nacházíme, zejména pokud hodnotíme dosažení remise, které je v současné době hlavním terapeutickým cílem. Léčba duálními AD vede k vyššímu výskytu remisí než terapie SSRI [8, 10, 11]. Nejvíce údajů máme k dispozici o léčbě venlafaxinem, který se používá v klinické praxi nejdelší dobu. I když některé jednotlivé studie neprokázaly superioritu SNRI [12, 13], většina metaanalýz a souhrnných prací ukazuje vyšší efekt SNRI. Částečně nesourodé údaje při srovnání s léčbou SSRI zřejmě souvisejí s heterogenitou souborů nemocných z hlediska závažnosti deprese, statutu nemocných (ambulantní versus hospitalizovaní pacienti), velikosti souborů a použitých dávek SNRI (viz tab. 1).
Z hlediska cílené aplikace je zajímavé, že na léčbu milnacipranem reagovali signifikantně lépe než na léčbu paroxetinem pacienti s výraznou bazální motorickou retardací [13].
Některé metodicky solidní studie naznačují i možnost rychlejšího nástupu účinku oproti placebu a některým TCA [14].
Vzájemné srovnání jednotlivých SNRI
Přímé srovnání jednotlivých látek ze skupiny SNRI nebylo zatím provedeno. V metaanalýze [15] publikovaných, randomizovaných, placebem kontrolovaných studií za období 1996–2005 (celkem 8 studií, téměř 1800 pacientů) byl výskyt remisí a opovědí na léčbu při podávání venlafaxinu o 17,8 % a 24,4 % vyšší, resp. o 14,2 % a 18,6 % u pacientů léčených duloxetinem než u těch, kterým bylo podáváno placebo. Vzhledem k nevyváženému počtu pacientů léčených jednotlivými alternativami nebyly rozdíly v účinnosti terapie venlafaxinem a duloxetinem statisticky signifikantní. V recentní systematické analýze [16] došli autoři k závěru, že venlafaxin vykazuje vyšší účinnost než duloxetin v léčbě závažné deprese.
Vedlejší účinky
Srovnání SNRI s ostatními antidepresivy
Nepřítomnost afinity k muskarinovým, histaminovým a a1-adrenergním receptorům limituje vedlejší účinky SNRI. Jsou obecně lépe snášeny než TCA (méně anticholinergních účinků) a tolerovány přibližně stejně dobře jako SSRI (viz tab. 1). Dosavadní údaje naznačují, že SNRI mají s výjimkou venlafaxinu méně sexuálních vedlejších účinků než SSRI [17].
Vzájemné srovnání jednotlivých SNRI
Obecně všechny SNRI mají obdobný profil vedlejších účinků. Venlafaxin je považován za nejhůře tolerovaný SNRI, v bezpečnostním profilu dominuje kombinace vysokého výskytu serotonergních vedlejších účinků (nauzea, sexuální dysfunkce, syndrom z odnětí) s výskytem hypertenze. Duloxetin a milnacipran jsou lépe tolerovány a jsou prosty kardiovaskulární toxicity.
Nejčastější je nauzea, vyskytuje se nepatrně častěji při užívání venlafaxinu a duloxetinu, méně v terapii milnacipranem, ale chybí přímé srovnání v ekvivalentních účinných dávkách. Podávání vyšších dávek venlafaxinu je spojeno se vzestupem diastolického krevního tlaku (incidence 2,2 % při podávání dávek do 200 mg/den a 5,1 % při podávání dávek vyšších). Při podávání milnacipranu se pouze dysurie vyskytovala významně častěji než při podávání TCA nebo SSRI [3, 18].
V poslední době se dostává do popředí zájmu kognitivní dysfunkce u depresivní poruchy. Ve dvojitě slepé, placebem kontrolované studii u 12 zdravých dobrovolníků neměla dávka 100 mg milnacipranu [19] vliv na řízení motorového vozidla a opakované podání milnacipranu nemělo ve srovnání s placebem žádný vliv na kognitivní funkce dobrovolníků [20].
Fatální případy byly popsány při úmyslné i neúmyslné intoxikaci venlafaxinem, samotným i v kombinaci s jinými léčivy, často po projevech serotoninového syndromu [5].
Nové indikace
Prolomení farmakorezistence
Farmakorezistence je v terapii deprese závažným problémem. Nejčastěji se setkáváme s nemocnými, kteří byli neúspěšně léčeni SSRI. Pokud volíme změnu AD, nabízí se kromě převedení na další SSRI a AD s jiným mechanismem účinku záměna za AD s širším mechanismem účinku. K těmto lze řadit klasická TCA a duální AD. Převedení na léčbu SNRI je úspěšné u 30–60 % léčených [21].
Úzkostné poruchy
SNRI jsou úspěšné v léčbě celého spektra úzkostných poruch, efekt je srovnatelný se SSRI. V této indikaci se opět uskutečnilo nejvíce studií s venlafaxinem; jako dostačující se jeví dávka 150 mg denně [22]. Nejčastějším aktivním komparátorem byl paroxetin. Byla publikována řada kontrolovaných studií s venlafaxinem v léčbě generalizované úzkostné poruchy, sociální úzkosti (sociální úzkostné poruchy), panické poruchy a obsedantně-kompulzivní poruchy [22–25].
Bolest (včetně bolesti v rámci depresivní symptomatologie)
Pro analgetický efekt je důležitý 5-HT i NA, proto jsou SNRI v této indikaci účinné. Ve dvojitě slepých kontrolovaných studiích byl venlafaxin v terapii neuropatické bolesti různého původu účinnější než placebo [26–28] a stejně účinný jako imipramin [28]. Venlafaxin také signifikantně lépe než SSRI ovlivnil tělesné příznaky spojené s depresí včetně různých vágních, špatně lokalizovaných bolestí [29]. V léčbě fibromyalgie byl signifikantně úspěšnější ve srovnání s placebem milnacipran [30] i duloxetin [31]. Duloxetin se ukázal jako účinné léčivo v terapii diabetické neuropatické bolesti [32, 33] a jeho použití v této indikaci je v ČR již schváleno. Také se úspěšně uplatňuje v léčbě stresové močové inkontinence (zvyšuje kvalitu života nemocných [34]), zřejmě proto, že vede ke zvýšené aktivaci uretrálního sfinkteru [35].
Deprese u somatických onemocnění
Je obecně akceptováno, že SSRI jsou pro svoji dobrou snášenlivost a bezpečnost preferovanými AD při depresi doprovázející somatická onemocnění. Ukazuje se, že SNRI budou další vítanou alternativou [36].
Noradrenergní a specifická serotoninergní antidepresiva (NaSSA)
K duálním AD řadíme dále mirtazapin. Je zatím prvním v klinické praxi dostupným zástupcem skupiny NaSSA (noradrenergic and specific serotonergic antidepressants). Zvyšuje noradrenergní neurotransmisi blokádou a2-adrenoreceptorů (autoreceptorů) a neurotransmisi 5-HT dvěma mechanismy: stimulací a1-adrenoreceptorů (umístěných na tělech serotoninergních neuronů) a blokádou a2-heteroreceptorů. Dále blokuje receptory 5-HT2 a 5-HT3. Z farmakokinetických parametrů má na rozdíl od SNRI relativně vysokou vazbu na plazmatické proteiny a dlouhý vylučovací poločas.
Mirtazapin je také dostupný ve formě rychle rozpustných tablet (orally disintegrating formulation, SolTab). Výhodou je, že se rozpouští na jazyku, není tedy nutno tabletu zapíjet vodou a má příjemnou chuť. To znamená zvýšení pohodlí pro nemocného a podporu compliance [37].
O antidepresivním účinku NaSSA platí v podstatě totéž co v případě SNRI, tj. stejná účinnost jako u TCA a lepší nebo minimálně stejná účinnost jako SSRI včetně dosažených odpovědí a remisí a možnosti rychlejšího nástupu účinku [38].
Mirtazapin se liší od SNRI profilem vedlejších účinků. Nejčastěji způsobuje sedaci, přírůstek hmotnosti a sucho v ústech. Naopak nevede k sexuálním obtížím a zlepšuje spánek včetně jeho kvality [39, 40].
Mirtazapin je často používán k ovlivnění insomnie i u nemocných bez depresivní poruchy a je úspěšně zkoušen (podobně jako SSRI) u poruch afektivity doprovázejících somatická onemocnění [41]. Novou zajímavou indikací může být zvracení, což souvisí s antagonismem 5-HT3-receptorů [42]. V malé sérii kazuistik byl mirtazapin účinný v léčbě rezistentního těhotenského zvracení. Neměl žádný vliv na průběh gravidity a matkám se narodily zdravé děti [43].
Závěr
Duální AD jsou charakterizována zvýšením dostupnosti 5-HT a NA blokádou jejich zpětného vychytávání (SNRI) nebo navíc modulací jejich receptorů (NaSSA). V některých případech mohou být výhodnější než AD ovlivňující pouze jeden neurotransmiterový systém. Ve srovnání se SSRI jsou účinnější v léčbě depresivní poruchy a stejně účinná v léčbě úzkostných poruch. Na rozdíl od SSRI jsou účinná v léčbě bolesti. Předběžné údaje naznačují možnost využití i v dalších indikacích. Drobné rozdíly ve farmakodynamickém profilu a farmakokinetice jednotlivých duálních AD se mohou promítat především do rozdílů ve snášenlivosti.
Podpořeno Výzkumným záměrem MSMT 0021622404.
Seznam použité literatury
- [1] Nelson CJ, Mazure CM, Jatlow PI, et al. Combining norepinephrine and serotonin reuptake inhibition mechanisms for treatment for depression: a double-blind, randomized study. Biol Psychiatry 2004; 55: 296–300.
- [2] Danish University Antidepressant Group. Paroxetine: a selective serotonin reuptake inhibitor showing better tolerance, but weaker antidepressant effect than clomipramine in a controlled multicenter study. J Affect Disord 1990; 18: 289–299.
- [3] Češková E. Duálně působící antidepresiva. Čes Slov Psychiatrie 2005; 101: 207–212.
- [4] Tůma I. Duloxetin – třetí antidepresivum skupiny SNRI. Remedia 2005; 15: 559–562.
- [5] Stahl SM, Grady M, Moret Ch, Briket M. SNRIs: The pharmacology, clinical efficacy, and tolerability in comparison with other classes of antidepressants. CNS Spectr 2005; 10: 732–747.
- [6] De Vane LC. Differential pharmacology of newer antidepressants. J Clin Psychiatry 1998; 59: (suppl 20): 85–93.
- [7] Žourková A, Hadašová E. Paroxetine-induced conversion of cytochrome P450 2D6 phenotype and occurrence of adverse effects. Gen Physiol Biophys 2003; 22: 103–113.
- [8] Hunziker ME, Suehs BT, Bettinger TL, Crismon LM. Duloxetine hydrochloride: a new dual-acting medication for the treatment of major depressive disorder. Clin Ther 2005; 27: 1126–1143.
- [9] Entsuah R, Chitra R. A benefit-risk analysis of once-daily venlafaxine extended release (XR) and venlafaxine immediate release (IR) in outpatients with major depression. Psychopharmacol Bull 1997; 33: 671–676.
- [10] Smith D, Dempster C, Glanville J, et al. Efficacy and tolerability of venlafaxine compared with SSRIs and other ADs: A meta-analysis. Br J Psychiatry 2002; 180: 396–404.
- [11] Puech A, Montgomery SA, Prost JF, et al. Milnacipran, a new serotonin and noradrenaline reuptake inhibitor: an overview of its antidepressant activity and clinical tolerability. Int Clin Psychopharmacol 1997; 12: 99–108.
- [12] Bielski RJ, Ventura D, Chang OC. A double-blind comparison of escitalopram and venlafaxine extended release in the treatment of major depressive disorder. J Clin Psychiatry 2004; 65: 1190–1196.
- [13] Sechter D, Vandel P, Weiller E, et al. A comparative study of milnacipran and paroxetine in outpatients with major depression. J Affect Disord 2005; 83: 233–236.
- [14] Guelfi JD, White C, Hackett D, et al. Effectiveness of venlafaxine in patiens hospitalised for major depression and melancholia. J Clin Psychiatry 1995; 56: 450–458.
- [15] Vis PM, van Baardewijk M, Einarson TR. Duloxetine and venlafaxine-XR in the treatment of major depressive disorder: A meta-analysis of randomized clinical trials. Ann Pharmacother 2005; 39: 1798–1807.
- [16] Eckert L, Lancon C. Duloxetine compared with fluoxetine and venlafaxine: use of meta-regression analysis for indirect comparisons. BMC Psychiatry 2006; 6: 30.
- [17] Clayton AH, Pradko JF, Croft HA, et al. Prevalence of sexual dysfunction among newer antidepressants. J Clin Psychiatry 2002; 63: 357–366.
- [18] Danjou P, Hackett D. Safety and tolerance profile of venlafaxine. Int Clin Psychopharmacol 1995; 10 (suppl 1): S15–S20.
- [19] Rochet F, Marais J, Serre C, Pandini E. Effects of milnacipran on driving vigilance. Int J Psych Clin Pract 2004; 8: 109–115.
- [20] Poirier MF, Galinowski A, Amado I, et al. Double-blind comparative study of the action of repeated administration of milnacipran versus placebo on cognitive functions in healthy volunteers. Hum Psychopharmacol Clin Exp 2004; 19: 1–7.
- [21] Souery D, Papakostas GI, Trivedi MH. Treatment-resistant depression. J Clin Psychiatry 2006; 67 (suppl 6): 16–22.
- [22] Allgulander C, Hackett D, Salina E. Venlafaxine extended release (ER) in the treatment of generalised anxiety disorder: twenty-four-week placebo-controlled dose-ranging study. Br J Psychiatry 2001; 179: 15–22.
- [23] Liebowitz MR, Gelenberg AJ, Munjack D. Venlafaxine extended release vs placebo and paroxetine in social anxiety disorder. Arch Gen Psychiatry 2005; 62: 190–198.
- [24] Bradwejn J, Ahokas A, Stein DJ, et al. Venlafaxine extended-release capsules in panic disorder: Flexible-dose, double-blind, placebo-controlled study. Br J Psychiatry 2005; 187: 352–359.
- [25] Denys D, van der Wee N, van Megen HJ, Westenberg HG. A double blind comparison of venlafaxine and paroxetine in obsessive-compulsive disorder. J Clin Psychopharmacol 2003; 23: 568–575.
- [26] Sumpton JE, Moulin DE. Treatment of neuropathic pain with venlafaxine. Ann Pharmacother 2001; 35: 557–559.
- [27] Tasmuth T, Hartel B, Kalso E. Venlafaxine in neuropathic pain following treatment of breast cancer. Eur J Pain 2002; 6: 17–24.
- [28] Sindrup SH, Bach FW, Madsen C, et al. Venlafaxine versus imipramine in painful polyneuropathy: a randomized, controlled trial. Neurol 2003; 60: 1284–1289.
- [29] Entsuah AR. Venlafaxine vs SSRIs: comparison of somatic symptom resolution. World J Biol Psychiatry 2004; 5 (suppl 1): 92–97.
- [30] Vitton O, Gendreau M, Gendreau J. A double-blind placebo-controlled trial of milnacipran in the treatment of fibromyalgia. Hum Psychopharmacol 2004; 19 (suppl 1): S27–S35.
- [31] Arnold LM, Lu Y, Crofford LJ, et al. A double-blind, multicenter trial comparing duloxetine with placebo in the treatment of fibromyalgia patients with or without major depressive disorder. Arthritis Rheum 2004; 50: 2974–2984.
- [32] Goldstein DJ, Lu Y, Detke MJ, et al. Duloxetine vs placebo in patients with painful diabetic neuropathy. Pain 2005; 116: 109–18.
- [33] Raskin J, Pritchet YL, Wang F, et al. A double-blind, randomized multicenter trial comparing duloxetine with placebo in the management of diabetic peripheral neuropathic pain. Pain Med 2005; 6: 346–56.
- [34] Mariappan P, Alhasso A, Ballantyne Z, et al. Duloxetine, a serotonin and noradrenaline reuptake inhibitor (SNRI) for the treatment of stress urinary incontinence: a systematic review. Eur Urol 2007; 51: 67–74.
- [35] McCormack PL, Keting GM. Duloxetine in stress urinary incontinence. Drugs 2004; 64: 2567–2573.
- [36] Kimura M, Kanetani K, Imai R, et al. Therapeutic effects of milnacipran, a serotonin and noradrenaline reuptake inhibitor, on post-stroke depression. Int Clin Psychopharmacol 2002; 17: 121–125.
- [37] Češková E, Pálenský V, Skotáková S. Současné možnosti farmakoterapie deprese. Čes Slov Psychiatrie 2004; 100: 148–152.
- [38] Behnke K, Sogaard J, Martin S, et al. Mirtazapine orally disintegrating tablets versus sertraline: a prospective onset of action study. J Clin Psychopharmacol 2003; 23: 358–364.
- [39] Kasper S. Clinical efficacy of mirtazapine: a review of meta-analyses of pooled data. Int Clin Psychopharmacol 1995; 10 (suppl 4): S25–S35.
- [40] Kent JM. SNaRIs, NaSSAs, and NaRIs: New agents for the treatment of depression. Lancet 2000; 355: 911–918.
- [41] Kim SW, Shin IS, Kim JM, et al. Mirtazapine treatment for pathological laughing and crying after stroke. Clin Neuropharmacol 2005; 28: 249–251.
- [42] Pae CU. Low-dose mirtazapine may be successful treatment option for severe nausea and vomiting. Prog Neuropsychopharmacol Biol Psychiatry 2006; 30: 1143–1145.
- [43] Guclu S, Gol M, Dogan E, Saygili U. Mirtazapine use in resistant hyperemesis gravidarum: report of three cases and review of the literature. Arch Gynecol Obstet 2005; 10: 1–3.