Eliminace HCV: mýtus, nebo realita?
Souhrn:
Infekce virem hepatitidy C (HCV) je jednou z nejčastějších příčin chronického onemocnění jater a postihuje celosvětově přibližně 71 milionů lidí, většina infikovaných osob o svém onemocnění neví. Onemocnění může probíhat desítky let zcela asymptomaticky, přesto v západních zemích představuje nejčastější příčinu jaterní cirhózy, hepatocelulárního karcinomu a selhání jater. Cílem terapie je vyléčení HCV infekce – dosažení kompletní eradikace viru, které je definováno jako dosažení setrvalé virologické odpovědi odpovídající nedetekovatelné HCV RNA v krvi za 12 a/nebo 24 týdnů po ukončení léčby. Eradikace HCV infekce brání rozvoji jaterních i mimojaterních komplikací onemocnění. Nová perorální přímo působící antivirotika, tzv. DAA, představují revoluci v léčbě HCV infekce díky vysoké, téměř 100% účinnosti a minimu nežádoucích účinků při krátké, osmi‑ až dvanáctitýdenní léčbě. Jejich použití má za cíl eliminaci HCV infekce do roku 2030, tedy snížení počtu nově diagnostikovaných případů na 10 % původního počtu nemocných.
Key words: HCV infection, cirrhosis, direct‑acting antivirals, elimination.
Summary:
HCV infection is a major cause of chronic liver disease with approximately 71 million infected individuals worldwide. Most people are unaware of the infection. The infection may have an asymptomatic course, with the hepatic injury ranging from minimal liver fibrosis to hepatic cirrhosis, liver failure and hepatocellular carcinoma. The primary goal of HCV therapy is to cure the infection, i.e., to achieve sustained virological response, defined as undetectable HCV RNA in blood 12 and/or 24 weeks after therapy completion. HCV eradication prevents the risk of hepatic as well as extrahepatic complications of HCV infection. The new, all‑oral, direct‑acting antivirals (DAA) represent a revolution in HCV therapy thanks to their high, nearly 100% efficacy without adverse reactions and short treatment duration (8 or 12 weeks). The goal of HCV therapy is HCV elimination by 2030 defined as 90% reduction of new cases of infection.
Úvod
Infekce virem hepatitidy (HCV) je celosvětově jednou z nejčastějších příčin chronického onemocnění jater a postihuje přibližně 71 milionů lidí [1,2]. Závažnost jaterního onemocnění způsobeného HCV může být různá, od zcela asymptomatické chronické infekce s mírnou elevací aktivit jaterních enzymů až po jaterní cirhózu komplikovanou jaterním selháním či hepatocelulárním karcinomem (HCC). Z důvodu asymptomatického průběhu o svém onemocnění většina infikovaných osob neví. Česká republika patří mezi země s nízkou prevalencí HCV infekce, v roce 2015 byla prevalence anti HCV pozitivity 1,67 %, HCV RNA byla detekována u 0,93 % vyšetřených jedinců [3]. Péče o pacienty s hepatitidou C se za posledních 20 let významně změnila díky pochopení replikačního cyklu viru, patofyziologie jaterního onemocnění, a zejména díky pokrokům v diagnostice a léčbě HCV infekce.
Cílem terapie je vyléčení HCV infekce – dosažení eradikace viru, které je definováno jako dosažení setrvalé virologické odpovědi (sustained virologic response, SVR) odpovídající nedetekovatelné HCV RNA v krvi za 12 (SVR12) nebo za 24 (SVR24) týdnů po ukončení protivirové léčby [4]. Podle dlouhodobých studií SVR znamená trvalé vyléčení HCV infekce, tj. u osob se SVR24 nedochází k pozdním relapsům onemocnění. Eradikace brání rozvoji jaterních i mimojaterních komplikací HCV infekce, včetně progrese jaterní fibrózy, dekompenzace jaterní cirhózy, a snižuje riziko vzniku HCC [5]. Dvacet pět let po objevu HCV nová přímo působící antivirotika (direct acting antivirals, DAA), z nichž většina byla registrována v letech 2014−2017, dosahují účinnosti 95−100 % při krátké, osmi až dvanáctitýdenní léčbě [4,6–12]. Zavedení DAA do klinické praxe je tak často přirovnáváno k revoluci. Od zavedení proteázových inhibitorů první generace, které bylo nutno užívat v kombinaci s interferonem a ribavirinem, až po zavedení bezinterferonových režimů v „jedné tabletě“ neuběhly ani čtyři roky.
Indikace k protivirové léčbě
Kandidáty protivirové terapie jsou v současné době všichni pacienti s chronickou HCV infekcí, ať již dosud neléčení, nebo v minulosti léčení neúspěšně kombinací pegylovaného interferonu a ribavirinu, kteří jsou k léčbě motivováni a léčit se chtějí [4]. Cílem léčby je tedy nejen předejít komplikacím vyplývajícím z chronického jaterního onemocnění, ale také zlepšit kvalitu života infikovaných pacientů a odejmout stigma, které je s onemocněním spojeno. Dalším, zcela zásadním cílem léčby je prevence přenosu na další osoby [13].
Protivirová léčba by měla být jednoznačně upřednostněna u pacientů s pokročilou jaterní fibrózou, u cirhotiků (včetně nemocných s dekompenzací) a u pacientů s extrahepatální manifestací HCV infekce (vaskulitida, HCV asociovaná glomerulonefritida, HCV asociované non hodgkinské lymfomy) [4]. Přednostní léčba je rovněž indikována i u pacientů, kteří představují významné epidemiologické riziko šíření HCV infekce [4,13].
Možnosti léčby hepatitidy C v roce 2018
V současné době je k dispozici
k léčbě HCV infekce v Evropské unii i v České
republice šest léčebných režimů, které jsou uvedeny v tabulce 1. Jejich použití se liší zejména podle genotypu viru
a pokročilosti jaterního onemocnění [4]. Cílem je co
nejkratší, nejlépe osmitýdenní léčba a jednoduché
dávkování léku, ideálně jedna tableta jednou denně, bez
nutnosti podání ribavirinu. Pangenotypální působení umožňuje
vysoce účinnou léčbu všech nemocných bez ohledu na genotyp
viru. K výběru optimálního léčebného režimu je
v současnosti nezbytné studium aktuálního souhrnu údajů
o přípravku (SPC) daného léku, doporučených postupů
odborných společností, ale i indikačního omezení platného
v ČR. Nejdůležitějšími body v rozhodovacím algoritmu
jsou genotyp a subtyp HCV, stupeň jaterní fibrózy, iniciální
hodnota HCV RNA, komorbidity (HIV či HBV koinfekce, selhání ledvin
aj.) a současně užívané léky s ohledem na potenciální
lékové interakce. Účinnost všech v současnosti používaných
léčebných režimů s DAA dosahuje 95−100 %.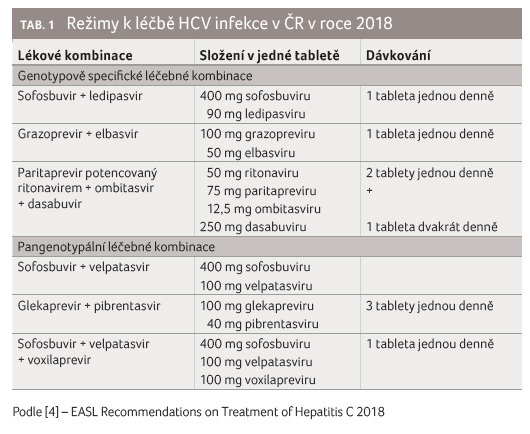
Sofosbuvir + ledipasvir
Sofosbuvir s ledipasvirem (SOF + LDV, Harvoni) jsou k dispozici jako fixní kombinace v jedné tabletě obsahující 400 mg sofosbuviru a 90 mg ledipasviru, která se užívá jednou denně s jídlem nebo bez jídla [6]. Režim SOF + LDV je indikován k léčbě pacientů infikovaných genotypy 1 a 4, standardní doba trvání léčby je 12 týdnů. Zkrácenou osmitýdenní léčbu lze použít u nemocných s genotypem 1, bez cirhózy a s iniciální viremií HCV RNA < 6 milionů IU/ml [14]. U pacientů s jaterní cirhózou je indikováno podání s ribavirinem [4,6]. Režim má minimální nežádoucí účinky, z nichž nejčastější jsou únava a bolest hlavy. Režim SOF + LDV nelze použít u pacientů s těžkým stupněm renální insuficience (glomerulární filtrace < 30 ml/min), naopak je jej možno použít i u pacientů s dekompenzovanou jaterní cirhózou (Childova–Pughova funkční klasifikace B a C) [6].
Paritaprevir potencovaný ritonavirem, ombitasvir + dasabuvir
Paritaprevir potencovaný ritonavirem, ombitasvir a dasabuvir (tzv. 3D kombinace, Viekireax + Exviera) je režim používaný u pacientů s genotypem 1, bez dasabuviru pak u pacientů s genotypem 4 (v kombinaci s ribavirinem) [7,8]. Ombitasvir je podáván v jedné tabletě v kombinaci s paritaprevirem potencovaným ritonavirem, denní dávku představují 2 tablety (každá obsahuje 50 mg ritonaviru, 75 mg paritapreviru, 12,5 mg ombitasviru) užívané obvykle ráno. Dasabuvir je užíván v dávce 250 mg dvakrát denně. Obvyklá doba léčby je 12 týdnů. Nežádoucí účinky jsou minimální, nejčastějšími z nich byly únava a nauzea. Režim má vynikající protivirovou účinnost u pacientů s genotypem 1b (včetně 100% účinnosti u pacientů s kompenzovanou jaterní cirhózou bez nutnosti užití ribavirinu) [15], u všech nemocných s genotypem 1a je nutno přidat ribavirin nezávisle na stupni fibrózy [7]. Režim je možno použít i u pacientů s významnou renální insuficiencí včetně pacientů chronicky dialyzovaných [7,8]. U pacientů s genotypem 1b a s nízkým a středním stupněm fibrózy (fibróza F1 a F2 dle Metavir skóre) lze léčbu zkrátit na osm týdnů bez ovlivnění účinnosti [7,8,16]. Nevýhodou režimu jsou častější lékové interakce a nemožnost podání u pacientů s dekompenzovanou jaterní cirhózou.
Grazoprevir + elbasvir
Grazoprevir a elbasvir (GZR + EBR, Zepatier) jsou k dispozici jako fixní kombinace 100 mg grazopreviru a 50 mg elbasviru v jedné tabletě užívané jedenkrát denně. Léčba je indikována u pacientů s genotypy 1 a 4 [4,9]. Režim je rovněž velice dobře tolerován, nežádoucí účinky jsou mírné (nejčastěji únava a bolest hlavy). U pacientů s renální insuficiencí včetně pacientů hemodialyzovaných není třeba úprava dávky [17], režim však není možno použít u pacientů s dekompenzovanou jaterní cirhózou. Dvanáctitýdenní léčba bez ribavirinu je indikována u pacientů s genotypem 1b, u genotypu 1a a 4 při iniciální HCV RNA < 800 000 IU/ml [4].
Sofosbuvir + velpatasvir
Sofosbuvir a velpatasvir (SOF + VEL, Epclusa) jsou k dispozici jako fixní kombinace (400 mg sofosbuviru a 100 mg velpatasviru) v jedné tabletě podávané v jedné denní dávce [10]. Jedná se o první pangenotypální režim s vysokou účinností na všechny genotypy viru HCV (1–6) bez ohledu na stupeň jaterní fibrózy, doporučená doba léčby je 12 týdnů [4,10]. Režim je velmi dobře tolerován, nejčastějšími, avšak mírnými nežádoucími účinky jsou bolest hlavy, nauzea a únava. Režim není možno použít u pacientů s významnou renální insuficiencí (glomerulární filtrace < 30 ml/min), jeho použití je však možné u pacientů s dekompenzovanou jaterní cirhózou, Childova–Pughova funkční klasifikace B a C [10].
Sofosbuvir + velpatasvir + voxilaprevir
Sofosbuvir, velpatasvir a voxilaprevir (SOF + VEL + VOX, Vosevi®) jsou k dispozici jako fixní kombinace (400 mg sofosbuviru, 100 mg velpatasviru a 100 mg voxilapreviru) v jedné tabletě užívané v jedné denní dávce [11]. Jedná se opět o pangenotypální režim s vysokou účinností na všechny genotypy viru HCV (1–6), jeho hlavní výhodou je možnost užití u pacientů, u kterých selhala předchozí léčba DAA obsahující inhibitor NS5A (ledipasvir, ombitasvir, daklatasvir atd.) [4]. Osmitýdenní léčba je indikována u pacientů, kteří dosud nebyli léčeni DAA a nemají cirhózu. U pacientů s cirhózou a těch, u kterých selhala předchozí léčba DAA, má být léčba dvanáctitýdenní [11]. Nejčastějšími nežádoucími účinky léčby jsou bolest hlavy, průjem a nauzea.
Glekaprevir + pibrentasvir
Glekaprevir a pibrentasvir (GLE + PIB, Maviret) jsou k dispozici jako fixní kombinace 100 mg glekapreviru a 40 mg pibrentasviru v jedné tabletě [18]. Doporučená dávka jsou tři tablety užité jednou denně s jídlem. Kombinace glekapreviru a pibrentasviru představuje pangenotypální režim s vysokou účinností na všechny genotypy viru HCV (1–6). Doporučená délka léčby je osm týdnů u nemocných bez cirhózy, 12 týdnů pak u pacientů s cirhózou [4,18]. Po dřívější neúspěšné léčbě kombinací pegylovaného interferonu a ribavirinu (ev. v kombinaci se sofosbuvirem) má být léčba prodloužena na 16 týdnů u nemocných s genotypem 3, pro ostatní genotypy platí doporučení uvedené výše [18]. Nežádoucí účinky jsou minimální, nejčastěji bolest hlavy a únava. Režim je možno použít i u pacientů s renálním selháním, je však kontraindikován u pacientů s dekompenzovanou cirhózou.
Kontraindikace protivirové léčby
V současné době je kontraindikací protivirové léčby HCV infekce naprosté minimum [4]. Kontraindikaci mohou představovat současně užívané silné induktory cytochromu P450 či P glykoproteinu, jako jsou např. třezalka tečkovaná, fenytoin nebo karbamazepin, z důvodu zásadního snížení koncentrací DAA a tím dané vysoké pravděpodobnosti virologického selhání. U pacientů s pokročilou jaterní cirhózou, Childova–Pughova funkční klasifikace B a C, jsou kontraindikovány režimy obsahující proteázový inhibitor (glekaprevir, grazoprevir, paritaprevir, voxilaprevir) [4]. Velké opatrnosti a pečlivé monitorace je třeba dbát u pacientů, kteří užívají amiodaron při použití režimů se sofosbuvirem z důvodu možnosti závažné bradykardie [6,10,11].
Screening HCV infekce
Velká část osob infikovaných HCV si není infekce vědoma [19]. Identifikace infikovaných jedinců je však jednou ze základních podmínek možnosti adekvátní léčby HCV infekce. Screeningovým vyšetřením HCV infekce je vyšetření anti HCV protilátek [4]. Anti HCV protilátky by měly být vyšetřeny u všech osob, u nichž je podezření, že byly někdy v průběhu života exponovány některému z rizikových faktorů přenosu HCV, a cílové skupiny screeningu se významně liší v jednotlivých zemích [4]. Testování na přítomnost HCV infekce je doporučeno zejména u osob s anamnézou injekční aplikace drog, a to i v případě jediné aplikace před mnoha lety, u příjemců krevních derivátů či orgánových transplantátů před rokem 1992, u osob HIV pozitivních, u hemofiliků, u pacientů s anamnézou hemodialyzační léčby, u pacientů s elevací aktivity jaterních aminotransferáz. Dále mají být testovány děti HCV pozitivních matek, zdravotničtí pracovníci a osoby s anamnézou poranění injekční jehlou, sexuální partneři HCV pozitivních osob a pacienti v minulosti vystavení invazivním lékařským zákrokům, zejména pak osoby s anamnézou komplikovaného chirurgického výkonu nebo osoby s anamnézou dlouhé hospitalizace (riziko iatrogenního přenosu).
Eliminace HCV infekce
V důsledku cirhózy jater je v Evropě každoročně zaznamenáno až 170 000 úmrtí, Evropská unie i Světová zdravotnická organizace (WHO) považují HCV za jednu z největších zdravotních hrozeb v současné Evropě [20,21]. V květnu 2016 vyhlásila WHO strategii eliminace HCV infekce do roku 2030 s cílem snížit do té doby mortalitu na jaterní onemocnění způsobená virovými hepatitidami o 65 % a incidenci nových případů onemocnění o 90 % [20,21].
V evropských zemích je v současné době nejčastějším zdrojem šíření HCV infekce nitrožilní aplikace drog. V západních zemích představuje tato skupina nejčastější způsob akvizice HCV infekce, 50–80 % nových případů, navíc tato skupina HCV infikovaných osob představuje největší epidemiologické riziko přenosu na další, dosud zdravé jedince [2,20,21].
I přes vysokou účinnost léčby je největším problémem eliminačních strategií fakt, že i ve vyspělých zemích většina nemocných o své infekci neví [21]. Screeningové a eliminační programy jsou proto zaměřeny zejména na skupiny s vysokou prevalencí HCV infekce a s vysokým epidemiologickým rizikem, strategie jsou odlišné v různých evropských zemích. Od roku 2014 je ve Francii zaveden screening těhotných žen, v případě mužů má byt test proveden u všech ve věku 18–59 let. Akční plán v Německu je zaměřen zejména na informovanost osob, které užívají drogy, součástí této strategie je plán výměny injekčních pomůcek, nabídnutí léčby těmto infikovaným jedincům a speciální výcvik zdravotních sester, které se zabývají léčbou HCV infekce. V Nizozemsku byl program časné léčby zaměřen na osoby užívající drogy a na osoby ve vězeních, kde je prevalence infekce rovněž velmi vysoká [21].
V současné době je eliminace reálná v zemích, kde je ročně léčeno alespoň 7 % infikované populace. Dle údajů World Hepatitis Alliance z května 2018 je eliminace HCV infekce do roku 2030 docílitelná při stávající strategii screeningu a léčby ve 12 zemích (Austrálie, Mongolsko, Gruzie, Egypt, Švýcarsko, Francie, Španělsko, Japonsko, Nizozemsko, Velká Británie, Itálie, Island) [22,23].
Závěr
Obrovský pokrok v léčbě HCV v posledních letech vedl k situaci, že teoreticky všichni infikovaní jedinci mohou být léčeni, pokud o své infekci vědí a k léčbě mají přístup [4]. Eliminace infekce v zemích disponujících dostatečnými finančními zdroji a efektivními screeningovými programy se zdá být, díky vysoké účinnosti a dobré toleranci léčby, v blízké budoucnosti reálná [24,25].
Seznam použité literatury
- [1] European Union HCVC. Hepatitis C virus prevalence and level of intervention required to achieve the WHO targets for elimination in the European Union by 2030: a modelling study. Lancet Gastroenterol Hepatol 2017; 2: 325–336.
- [2] Polaris Observatory HCVC. Global prevalence and genotype distribution of hepatitis C virus infection in 2015: a modelling study. Lancet Gastroenterol Hepatol 2017; 2: 161–176.
- [3] Chlibek R, Smetana J, Sosovickova R, et al. Prevalence of hepatitis C virus in adult population in the Czech Republic – time for birth cohort screening. PloS One 2017; 12:e0175525.
- [4] European Association for the Study of the Liver. Electronic address eee, European Association for the Study of the L. EASL Recommendations on Treatment of Hepatitis C 2018. J Hepatol 2018; 69: 461–511.
- [5] van der Meer AJ, Veldt BJ, Feld JJ, et al. Association between sustained virological response and all‑cause mortality among patients with chronic hepatitis C and advanced hepatic fibrosis. JAMA 2012; 308: 2584–2593.
- [6] SPC Harvoni. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/003850/WC500177995.pdf
- [7] SPC Viekirax. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/003839/WC500183997.pdf
- [8] SPC Exviera. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/003837/WC500182233.pdf
- [9] SPC Zepatier. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/004126/WC500211235.pdf
- [10] SPC Epclusa. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/004210/WC500211151.pdf
- [11] SPC Vosevi. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/004350/WC500235373.pdf
- [12] SPC Maviret. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/004430/WC500233677.pdf
- [13] Dore GJ, Hajarizadeh B. Elimination of Hepatitis C Virus in Australia: Laying the Foundation. Infect Dis Clin North Am 2018; 32: 269–279.
- [14] Buggisch P, Vermehren J, Mauss S, et al. Real‑world effectiveness of 8‑week treatment with ledipasvir/sofosbuvir in chronic hepatitis C. J Hepatol 2017; doi: 10.1016/j.jhep.2017.11.009.
- [15] Feld JJ, Moreno C, Trinh R, et al. Sustained virologic response of 100% in HCV genotype 1b patients with cirrhosis receiving ombitasvir/paritaprevir/r and dasabuvir for 12weeks. J Hepatol 2016; 64: 301−307.
- [16] Welzel TM, Asselah T, Dumas EO, et al. Ombitasvir, paritaprevir, and ritonavir plus dasabuvir for 8 weeks in previously untreated patients with hepatitis C virus genotype 1b infection without cirrhosis (GARNET): a single‑arm, open‑label, phase 3b trial. Lancet Gastroenterol Hepatol 2017; 2: 494−500.
- [17] Roth D, Nelson DR, Bruchfeld A, et al. Grazoprevir plus elbasvir in treatment‑naive and treatment‑experienced patients with hepatitis C virus genotype 1 infection and stage 4‑5 chronic kidney disease (the C‑SURFER study): a combination phase 3 study. Lancet 2015; 386: 1537–1545.
- [18] SPC Maviret. Dostupné na: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_‑_Summary_for_the_public/human /004430/WC500233680.pdf
- [19] Bruggmann P, Berg T, Ovrehus AL, et al. Historical epidemiology of hepatitis C virus (HCV) in selected countries. J Viral Hepat 2014; 21 (Suppl 1): 5–33.
- [20] World Health Organization. Dostupné na: http://www.who.int/hepatitis/publications/global‑hepatitis‑report2017/en/. 2017
- [21] http://www.hepbcppa.org/newsletter‑april.2016/. 2018
- [22] http://cdafound.org/just‑12‑countries‑worldwide‑on‑track‑to‑eliminate‑hepatitis‑c‑infection‑by‑2030‑with‑united‑kingdom‑italy‑and‑spain‑among‑those‑joining‑the‑list/
- [23] http://www.nohep.org/race‑to‑2030/
- [24] Papatheodoridis GV, Hatzakis A, Cholongitas E, et al. Hepatitis C: The beginning of the end‑key elements for successful European and national strategies to eliminate HCV in Europe. J Viral Hepat 2018; 25 (Suppl 1): 6–17.
- [25] Wedemeyer H, Duberg AS, Buti M, et al. Strategies to manage hepatitis C virus (HCV) disease burden. J Viral Hepat 2014; 21 (Suppl 1): 60–89.