Farmakoterapie perianální Crohnovy choroby
Souhrn:
Pipek B. Farmakoterapie perianální Crohnovy choroby. Remedia 2019; 29: 64–66.
Crohnova choroba je chronické zánětlivé onemocnění trávicího traktu. Její perianální manifestace je závažným a mnohdy devastujícím postižením, které snižuje kvalitu života. Je zároveň prognosticky nepříznivým faktorem rozvoje těžkého a komplikovaného průběhu nemoci. Dělíme ji na fistulující formu, která zahrnuje komplexní a simplexní píštěle, a na nefistulující postižení, kam patří řitní trhlina, fibrózní výčnělky, anální ulcerace, striktury distálního rekta a anu a karcinom. Více než 25 % pacientů s Crohnovou chorobou má perianální manifestaci a výskyt tohoto typu postižení výrazně narůstá s délkou trvání nemoci. V klinické praxi jsou využívány dvě základní anatomické klasifikace. Parksova klasifikace podává popis průběhu píštěle ve vztahu ke svěrači a AGA (klasifikace Americké gastroenterologické asociace) dělí píštěle na prosté a rozvětvené. Pro hodnocení klinické aktivity využíváme škálu PDAI (Perianal Crohnʼs Disease Activity Index), která zahrnuje popis sekrece z píštělí, hodnocení bolesti, omezení sexuálních aktivit, typ perianálního postižení a stupeň indurace. Základem léčby je pak správná diagnostika, mezioborová spolupráce a intenzivní medikamentózní terapie v kombinaci s drenážním chirurgickým výkonem.
Summary:
Pipek B. Pharmacological treatment of perianal Crohn’s disease. Remedia 2019; 29: 64–66.
Crohn’s disease is a chronic inflammatory disease of the digestive tract. Perianal manifestation is a serious and often devastating disability, that reduces the quality of life. It is also a prognostically adverse factor in the development of a severe and complicated duration of illness. We divide it into a fistulative form that includes complex and simplex fistula and non‑fistulative form including anal fissure, skin tags, anal ulcers, stricture and carcinoma. More than 25% of patients with Crohn’s disease have a perianal manifestation and the incidence significantly increases with the duration of the disease. In clinical practice, two basic anatomical classific ations are used. The Parks classification provides a description of the fistula in relation to the sphincter and the AGA (American Gastroenterological Association) classification which divides fistula to simple and branched. To evaluate clinical activity, we use the Perianal Crohn’s Disease Activity Index (PDAI) which includes a description of the secretion from fistulas, pain, limitation of sexual activities, type of perianal affection and degree of induration. The basis of treatment is the right diagnosis, interdisciplinary cooperation and intensive medication treatment in combination with surgery drainage.
Key words: perianal Crohn’s disease, fistula, biological treatment, antibiotics
Úvod
Terapie perianální Crohnovy choroby vyžaduje komplexní přístup. Základem léčby je spolupráce mezi mnoha medicínskými obory, převážně mezi radiology, gastroenterology a chirurgy, a dále kvalitní diagnostika zahrnující vyšetření magnetickou rezonancí či provedení endosonografie rekta zkušeným endosonografistou [1]. Nezbytné je rovněž vyšetření perianální oblasti proktologem v celkové anestezii. Farmakologická léčba je spolu s chirurgickým přístupem pilířem úspěšné léčby perianální manifestace Crohnovy choroby.
Níže uvádíme konkrétní skupiny farmak, se kterými se v léčbě perianální Crohnovy choroby setkáváme.
Kortikosteroidy a aminosalicyláty
Kortikosteroidy a aminosalicyláty nemají prokázaný vliv na hojení píštělí či na klinické zmírnění symptomů nemoci, a proto by neměly být v této indikaci využívány [2,3].
Antibiotika
Velkou skupinou léčiv užívanou k terapii perianálního postižení jsou antibiotika (ATB). Je prokázáno, že ATB nevedou ke kompletnímu zhojení píštělí, ale výrazně zmírňují symptomy perianální nemoci. Snižují bolest, perianální dyskomfort a sekreci z píštělí [4,5]. Exacerbace či zhoršení perianální choroby v průběhu ATB terapie je důvodem ke změně či ukončení léčby. Dále mají ATB význam jako přechodná léčba před plánovanou chirurgickou intervencí či před zahájením biologické terapie. V klinické praxi využíváme nejčastěji kombinační léčbu ciprofloxacinem a metronidazolem. Samostatné užití těchto ATB neprokázalo efekt [6], ve vzájemné kombinaci však statisticky významně snižují potřebu chirurgické drenáže, zmírňují bolest při defekaci a snižují sekreci z píštělí [7]. Podávání ciprofloxacinu 1 000–1 500 mg denně je rozděleno do dvou dávek a u metronidazolu je dávka 20 mg/kg (ev. 750–1 000 mg rozdělených většinou do čtyř denních dávek). Léčba by měla být dlouhodobá, doporučována je doba 8–12 týdnů [7]. Výraznou limitací dlouhodobého užívání ATB je jejich intolerance (zvláště metronidazolu) a rozvoj rezistence. Při perorální intoleranci metronidazolu můžeme využít rektální aplikaci čípků či klyzmat s metronidazolem, jež většinou nečiní pacientům zažívací obtíže.
Imunosupresivní terapie
U azathioprinu (AZA) nebyla provedena žádná kontrolovaná randomizovaná studie hodnotící jeho efekt v monoterapii na hojení perianálních píštělí [8]. Jeho význam spočívá hlavně v kombinační léčbě s ATB a biologickou léčbou. Nevýhodou AZA je latence nástupu účinku. Pearson a kol. v metaanalýze pěti randomizovaných studií z roku 1995 udávají snížení sekrece z píštělí u 54 % pacientů s perianálním postižením léčeným AZA ve srovnání s 21 % v placebové větvi. Samostatně ale AZA nedosáhne úplného zhojení píštělí [9].
Nadějná data nám podává randomizovaná, dvojitě zaslepená a placebem kontrolovaná studie, kde kombinační léčba ciprofloxacinem s AZA vedla ke klinickému zlepšení u 48 % pacientů ve srovnání s 15 % v placebové větvi. Klinický efekt má i AZA s infliximabem ve srovnání s placebem (73 % vs. 39 %). Obdobná data patří i adalimumabu, kdy zlepšení pozorujeme u 65 % pacientů léčených kombinací ve srovnání s 33 % u placeba [10].
Z dalších imunosupresiv uvádíme cyklosporin. Jeho běžnému využití v klinické praxi brání velmi časný relaps obtíží po ukončení léčby [11]. Takrolimus v perorálním podání zmírňuje klinické projevy choroby u 48 % pacientů ve srovnání s 8 % při podávání placeba, ale nevede k remisi [12]. Metotrexát pro monoterapii u perianální choroby má zatím velmi limitované důkazy a není standardně využíván [13].
Biologická léčba
Zlatým standardem léčby komplexních píštělí u perianální Crohnovy choroby je biologická léčba. V České republice se setkáme s anti TNF (tumor nekrotizující faktor) přípravky infliximabem a adalimumabem, dále pak s vedolizumabem, protilátkou proti α4β7 integrinovému receptoru, a s protilátkou proti interleukinu 12/23 ustekinumabem. Certolizumab pegol je dostupný v zahraničí, nikoliv však v ČR.
Všechny výše zmíněné přípravky
prokázaly přínos pro indukci a udržení remise v léčbě
perianální choroby [14]. Ve studii ACCENT II infliximab
v dávce 5 mg/kg snížil u 68 % pacientů počet
secernujících píštělí o více než 50 % [15]. U 36 %
pacientů, kteří odpověděli na indukční terapii, byl efekt
patrný i v 54. týdnu udržovací léčby ve srovnání
s 19 % u placeba [16], graf 1A, B. Dále pak infliximab snížil počet hospitalizací
a počet chirurgických intervencí v perianální oblasti.
Ve studii CHARM se v 56. týdnu snížil počet
secernujících píštělí u pacientů léčených adalimumabem
oproti placebu (33 % vs. 13 %) [17]. Po jednom roce si
remisi udrželo 90 % pacientů, kteří odpověděli na léčbu
v týdnu 56. Studie CHOICE prokazuje účinnost adalimumabu
u 50 % pacientů, u nichž selhala léčba
infliximabem. Došlo zde ke klinickému zlepšení již
po čtyřech týdnech léčby [18]. Adalimumab má dobrý
bezpečnostní profil a zvyšuje kvalitu života pacientů.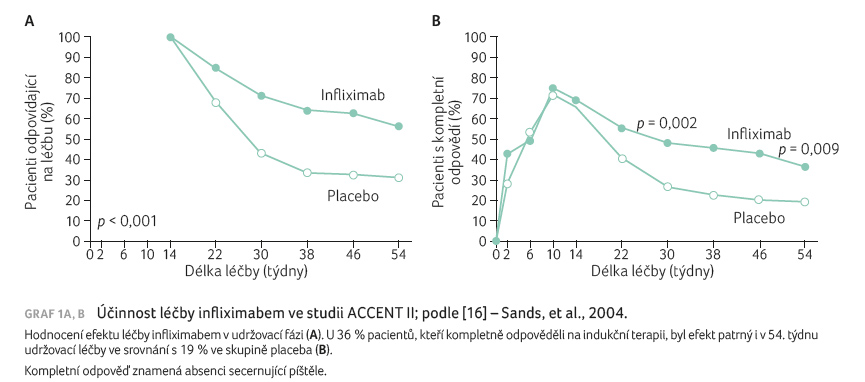
K léčbě perianální choroby se jeví jako výhodné využití vyšších sérových koncentrací biologika. Strik a kol. léčili celkem 352 pacientů s CN s perianální manifestací, z toho 67 pacientů mělo fistulující perianální postižení. Zjistili, že k hojení píštělí je potřeba vyšší sérové koncentrace léčiva. V případě infliximabu byla sérová koncentrace léčiva potřebná ke zhojení píštěle 6 µg/ml oproti 2,3 µg/ml ve skupině pacientů, kde se píštěl nezhojila. Dále nebyl zjištěn rozdíl v hojení mezi adalimumabem a infliximabem. Z daného sledování vyplývá závěr, že k hojení píštělí je potřeba vyšší sérové koncentrace léčiva než k hojení luminální nemoci [19].
Data o účinnosti vedolizumabu jsou stále limitovaná. K dispozici máme výsledky studie GEMINI II, kdy po jednom roce léčby byl efekt vedolizumabu na uzavření píštělí vyšší ve srovnání s placebem (31 % vs. 11 %). Při podávání vedolizumabu bylo rovněž doloženo rychlejší hojení než při podávání placeba a předchozí selhání anti TNF léčby se jeví jako negativní prediktivní faktor [20,21].
Data pro užití ustekinumabu jsou taktéž zatím omezená. Ve španělské multicentrické studii měli pacienti, u nichž došlo k selhání anti TNF léčby, prospěch z léčby ustekinumabem ve smyslu snížení počtu píštělí a klinického zlepšení již v 8. týdnu léčby (24 % vs. 14 % při podávání placeba) [22,23]. Je však potřeba delší doby sledování a většího počtu pacientů zařazených do dispenzarizace.
Pro certolizumab pegol je zatím dostupných také velmi málo dat. Studie PRECiSE prokazuje, že není statistický rozdíl mezi podáváním placeba a certolizumab pegolu v poklesu hodnot CDAI (Crohn’s Disease Activity Index, index aktivity Crohnovy nemoci), ale u 36 % pacientů léčených certolizumabem došlo ke snížení sekrece a k uzavření píštělí ve srovnání se 17 % pacientů léčených placebem [24].
Kombinovaná léčba imunosupresivy, biologiky a chirurgickou drenáží je spojena s lepšími výsledky. Výhodná je kombinace anti TNF terapie s ciprofloxacinem, kdy právě kombinovaná léčba zlepšuje hodnoty PDAI (Perianal Crohn’s Disease Activity Index) u 73 % pacientů ve srovnání s 39 % při podávání placeba. Podávání adalimumabu s ciprofloxacinem zlepšuje klinickou odpověď (71 % vs. 47 %). Kombinace anti TNF terapie s thiopuriny vede k parciálnímu či úplnému zhojení píštělí a celkově zvyšuje účinnost biologika [25,26].
Další možnosti léčby
Úloha exkluzivní enterální výživy nebyla v dospělé populaci detailně studována. Její význam spočívá v léčbě Crohnovy choroby dětského věku, ale i zde je efekt na hojení perianálního postižení limitován dostupnými daty [27]. Mykofenolát mofetil a thalidomid nejsou v běžné klinické praxi využívány [28]. S léčbou kmenovými buňkami (stem cell treatment) máme zatím počáteční zkušenosti; zlepšuje hojení a přináší symptomatickou úlevu [29]. K potvrzení efektu léčby bude potřeba dalších studií.
Závěr
Biologická léčba je zlatým standardem farmakoterapie perianální Crohnovy choroby (anti TNF přípravky). Klinický efekt má také dlouhodobá antibiotická terapie s ohledem na toleranci a nežádoucí účinky. Imunosupresivní medikace má význam hlavně v kombinační léčbě s biologiky či antibiotiky.
Léčba perianální Crohnovy choroby vyžaduje správnou diagnostiku a komplexní multioborový přístup, prioritně ve spolupráci s proktologem s následnou optimalizací operačních postupů. Nedostatečná léčba zhoršuje kvalitu života pacientů a vede k jejich invalidizaci.
Seznam použité literatury
- [1] Zbořil V, a kol. Idiopatické střevní záněty. Praha: Mladá fronta, 2018.
- [2] Panés J, Rimola J. Perianal fistulizing Crohnʼs disease: pathogenesis, diagnosis and therapy. Nat Rev Gastroenterol Hepatol 2017; 14: 652−664.
- [3] Aguilera‑Castro L, Ferre‑Aracil C, Garcia‑Garcia‑de‑Paredes A, et al. Management of complex perianal Crohnʼs disease. Ann Gastroenterol 2017; 30: 33–44.
- [4] Thia KT, Mahadevan U, Feagan BG, et al. Ciprofloxacin or metronidazole for the treatment of perianal fistulas in patients with Crohnʼs disease: a randomized, double‑blind, placebo‑controlled pilot study. Inflamm Bowel Dis 2009; 15: 17–24.
- [5] Khan KJ, Ullman TA, Ford AC, et al. Antibiotic therapy in inflammatory bowel disease: a systematic review and meta‑analysis. Am J Gastroenterol 2011; 106: 661–673.
- [6] Dejaco C, Harrer M, Waldhoer T, et al. Antibiotics and azathioprine for the treatment of perianal fistulas in Crohn’s disease. Aliment Pharmacol Ther 2003; 18: 1113–1120.
- [7] West RL, van der Woude CJ, Hansen BE, et al. Clinical and endosonographic effect of ciprofloxacin on the treatment of perianal fistulae in Crohn’s disease with infliximab: a double‑blind placebo‑controlled study. Aliment Pharmacol Ther 2004; 20: 1329–1336.
- [8] Chande N, Tsoulis DJ, MacDonald JK. Azathioprine or 6‑mercaptopurine for induction of remission in Crohn’s disease. Cochrane Database Syst Rev 2013; 4: CD000545.
- [9] Pearson DC, May GR, Fick GH, et al. Azathioprine and 6‑mercaptopurine in Crohn disease. A meta‑analysis. Ann Intern Med 1995; 123: 132–142.
- [10] Dewint P, Hansen BE, Verhey E, et al. Adalimumab combined with ciprofloxacin is superior to adalimumab monotherapy in perianal fistula closure in Crohn’s disease: a randomised, double‑blind, placebo controlled trial (ADAFI) Gut 2014; 63: 292–299.
- [11] Egan LJ, Sandborn WJ, Tremaine WJ. Clinical outcome following treatment of refractory inflammatory and fistulizing Crohn’s disease with intravenous cyclosporine. Am J Gastroenterol 1998; 93: 442–448.
- [12] Sandborn WJ, Present DH, Isaacs KL, et al. Tacrolimus for the treatment of fistulas in patients with Crohn’s disease: a randomized, placebo‑controlled trial. Gastroenterology 2003; 125: 380–388.
- [13] Mahadevan U, Marion JF, Present DH. Fistula response to methotrexate in Crohn’s disease: a case series. Aliment Pharmacol Ther 2003; 18: 1003–1008.
- [14] Ford AC, Sandborn WJ, Khan KJ, et al. Efficacy of biological therapies in inflammatory bowel disease: systematic review and meta‑analysis. Am J Gastroenterol 2011; 106: 644–659, quiz 660.
- [15] Present DH, Rutgeerts P, Targan S, et al. Infliximab for the treatment of fistulas in patients with Crohn’s disease. N Engl J Med 1999; 340: 1398–1405.
- [16] Sands BE, Anderson FH, Bernstein CN, et al. Infliximab maintenance therapy for fistulizing Crohn’s disease. N Engl J Med 2004; 350: 876–885.
- [17] Colombel JF, Sandborn WJ, Rutgeerts P, et al. Adalimumab for maintenance of clinical response and remission in patients with Crohnʼs disease: the CHARM trial. Gastroenterology 2007; 132: 52–65.
- [18] Lichtiger S, Binion DG, Wolf DC, et al. The CHOICE trial: adalimumab demonstrates safety, fistula healing, improved quality of life and increased work productivity in patients with Crohn’s disease who failed prior infliximab therapy. Aliment Pharmacol Ther 2010; 32: 1228–1239.
- [19] Strik A, et al. Higher anti‑TNF serum levels are associated with perianal fistula closure in Crohns disease patients. Oral Presentation ECCO 2018 Wien.
- [20] Sandborn WJ, Feagan BG, Rutgeerts P, et al. GEMINI 2 Study Group. Vedolizumab as induction and maintenance therapy for Crohnʼs disease. N Engl J Med 2013; 369: 711–721.
- [21] Feagan BG, Schwartz D, Danese S, et al. Efficacy of Vedolizumab in Fistulising Crohn’s Disease: Exploratory Analyses of Data from GEMINI 2. J Crohns Colitis 2018; 12: 621–626.
- [22] Khorrami S, Ginard D, Marín‑Jiménez I, et al. Ustekinumab for the treatment of refractory Crohnʼs disease the Spanish experience in a large multicentre open‑label cohort. Inflamm Bowel Dis 2016; 22: 1662–1669.
- [23] Satyam VR, Zullow S, Noronha A, et al. Efficacy of ustekinumab in patients with refractory perianal Crohn’s disese in a tertiary care IBD center. DDW 2018 Mo1875.
- [24] Schreiber S, Lawrance IC, Thomsen OØ, et al. Randomised clinical trial: certolizumab pegol for fistulas in Crohn’s disease – subgroup results from a placebo‑controlled study. Aliment Pharmacol Ther 2011; 33: 185–193.
- [25] Dewint P, Hansen BE, Verhey E, et al. Adalimumab combined with ciprofloxacin is superior to adalimumab monotherapy in perianal fistula closure in Crohn’s disease:a randomised, double‑blind, placebo controlled trial (ADAFI). Gut 2014; 63: 292–299.
- [26] Jones JL, Kaplan GG, Peyrin‑Biroulet L, et al. Effects of concomitant immunomodulator therapy on efficacy and safety of anti‑tumor necrosis factor therapy for Crohn’s disease:a meta‑analysis of placebo‑controlled trials. Clin Gastroenterol Hepatol 2015; 13: 2233–2240.e1‑e2.
- [27] Ruemmele FM, Veres G, Kolho KL, et al. European Society of Pediatric Gastroenterology, Hepatology and Nutrition. Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn’s disease. J Crohns Colitis 2014; 8: 1179–1207.
- [28] Mahadevan U, Marion JF, Present DH. Fistula response to methotrexate in Crohn’s disease:a case series. Aliment Pharmacol Ther 2003; 18: 1003–1008.
- [29] Grégoire C, Lechanteur C, Briquet A, et al. Review article:mesenchymal stromal cell therapy for inflammatory bowel diseases. Aliment Pharmacol Ther 2017; 45: 205–221.