Farmakoterapie stabilní anginy pectoris
Léčba stabilní anginy pectoris (AP) musí být komplexní. Tvoří ji nezbytná preventivní opatření, farmakologická léčba a invazivní revaskularizace myokardu, buď katetrizační nebo chirurgická. Farmakologická a invazivní léčba nejsou konkurenční, ale vzájemně se doplňují.
Článek přináší přehled farmakologické léčby stabilní AP tak, jak je uvedeno v novém Doporučeném postupu pro diagnostiku a léčbu stabilní AP České kardiologické společnosti z roku 2010. U každého nemocného musí být důsledně uplatňována všechna sekundárně preventivní opatření, nefarmakologická i farmakologická. Vlastní farmakologickou léčbu AP je možné formálně rozdělit na léčbu ovlivňující prognózu a léčbu ovlivňující symptomy. Do léčby ovlivňující prognózu patří postupy zabraňující uzávěru věnčité tepny (protidestičkové léky – antiagregancia), dále pak léky upravující endoteliální dysfunkci, stabilizující aterosklerotické pláty, případně navozující regresi aterosklerózy (statiny, inhibitory ACE a sartany) a konečně léky snižující riziko vzniku arytmií (betablokátory). Pro symptomatickou farmakologickou léčbu jsou k dispozici léky zpomalující srdeční frekvenci (betablokátory, bradykardizující blokátory kalciových kanálů a ivabradin), dále léky zlepšující koronární průtok relaxací koronárního řečiště (blokátory kalciových kanálů, dlouhodobě působící nitráty a molsidomin) a konečně metabolicky působící léky (trimetazidin a ranolazin). Betablokátory jako jediné léky ovlivňující vedle symptomů i prognózu jsou antianginózními léky první volby. K přerušení záchvatu AP se používají krátkodobě účinkující nitráty (nitroglycerin a isosorbiddinitrát) podávané intraorálně v tabletách nebo v aerosolu.
Úvod
Ischemická choroba srdeční (ICHS) je jedním z nejčastěji se vyskytujících onemocnění v rozvinutých zemích včetně České republiky. Je nejčastější příčinou závažné morbidity i mortality dospělé populace. V ČR je více než polovina všech hospitalizací dospělých na interních odděleních podmíněna kardiovaskulárními chorobami. Kardiovaskulární choroby jsou u nás na prvním místě příčin úmrtí. V roce 2008 na ně zemřelo 52 000 lidí, což představovalo polovinu všech úmrtí. Přitom samotná ICHS je příčinou přibližně 40 % všech úmrtí [1]. V posledních dvaceti letech pozorujeme v ČR významný pokles standardizované kardiovaskulární mortality, nejvýraznější je pokles mortality na cerebrovaskulární a koronární příhody, který dosáhl 50 % pro obě pohlaví [1]. Jeho příčiny nejsou zcela jasné. Nové a účinnější způsoby léčby jsou odpovědné pouze za část tohoto poklesu. Daleko větší význam zřejmě mají změny životního stylu, např. pokles kouření cigaret v některých skupinách obyvatelstva, zdravější stravovací návyky, ale také neustále se zlepšující detekce a účinnější léčba hypertenze i dyslipidemií a obecně důslednější uplatňování zásad primární a sekundární prevence.
Stabilní angina pectoris (AP) je jednou z nejčastějších klinických manifestací ICHS. Je prvomanifestací ICHS přibližně u poloviny nemocných. V roce 2010 Česká kardiologická společnost vypracovala a publikovala Doporučený postup pro diagnostiku a léčbu stabilní anginy pectoris [2], který shrnuje současný stav znalostí a jehož doporučení jsou založena na existujících důkazech. Je pravda, že ve srovnání s ostatními oblastmi kardiologie nechybějí u stabilní anginy pectoris klinické studie, ale jen nemnohé z nich jsou studie mortalitní. Léčba stabilní anginy pectoris musí být komplexní, zahrnuje zásady sekundární prevence aterosklerózy a jejích klinických projevů a vlastní léčbu. Léčebné postupy jsou jednak farmakologické, jednak nefarmakologické – invazivní revaskularizace myokardu, ať již katetrizační, nebo chirurgická. Farmakologická léčba a invazivní postupy revaskularizace myokardu nejsou konkurenčními léčebnými postupy, ale naopak se navzájem doplňují. V následujícím textu shrnujeme farmakologickou léčbu stabilní anginy pectoris.
Léčba stabilní AP
Péče o nemocného s chronickými formami ICHS má dva aspekty: zlepšení prognózy a úpravu kvality života čili zbavení potíží. Nemocného nejvíce ohrožuje akutní uzávěr věnčité tepny, porucha srdečního rytmu a vývoj dysfunkce levé komory. Potíže vycházejí z myokardiální ischemie (stenokardie či jejich ekvivalenty), z poruch srdečního rytmu či z dysfunkce srdečních komor. Jednotlivé léčebné kroky by měly vést k zabránění uzávěru věnčité tepny trombem (antitrombotika), ke stabilizaci a zabránění progrese sklerotického plátu (hypolipidemika, zejména statiny), k prevenci vzniku arytmií či k léčbě již přítomných poruch rytmu (betablokátory, antiarytmika), k zamezení remodelace komory a vývoje srdeční insuficience (blokátory systému renin-angiotenzin-aldosteron – RAAS, léčba hypertenze) a rovněž je třeba předcházet myokardiální ischemii (bradykardizující, vazodilatační a eventuálně metabolickou léčbou). Profylaxe ischemie zlepší kvalitu života, není však doložen dopad na prognózu.
Sekundární prevence u nemocných se stabilní anginou pectoris
Nemocný s AP již má manifestní ischemickou chorobu srdeční, má vysoké riziko vzniku komplikací, včetně akutního infarktu myokardu nebo náhlé srdeční smrti. Je proto zbytečné u něj stanovovat absolutní kardiovaskulární riziko tak, jako to děláme v primární prevenci [3]. U nemocných se stabilní AP by se automaticky měl realizovat soubor opatření, která souhrnně nazýváme sekundární prevence. Její zásady jsou totožné s primární prevencí u nemocných s vysokým kardiovaskulárním rizikem, musejí být aplikovány důsledně a razantně [3]. Navíc přibývají některá preventivní opatření farmakologická.
Modifikace životního stylu a důsledná intervence všech ovlivnitelných rizikových faktorů včetně farmakoterapie hypertenze a dyslipidemií je tím nejzákladnějším a naprosto nutným opatřením u každého nemocného. Cílové hodnoty krevního tlaku (< 130/80 mm Hg) stejně jako celkového a LDL cholesterolu (< 4,5 mmol/l a < 2,5 mmol/l) jsou ale nižší než v primární prevenci. Zvláštní pozornost si zaslouží kouření. Kardiovaskulární mortalita nemocných, kteří i se stabilní AP kouří, je dvojnásobně vyšší nežli těch, kteří nekouří nebo kouřit přestali. Abstinence od kouření je tím nejúčinnějším opatřením v sekundární prevenci. Žádný lék nedokáže snížit mortalitu o 50 %, jako to dokáže přerušení kuřáckého zlozvyku.
Farmakologická léčba ovlivňující prognózu
Zabránění uzávěru tepny trombem – protidestičková léčba (antiagregancia)
Antiagregační léčba vede ke snížení mortality a výskytu reinfarktů o 20–25 %. Je proto odůvodněné, aby byla všem nemocným se stabilní AP, kteří nemají absolutní kontraindikace, poskytnuta.
Lékem první volby je kyselina acetylsalicylová (ASA), která ireverzibilně blokuje destičkový enzym cyklooxygenázu-1 (COX-1), a působí tak po celou dobu cirkulace trombocytu. Doporučovaná denní dávka je mezi 75–150 mg, u nás je obvyklé dávkování 1krát denně 100 mg per os. Při této nízké dávce je riziko krvácivých komplikací minimální. Léčba by měla být celoživotní. Se zvyšující se dávkou antiagregační účinek nestoupá, ale narůstá riziko krvácivých komplikací a nežádoucích účinků v oblasti gastrointestinálního traktu.
Alternativou podávání ASA jsou inhibitory destičkových receptorů pro adenosindifosfát (ADP): tiklopidin, klopidogrel a nově také prasugrel. Tyto léky, patřící do skupiny thienopyridinů, jsou nekompetitivními inhibitory destičkového receptoru P2Y12, klíčového receptoru pro ADP. Mají podobné protidestičkové účinky jako ASA. Tiklopidin byl takřka úplně nahrazen klopidogrelem, který je bezpečnější a zejména nepůsobí neutropenii. Ve studii CAPRIE byl u nemocných s různými klinickými manifestacemi aterosklerózy klopidogrel v dávce 75 mg denně v prevenci kardiovaskulárních příhod jen o 7,6 % účinnější než ASA v denní dávce 325 mg [4]. Výskyt krvácivých komplikací do gastrointestinálního traktu byl přitom při podávání klopidogrelu jen o málo nižší, i přes relativně vysokou denní dávku ASA. Klopidogrel je však výrazně dražší než ASA. Je proto alternativním antiagregans pro nemocné s kontraindikacemi nebo intolerancí ASA.
Obdobně jako na ASA, i na klopidogrel se vyskytuje rezistence. Přibližně třetina nemocných neodpovídá na léčbu dostatečně. Příčinou je skutečnost, že klopidogrel je proléčivo a je nutná jeho bioaktivace v játrech na aktivní metabolit za účasti řady izoenzymů, kde klíčovým enzymem je oxidáza CYP2C19. U 25–30 % evropské populace není tento izoenzym aktivní a konverze na účinný metabolit selhává. Druhou příčinou rezistence může být inhibice oxidázy CYP2C19 silnými inhibitory, jakými jsou zejména omeprazol či lansoprazol. Nakolik je však léková interakce mezi klopidogrelem a některými inhibitory protonové pumpy klinicky relevantní, zůstává stále předmětem vášnivé diskuse. Některé práce dokládají relativně nižší riziko pantoprazolu a esomeprazolu v inhibici bioaktivace, proto by tyto inhibitory protonové pumpy měly být u nemocných s antiagregační léčbou klopidogrelem používány přednostně [5]. Kontroverzní zůstává také význam farmakogenetického testování pro prevenci selhání léčby klopidogrelem, které je sice v ČR dostupné, ale jeho klinický význam zatím jednoznačně prokázán nebyl. Alternativou je volba prasugrelu, jehož bioaktivace není závislá na aktivitě CYP2C19.
Klopidogrel se také často používá jako alternativní antiagregans u nemocných s intolerancí ASA gastrointestinálním traktem. Na rozdíl od ASA sice klopidogrel nemá přímý účinek na sliznici žaludku a působí méně často dyspeptické potíže, je však nutné konstatovat, že riziko krvácení do gastrointestinálního traktu stoupá při každé protidestičkové léčbě. Nebezpečí gastrointestinálního krvácení při ASA může být sníženo současným podáváním antacid, eradikací infekce Helicobacter pylori nebo podáváním inhibitorů protonové pumpy s výše uvedenými omezeními.
Pro nemocné, kteří prodělali infarkt myokardu bez elevací úseku ST (NSTEMI) nebo koronární intervenci se zavedením intrakoronárního stentu, přináší další prospěch duální antiagregační léčba – kombinace ASA a klopidogrelu. Její podávání je časově omezeno. Po zavedení metalického intrakoronárního stentu při perkutánní koronární intervenci (percutaneous coronary intervention – PCI) se doporučuje na dobu jednoho měsíce, u nemocných, kteří proděla-li NSTEMI, na 6–12 měsíců; po zavadení stentu uvolňujícího léky (drug eluting stent – DES) není optimální doba podávání jasná, podle informací dostupných v současnosti by měla trvat alespoň 12 měsíců.
Úprava endoteliální dysfunkce, stabilizace plátu, zástava aterogeneze
Stabilizace cévní stěny je účinným léčebným postupem snižujícím riziko trombotické okluze i progrese aterosklerotického postižení. Vedle abstinence od aktivního i pasivního kouření, kontroly případné hypertenze či diabetu mellitu je rozhodující důsledná léčba dyslipidemií s využitím všech nefarmakologických i farmakologických možností. U nemocných s ICHS musí být snaha dosáhnout hodnot lipidogramu, při kterých dochází k regresi aterosklerotických plátů, tj. plazmatické koncentrace LDL cholesterolu < 2,5 mmol/l (u zvlášť rizikových nemocných < 2,0 mmol/l, je-li to možné), HDL cholesterolu u žen > 1,2 mmol/l, u mužů > 1,0 mmol/l a trigacyl-glycerolemie < 1,7 mmol/l [3]. Endoteliální dysfunkci také zlepšuje farmakologická blokáda RAAS, která působí komplexním mechanismem i v jiných etážích.
Statiny
K léčbě hypercholesterolemie, resp. k dosažení cílových hodnot LDL cholesterolu, jsou nejúčinnější statiny. Jejich hypolipidemická účinnost stoupá v řadě pravastatin, lovastatin, fluvastatin (ve formě s prodlouženým účinkem), simvastatin, atorvastatin a rosuvastatin. Zlepšení prognózy je závislé na dosaženém poklesu aterogenních lipidů. Poklesu hladiny LDL cholesterolu o více než 50 %, při kterém je dokumentována regrese aterosklerotických plátů, je možné dosáhnout pouze vysokými dávkami atorvastatinu či rosuvastatinem. V dávkách obvykle užívaných je možno počítat s asi 20–30% snížením mortality, pokles incidence infarktu myokardu (IM) je výraznější. Výskyt nežádoucích účinků je při léčbě statiny velmi nízký, vedle občasných drobných dyspeptických potíží či průjmu se mohou objevit zejména myalgie až lehké myopatie, potenciálně letální rabdomyolýza je však mimořádně vzácná s výskytem 5–10 případů/milion léčených.
Nedosáhne-li se cílových hodnot lipidogramu ani vyššími dávkami statinů, je možná kombinace statinu s dalším hypolipidemikem – ezetimibem, fibrátem nebo kyselinou nikotinovou v kombinaci s laropiprantem. Od přidání ezetimibu je možno očekávat další pokles hladiny LDL cholesterolu o 15–20 %, tedy obdobný účinek, jako má minimálně ztrojnásobení dávky statinu; výskyt nežádoucích účinků se však nezvyšuje. Kombinace s fibrátem nebo s kyselinou nikotinovou (s laropiprantem) vede k výraznějšímu poklesu hladin triacylglycerolů a většímu vzestupu koncentrace HDL cholesterolu. Přesvědčivé důkazy příznivého dopadu kombinační hypolipidemické léčby na prognózu nemocných však zatím chybějí.
Inhibitory ACE a sartany
Dalšími skupinami léků upravujících endoteliální dysfunkci jsou inhibitory angiotenzin konvertujícího enzymu (ACE) a blokátory receptorů AT1 pro angiotenzin II – sartany. Mechanismem pozitivního účinku je úprava hyperaktivované osy renin-angiotenzin-aldosteron (RAA), snížení krevního tlaku a zlepšení endoteliální funkce. Důkazy o příznivém dopadu léčby na prognózu a výskyt kardiovaskulárních příhod také u normotenzních nemocných s chronickou ICHS existují pro ramipril [6], perindopril [7] a telmisartan [8]. Při srovnání jednotlivých inhibitorů ACE mezi sebou bylo u nemocných po prodělaném infarktu myokardu a nemocných s chronickým srdečním selháním pozorováno, že léčba ramiprilem a perindoprilem je spojena s nižší mortalitou ve srovnání s inhibitory ACE s kratší dobou účinku. Farmakologická blokáda RAAS inhibitory ACE nebo sartany vede v sekundární prevenci k poklesu závažné kardiovaskulární morbidity a mortality přibližně o 20 %. Léčba je indikována především u nemocných s hypertenzí, diabetem mellitem, dysfunkcí levé srdeční komory, srdečním selháním či při nefropatii s proteinurií.
Prevence poruch srdečního rytmu
Betablokátory
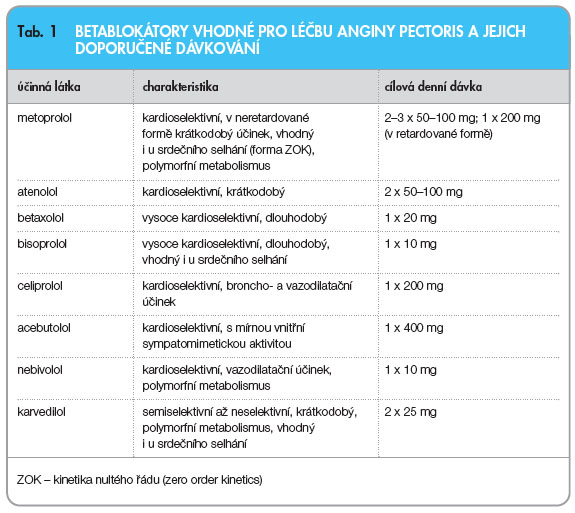
Užití betablokátorů v léčbě chronických forem ICHS vede ke zlepšení prognózy i snížení výskytu ischemie myokardu a ke zlepšení tolerance zátěže. Komplexním účinkem, tj. snížením rizika závažných arytmií (vzestupem fibrilačního prahu), poklesem krevního tlaku či zlepšením myokardiální perfuze, se dosáhne poklesu výskytu náhlé smrti o 30–40 %, reinfarktu o 30–35 % a celkové mortality o 20–25 % [9]. Pro výběr betablokátoru má největší význam afinita k receptorům b1 či b2 (tj. kardioselektivita). V kardiologických indikacích se užívají kardioselektivní přípravky, protože mají méně nežádoucích metabolických účinků a jsou lépe tolerovány. Některé betablokátory jsou také parciálními agonisty b-receptorů neboli mají vnitřní sympatomimetickou aktivitu (ISA). Ta není v sekundární prevenci žádoucí, neboť snižuje terapeutickou odpověď [9]. Pro výběr betablokátoru je důležitý i metabolický profil, konkrétně ovlivnění citlivosti k inzulinu. Betablokátory, zejména neselektivní, navozují inzulinorezistenci. Výjimkou je skupina s přídatným vazodilatačním účinkem, jako je kombinovaný alfa- i beta-blokátor karvedilol, dále nebivolol, který uvolňuje oxid dusnatý, či blokátor b1-receptorů se stimulačním působením na b2-receptory celiprolol. U všech těchto přípravků existují důkazy o příznivém, či alespoň neutrálním působení na glycidový metabolismus. U pacientů s diabetem a u osob s vysokým rizikem vzniku cukrovky (obézní, s pozitivní rodinnou anamnézou či s vyšší glykemií nalačno) by měly být betablokátory s příznivým metabolickým profilem preferovány. Nutno zdůraznit, že diabetici jako nemocní s vysokým kardiovaskulárním rizikem mají větší přínos z podávání betablokátorů než nediabetici.
Kontraindikací podávání betablokátorů jsou síňo-komorové blokády vyššího stupně a sick sinus syndrom bez zajištění trvalou kardiostimulací, těžké nestabilní srdeční selhání, těžká hypotenze (se systolickým TK < 90 mm Hg) a bronchiální astma. Chronická obstrukční plicní nemoc, deprese a ischemická choroba dolních končetin nejsou absolutními kontraindikacemi, při těchto komorbiditách je možno užít vysoce kardioselektivní bisoprolol či betaxolol či celiprolol s b2-mimetickým účinkem. U depresivních osob se nemají podávat lipofilní betablokátory. U variantní anginy se mají betablokátory, jsou-li indikovány z jiného důvodu, podávat pouze současně s účinnou vazodilatační léčbou (optimálně s vyšší dávkou amlodipinu), jinak hrozí akcentace koronárních spasmů.
U nemocných s AP nebyly s betablokátory provedeny žádné prognostické studie, pouze se extrapolují příznivé výsledky z poinfarktových studií. Významným omezením platnosti jejich závěrů je, že poinfarktové studie s betablokátory byly většinou provedeny v osmdesátých letech minulého století, tedy v době, kdy se ještě nepoužívala sekundárně preventivní farmakoterapie, jakou představují statiny či inhibitory ACE. Rozdíly v terapeutickém přístupu proto vzbuzují určité pochybnosti, zda jsou závěry těchto studií platné i při současné léčbě. Nicméně stále platí, že betablokátory jsou u nemocných s AP i němou ischemií, kteří nemají kontraindikace, považovány za antianginózní léky první volby.
 Velmi důležitá je otázka dávky. Vzhledem k interindividuálním rozdílům v působení je nejlepší se orientovat podle dosažené klidové srdeční frekvence. Tento postup je podložen i výsledky klinických studií, snížení mortality je přímo úměrné bradykardizujícímu účinku [9]. Optimální hodnoty klidové srdeční frekvence se pro většinu nemocných pohybují v rozmezí 50–60 tepů/min. Při této frekvenci je předpoklad dostatečné sympatoadrenální inhibice, a navíc se docílí i optimální perfuze koronárními tepnami. Nemá-li nemocný potíže, pak není třeba se obávat ani klidové bradykardie pod hodnotou 50 tepů/min. Ideálně by podávaná dávka betablokátoru měla též limitovat vzestup srdeční frekvence při zátěži na 75 % srdeční frekvence, která vyvolává ischemii myokardu. Ukončení léčby betablokátory nesmí být náhlé, lék se musí vysazovat postupně během několika dnů. Při náhlém vysazení hrozí vznik ischemie myokardu, akcentace anginózních potíží a vzácně až vznik infarktu myokardu.
Velmi důležitá je otázka dávky. Vzhledem k interindividuálním rozdílům v působení je nejlepší se orientovat podle dosažené klidové srdeční frekvence. Tento postup je podložen i výsledky klinických studií, snížení mortality je přímo úměrné bradykardizujícímu účinku [9]. Optimální hodnoty klidové srdeční frekvence se pro většinu nemocných pohybují v rozmezí 50–60 tepů/min. Při této frekvenci je předpoklad dostatečné sympatoadrenální inhibice, a navíc se docílí i optimální perfuze koronárními tepnami. Nemá-li nemocný potíže, pak není třeba se obávat ani klidové bradykardie pod hodnotou 50 tepů/min. Ideálně by podávaná dávka betablokátoru měla též limitovat vzestup srdeční frekvence při zátěži na 75 % srdeční frekvence, která vyvolává ischemii myokardu. Ukončení léčby betablokátory nesmí být náhlé, lék se musí vysazovat postupně během několika dnů. Při náhlém vysazení hrozí vznik ischemie myokardu, akcentace anginózních potíží a vzácně až vznik infarktu myokardu.
Přehled betablokátorů, jejich stručná charakteristika a obvyklé dávkování při AP jsou uvedeny v tab. 1.
Farmakologická léčba ovlivňující symptomy a ischemii
Vlastní farmakoterapii odstraňující potíže nemocného (antianginózní symptomatickou léčbu) je možné formálně rozdělit na:
a) léčbu anginózního záchvatu,
b) profylaktickou antianginózní léčbu.
Léčba anginózního záchvatu
K přerušení anginózního záchvatu se používají krátkodobě působící nitráty. Základním lékem je nitroglycerin (glyceroltrinitrát). Je k dispozici v řadě aplikačních forem, nejčastěji jako sublinguální tablety nebo perorální sprej. Při sublinguální aplikaci nebo po použití orálního aerosolu mizí anginózní bolest zpravidla za jednu až pět minut. Pro akutní použití jsou k dispozici také aerosolové přípravky obsahující isosorbid 2,5-dinitrát (ISDN), s nástupem účinku za jednu až dvě minuty. Všichni nemocní se stabilní AP by měli mít trvale u sebe k dispozici krátkodobě působící nitrát (nitroglycerin nebo ISDN) a měli by být instruováni, jak ho správně používat. Měli by být informováni, že tyto krátkodobě působící přípravky mohou používat tak často, jak je potřeba, bez jakýchkoli dlouhodobých následků. Mohou být také použity profylakticky před fyzickou zátěží.
Nitroglycerin může mít nežádoucí účinky vyplývající z náhlé vazodilatace. Jejich výskyt je závislý na dávce. Nejčastějšími jsou bolest hlavy a zrudnutí. Vyšší dávky mohou vést k hypotenzi, vzácně i k těžké nebo k tzv. nitroglycerinové synkopě. Spotřeba krátkodobě účinkujících nitrátů je také jednoduchým a dobrým ukazatelem léčebného účinku profylakticky používaných antianginózních léků.
Profylaktická antianginózní léčba
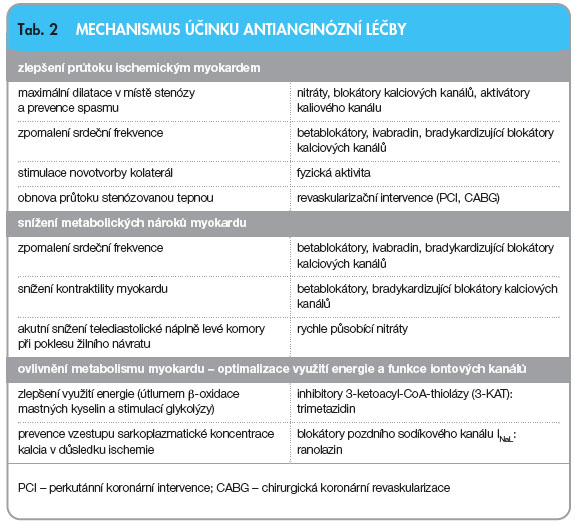 Profylaktická antianginózní léčba má za cíl odstranit, nebo alespoň zmenšit potíže nemocného. S výjimkou betablokátorů však neovlivňuje prognózu. K dispozici jsou následující léky rozdělené do skupin podle mechanismu účinku (viz tab. 2): 1. bradykardizující léčba – betablokátory nebo ivabradin, 2. vazodilatační léčba – blokátory kalciových kanálů nebo nitráty, 3. metabolická léčba – trimetazidin nebo ranolazin.
Profylaktická antianginózní léčba má za cíl odstranit, nebo alespoň zmenšit potíže nemocného. S výjimkou betablokátorů však neovlivňuje prognózu. K dispozici jsou následující léky rozdělené do skupin podle mechanismu účinku (viz tab. 2): 1. bradykardizující léčba – betablokátory nebo ivabradin, 2. vazodilatační léčba – blokátory kalciových kanálů nebo nitráty, 3. metabolická léčba – trimetazidin nebo ranolazin.
Přípravky z různých skupin lze s výhodou vzájemně kombinovat. Léčba se obvykle zahajuje monoterapií, pokud není dostatečně účinná, přechází se na dvojkombinaci a u značně symptomatických nemocných výjimečně i na trojkombinaci léků. Kombinace antianginózních léků však zvyšuje antianginózní a antiischemický účinek již jen málo, a proto by u každého výrazně symptomatického nemocného měla být provedena koronární angiografie a zvážena indikace k revaskularizaci, ať již katetrizační (PCI), nebo chirurgické (CABG – coronary artery bypass grafting, implantace aortokoronárních bypassů).
Léky zpomalující srdeční frekvenci
Dosažení optimální klidové srdeční frekvence (zpravidla mezi 50–60 tepy/min) je důležité, protože jednak se prodloužením diastolické fáze srdečního cyklu zlepší perfuze myokardu, jednak se sníží metabolické nároky myokardu. Dosáhnout zpomalení srdeční frekvence lze betablokátory, ivabradinem a bradykardizujícími blokátory kalciových kanálů typu L (verapamil a diltiazem).
Betablokátory jsou velmi účinné antianginózní léky. Zvyšují toleranci zátěže a snižují počet symptomatických i němých epizod ischemie myokardu. Současně jako jediná skupina antianginózních léků mají pravděpodobně také příznivý vliv na prognózu nemocných s chronickou ICHS. Snižují výskyt kardiovaskulárních příhod a zlepšují přežívání nemocných po prodělaném IM, hypertoniků a nemocných s chronickým srdečním selháním. Proto by při nepřítomnosti kontraindikací a intolerance měly být u všech nemocných se stabilní AP antianginózními léky první volby. Jejich antianginózní účinek je dán negativně chronotropním působením s následným prodloužením diastoly a zlepšením perfuze myokardu spolu s negativně inotropním účinkem se snížením spotřeby kyslíku v myokardu.
Podrobněji o vlastnostech betablokátorů viz také odstavec o prevenci poruch srdečního rytmu a tab. 1.Ivabradin je prvním klinicky používaným zástupcem nové skupiny antianginózních léků, tzv. inhibitorů sinusového uzlu (také blokátorů kanálů If). Tato látka selektivně zpomaluje spontánní depolarizaci buněk sinusového uzlu, a zpomaluje tak srdeční frekvenci. Antianginózní účinky ivabradinu a zlepšení tolerance zátěže jsou srovnatelné s betablokátory nebo amlodipinem [10]. Ivabradin je u nemocných se sinusovým rytmem alternativou k betablokátorům při jejich intoleranci či kontraindikacích. Pokles srdeční frekvence po podání ivabradinu je srovnatelný s betablokátory. Jak ukázaly výsledky klinických studií BEAUTIFUL [11] a ASSOCIATE [12], lze ho s betablokátory bezpečně kombinovat, antianginózní účinek je pak aditivní. Navíc u nemocných s klidovou srdeční frekvencí ≥ 70 tepů/min příznivě ovlivňuje prognózu [11] a zdá se, že příznivý účinek na prognózu má u všech nemocných se stabilní AP [13].
Bradykardizující blokátory kalciových kanálů (verapamil a diltiazem) představují další alternativu bradykardizující antianginózní léčby. Pokles srdeční frekvence je proti oběma předchozím skupinám léků menší, mají ale mírné vazodilatační účinky. Kvůli obdobným negativně inotropním a negativně dromotropním účinkům je kombinace verapamilu či diltiazemu s betablokátory nevhodná. Hrozí při ní vznik síňo-komorových blokád vyššího stupně anebo zhoršení systolické funkce levé komory až vznik srdečního selhání.
Léky zlepšující průtok pomocí relaxace koronárního řečiště
Jestliže není myokardiální ischemie spolehlivě kontrolována betablokátorem, spolupodílejí se koronární spasmy či je přítomna hypertenze, je výhodná léčba působící relaxaci svaloviny epikardiální části koronárního řečiště. Koronární vazodilatancia lze výhodně kombinovat s bradykardizující léčbou, ať již s betablokátory, nebo s ivabradinem. Do této široké skupiny léků patří blokátory kalciového kanálu, nitráty a jiné donátory NO. Aktivátory draslíkového kanálu (nikorandil), které mechanismem účinku patří také do této skupiny, nejsou v ČR registrovány.Blokátory kalciových kanálů (BKK) dihydropyridinového typu mají vysokou cévní selektivitu. Vedou k relaxaci arterií i rezistenčních arteriol a přitom mají minimální účinek na kontraktilitu myokardu a tvorbu i vedení vzruchu. K profylaxi ischemie jsou u nás registrovány z dihydropyridinových BKK amlodipin a felodipin ve formě s prodlouženým účinkem, z non-dihydropyridinových BKK pak verapamil a diltiazem, optimálně opět ve formě s řízeným uvolňováním.
Vzhledem k tomu, že rychle navozená periferní vazodilatace může vést k sympatoadrenální aktivaci, volí se přednostně BKK s pomalým nástupem účinku – k profylaxi ischemie myokardu je z této skupiny schválen pouze amlodipin a felodipin. Amlodipin je výhodný pro pomalý nástup účinku, dlouhodobé působení, ale také pro minimální riziko lékových interakcí a konečně pro možnost podávat ho i při zhoršené funkci levé komory. Dlouhý biologický poločas (kolem 50 hodin) amlodipinu zajišťuje účinek i při vynechání jedné dávky. Další předností je výhodná kombinace amlodipinu s betablokátory; klinickými studiemi je doložen významný aditivní účinek na pokles ischemické zátěže (CAPE II) [14] či na pokles výskytu kardiovaskulárních příhod (CAMELOT) [15].
Vhodnou alternativou k profylaxi stenokardií u AP je také verapamil, eventuálně diltiazem, oba podávané v retardované formě. Ve srovnání s BKK dihydropyridinového typu mají menší cévní selektivitu a negativní dromotropní, chronotropní i inotropní účinky. Účinek na převodní systém je výhodný u nemocných s AP a fibrilací síní s rychlejší komorovou odpovědí. Kvůli negativně inotropnímu účinku jsou non-dihydropyridinové BKK kontraindikovány u nemocných se systolickou dysfunkcí levé srdeční komory nebo srdečním selháním. Optimální indikací je AP při nemožnosti podat betablokátor, kdy se využívá jak vazodilatační, tak i bradykardizující účinek verapamilu. Je nutno upozornit, že jak verapamil, tak diltiazem jsou poměrně silnými inhibitory exponovaného izoenzymu CYP3A4, který metabolizuje řadu často používaných léků (např. simvastatin, atorvastatin, sildenafil, řadu psychofarmak a jiné), a membránového transportního glykoproteinu P (P-gp). Kombinace verapamilu s betablokátory přináší riziko převodních blokád a zhoršení kontraktility. Při kombinaci verapamilu s digoxinem, který je substrátem P-gp, je vhodné kontrolovat plazmatickou koncentraci digoxinu a redukovat jeho dávku zhruba na polovinu. K léčbě AP nejsou vhodné krátkodobě působící BKK, zejména nifedipin, a to ani ve formě s prodlouženým účinkem, neboť byl doložen negativní prognostický dopad [16].
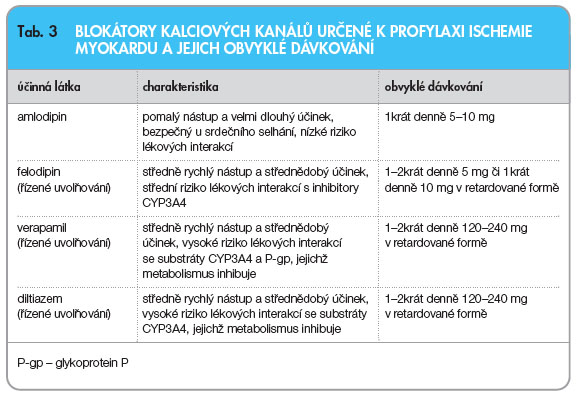 Důkaz o snížení mortality u nemocných léčených BKK pouze z indikace AP (tedy nikoli též pro hypertenzi) podán nebyl. U non-dihydropyridinových BKK – verapamilu a diltiazemu – existují prognostické studie u nemocných po infarktu myokardu, ve kterých byl u nemocných se zachovanou funkcí levé komory dokumentován pokles morbidity a mortality asi o pětinu (DAVIT-II a MDPIT) [17, 18]. Není však jasné, zda jejich závěry platí i v době moderní léčby chronických forem ICHS (tj. se současnou aplikací inhibitorů ACE, betablokátorů, statinů apod.). Blokátory kalciových kanálů používané pro léčbu AP a jejich obvyklé dávkování jsou uvedeny vtab. 3.
Důkaz o snížení mortality u nemocných léčených BKK pouze z indikace AP (tedy nikoli též pro hypertenzi) podán nebyl. U non-dihydropyridinových BKK – verapamilu a diltiazemu – existují prognostické studie u nemocných po infarktu myokardu, ve kterých byl u nemocných se zachovanou funkcí levé komory dokumentován pokles morbidity a mortality asi o pětinu (DAVIT-II a MDPIT) [17, 18]. Není však jasné, zda jejich závěry platí i v době moderní léčby chronických forem ICHS (tj. se současnou aplikací inhibitorů ACE, betablokátorů, statinů apod.). Blokátory kalciových kanálů používané pro léčbu AP a jejich obvyklé dávkování jsou uvedeny vtab. 3.
Nitráty a jiné donátory NO jsou druhou skupinou léčiv často užívanou k léčbě i k profylaxi stenokardií při AP. Ve srovnání s BKK mají méně vyjádřený účinek na periferní rezistenci při srovnatelném vazodilatačním účinku na oblast epikardiálního koronárního řečiště. Pouze při podání rychle působícího nitrátu (při vysoké akutní expozici) je nutno počítat s periferní vazodilatací, venodilatací, a tedy i s rizikem náhlého poklesu krevního tlaku. Profylakticky podávané nitráty a donátory NO krevní tlak nesnižují. Díky větší selektivitě na epikardiální část koronárního řečiště jsou nitráty ve srovnání s BKK vhodnější k profylaxi AP při sklonu k hypotenzi, naopak BKK jsou ideální u nemocných s AP při normotenzi či hypertenzi.
Je-li pacient léčen nitráty (nikoli však molsidominem), je nutno počítat se vznikem tachyfylaxe, v případě nitrátů mluvíme o navození tolerance. Důvodů ke snížení farmakodynamické odpovědi je více, rozhodující však je nedostatečná konverze nitrátu na NO při vyčerpání zdroje sulfhydrylových skupin – glutathionu. Z těchto důvodů se 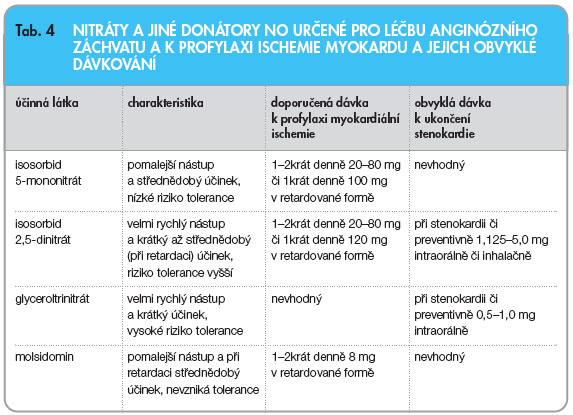 nitráty dávkují tak, aby se uplatňovaly v době jejich potřeby, tj. u nemocných s AP či s koronárním syndromem X v době fyzické aktivity, tedy zpravidla během dne, naopak u nemocných s variantní anginou s převahou nočních a časných ranních stenokardií na noc. Dávky se volí individuálně podle terapeutické odpovědi. U molsidominu, který ke svému účinku nepotřebuje sulfhydrylové skupiny, tachyfylaxe nevzniká.
nitráty dávkují tak, aby se uplatňovaly v době jejich potřeby, tj. u nemocných s AP či s koronárním syndromem X v době fyzické aktivity, tedy zpravidla během dne, naopak u nemocných s variantní anginou s převahou nočních a časných ranních stenokardií na noc. Dávky se volí individuálně podle terapeutické odpovědi. U molsidominu, který ke svému účinku nepotřebuje sulfhydrylové skupiny, tachyfylaxe nevzniká.
Pro výběr nitrátu je rozhodující indikace. K akutní léčbě stenokardie jsou k dispozici dva nitráty s velmi rychlým nástupem účinku: glyceroltrinitrát (nitroglycerin) a isosorbid 2,5-dinitrát (ISDN). K profylaxi myokardiální ischemie jsou k dispozici nitráty – isosorbid 5-mononitrát (ISMN) a isosorbid 2,5-dinitrát (ISDN) – nebo molsidomin (viz tab. 4).
Při srovnání obou nitrátů je ISMN výhodnější pro delší dobu účinku, v praxi mu proto dáváme přednost. Naopak při srovnání ISMN s molsidominem je výhodnější molsidomin, protože nenavozuje vznik tolerance, nezvyšuje oxidační stres a v obvyklých denních terapeutických dávkách je také levnější. Molsidomin je proto neprávem nedoceněn [16]. Oblíbená kombinace ISMN během dne a molsidominu k pokrytí nočních hodin nemá racionální základ, nicméně je možné ji užít při potřebě vysokých dávek nitrátu během dne a nutnosti zajistit nemocného i na noc. U naprosté většiny nemocných však vystačíme jen s jedním přípravkem. Glyceroltrinitrát není k profylaxi AP vhodný ani ve formě s prodlouženým účinkem. Důvodem je rychlé navození tolerance, riziko vzniku oxidačního stresu v cévní stěně a nedostatečná retardace dostupných přípravků.
Nejčastějším nežádoucím účinkem léčby nitráty jsou bolesti hlavy, ve farmakoekvivalentních dávkách jsou stejně časté při podávání všech přípravků a nelze jim zabránit přechodem na jiné léčivo. Mohou vymizet po snížení dávky, v profylaktické indikaci je většinou nutný přechod na BKK.
Kombinace nitrátů či molsidominu s BKK není obecně indikována, protože při užití dostatečných terapeutických dávek není přítomen aditivní účinek. Pouze u nemocných s variantní anginou může být kombinace, například noční aplikace dlouhodobě působícího nitrátu při udržovací léčbě BKK (nejlépe amlodipinem), výhodná. Dlouhodobě působící nitráty lze s výhodou kombinovat s betablokátory. Účinek na pokles myokardiální ischemie i stenokardií je u této kombinace aditivní, nitráty navíc sníží riziko vazospastických reakcí, které mohou beta-blokátory navodit. Je nutné upozornit na riziko fatální hypotenze při kombinaci nitrátu s inhibitory fosfodiesterázy 5 (PDE-5), tj. sildenafilem, vardenafilem či tadalafilem. Riziko interakce trvá po užití prvních dvou inhibitorů PDE-5 po dobu 24 hodin, po podání tadalafilu až 48 hodin.
Metabolicky působící léky
Metabolicky aktivní léky jsou indikovány jako podpůrná antianginózní léčba tam, kde léčba přípravky prvních dvou skupin nebo jejich kombinací není dostatečně účinná nebo kdy ji nelze použít.
Trimetazidin je prvním zástupcem nové skupiny antianginózních léků – inhibitorů 3-ketoacyl-CoA-thiolázy (3-KAT), jež se také nazývají metabolické modulátory. Inhibice 3-KAT v kardiomyocytech potlačuje b-oxidaci mastných kyselin nevýhodnou kvůli spotřebě kyslíku a přesunuje výrobu adenosintrifosfátu (ATP) na anaerobní glykolýzu, čímž se při stejné spotřebě kyslíku v ischemickém myokardu zvýší nabídka makroergních fosfátů a zabrání se akumulaci kyseliny mléčné a vzniku intracelulární acidózy.
U nemocných s AP má trimetazidin prokazatelný antiischemický účinek, který je aditivní k účinku jak bradykardizujících, tak i vazodilatačních antianginózních léků. Snižuje výskyt anginózních záchvatů, spotřebu nitroglycerinu a zvyšuje toleranci zátěže i anginózní práh [20]. Jeho výhodou je to, že nemá žádné hemodynamické účinky, neovlivňuje srdeční frekvenci, krevní tlak ani kontraktilitu myokardu. Je proto velmi dobře tolerován a nežádoucí účinky jsou vzácné a banální. Je vhodný především pro kombinační léčbu u nemocných, u kterých nejsou potíže uspokojivě kontrolovány stávající antianginózní léčbou. Informace o dopadu na prognózu nemocných se stabilní AP chybějí. Používá se výhradně v retardované formě (modified release – MR), obvyklé dávkování je 2krát denně 35 mg.
Ranolazin představuje druhou možnost, jak příznivě ovlivnit metabolismus ischemického myokardu. Blokádou pozdního sodíkového kanálu INaL zabraňuje zvýšení sarkoplazmatické koncentrace kalcia a tím snižuje negativní dopad ischemie na myokard. Kanál INaL je krátce aktivován během systoly, kdy udržuje trvání akčního potenciálu, ischemie stimuluje jeho aktivaci. Důsledkem je zvýšení cytosolické koncentrace sodíku se sekundárním vzestupem koncentrace kalcia, což vede k nevýhodné stimulaci kontraktility, zhoršení relaxace a zvýšení dráždivosti a elektronestability myokardu. U ranolazinu však existuje zatím relativně málo důkazů o zlepšení tolerance zátěže u nemocných s AP. Odečte-li se placebo efekt, prodloužení doby do vzniku myokardiální ischemie se ve studiích pohybovalo jen kolem 10 %. Účinek je aditivní k účinkům betablokátorů a blokátorů kalciových kanálů.
Taktika antianginózní léčby
Každý nemocný se stabilní AP má mít u sebe nepřetržitě krátkodobě účinkující nitrát pro přerušení anginózního záchvatu. Profylaktická antianginózní léčba by měla být zahajována monoterapií kardioselektivním betablokátorem v optimální dávce. Při kontraindikacích nebo intoleranci beta-blokátorů může ![Obr. 1 Algoritmus léčby stabilní anginy pectoris; podle [2] – Hradec, et al., 2010.](https://www.remedia.cz/photo-a-28388---.jpg) být jako alternativa použit buď bradykardizující blokátor kalciových kanálů (verapamil, diltiazem) nebo ivabradin. Pokud nemocný zůstává stále významně symptomatický, přidává se buď vazodilatačně působící antianginózní lék (blokátor kalciových kanálů dihydropyridinového typu či dlouhodobě působící nitrát) nebo trimetazidin. Trojkombinace antianginózních léků nemá obvykle příliš větší účinek než dvojkombinace léků v dostatečných dávkách. Zůstává-li nemocný i při léčbě dvojkombinací antianginózních léků výrazně symptomatický, je lépe provést koronární angiografii a zvážit možnosti invazivní léčby, než přidávat třetí antianginózní lék. Algoritmus léčby stabilní AP uvádí obr. 1. Při nedostatečném antianginózním účinku léků je také vždy třeba vzít v úvahu eventuální nízkou compliance nemocného s léčbou.
být jako alternativa použit buď bradykardizující blokátor kalciových kanálů (verapamil, diltiazem) nebo ivabradin. Pokud nemocný zůstává stále významně symptomatický, přidává se buď vazodilatačně působící antianginózní lék (blokátor kalciových kanálů dihydropyridinového typu či dlouhodobě působící nitrát) nebo trimetazidin. Trojkombinace antianginózních léků nemá obvykle příliš větší účinek než dvojkombinace léků v dostatečných dávkách. Zůstává-li nemocný i při léčbě dvojkombinací antianginózních léků výrazně symptomatický, je lépe provést koronární angiografii a zvážit možnosti invazivní léčby, než přidávat třetí antianginózní lék. Algoritmus léčby stabilní AP uvádí obr. 1. Při nedostatečném antianginózním účinku léků je také vždy třeba vzít v úvahu eventuální nízkou compliance nemocného s léčbou.
Léčba zvláštních klinických situací
Němá ischemie myokardu
Obecně lze říci, že nemocní s němou ischemií myokardu vyžadují stejné zásahy do životosprávy jako nemocní se stabilní AP. Farmakoterapie je zaměřena na stabilizaci plátu a profylaxi trombotické okluze, tj. na postupy zlepšující prognózu. O indikaci antiischemické léčby blokátory kalciového kanálu není shoda. Není totiž známo, zda důsledná prevence ischemických epizod může ovlivnit průběh choroby a zlepšit prognózu nemocných. Shoda panuje o nezbytnosti důsledné sekundární prevence včetně intervence všech ovlivnitelných rizikových faktorů a podávání léků, které ovlivňují prognózu, tj. betablokátorů, ASA a statinů.
Variantní (vazospastická) angina
Léčba je u nemocných s variantní anginou nesmírně důležitá. Je-li dobře vedena, může nemocné nejen zbavit příznaků, ale zásadním způsobem ovlivnit i jejich prognózu. Péče o nemocné s koronárními spasmy má některé zvláštnosti. Předně je nadmíru důležitá abstinence od kouření. Přestane-li nemocný kouřit, projeví se účinek často bezprostředně. Intenzivně je nutno léčit častou dyslipidemii, jejíž úprava je podmínkou zlepšení endoteliální dysfunkce a „vyhasnutí“ choroby. Pro nemocného je důležité vyvarovat se situací, které mohou vyvolat koronární spasmus, zejména prudkých změn teploty, chladu a stresových situací.
Ve farmakoterapii je lékem první volby dlouhodobě působící blokátor kalciového kanálu, optimálně amlodipin v dostatečné dávce. Při nedostatečné kontrole potíží se může na dobu nejčastějšího výskytu stenokardií (často v noci) přidat dlouhodobě působící nitrát (ISMN) nebo jiný donátor NO (molsidomin). V této indikaci jsou obě skupiny léků rovnocenné, amlodipin je však výrazně spolehlivější v případě vynechání dávky. Podávání betablokátorů je lépe se vyhnout pro jejich vazokonstrikční potenciál. Nicméně je-li k nim indikace z jiných důvodů, je možné je podávat při dostatečné dávce současně podávaného koronárního vazodilatancia. Vzhledem k častému výskytu závažných arytmií v průběhu spasmu je velmi důležitá důsledná prevence všech anginózních záchvatů. Pokud dojde k záchvatu bolestí, je nutné jej ihned ukončit rychle působícím nitrátem (optimálně v aerosolu) a tak snížit riziko arytmií ohrožujících život.
Koronární syndrom X
Léčba tohoto klinického stavu je obtížná, soustřeďuje se na úlevu od potíží a často je málo úspěšná. Je užitečné hned zpočátku nemocným vysvětlit relativně benigní charakter onemocnění a tím snížit negativní psychické dopady stenokardií. Vzhledem k různým příčinám syndromu X neexistuje jednotný léčebný postup. U některých pacientů se uspěje s betablokátory v obvyklých dávkách, u jiných se osvědčí nitráty či blokátory kalciového kanálu. U žen s podezřením na snížení algického prahu by se měla vyzkoušet blokáda adenosinových receptorů xantiny, např. aminofylinem, nebo vyzkoušet podávání antidepresiv, např. imipraminu. Někdy se dosáhne úlevy též estrogeny aplikovanými transdermálně. Inhibitory ACE a statiny mohou pomoci upravit endoteliální dysfunkci, která na etiopatogenezi syndromu participuje, a proto by jejich podávání mělo být také zváženo. Protidestičkové léky ani jiná antitrombotika se pro minimální riziko trombózy nepodávají.
Seznam použité literatury
- [1] Zdravotnictví České republiky 2008 ve statistických údajích. Praha: Ústav zdravotnických informací a statistiky, 2009, nebo www.uzis.cz
- [2] Hradec J, Bultas J, Želízko M. Stabilní angina pectoris. Doporučený diagnostický a léčebný postup České kardiologické společnosti. Cor Vasa 2010; 43: 543–561.
- [3] Cífková R, Býma S, Češka R, et al. Prevence kardiovaskulárních onemocnění v dospělém věku. Společná doporučení českých odborných společností. Cor Vasa 2005; 47 (9 Suppl.): 3–14.
- [4] CAPRIE Steering Committee. A randomised blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). Lancet 1996; 348: 1329–1339.
- [5] Ellis KJ, Stouffer GA, McLeod HL, Lee CR. Clopidogrel pharmacogenomics and risk of inadequate platelet inhibition: US FDA recommendations. Pharmacogenomics 2009; 10: 1799–1817.
- [6] Yusuf S, Sleight P, Pogue J, et al. Effects of an angiotensin-converting enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study (HOPE) investigators. N Engl J Med 2000; 342: 145–153.
- [7] Fox K, on behalf of the EUROPA Executive Committee. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: a randomised, double-blind, placebo-controlled, multicentre trial (the EUROPA study). Lancet 2003; 362: 782–788.
- [8] The ONTARGET Investigators. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med 2008; 358: 1547–1559.
- [9] Kjekshus JK. Importance of heart rate in determining beta-blocker efficacy in acute and long-term acute myocardial infarction intervention trials. Am J Cardiol 1986; 57: 43F–49F.
- [10] Tardif JC, Ford I, Tendera M, et al. Efficacy of ivabradine, a new selective I(f) inhibitor, compared with atenolol in patients with chronic stable angina. Eur Heart J 2005; 26: 2529–2536.
- [11] Fox K, Ford I, Steg PG, et al. Ivabradine for patients with stable coronary artery disease and left-ventricular dysfunction (BEAUTIFUL): a randomised, double-blind, placebo-controlled trial. Lancet 2008; 372: 807–816.
- [12] Tardif JC, Ponikowski P, Kahan T. Efficacy of the current I(f) inhibitor ivabradine in patients with chronic stable angina receiving beta-blocker therapy: a 4-month, randomized, placebo-controlled trial. Eur Heart J 2009; 30: 540–548.
- [13] Fox K, Ford I, Steg G, et al. Relationship between ivabradine treatment and cardiovascular out-comes in patients with stable coronary artery disease and left ventricular systolic dysfunction with limiting angina: a subgroup analysis of the randomized, controlled BEAUTIFUL trial. Eur Heart J 2009; 30: 2185–2194.
- [14] Deanfield JE, Detry JM, Selier P, et al. Medical tratment of myocardial ischemia in coronary artery disease: effect of drug regimen and irregular dosing in the CAPE II trial. J Am Coll Cardiol 2002; 40: 917–925.
- [15] Nissen SE, Tuzcu EM, Libby P, et al. Effect of antihypertenzive agents on cardiovascular events in patiens with coronary artery disease and normal blood pressure – the CAMELOT study: a randomized controlled study. JAMA 2004; 292: 2217–2225.
- [16] Lubsen J, Wagener G, Kirwan BA, et al. Effect of long-acting nifedipine on mortality and cardiovascular morbidity in patients with symptomatic stable angina and hypertension: the ACTION trial. J Hypertens 2005; 23: 641–648.
- [17] Jespersen CM, Gischer Hansen J for the Danish study group on verapamil in myocardial infarction. Effect of verapamil on morbidity and major events after myocardial infarction (The Danish Verapamil Infarction Trial II – DAVIT II). Am J Cardiol 1990; 66: 779–785.
- [18] Goldstein RE, Boccuzi SJ, Cruess D, et al. The effect of diltiazem on mortality and reinfarction after myocardial infarction. N Engl J Med 1988; 319: 285–392.
- [19] Marzilli M, Klein WW. Efficacy and tolerability of trimetazidine in stable angina: a meta-analysis of randomized, double-blind, controlled trials. Coronary Artery Dis 2003; 14: 171–179.
- [20] Silber S, Albertsson P, Aviles FF, et al. Guidelines for percutaneous coronary interventions. The Task Force for Percutaneous Coronary Interventions of the European Society of Cardiology. Eur Heart J 2005; 26: 804–847.