Fertilita, gravidita a kojení u nemocných s idiopatickými střevními záněty
Souhrn:
Idiopatické střevní záněty jsou chronická onemocnění postihující zejména mladé lidi v reprodukčním věku. Onemocnění má tedy vliv na jejich rozhodování o plánování rodičovství. Při léčbě v graviditě je nutná rovnováha mezi snahou o udržení remise a bezpečností léčby. V článku jsou řešeny otázky vlivu aktivity onemocnění a léčby na průběh těhotenství, kojení, na zdraví a vývoj dětí a mnohá další témata. Doporučení se týkají jak období plánování rodičovství, tak průběhu těhotenství, porodu i následujícího kojení. Antibiotika, kortikosteroidy a aminosalicyláty jsou v graviditě relativně bezpečné, data ohledně bezpečnosti imunosupresiv (s výjimkou metotrexátu) a o podávání léčby protilátkami proti tumor nekrotizujícímu faktoru (anti‑TNF) jsou stále přesvědčivější. Výzkum ohledně laktace prokázal, že koncentrace anti‑TNF přípravků a thiopurinů v mateřském mléce jsou nedetekovatelné nebo zanedbatelné. Dostupné informace týkající se antiintegrinů naznačují, že léčba je bezpečná. Dlouhotrvající léčba v těhotenství vyžaduje další zkoumání, ale aktuální informace jsou pro matky v reprodukčním věku i pro jejich ošetřující lékaře uklidňující.
Key words: inflammatory bowel disease − Crohn’s disease − ulcerative colitis – pregnancy – breastfeeding − treatment.
Summary:
Inflammatory bowel disease (IBD) is a chronic disease affecting mainly young people in their reproductive years. IBD therefore has a major impact on patients' family planning decisions. Management of IBD in pregnancy requires a challenging balance between optimal disease control and drug safety considerations. The areas of concern are the influence of the activity of illness and treatment regimen on the course of gravidity, on foetal development, on lactation, and other areas. Advices concern family planning time, pregnancy, delivery, and lactation. Antibiotics, steroids, and aminosalicylates are relatively low risk for use in pregnancy, and growing evidence supports the safety of immunomodulators (other than methotrexate) and anti‑tumour necrosis factor agents as well. Studies on lactation demonstrate that concentrations of anti‑tumour necrosis factor biologicals are undetectable, and levels of thiopurines and infliximab are negligible in breast milk. Less is known about anti‑integrins in pregnancy but currently available data suggest they may be safe as well. Although more studies are needed to examine the longterm effects of these medications on offspring, the available data provide reassuring information for providers caring for women of childbearing age.
Idiopatické střevní záněty (IBD) představují celospolečensky závažný problém nejen medicínský, ale také sociální a ekonomický. Jejich incidence a prevalence v západním světě vzrůstá. V Evropě jsou IBD postiženy téměř tři miliony lidí, prevalence Crohnovy choroby se za posledních 30 let zdvojnásobila, z dosavadního vývoje lze usuzovat, že tento vzestup bude i v budoucnu dále pokračovat [1]. Onemocnění zpravidla začíná v mladém věku, proto je otázka reprodukce u nemocných s IBD velmi aktuálním tématem.
Plodnost
Plodnost je u nemocných s Crohnovou chorobou snížena jen v období aktivního onemocnění, v období remise je normální jako u zdravé populace. Ke snížení plodnosti žen s aktivním onemocněním může dojít jak přímo indukcí zánětu vejcovodů a ovarií, bolestivou perianální formou onemocnění, tak i chirurgickou intervencí spojenou s adhezemi vejcovodů.
Při ulcerózní kolitidě je plodnost snížena pouze u pacientů po kolektomii s ileo pouch anální anastomózou. Vysoké procento dobrovolné bezdětnosti svědčí o nutnosti větší informovanosti a vzdělávání pacientek v reprodukčním věku [2−4]. U žen není fertilita medikací ovlivněna. U mužů způsobuje medikace sulfasalazinem reverzibilní abnormality spermatogramu. Sulfapyridinová složka v sulfasalazinu je příčinou infertility až u 60 % pacientů. K úpravě dochází během dvou měsíců po ukončení léčby. Jednoduchým řešením je převedení pacientů z léčby sulfasalazinem na léčbu mesalazinem. Muži užívající azatioprin jsou normálně plodní, teratogenní potenciál azatioprinu je velmi sporný, a proto se nedoporučuje léčbu v době plánování rodičovství vysazovat. Metotrexát u mužů působí reverzibilní oligospermii. Přestože nebyl zjištěn zvýšený počet vrozených vad u léčených otců, jeví se jako racionální obezřetný postup a doporučení vyčkat s koncepcí 3−6 měsíců po ukončení léčby. Pokud jde o léčbu infliximabem, byly popsány případy snížení motility spermií při zvýšeném množství spermatu [5,6]. Obecně lze tedy říci, že plodnost není u pacientů s IBD změněna.
Gravidita
U těhotných pacientek s IBD se ve srovnání se zdravými kontrolami častěji vyskytují komplikace včetně spontánního potratu, předčasného porodu a nižší porodní hmotnosti dítěte. Tyto komplikace jsou do značné míry způsobeny aktivitou choroby. I proto je nutné dodržet základní podmínku nekomplikovaného těhotenství – zajistit remisi onemocnění v době koncepce. V případě aktivity ulcerózní kolitidy v době koncepce dojde ke zhoršení stavu u 45 % pacientek, 25 % je stabilních (s nezměněnou aktivitou onemocnění) a u 25 % dojde ke zmírnění příznaků onemocnění. Při aktivní Crohnově chorobě se v době koncepce u třetiny pacientek stav zhorší, u třetiny zůstane stabilní (aktivní) a u třetiny dojde ke zlepšení stavu. Snížení aktivity choroby často souvisí s přerušením kouření v době těhotenství a exacerbace v prvním trimestru může být způsobena svévolným přerušením léčby. Někdy pozorované zlepšení průběhu choroby po porodu charakterizované redukcí stenóz a snížením počtu resekčních výkonů je vysvětlováno vlivem těhotenství na imunitní odpověď, rozdílností hlavního histokompatibilního systému (HLA) matky a plodu a tvorbou hormonu relaxin v době porodu [5−8].
Porod
Způsob porodu je většinou v rukou porodníka. U všeobecné populace je porod veden císařským řezem v 15 %, u pacientek s ulcerózní kolitidou i s Crohnovou chorobou je to ve více než 20 % případů. Jasnou indikací k císařskému řezu je u Crohnovy choroby aktivní perianální onemocnění a u ulcerózní kolitidy stav po kolektomii s ileo pouch anální anastomózou. Děti rodičů s IBD jsou ohroženy vyšším rizikem vzniku onemocnění. Přenos choroby je častější z matky a na ženské potomky. Riziko dědičnosti je větší pro Crohnovu chorobu; pokud tímto onemocněním trpí oba rodiče, pak riziko dědičnosti dosahuje až 30 % [9].
Bezpečnost léčby
Podávání medikace během těhotenství a laktace je v naprosté většině případů bezpečné mimo imunosupresivní léčbu metotrexátem (a talidomidem). Americký Úřad pro kontrolu potravin a léčiv (Food and Drug Adiministration, FDA) tradičně rozděluje léčbu pro užití v těhotenství do jednotlivých kategorií. Kategorie A označuje přípravky, které nenesou žádné riziko, byly náležitě otestovány i u těhotných. V kategorii B bylo zjištěno riziko u zvířat, není však průkazné u lidí. V kategorii C jsou zařazeny přípravky, kdy riziko u lidí nelze vyloučit (studie na zvířatech prokázaly riziko a chybějí dobře kontrolované studie u těhotných žen nebo nebyly provedeny studie na zvířatech a chybějí dobře kontrolované studie u těhotných žen). U přípravků kategorie D byly nežádoucí účinky prokázány, nicméně přínos léčby může vyvážit potenciální riziko. Přípravky kategorie X jsou kontraindikovány u žen, které jsou nebo mohou být těhotné. Přestože jednotlivé přípravky jsou charakterizovány mírou rizika podle FDA, není to z hlediska pacientů s IBD optimální. Ačkoliv imunosupresiva mají teoretický teratogenní efekt, jejich bezpečnostní profil je příznivý pro matku i dítě a jsou podle doporučení Evropské společnosti pro Crohnovu nemoc a kolitidu (European Crohn’s and Colitis Organisation, ECCO) považovány za bezpečné [5] a také FDA chystá změnu v jejich klasifikaci. Níže jsou popsány jednotlivé skupiny léků používané v léčbě IBD a jejich vztah k těhotenství.
Aminosalicyláty
Léčba mesalazinem není zatížena zvýšeným rizikem vrozených vad ani při jejich užívání v kritickém prvním trimestru těhotenství. Nezvyšují riziko vzniku vrozených vad nebo narození mrtvého plodu, spontánního potratu či nižší porodní hmotnosti. Týká se to také nejdéle užívaného přípravku v léčbě IBD − sulfasalazinu. Tento lék prochází placentární bariérou, proto je nutná současná medikace kyselinou listovou. Stejně jako u zdravé populace je medikace kyselinou listovou prevencí vývojových vad neurální trubice, u gravidních pacientek s IBD užívajících sulfasalazin zvyšujeme její dávku na 2 mg denně. Přípravky jsou zařazeny do kategorie B dle FDA. Léčivý přípravek Asacol HD (800 mg) obsahuje v obalovém materiálu dibutylftalát, který může způsobovat vrozené malformace urogenitálního traktu mužů, a proto je zařazen do kategorie C. Toto bylo popsáno v animálních studiích na krysách, ale nebylo potvrzeno v observačních studiích na lidech. Proto není nutné v průběhu těhotenství přípravek měnit, ale při plánování rodičovství je doporučen jiný mesalazinový přípravek
[5,7].
Antibiotika
Obecně jsou možností volby v léčbě infekce v těhotenství antibiotika penicilinového a cefalosporinového typu, která jsou považována za nejbezpečnější (skupina B). Chinolony mají afinitu ke kosti a chrupavce, proto existuje riziko vzniku artropatií a u animálních modelů obecně riziko vzniku muskuloskeletálních vad (kategorie C). Společnost ECCO doporučuje fluorochinolony nepodávat v prvním trimestru těhotenství. Nicméně dle TERIS (Teratogen Information System) terapeutické dávky ciprofloxacinu působí teratogenně jen velmi nepravděpodobně. Amoxicilin/klavulanát je bezpečnou alternativou k chinolonům v léčbě pouchitidy. Metronidazol prochází placentární bariérou, přesto je zařazen do kategorie B, protože ani při podávání vysokých dávek nebylo prokázáno postižení fétu u laboratorních zvířat. Metronidazol je doporučován k lokální léčbě bakteriální vaginózy ve všech stadiích gravidity [5−7]. Systémová terapie se nedoporučuje v prvním trimestru.
Kortikoidy
Kortikoidy jsou užívány k léčbě akutního vzplanutí choroby i v těhotenství. Přibývá důkazů o tom, že tato léčiva nemají žádný významný teratogenní efekt. Kortikoidy jsou považovány za relativně bezpečné i vzhledem k tomu, že dochází k jejich inaktivaci enzymem dehydrogenázou v syncitiotrofoblastech placenty. Předchozí studie ukazovaly na asociaci s rizikem rozštěpu patra u žen užívajících v těhotenství kortikoidy (zejména z důvodu astmatu). Nicméně recentní studie toto nepotvrdily, rizika vzniku významných vrozených vad (srdce, končetin, genitouretrálního traktu) jsou identická ve srovnání s dětmi narozenými pacientkám s IBD, které nebyly v expozici kortikoidům v prvním trimestru gravidity. Nejsou ani důkazy o adrenální insuficienci nebo abnormální funkci T lymfocytů u dětí, které byly exponovány kortikoidům in utero. Obdobně budesonid není spojen s teratogenním účinkem a může být dobrou alternativou léčby mírného až středního vzplanutí onemocnění. Významná data pocházejí z prospektivní studie PIANO (Pregnancy in Inflammatory bowel disease And Neonatal Outcomes). Z tohoto sledování vyplývá, že kortikoidy nemají vztah k opožděnému vývoji nebo ke vzniku kongenitálních malformací, ale jsou rizikovým faktorem vzniku gestačního diabetu, nízké porodní hmotnosti a časných kojeneckých infekcí. Proto léčba kortikoidy nepředstavuje bezpečnější alternativu existující udržovací léčby IBD [6,7].
Imunomodulační léky
Mezi skupinu imunomodulačních léků jsou zahrnuta nejvíce teratogenní léčiva (zařazena do kategorie X dle FDA užívané u IBD) – talidomid a metotrexát. Při expozici v prvním trimestru způsobují aminopterinový syndrom (porucha růstu, vady CNS, kostí, chrupavek, srdce). Proto je nutné šest měsíců před koncepcí vysadit léčbu a podávat suplementaci kyselinou listovou.
Azatioprin (AZA) a 6 merkaptopurin (6 MP) jsou nejčastěji používanými imunosupresivy; řadí se do kategorie D. Toto zařazení pochází z doby, kdy byly thiopuriny podávány ve vysokých dávkách při léčbě leukemie; v souvislosti s touto léčbou byla prokázána neonatální myelotoxicita, imunosuprese a chromozomální abnormality u dětí a teratogenitu potvrdily výsledky podávání vysokých dávek thiopurinů u laboratorních krys. Přestože dochází k transplacentárnímu pasivnímu přestupu metabolitů 6 MP, biologická dostupnost AZA a 6 MP po perorálním podání dosahuje pouze 47 % a 16 %. Fetální játra nedokáží konvertovat AZA na 6 MP z důvodu absence enzymu pyrofosforylázy kyseliny inosinové. Studie PIANO, která sledovala vývojové percentily u dětí exponovaných thiopurinům, neprokázala žádné opoždění až do věku čtyř let [10]. Ani ostatní kohortové studie nezjistily jiné výsledky, včetně absence častějších infekcí nebo neoplazií v dětském věku. Negativní zjištění z malých studií (předčasné porody, anémie, pancytopenie a vysoká aktivita alkalické fosfatázy) nebyla ve velkých studiích (francouzská CESAME) potvrzena [11]. Nicméně vzhledem ke známým rizikům, jako je leukopenie, hepatopatie a pankreatitida, léčbu thiopuriny v graviditě nezahajujeme.
Kalcineurinové inhibitory procházejí placentou a jsou u novorozence rychle eliminovány. Z robustních dat transplantologie je jasné, že cyklosporin není významný teratogen a je možné jej bezpečně a efektivně užít u fulminantní ulcerózní kolitidy během těhotenství s cílem zabránit urgentní kolektomii. V současné době ale preferujeme v této indikaci léčbu infliximabem, který má lepší bezpečnostní profil než cyklosporin. Při léčbě cyklosporinem může docházet k předčasné zralosti plodu. Léčba takrolimem není spojena se zvýšeným rizikem komplikací v těhotenství [6,7].
Anti TNF přípravky
V současné době je k dispozici velké množství dat o léčbě anti TNF přípravky (infliximab, adalimumab, certolizumab pegol, golimumab) v graviditě. Nejužitečnější informace pocházejí opět ze studie PIANO, kdy byla sledována jak expozice thiopurinům, tak anti TNF léčba a také konkomitantní léčba thiopuriny a anti TNF. Ani thiopuriny, ani anti TNF přípravky nejsou asociovány s vyšším rizikem spontánního potratu, vrozených vad, předčasného porodu, intrauterinního zpomalení růstu, s vyšší frekvencí porodů císařským řezem nebo s pobytem na neonatální jednotce intenzivní péče. Užití anti TNF léčby v graviditě je relativně bezpečné, třebaže zatížené rizikem vzniku infekčních komplikací u dítěte exponovaného kombinované léčbě [10,12−16]. Pokud se gravidní žena nachází v riziku vzplanutí choroby, je bezpečné a pravděpodobně lepší pro osud plodu pokračovat v léčbě po celou dobu těhotenství a eventuálně zvažovat i indukční léčbu při vzplanutí onemocnění za předpokladu, že pacientka dosud nebyla léčena biologiky. Pokud se pacientka nachází v remisi, pak ve Spojených státech amerických je tato léčba vysazována v 30.−32. týdnu gravidity (infliximab) nebo v 36.−38. týdnu (adalimumab). Dle evropských a národních guidelines se doporučuje ukončit léčbu infliximabem nebo adalimumabem na konci druhého trimestru gravidity (24. týden), protože se jedná o protilátky IgG1, které mají zvýšený transfer přes placentární membránu v průběhu třetího trimestru. Jiná situace je v zemích Evropské unie u neschváleného léku certolizumab pegol. Jde o IgG4 fragment navázaný na pegylovaný Fab fragment anti TNF protilátky, který má menší placentární transfer ve srovnání s protilátkami IgG1. Proniká do krve plodu jen pasivně a jeho koncentrace jsou v ní významně nízké, nezávislé na hodnotě v krvi matky.
V závislosti na gestačním týdnu, na době poslední aplikace léku, dávce a zralosti retikuloendoteliálního systému dítěte mohou anti TNF přípravky přetrvávat v jeho oběhu až do 12. měsíce po narození, i když obvykle mizejí během prvních šesti měsíců života. Stanovení koncentrací anti TNF léčiva v séru dítěte se doporučuje před případným očkováním živými vakcínami v průběhu prvního půl roku až roku života dítěte. Pokud toto měření není k dispozici, doporučuje se odložit očkování (proti tuberkulóze, proti rotavirové infekci a očkování intranazální vakcínou proti chřipce) minimálně do věku 6 měsíců [12,13,17,18].
Antiintegriny
Vedolizumab je monoklonální protilátka cílená na integrin α4β7, která selektivně brání migraci tzv. GIT tropních lymfocytů do střevní submukózy a tím čelí vzniku zánětu v trávicí trubici. Bezpečnost léčby vedolizumabem je relativně málo prozkoumána a lék náleží do kategorie B dle FDA. Vzhledem k podobnému mechanismu účinku vycházíme z dat pro natalizumab užívaný pro Crohnovu chorobu jen v USA a jinde ve světě pro léčbu roztroušené sklerózy. V registru týkajícím se expozice natalizumabu u těhotných žen byla prokázána četnost spontánních potratů stejná jako v ostatní americké populaci [19]. Při expozici vedolizumabu u laboratorních zvířat (krysy a opice) nebyly zjištěny žádné známky poškození plodu. Případy popsané v literatuře byly zaznamenány jako předčasný porod, vrozená abnormalita i spontánní potraty (tato data jsou limitovaná). Užití vedolizumabu je považováno za bezpečné, ale k jeho ověření jsou nutné další studie. Zatím je jeho užití v těhotenství doporučeno pouze tehdy, pokud prospěch pro zdraví matky převyšuje rizika pro matku a plod. Poslední dávku je doporučováno podat u stabilní pacientky na konci druhého trimestru jako ostatní IgG1 protilátky, respektive v USA ve 30.–32. týdnu [7−20].
Ustekinumab
Ustekinumab je humánní monoklonální IgG1 protilátka proti podjednotce p40 interleukinu 12 a 23, které sehrávají jednu z klíčových rolí v onemocnění zprostředkovaném imunitním systémem. V malých kohortách kazuistických sdělení nebyla zjištěna vyšší frekvence malformací, ale vzhledem k nevelkým zkušenostem se léčba v těhotenství nedoporučuje [21].
Kojení
Kojení je obecně doporučováno u všech žen, včetně pacientek s IBD. Při kojení je kontraindikována léčba talidomidem, metotrexátem a cyklosporinem, protože v mateřském mléce dosahují vysokých koncentrací. Sulfapyridinová složka se vylučuje do mateřského mléka, ale její množství je zanedbatelné, aby mohlo způsobit jádrový ikterus, a proto je kojení při medikaci sulfasalazinem považováno za bezpečné. V literatuře bylo popsáno několik případů průjmů u kojených dětí, jejichž matky užily rektálně mesalazin, ale jinak je léčba považována za bezpečnou. Kojení je při medikaci kortikoidy bezpečné, do mléka se vylučuje méně než 0,1 % požité dávky, což je 10 % endogenní koncentrace kortizolu kojence. Metronidazol se vylučuje do mateřského mléka, proto se kojení doporučuje až za 12−24 hodin po požití medikace. Chinolony jsou při kojení pravděpodobně bezpečné. Při medikaci thiopuriny je kojenec vystaven méně než 1 % dávky matky. Exkrece do mléka probíhá v maximální míře první až čtvrtou hodinu po požití přípravku. Léčba je považována za bezpečnou, ale racionální postup je kojit až za 4 hodiny po požití medikace. Anti TNF léčba je při kojení možná, neboť primární imunoglobulin secernovaný do mléka je IgA, a nikoliv IgG. Ve studiích bylo v mateřském mléce detekováno jen minimální množství anti TNF protilátek. Navíc infliximab po požití per os není absorbován. V registru studie PIANO nebyly zjištěny u kojených dětí matek léčených anti TNF přípravky rozdíly proti dětem bez expozice anti TNF léčbě jak v jednotlivých percentilech růstu, tak ve vzniku infekcí. U laboratorních opic byl vedolizumab v mateřském mléce detekován, ale v klinické praxi byly předběžně zjištěny obdobné výsledky jako u anti TNF léčby [22]. Studie hodnotící léčbu vedolizumabem při kojení aktuálně probíhá [23]. Léčivo je velká bílkovina, proto se nejeví jako reálné, že by větší množství léčiva bylo schopné projít do mateřského mléka. Vedolizumab se také velmi špatně vstřebává ze střeva, proto není pravděpodobné, že by léčivo ovlivňovalo imunitní systém dítěte. Je možné, že předčasně narozené děti (před 37. týdnem těhotenství) s nedostatečně vyvinutým trávicím ústrojím, mohou část léčiva z mateřského mléka absorbovat.
Závěr
Základ úspěšného průběhu
těhotenství pacientky s IBD spočívá zejména v komunikaci
s pacientkou. Poučení pacientky o bezpečnosti podávané
léčby a o rizicích aktivity onemocnění zlepšuje její
spolupráci a adherenci k léčbě [2−4,24]. Úlohou
gastroenterologa je dosáhnout remise a optimalizovat léčbu
tak, aby se remisi dařilo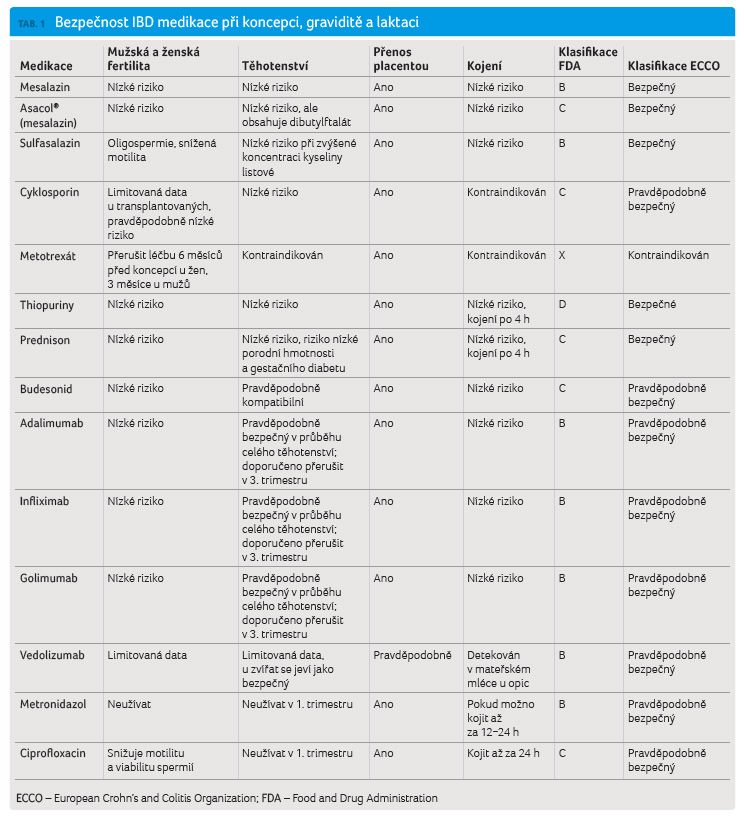 udržet v období před koncepcí. Je
nutné kontrolovat a suplementovat nutriční deficity vitaminu
B12, vitaminu D, železa a zejména kyseliny listové.
Příjem kyseliny listové před otěhotněním a na počátku
těhotenství působí jako účinná prevence defektů neurální
trubice u dítěte. Je vhodné pacientku kontrolovat každých
8−12 týdnů. Většina léků kromě metotrexátu představuje
v těhotenství minimální rizika a v léčbě by
mělo být pokračováno jak v průběhu gravidity, tak
i během laktace (tab. 1). Biologická léčba je přerušována jen v případě
stabilního onemocnění v remisi koncem druhého trimestru,
u rizikových pacientů se v léčbě pokračuje bez
přerušení. Způsob porodu je v režii porodníka, ale
císařský řez je jednoznačně indikován pouze u aktivní
perianální Crohnovy nemoci v době porodu nebo u pacientek
po ileo pouch anální anastomóze [25].
Po porodu, v případě expozice plodu anti TNF
přípravkům, je nutné uvědomit pediatra a probrat důsledky
pro očkování – tedy nepodávat žádné živé vakcíny
v prvních šesti měsících života nebo dříve jen při
nulových hodnotách anti TNF léčiv v séru dítěte.
udržet v období před koncepcí. Je
nutné kontrolovat a suplementovat nutriční deficity vitaminu
B12, vitaminu D, železa a zejména kyseliny listové.
Příjem kyseliny listové před otěhotněním a na počátku
těhotenství působí jako účinná prevence defektů neurální
trubice u dítěte. Je vhodné pacientku kontrolovat každých
8−12 týdnů. Většina léků kromě metotrexátu představuje
v těhotenství minimální rizika a v léčbě by
mělo být pokračováno jak v průběhu gravidity, tak
i během laktace (tab. 1). Biologická léčba je přerušována jen v případě
stabilního onemocnění v remisi koncem druhého trimestru,
u rizikových pacientů se v léčbě pokračuje bez
přerušení. Způsob porodu je v režii porodníka, ale
císařský řez je jednoznačně indikován pouze u aktivní
perianální Crohnovy nemoci v době porodu nebo u pacientek
po ileo pouch anální anastomóze [25].
Po porodu, v případě expozice plodu anti TNF
přípravkům, je nutné uvědomit pediatra a probrat důsledky
pro očkování – tedy nepodávat žádné živé vakcíny
v prvních šesti měsících života nebo dříve jen při
nulových hodnotách anti TNF léčiv v séru dítěte.
Seznam použité literatury
- [1] Burisch J, Jess T, Martinato M, Lakatos PL. The burden of inflammatory bowel disease in Europe. J Crohns Colitis 2013; 7: 322−337.
- [2] Mountifield R, Bampton P, Prosser R, et al. Fear and fertility in inflammatory bowel disease: a mismatch of perception and reality affects family planning decisions. Inflamm Bowel Dis 2009; 15: 720−725.
- [3] Mountifield R, Andrews JM, Bampton P. It IS worth the effort: Patient knowledge of reproductive aspects of inflammatory bowel disease improves dramatically after a single group education session. J Crohns Colitis 2014; 8: 796−801.
- [4] Zelinkova Z, Mensink PB, Dees J. Reproductive wish represents an important factor influencing therapeutic strategy in inflammatory bowel diseases. Scand J Gastroenterol 2010; 45: 46–50.
- [5] Vermeire S, Carbonnel F, Coulie PG, et al. Management of inflammatory bowel disease in pregnancy. J Crohns Colitis 2012; 6: 811−823.
- [6] van der Woude CJ, Ardizzone S, Bengtson MB, et al. The second European evidenced‑based consensus on reproduction and pregnancy in inflammatory bowel disease. J Crohns Colitis 2015; 9: 107−124.
- [7] Damas OM, Deshpande AR, Avalos DJ, Abreu MT. Treating Inflammatory Bowel Disease in Pregnancy: The Issues We Face Today. J Crohns Colitis 2015; 9: 928−936.
- [8] Beaulieu DB, Kane S. Inflammatory Bowel Disease in Pregnancy. Gastroenterol Clin North Am 2011; 40: 399–413.
- [9] Glover LE, Fennimore B, Wingfield M. Innflammatory Bowel Disease: Influence and Implications in Reproduction. Inflamm Bowel Dis 2016; 22: 2724–2732.
- [10] Mahadevan U, Martin CF, Sandler RS, et al. PIANO: A 1000 patient prospective registry of pregnancy outcomes in women with IBD exposed to immunomodulators and biologic therapy. Gastroenterology 2012; 142: S‑149.
- [11] Coelho J, Beaugerie L, Colombel JF, et al. Pregnancy outcome in patients with inflammatory bowel disease treated with thiopurines: cohort from the CESAME Study. Gut 2011; 60: 198–203.
- [12] Nielsen OH, Loftus E V, Jess T. Safety of TNF‑α inhibitors during IBD pregnancy: a systematic review. BMC Med 2013; 11: 174.
- [13] Bortlík M, Ďuricová D, Kohout P, et al. Doporučení pro podávání biologické terapie u idiopatických střevních zánětů: třetí, aktualizované vydání. Gastroent Hepatol 2016; 70: 11–26.
- [14] Mahadevan U, Martin CF, Chambers C, et al. Achievement of developmental milestones among offspring of women with inflammatory bowel disease: The PIANO Registry. Gastroenterology 2014; 146: S‑1.
- [15] Bortlik M, Duricova D, Machkova N, et al. Impact of anti‑tumor necrosis factor alpha antibodies administered to pregnant women with inflammatory bowel disease on long‑term outcome of exposed children. Inflamm Bowel Dis 2014; 20: 495–501.
- [16] Bortlik M, Machkova N, Duricova D, et al. Pregnancy and newborn outcome of mothers with inflammatory bowel diseases exposed to anti‑TNF‑alpha therapy during pregnancy: three‑center study. Scand J Gastroenterol 2013; 48: 951–958.
- [17] Deepak P, Stobaugh DJ. Maternal and foetal adverse events with tumour necrosis factor‑alpha inhibitors in inflammatory bowel disease. Aliment Pharmacol Ther 2014; 40: 1035–1043.
- [18] De Lima A, Zelinkova Z, van der Ent C, van der Woude CJ. Anti‑TNF is safe to stop in the second trimester of pregnancy in IBD women in remission. Gastroenterology 2014; 146: S‑78.
- [19] Friend S, Richman S, Bloomgren G, et al. Evaluation of pregnancy outcomes from the Tysabri® (natalizumab) pregnancy exposure registry: a global, observational, follow‑up study. BMC Neurol 2016; 16: 150.
- [20] Mahadevan U, Vermeire S, Lasch K, et al. Vedolizumab exposure in pregnancy: outcomes from clinical studies in inflammatory bowel disease. Aliment Pharmacol Ther 2017; 45: 941−950.
- [21] Levy RA, de Jesús GR, de Jesús NR, Klumb EM. Critical review of the current recommendations for the treatment of systemic inflammatory rheumatic diseases during pregnancy and lactation. Autoimmun Rev 2016; 15: 955−963.
- [22] Matro R, Martin CF, Wolf DC, et al. Detection of biologic agents in breast milk and implication for infection, growth and development in infants born to women with inflammatory bowel disease: Results from the PIANO Registry. Gastroenterology 2015; 148: S‑141.
- [23] ClinicalTrials.gov Identifier: NCT02559713: Postmarketing Vedolizumab Milk‑Only Lactation Study in Lactating Women With Active Ulcerative Colitis or Crohn's Disease
- [24] de Lima A, Zelinkova Z, Mulders AG, van der Woude CJ. Preconception Care Reduces Relapse of Inflammatory Bowel Disease During Pregnancy. Clin Gastroenterol Hepatol 2016; 14: 1285−1292.
- [25] Ilnyckyji A, Blanchard JF, Rawsthorne P, Bernstein CN. Perianal Crohn‘s disease and pregnancy: role of the mode of delivery. Am J Gastroenterol 1999; 94: 3274–3278.