Fixní kombinace oxykodonu s naloxonem – nový silný opioid s prevencí vzniku zácpy vyvolané opioidy
Chronická bolest představuje v současnosti velký zdravotnický problém a silné opioidy jsou často nezbytnou součástí její léčby. Žádný ze silných opioidů však nemusí v obvyklé terapeutické dávce dostatečně tlumit bolest u každého pacienta a může vést ke vzniku nežádoucích účinků.
Velký počet opioidních receptorů, které jsou lokalizovány ve střevě, vyvolává po aplikaci opioidů gastrointestinální nežádoucí účinky, zvláště častá je zácpa, která vzniká u 15–81 % nemocných užívajících opioidní terapii. Střevní problémy, k nimž dochází po aplikaci opioidů, proto často vedou k odmítání těchto analgetik nemocnými. Nové opiodní přípravky (nové účinné látky, nové lékové formy) pomáhají zlepšit léčbu různých typů chronické nádorové i nenádorové bolesti a snižují nežádoucí účinky silných opioidů, zejména omezují zácpu. V současné době již máme též v České republice k dispozici fixní kombinaci silného opioidu oxykodonu a antagonisty opioidních receptorů naloxonu ve formě tablet s prodlouženým uvolňováním. Tato kombinace účinných látek zachovává výborný analgetický účinek silného opioidu oxykodonu a zároveň díky obsahu naloxonu zabraňuje vzniku zácpy vyvolané opioidy.
Úvod
Opioidy jsou jedny z nejstarších léčiv používaných v medicíně. Jejich role v terapii silné akutní a chronické nádorové i nenádorové bolesti je nezastupitelná. Cílem léčby opioidy je dosažení rovnováhy mezi již dostatečnou analgezií a ještě přijatelnou mírou nežádoucích účinků [1]. Nejčastějším nežádoucím účinkem opioidů je zácpa, na kterou na rozdíl od jiných nežádoucích účinků nevzniká nikdy tolerance. Prevalence zácpy se dle mnoha studií pohybuje v širokém rozmezí 15–81 % [2, 3]. Zácpa je pro nemocné nezřídka tak ohrožující a zničující, že mnozí raději vůbec nechtějí být opioidy léčeni nebo jsou jimi trvale léčeni nedostatečně, případně dochází k přerušení léčby opioidy, a to až u 30 % nemocných [2, 4]. Jedním ze základních opatření při léčbě opioidy je tedy již ze začátku léčby dodržování antiobstipačního režimu s úpravou dietetických návyků (dostatek tekutin, zelenina, kysané mléčné produkty, cereálie atd.). Většina pacientů musí užívat v důsledku chronické zácpy laxativa [1–3, 5]. V případě opioidní léčby se jedná o specifický typ zácpy označovaný jako opioidy indukovaná obstipace (opioid-induced constipation, OIC).
Opioidní receptory nejsou lokalizovány pouze v nervovém systému, ale významné zastoupení mají i v oblasti gastrointestinálního traktu (GIT). Právě obsazení μ-receptorů ve sliznici GIT molekulami opioidu má za následek těžko ovlivnitelnou zácpu.
Mechanismus zácpy vyvolané opioidy
Tento typ zácpy je způsoben inhibicí uvolňování acetylcholinu z mezenterického plexu, což vede k relaxaci podélné svaloviny v oblasti tenkého i tlustého střeva. Následně dochází ke snížení propulzní motorické aktivity, opioidy navíc způsobují zvýšení segmentálních kontrakcí ve střevě. To vše vede k opožděnému (zpomalenému) průchodu tráveniny ve střevě se zahušťováním obsahu. Navíc dochází ke snížení sekrece střevní, žaludeční, žlučové i pankreatické. Zácpě napomáhá též zvýšený tonus střevních sfinkterů a snížený defekační reflex [2, 4].
Mechanismus účinku oxykodonu s naloxonem
Oxykodon zprostředkovává svůj analgetický účinek přes receptory µ, κ a δ v mozku; působí jako agonista na těchto receptorech a zmírňuje bolest navázáním na endogenní opioidní receptory v centrálním nervovém systému. Díky ovlivnění κ-receptoru je u oxykodonu ve srovnání s jinými opioidy větší pravděpodobnost, že u nemocného zmírní neuropatickou složku bolesti [6]. Velmi snadno se absorbuje po perorální aplikaci (biologická dostupnost až 87 %) [2, 5]. Po absorpci je oxykodon distribuován po celém těle. Přibližně 45 % je vázáno na plazmatické bílkoviny. Oxykodon rovněž prochází placentou a může být detekován v mateřském mléce. Je metabolizován cytochromem P450 prostřednictvím izoenzymů CYP3A4 na noroxykodon a menší část je metabolizována pomocí izoenzymů CYP2D6 na oxymorfon a na různé glukuronidové konjugáty [3]. Oxykodon i jeho metabolity jsou vylučovány močí a stolicí. Oxykodon je velmi dobře analgeticky působící silný opioid, ale jeho působení je omezeno tak jako u jiných silných opioidů nežádoucími účinky, zejména zácpou [3].
Naloxon je naopak čistý antagonista, postrádá jakoukoliv vnitřní agonistickou aktivitu a působí na všechny typy opioidních receptorů [2, 5]. Snadněji než agonisté se váže zejména na µ-receptory ve stěně střeva a v mukóze dolní části zažívacího traktu [4]. V horní části zažívacího traktu dochází díky účinku naloxonu navíc k lepšímu vyprazdňování žaludku, což snižuje výskyt nauzey a zvracení. Obsazení μ-receptoru antagonistou opioidu zejména při jeho perorální aplikaci by sice mělo vést k zamezení (omezení) výskytu zácpy, zároveň by však mohl být blokován klíčový farmakodynamický účinek opioidů – analgezie. V případě naloxonu tomu tak ale není [7]. Po průchodu jaterním parenchymem se do systémové cirkulace dostávají jen neúčinné metabolity a pouze nepatrné množství vlastního naloxonu, které již nemůže přispět k antagonizaci analgetického účinku opioidu [8, 9]. Kvůli výraznému first-pass metabolismu je biologická dostupnost naloxonu po perorálním podání nižší než 3 %, a proto je klinicky relevantní systémový účinek nepravděpodobný. To ukazují i dvojitě zaslepené studie dokládající, že analgetický účinek oxykodonu je srovnatelný s kombinací oxykodonu a naloxonu [2, 3]. Naloxon přechází přes placentu; není známo, zda také přechází do mateřského mléka. Hlavními metabolity jsou naloxon glukuronid, 6β-naloxol a jeho glukuronidy. Naloxon je metabolizován v játrech a vylučuje se močí [9]. Naloxon snižuje porušení funkce vyprazdňování typické při léčbě opioidy, a to díky lokálnímu kompetitivnímu antagonismu oxykodonového účinku, který je zprostředkován opioidními receptory ve střevě [2, 5].
Klinický výzkum
Bylo provedeno mnoho studií, které prokázaly analgetický účinek kombinace oxykodonu s naloxonem (OxN) s výrazným antiobstipačním efektem. V prospektivní neintervenční studii trvající čtyři týdny, do níž bylo zařazeno téměř 8000 pacientů, došlo ke snížení výskytu zácpy ze 71 % na 34 % při zachování velmi dobrého analgetického účinku a snášenlivosti až u 84 % nemocných se střední a silnou bolestí [10]. Čtyřtýdenní prospektivní neintervenční multicentrická studie s 1178 pacienty s nádorovou bolestí prokázala zlepšení analgezie a snížení zácpy o 20 % až 37 % se zlepšením kvality života [11]. Multicentrická prospektivní observační studie s 588 pacienty se střední a silnou bolestí, která trvala 6 týdnů, srovnávala OxN s jinými silnými opioidy. Studie prokázala zlepšení, jež přineslo podávání OxN v porovnání s ostatními opioidy, pro funkci střev, kvalitu života a snášenlivost léčby. Došlo až ke 40% snížení intenzity bolesti, zlepšení funkčnosti střev bylo signifikantně vyšší než v kontrolní skupině. Navíc bylo v kontrolní skupině zaznamenáno více i dalších nežádoucích střevních potíží (nauzea, zvracení) a vyšší spotřeba laxativ [4].
Efektivita (srovnatelný analgetický účinek), zlepšení činnosti střev a bezpečnost léčby OxN u pacientů s nádorovou i nenádorovou bolestí byla prokázána v mnohých studiích, které byly v rámci zkušebního období studií provedeny jako rozsáhlá klinická sledování v Německu a v několika dalších zemích Evropy, včetně České republiky [12, 13]. Další rozsáhlá dvojitě slepá studie trvající 52 týdnů, jíž se účastnili i čeští algeziologové, byla zaměřena na bezpečnost a účinnost fixní kombinace OxN. Studie prokázala dlouhodobou účinnost a výbornou snášenlivost této kombinace u nemocných s chronickou bolestí se signifikantně zlepšenou činností střev a zachovanou (dostatečnou) analgetickou účinností [14].
V dvanáctitýdenní dvojitě slepé studii u 322 pacientů se středně silnou a silnou bolestí bylo prokázáno zmírnění zácpy ve skupině OxN ve srovnání se skupinou léčenou pouze oxykodonem (denní dávka ≤ 50 mg) dle kritérií BFI (Bowel Function Index, index funkce střev). Došlo k signifikantnímu zlepšení činnosti střeva již po týdnu léčby a tento stav přetrvával až do konce léčby. Bylo zaznamenáno zvýšení počtu stolic a snížení spotřeby laxativ bez omezení (změny) dostatečného analgetického účinku. Jiné nežádoucí účinky zůstaly srovnatelné [15].
V plně randomizované dvojitě slepé studii se 185 nemocnými trpícími středními až silnými nádorovými bolestmi byl srovnáván samotný oxykodon s kombinací OxN (denní dávka až 120 mg oxykodonu), hodnocení bylo uskutečněno pomocí dotazníků BFI a BPI-SF (Brief Pain Inventory Short-Form) a kvality života. U pacientů léčených OxN se prokázaly signifikantně nižší hodnoty BFI, došlo ke snížení dávek podávaných laxativ až o 20 % a prokázalo se zlepšení kvality života odpovídající velkému zmírnění zácpy. Úroveň bolesti, použití záchranné medikace a další nežádoucí účinky byly při léčbě OxN srovnatelné s léčbou samotným oxykodonem [16].
Studie s 15 dobrovolníky, jimž byly podávány tablety oxykodonu 10 mg a 20 mg a fixní kombinace OxN 10 mg/5 mg a 20 mg/10 mg, prokázala stejný čas průchodu střevem u fixní kombinace ve srovnání s placebem a signifikantní zrychlení průchodu u silnější kombinace OxN 20 mg/10 mg a nesignifikantní u slabší dávky OxN 10 mg/5 mg ve srovnání se samotným oxykodonem podávaným ve srovnatelných dávkách [17]. V randomizované studii fáze III bylo srovnáváno podávání kombinace OxN s oxykodonem samotným z hlediska cenové úrovně a přínosu pro kvalitu života. Při podávání OxN mírně stouply přímé finanční náklady na léčbu, výrazně se ale zvýšila kvalita života a snížila se dloudobá ekonomická náročnost léčby [18].
Klinické údaje
Fixní kombinace účinných látek oxykodon hydrochloridu a naloxon hydrochloridu v OxN je vyjádřena poměrem 2 : 1. Jedná se o tablety v silách 5 mg/2,5 mg, 10 mg/5 mg, 20 mg/10 mg a 40 mg/20 mg s prodlouženým uvolňováním. Dávkování má být upraveno podle intenzity bolesti a senzitivity u každého jednotlivého pacienta. Obvyklá počáteční dávka u pacientů, kteří opioidy doposud neužívali, činí 5 mg/2,5 mg, případně 10 mg/5 mg ve 12hodinových intervalech. U pacientů, kterým jsou již opioidy podávány, je možno začít léčbu vyššími dávkami přípravku OxN, a to v závislosti na jejich předchozích zkušenostech s opioidy [5].
Maximální denní dávka OxN je 80 mg oxykodonu a 40 mg naloxonu. U pacientů vyžadujících vyšší dávky přípravku OxN je třeba zvážit dodatečné podávání oxykodonu s prodlouženým uvolňováním ve stejných časových intervalech, přičemž je třeba vzít v úvahu doporučenou maximální denní dávku 400 mg oxykodonu s prodlouženým uvolňováním. V případě dodatečného dávkování oxykodonu může dojít k omezení prospěšného účinku naloxonu na funkci střev. Při úplném ukončení léčby přípravkem OxN s následným přechodem na léčbu jiným opioidem lze očekávat zhoršení funkce střev [9]. Někteří pacienti, kteří užívají přípravek OxN podle pravidelného časového rozvrhu, vyžadují analgetika s okamžitým uvolňováním jako záchrannou medikaci při průlomové bolesti. OxN je přípravek s prodlouženým uvolňováním, proto není určen k léčbě průlomové bolesti. Není doporučeno použití OxN k pooperační analgezii v prvních 12–24 hodinách, nedoporučuje se ani pro léčbu syndromu z odnětí [9]. Přípravek OxN se nedoporučuje používat u dětí a dospívajících do 18 let vzhledem k nedostatečným údajům o bezpečnosti a účinnosti. Přípravek by se měl užívat v těhotenství pouze v případě, že prospěch léčby převáží nad možnými riziky pro nenarozené dítě nebo novorozence. Oxykodon přechází do mateřského mléka, a nelze proto vyloučit riziko pro kojence.
Tablety s prodlouženým uvolňováním je možné užívat s jídlem nebo bez jídla a zapíjejí se dostatečným množstvím tekutiny. Tablety OxN s prodlouženým uvolňováním se musí polykat celé, nesmí se lámat, žvýkat ani drtit pro nebezpečí rychlejšího uvolnění oxykodonu a možnou absorpci i fatální dávky oxykodonu.
OxN se již používá v mnoha zemích, poprvé byl klinicky použit v roce 2006 v Německu. V České republice byl zaveden do klinické praxe v březnu 2013 v tabletách s prodlouženým uvolňováním v síle 10 mg/5 mg, 20 mg/10 mg a 40 mg/20 mg.
Nežádoucí účinky
Nejsou zaznamenány žádné velmi časté nežádoucí účinky léčby OxN, tedy s výskytem od 1 % do 10 %. K častým nežádoucím účinkům (do 1 %) patří snížená chuť k jídlu nebo ztráta chuti k jídlu, neklid, závrať, bolest hlavy, vertigo, snížení krevního tlaku, bolesti břicha, zácpa, průjem, sucho v ústech, dyspepsie, zvracení, nauzea, flatulence, zvýšení hodnot jaterních enzymů, pruritus, kožní reakce (vyrážka), hyperhidróza, abstinenční syndrom, pocity tepla a zimy, zimnice a astenické stavy [9].
Interakce OxN s jinými léčivy
Nejnebezpečnějším rizikem nadměrného užití OxN je tak jako u jiných silných opioidů respirační deprese. Látky, které mají depresivní účinek na CNS (např. jiné opioidy, sedativa, hypnotika, antidepresiva, fenothiaziny, neuroleptika, antihistaminika a antiemetika), mohou zvýrazňovat depresivní účinek kombinace OxN na CNS, např. právě respirační depresi. Rovněž alkohol může zesilovat farmakodynamické účinky OxN včetně nežádoucích účinků, a je potřeba se v průběhu užívání OxN vyvarovat požívání alkoholu.Oxykodon je primárně metabolizován přes izoenzymy systému cytochromu P450 CYP3A4 a částečně přes CYP2D6, aktivita těchto enzymů může být ovlivněna podáváním různých léčiv.
Silné inhibitory aktivity CYP3A4 jako například makrolidová antibiotika (klarithromycin, erythromycin), azolová antimykotika (ketokonazol, itrakonazol, vorikonazol) či inhibitory proteáz (ritonavir, indinavir, nelfinavir) a grapefruitová šťáva mohou způsobit snížení clearance oxykodonu, což může vést ke zvýšení koncentrací oxykodonu v plazmě.
Naopak induktory CYP3A4 jako rifampicin, karbamazepin, fenytoin či třezalka tečkovaná mohou indukovat metabolismus oxykodonu a snížit tak koncentraci oxykodonu v plazmě. Léčiva inhibující aktivitu CYP2D6 jako paroxetin, fluoxetin či chinidin mohou vést ke zvýšení koncentrace oxykodonu v plazmě [9]. V případě podávání těchto léčiv je nutno upravit dávky OxN.
V této souvislosti je namístě zdůraznit, že OxN je díky obsahu naloxonu nevhodný pro zneužívání. V souhrnu údajů o přípravku je uvedeno, že je-li kombinovaný přípravek OxN zneužit parenterálně, intranazálně nebo orálně (po úpravě tablet, např. rozdrcením) osobami závislými na agonistech opioidních receptorů, jako je např. heroin, morfin nebo methadon, potom se očekává, že se dostaví výrazné abstinenční příznaky (kvůli naloxonu jako antagonistovi opioidních receptorů) anebo se zintenzivní již existující abstinenční příznaky [9].
Kontraindikace
Léčba OxN je kontraindikována ve všech případech, kdy jsou kontraindikovány opioidy. Ke kontraindikacím patří zejména závažná respirační deprese s hypoxií a/nebo hyperkapnií, závažná chronická obstrukční plicní nemoc, cor pulmonale, závažné bronchiální astma, paralytický ileus nevyvolaný opioidy a mírná až závažná porucha funkce jater [9].Opatrnosti je třeba při podávání OxN starším a oslabeným pacientům, pacientům se závažnou poruchou plicních funkcí, s myxedémem, hypotyreózou, Addisonovou nemocí (nedostatečnost kůry nadledvin), toxickou psychózou, cholelitiázou, hypertrofií prostaty, alkoholismem, deliriem tremens, pankreatitidou, hypotenzí, hypertenzí, preexistujícím kardiovaskulárním onemocněním, poraněním hlavy (vzhledem k riziku zvýšení intrakraniálního tlaku), epileptickými záchvaty nebo s predispozicí ke křečím anebo pacientům, kteří užívají inhibitory monoaminooxidázy (IMAO).
Omezení při předepisování OxN v České republice
OxN je indikován pro léčbu pacientů, u nichž je terapie opioidním analgetikem pro silnou bolest provázena také po aplikaci transdermální lékové formy extrémní zácpou, která nereaguje na standardní terapii zahrnující režimová opatření nebo na systematické a pravidelné podávání laxativ s různým mechanismem působení (obr. 1). Terapie se ukončí, pokud se do čtyř týdnů neprokáže její dostatečná účinnost definovaná jako zvýšení počtu stolic nejméně o jednu stolici týdně oproti stavu před započetím léčby OxN [9].Jak již ale bylo uvedeno, oxykodon má největší pravděpodobnost účinku na neuropatickou bolest, to znamená, že by měl být ![Obr. 1 Doporučený postup pro použití kombinace oxykodonu s naloxonem (OxN); podle [19] – www.sukl.cz.](https://www.remedia.cz/photo-a-29826---.jpg) opioidem první volby pro léčbu neuropatické bolesti mezi silnými opioidy. Vzhledem k tomu, že oxykodon není dostupný v náplasťové formě, jak požaduje SÚKL, měl by být OxN logickou volbou u pacientů s neuropatickou bolestí, kteří navíc mají potíže se zácpou i při režimových opatřeních a použití laxativ. Například v Německu nebo v Anglii není povinností, aby podání OxN předcházela léčba transdermální formou silných opioidů.
opioidem první volby pro léčbu neuropatické bolesti mezi silnými opioidy. Vzhledem k tomu, že oxykodon není dostupný v náplasťové formě, jak požaduje SÚKL, měl by být OxN logickou volbou u pacientů s neuropatickou bolestí, kteří navíc mají potíže se zácpou i při režimových opatřeních a použití laxativ. Například v Německu nebo v Anglii není povinností, aby podání OxN předcházela léčba transdermální formou silných opioidů.
Předepisování je možné jen na recepty označené modrým pruhem (viz zákon 167/1998 Sb., o návykových látkách, ve znění pozdějších předpisů) a je umožněno lékařům těchto specializací: revmatologie, dětská revmatologie, ortopedie, traumatologie, klinická onkologie, dětská onkologie a hematologie, radiační onkologie a onkogynekologie, neurologie, dětská neurologie, vnitřní lékařství, hematologie a transfuzní lékařství, geriatrie, paliativní medicína a léčba bolesti (algeziologie) [19]. Zde nacházíme rozpor ohledně nedoporučení aplikace OxN u dětské populace (viz dříve) a možnosti preskripce některými dětskými specialisty. V českém SPC je uvedeno, že u pediatrické populace nebyla bezpečnost a účinnost OxN u dětí do 18 let stanovena. K dispozici nejsou žádná data [9]. To tedy znamená, že není přímo vyloučeno použití u dětí, ale že, jak tomu u většiny léků bývá, tato populace nebyla z etických důvodů studována.
Vlastní zkušenosti
V rámci dosavadních zkušeností asi u 25 nemocných s chronickou, většinou nenádorovou bolestí na ambulanci léčby bolesti ARO Nemocnice Na Homolce se nám potvrdilo, že u většiny nemocných, kteří byli převedeni na perorální aplikaci OxN, došlo k výraznému (přesvědčivému) snížení výskytu zácpy při zachovaném analgetickém efektu (při rotaci z jiných silných opioidů), či dokonce došlo k zlepšení analgetického účinku (při rotaci ze slabých opioidů). Samozřejmě nejsnadnější je rotace z oxykodonu. 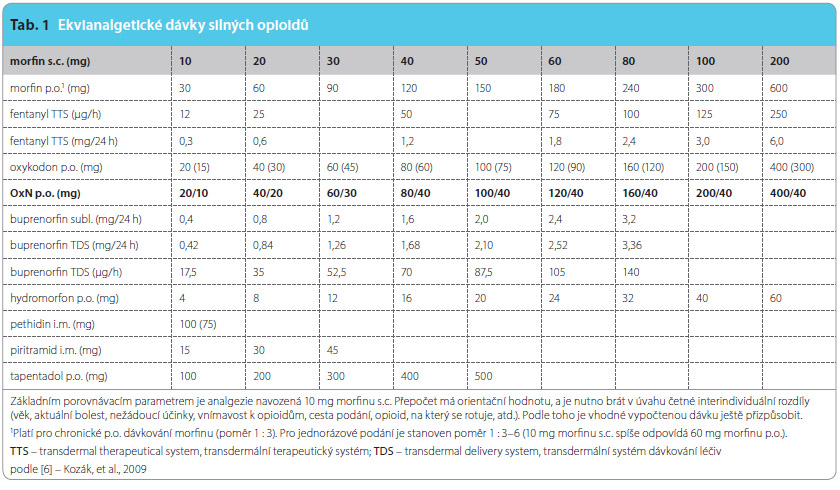 K usnadnění převodu léčby jednotlivými opioidy nám orientačně slouží převodní tabulka mezi jednotlivými opioidy s ekvipotentními dávkami (tab. 1). Naši pacienti, kteří jsou léčeni kombinací OxN, si pochvalují zlepšenou kvalitu života a zlepšení funkčních a společenských aktivit vzhledem k omezení či přímo vyloučení obtěžující zácpy a snížení dávek laxativ i finančních nákladů. Je ovšem vždy nutné si uvědomit, že i OxN je stále silný opioid se všemi přednostmi, ale i záludnostmi této léčby a že i silné opioidy jsou jen součástí multidisciplinárního a multifaktoriálního přístupu k často velmi komplikované léčbě chronické, zvláště nenádorové bolesti.
K usnadnění převodu léčby jednotlivými opioidy nám orientačně slouží převodní tabulka mezi jednotlivými opioidy s ekvipotentními dávkami (tab. 1). Naši pacienti, kteří jsou léčeni kombinací OxN, si pochvalují zlepšenou kvalitu života a zlepšení funkčních a společenských aktivit vzhledem k omezení či přímo vyloučení obtěžující zácpy a snížení dávek laxativ i finančních nákladů. Je ovšem vždy nutné si uvědomit, že i OxN je stále silný opioid se všemi přednostmi, ale i záludnostmi této léčby a že i silné opioidy jsou jen součástí multidisciplinárního a multifaktoriálního přístupu k často velmi komplikované léčbě chronické, zvláště nenádorové bolesti.
Závěr
Použití fixní tabletové kombinace OxN s prodlouženým uvolňováním se ukazuje jako účinné a bezpečné při léčbě chronické bolesti. Při podávání fixní kombinace OxN nedochází ke snížení analgetické účinnosti léčby, efekt analgezie je srovnatelný s monoterapií oxykodonem (graf 1) a výskyt opioidy vyvolané zácpy je významně snížen (graf 2). Proto je tato kombinace výbornou možností, zejména v dlouhodobé léčbě chronické bolesti. Snížení výskytu zácpy přináší nemocn![Graf 1 Analgetická účinnost oxykodonu a kombinace OxN; podle [14,15] – Sandner-Kiesling, et al., 2010, Simpson, et al., 2008.](https://www.remedia.cz/photo-a-29828---.jpg) ým významné zkvalitnění života s omezením nutnosti používání laxativ a zmenšením finanční zátěže pro nemocného. Další předností je zlepšení (zvýšení) sociálních interakcí a rozšíření i pracovních příležitostí. Dochází též ke snížení zátěže lékařů, ošetřovatelů, případně nejbližších rodinných příslušníků a také k redukci doby hospitalizace a tím i finančních nákladů. To je zvláště cenné při předpokladu vzrůstajícího počtu nemocných s chronickou bolestí v budoucnosti, zejména vzhledem ke stárnutí populace. Velmi
ým významné zkvalitnění života s omezením nutnosti používání laxativ a zmenšením finanční zátěže pro nemocného. Další předností je zlepšení (zvýšení) sociálních interakcí a rozšíření i pracovních příležitostí. Dochází též ke snížení zátěže lékařů, ošetřovatelů, případně nejbližších rodinných příslušníků a také k redukci doby hospitalizace a tím i finančních nákladů. To je zvláště cenné při předpokladu vzrůstajícího počtu nemocných s chronickou bolestí v budoucnosti, zejména vzhledem ke stárnutí populace. Velmi ![Graf 2 Index funkčnosti střev (Bowel Function Index, BFI) pro opioidy indukovanou zácpu; podle [5] – Clemens, Mikus, 2010. BFI – Bowel Function Index, index funkčnosti střev, kde 0 znamená žádnou zácpu a 100 velmi silnou zácpu; n = počet pacientů; NRS – numerical rating scale, numerická škála, kde 0 znamená žádnou bolest a 10 bolest maximální; Ox PR – oxykodon v tabletách s prodlouženým uvolňováním; OxN PR – kombinace oxykodonu a naloxonu v tabletách s prodlouženým uvolňováním; PR – prolonged-release, prodloužené uvolňování](https://www.remedia.cz/photo-a-29829---.jpg) výhodná se ukazuje zejména výměna slabých opioidů s nedostatečným analgetickým efektem a významnými nežádoucími účinky za léčbu OxN. Všechny dostupné studie prokazují, že fixní kombinace OxN je ve srovnání s jinými silnými opioidy velmi vhodnou, účinnou a bezpečnou léčebnou možností pro nemocné se střední až silnou chronickou bolestí nejrůznějšího původu, zejména pro nemocné se zácpou vyvolanou opioidy.
výhodná se ukazuje zejména výměna slabých opioidů s nedostatečným analgetickým efektem a významnými nežádoucími účinky za léčbu OxN. Všechny dostupné studie prokazují, že fixní kombinace OxN je ve srovnání s jinými silnými opioidy velmi vhodnou, účinnou a bezpečnou léčebnou možností pro nemocné se střední až silnou chronickou bolestí nejrůznějšího původu, zejména pro nemocné se zácpou vyvolanou opioidy.
Do budoucna by určitě bylo vhodné zařadit do portfolia v naší republice i OxN o nižší síle 5 mg/2,5 mg a zmírnit současné neopodstatněné preskripční omezení ve srovnání s preskripcí OxN v zahraničí.
Seznam použité literatury
- [1] Lejčko J. Antiobstipační efekt nového opioidu. Medical Tribune 2013; 5: 6.
- [2] Clemens KE, Quednau I, Klaschik E. Bowel function during pain therapy with oxycodone/naloxone prolonged-release tablets in patients with advanced cancer. Int J Clin Pract 2011; 65: 472–478.
- [3] Burness CB, Keating GM. Oxycodone/naloxone prolonged-release. A review of its use in the management of chronic pain while counteracting opioid-induced constipation. Drugs 2014; 74: 401–402.
- [4] Hesselbarth S, Löwenstein O, Cegla T. Effects of prolonged-release oxycodone/naloxone on pain control, bowel function and quality of life: A prospective observational study. Scand J Pain 2014; 5: 75–81.
- [5] Clemens KE, Mikus G. Combined oral prolonged-release oxycodone and naloxone in opioid -induced bowel dysfunction: review of efficacy and safety data in the treatment of patients experiencing chronic pain. Expert Opin Pharmacother 2010; 11: 297–310.
- [6] Kozák J, Doležal T, Hakl T, et al. Metodické pokyny pro farmakoterapii bolesti (přepracované vydání). Bolest 2009, 12: Supplementum 2.
- [7] Hakl M, Ševčík P. Novinky v léčbě chronické bolesti. Klinická farmakologie a farmacie 2009; 23: 179–180.
- [8] Kršiak M. Novinky ve farmakologii opioidů s významem pro praxi. Paliatívna medicína a liečba bolesti 2010; 3: 28–30.
- [9] Targin – Souhrn údajů o přípravku, dostupné na www.sukl.cz. Navštíveno 8. 7. 2014.
- [10] Schutter U, Grunert S, Meyer C, et al. Innovative pain therapy with a fixed combination of prolonged-release oxycodone/naloxone: a large observational study under conditions of daily practice. Current Medical Research 2010; 26: 1377–1387.
- [11] Nolte T, Schutter U, Löwenstein O. Cancer pain therapy with a fixed combination of prolonged-release oxycodone/naloxone: results from a non-interventional study. Pragmatic and Observational Research 2014, 5: 1–13.
- [12] Löwenstein O, Leyendecker P, Lux EA, et al. Efficacy and safety of combined prolonged-release oxycodone and naloxone in the management of moderate/severe chronic non-malignant pain: results of a prospectively designed pooled analysis of two randomised,double-blind clinical trials. BMC Clin Pharmacol 2010; 10: 1–9.
- [13] Vondrackova D, Leyendecker P, Meissner W, et al. Analgesic efficacy and safety of oxycodone in combination with naloxone as prolonged release tablets in patients with moderate to severe chronic pain. J Pain 2008; 9: 1144–1154.
- [14] Sandner-Kiesling A, Leyendecker P, Hopp M, et al. Long-term efficacy a safety of combined prolonged-release oxycodone and naloxone in the management of non-cancer chronic pain. Int J Clin Pract 2010; 64: 763–774.
- [15] Simpson K, Leyendecker P, Hopp M, et al. Fixed-ratio combination oxycodone/naloxone compared with oxycodone alone for the relief of opioid-induced constipation in moderate-to-severe noncancer pain. Curr Med Res Opin 2008; 24: 3503–3512.
- [16] Ahmedzai SH, Nauck F, Bar-Sela G, et al. A randomized, double blind, active controlled, double-dummy, parallel-group study to determine the safety and efficacy of oxycodone/naloxone prolonged-release tablets in patients with moderate/severe, chronic cancer pain. Palliat Med 2012; 26: 50–60.
- [17] Smith K, Hopp M, Mundin G, et al. Naloxone as part of prolonged release oxycodone/naloxone combination reduces oxycodone-induced slowing of gastrointestinal transit in healthy volunteers. Expert Opin Investig Drugs 2011; 20: 427–439.
- [18] Dunlop W, Uhl R, Khan I, et al. Quality of life benefits and cost impact of prolonged release oxycodone/naloxone versus prolonged release oxycodone in patients with moderate-to-severe non-malignant pain and opioid-induced constipation: a UK cost-utility analysis. J Med Econ 2012; 15: 564–575.
- [19] Státní ústav pro kontrolu léčiv, Informace o základní úhradě; dostupné na: http://www.sukl.cz/modules/medication/detail.php?code=0138530&tab=prices Navštíveno 14. 7. 2014.