Glatiramer acetát v České republice – výstupy z registru ReMuS
Souhrn:
V České republice (ČR) jsou v součinnosti s jednotlivými centry pro diagnostiku a léčbu demyelinizačních onemocnění (RS centra) shromažďována od roku 2013 data pacientů léčených chorobu modifikujícími léky v registru pacientů s diagnózou roztroušené sklerózy (ReMuS). Aktuálně jsou odborné veřejnosti předkládána data nemocných léčených v ČR glatiramer acetátem (GA). Uvedené výstupy byly zpracovány k 31. prosinci 2015 nejen z pohledu zadaných dlouhodobých retrospektivních dat každodenní aplikace 20 mg GA subkutánně, ale rovněž prospektivně od roku 2013, včetně změny léčby na dávku 40 mg GA subkutánně třikrát týdně.
Key words: multiple sclerosis – glatiramer acetate – ReMuS.
Summary:
Since 2013, data concerning patients suffering from multiple sclerosis and treated with disease-modifying drugs are being collected in the ReMuS registry through collaboration with individual centers for evaluation and treatment of demyelinating diseases (MS centers). Currently, data from patients treated with glatiramer acetate (GA) in the Czech Republic are being presented to relevant specialists. The presented data were analyzed as of December 31st, 2015, not only with respect to long-term retrospective data dealing with everyday application of GA 20mg subcutaneously but also to prospective evaluation since 2013, including the change of dosing to GA 40mg subcutaneously three times a week.
Úvod
U pacientů s první manifestací demyelinizačního onemocnění (CIS – klinicky izolovaný syndrom, clinically isolated syndrome) nebo v časné fázi remitující formy roztroušené sklerózy (RS) jsou první volbou léčivé přípravky ve formě injekční (interferon beta [IFNb], glatiramer acetát) nebo tabletové (teriflunomid). Vzhledem k různé tolerabilitě této skupiny léků ovlivňujících onemocnění (disease modifying drugs, DMD) a vzhledem k nežádoucím reakcím (flu like syndrom, kožní reakce, míra hepatotoxicity atd.), k frekvenci podávání (1× týdně, 3× týdně, ob den, denně) a k aplikační formě (i.m., s.c., p.o.) má každý jednotlivý přípravek ze skupiny DMD své specifické indikační postavení, a proto jejich vzájemná zastupitelnost není možná. V případě nedostatečné účinnosti a nežádoucích reakcí na léčbu (včetně vývoje neutralizačních protilátek proti IFNβ) lze terapii zaměnit za dosud nepoužitý léčivý přípravek této skupiny [1,2].
Imunomodulační léčba DMD je nejúčinnější v prvních 5–7 letech trvání RS a její indikace vyplývá z konsensu expertů opírajícího se o výsledky dlouhodobých klinických studií [3–8]. V České republice (ČR) je indikace léčby DMD limitována úhradovými mechanismy regulatorních orgánů. Časový interval do zahájení léčby by měl být co nejkratší ‒ podle nařízení vlády ČR č. 307/2012 Sb. s účinností od 1. 1. 2013 je stanoven na čtyři týdny od určení diagnózy RS. Volba léčivého přípravku by měla být individuální s ohledem na jeho účinnost a snášenlivost a na vývoj RS stanovený pomocí objektivizujících markerů [9]. U části nemocných se navzdory stálému zdokonalování léčebné strategie vyvine sekundárně progresivní forma RS s trvalou pozvolnou progresí invalidity bez manifestace klinických atak, což determinuje ukončení léčby DMD. Switch v léčbě relabující remitující (RR) formy RS můžeme zvolit v rámci jedné skupiny imunomodulačních léků (1. nebo 2. linie léčby) nebo zaměníme přípravek z jedné skupiny (1. linie) za přípravek z druhé skupiny (2. linie léčby), tj. provedeme eskalaci terapie. Léčbu můžeme pro neúčinnost definitivně ukončit [10].
V České republice jsou v součinnosti s centry pro diagnostiku a léčbu demyelinizačních onemocnění (RS centry) shromažďována od roku 2013 data pacientů léčených DMD v registru pacientů s diagnózou RS (ReMuS). Aktuálně jsou odborné veřejnosti překládána data nemocných léčených v ČR glatiramer acetátem (GA) oficiálně poskytnutá firmou Teva Pharmaceuticals CR, s.r.o., která je získala po projednání a schválení Nadačním fondem IMPULS a Sekcí klinické neuroimunologie a likvorologie (SKNIL) z registru ReMuS. Výstupy z registru byly zpracovány k 31. prosinci 2015 nejen z pohledu zadaných dlouhodobých retrospektivních dat každodenní aplikace 20 mg GA subkutánně, ale i prospektivně od roku 2013, včetně změny léčby na 40 mg GA subkutánně třikrát týdně.
Metodika
Registr ReMuS byl založen Nadačním fondem IMPULS v roce 2013 za odborné podpory Sekce klinické neuroimunologie a likvorologie České neurologické společnosti (SKNIL ČNS) ČLS JEP s cílem získávat kvalitní a reprezentativní údaje o pacientech s diagnózou RS v České republice [11].
K 31. prosinci 2015 byla v registru ReMuS k dispozici data z třinácti RS center: Všeobecná fakultní nemocnice Praha, FN Motol (Praha), FN Královské Vinohrady (Praha), Fakultní Thomayerova nemocnice (Praha), FN Brno Bohunice, FN Hradec Králové, FN Plzeň, FN Ostrava, FN Olomouc, Nemocnice České Budějovice, Nemocnice Jihlava, Pardubická nemocnice, Nemocnice Teplice. Pro analýzu byla vybrána data pacientů, kteří byli v období od 1. ledna 2013 léčeni jedním z níže uvedených přípravků DMD nebo intravenózními imunoglobuliny (IVIG) a zároveň u nich byla k dispozici aktuální data:
- DMD ‒ Aubagio (teriflunomid), Avonex (IFNβ), Betaferon (IFNβ), Copaxone 20 (glatiramer acetát), Copaxone 40 (glatiramer acetát), Extavia (IFNβ), Rebif 22 (IFNβ), Rebif 44 (IFNβ), Tecfidera (dimethyl fumarát), Gilenya (fingolimod), Tysabri (natalizumab), Lemtrada (alemtuzumab);
- IVIG ‒ Endobulin, Flebogamma, Gammagard, Kiovig, Octagam (imunoglobuliny pro intravenózní podání 10% a 5%).
Výsledky
Pro komplexní pohled na léčbu GA (Copaxone) v ČR jsou zde předkládána i základní demografická data, údaje o zaměstnanosti a sociálních dávkách, době trvání nemoci, stupni postižení, výskytu relapsů a změně léčby.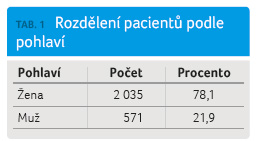
Celkový počet pacientů, kteří byli k 31. prosinci 2015 v minulosti nebo v současnosti léčeni přípravkem GA, byl 2 606. Tito pacienti splnili podmínky k zařazení do registru ReMuS ‒ podepsali informovaný souhlas o účasti v registru a jsou léčeni v jednom z uvedených třinácti RS center. Zastoupení nemocných léčených v jednotlivých RS centrech je rozdílné a pohybuje se od 2,6 % do 19,6 % z celkového počtu 2 606 pacientů. Vzhledem k dynamice v léčbě RS kolísají rovněž celkové počty pacientů léčených GA. Proto při poslední návštěvě na konci roku 2015 bylo GA léčeno 1 656 pacientů v registru, tj. 63,5 % z celkového počtu pacientů léčených GA i v minulosti.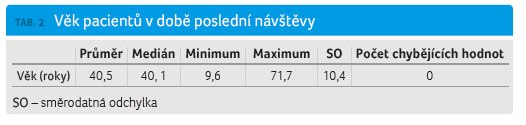
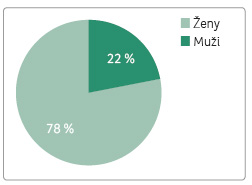
Ve sledované kohortě pacientů léčených GA podle registru ReMuS bylo 78,1 % žen a 21,9 % mužů (tab. 1, graf 1). Věkový medián v době poslední návštěvy v roce 2015 byl 40,1 roku. Největší podíl pacientů léčených GA byl zaznamenán ve věkové skupině 30‒40 let, a to 34,3 % (tab. 2, graf 2). Věkov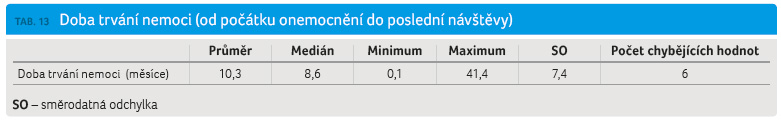 ý medián začátku onemocnění byl 29,3 roku a významně se liší od mediánu věku 34,1 roku, k
ý medián začátku onemocnění byl 29,3 roku a významně se liší od mediánu věku 34,1 roku, k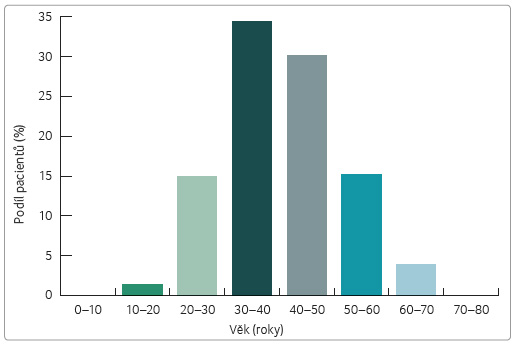 dy byla zahájena léčba GA (tab. 3).
dy byla zahájena léčba GA (tab. 3).
K hodnocení stupně disability v registru ReMuS je standardně používána škála EDSS (Expanded Disability Status Scale: 0‒10). Stupeň postižení byl analyzován na základě poslední zaznamenané návštěvy pacienta. Medián hodnoty EDSS byl 2,5, nejvíce pacientů mělo stupeň disability 1,5‒2,0 (tab. 4, graf 3).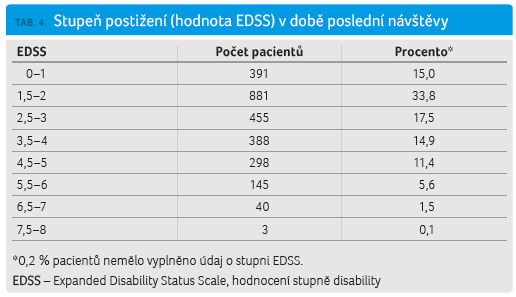
Z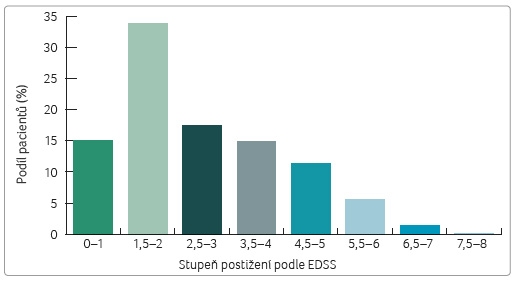 a posledních šest měsíců prodělalo relaps 11,1 % pacientů a za dvanáct měsíců to bylo celkem 30,1 % pacientů. Hodnocený průměrný počet relapsů za jeden rok (annualised relapse rate, ARR) byl 0,301. Závažnost relapsů je definována v registru ReMuS jako lehká, střední a těžká. Lehký relaps neovlivňuje aktivity denního života, střední ovlivňuje aktivity denního života a těžký relaps způsobuje pacientovi těžký diskomfort, významně ovlivňuje aktivity denního života a vede k pracovní neschopnosti, ev. k hospitalizaci. V analyzovaném souboru převažuj
a posledních šest měsíců prodělalo relaps 11,1 % pacientů a za dvanáct měsíců to bylo celkem 30,1 % pacientů. Hodnocený průměrný počet relapsů za jeden rok (annualised relapse rate, ARR) byl 0,301. Závažnost relapsů je definována v registru ReMuS jako lehká, střední a těžká. Lehký relaps neovlivňuje aktivity denního života, střední ovlivňuje aktivity denního života a těžký relaps způsobuje pacientovi těžký diskomfort, významně ovlivňuje aktivity denního života a vede k pracovní neschopnosti, ev. k hospitalizaci. V analyzovaném souboru převažuj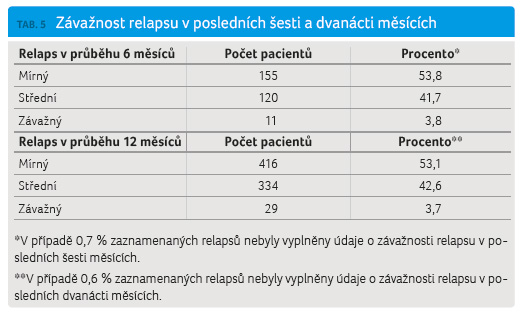 e výskyt lehkých nebo středně těžkých relapsů. Těžkých relapsů v obou hodnocených obdobích šesti měsíců (3,8 %) a dvanácti měsíců (3,7 %) bylo minimum (tab. 5, graf 4). Poslední hodnocený pa
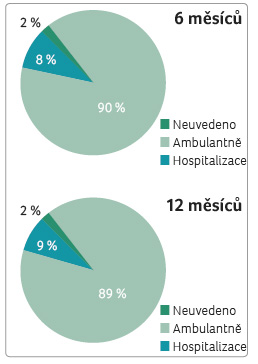
e výskyt lehkých nebo středně těžkých relapsů. Těžkých relapsů v obou hodnocených obdobích šesti měsíců (3,8 %) a dvanácti měsíců (3,7 %) bylo minimum (tab. 5, graf 4). Poslední hodnocený pa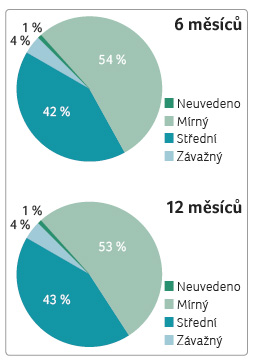 rametr způsobu léčby relapsu ambulantně nebo za hospitalizace reflektuje známou zkušenost převažující ambulantní péče o pacienty s RS. Celkem 8‒9 % pacientů mělo relaps léčený při hospitalizaci (graf 5). Zaznamenané relapsy byly nejčastěji léčeny intravenózně methylprednisolonem (IVMP), jen výjimečně perorálními kortikosteroidy (Medrol, Prednison; 1,4‒1,8 %) nebo plazmaferézou (0,3 %) (tab. 6). Medián celkové dávky methylprednisolonu (MP) podávané k léčbě relapsu byl 3 000,0 mg (tab. 7) a odpovídá standardní doporučené dávce 3 000,0–5 000,0 mg IVMP pro léčbu relapsu. V tabulce uvedená minimální a maximální podaná dávka MP nepřímo reflektuje závažnost relapsu.
rametr způsobu léčby relapsu ambulantně nebo za hospitalizace reflektuje známou zkušenost převažující ambulantní péče o pacienty s RS. Celkem 8‒9 % pacientů mělo relaps léčený při hospitalizaci (graf 5). Zaznamenané relapsy byly nejčastěji léčeny intravenózně methylprednisolonem (IVMP), jen výjimečně perorálními kortikosteroidy (Medrol, Prednison; 1,4‒1,8 %) nebo plazmaferézou (0,3 %) (tab. 6). Medián celkové dávky methylprednisolonu (MP) podávané k léčbě relapsu byl 3 000,0 mg (tab. 7) a odpovídá standardní doporučené dávce 3 000,0–5 000,0 mg IVMP pro léčbu relapsu. V tabulce uvedená minimální a maximální podaná dávka MP nepřímo reflektuje závažnost relapsu.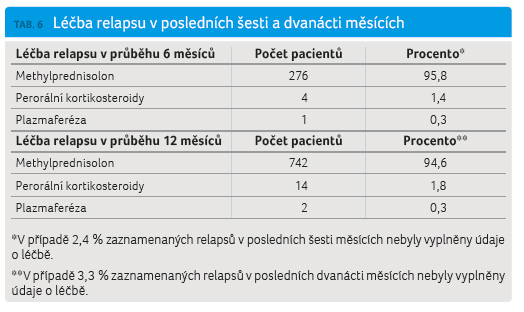
V hodnoceném souboru pacientů léčených GA se jednalo v 74,0 % o první léčivý přípravek ze skupiny DMD. Druhou volbou byl GA u 19,8 % pacientů, u nichž nejčastěji předcházela léčba interferonem beta (Betaferon, Avonex, Rebif) (tab. 8).
Pozornost byla věnována analýze poslední návštěvy v roce 2015 a nové možnosti změny léčby z GA v dávce 20 mg denně subkutánně na GA v dávce 40 mg třikrát týdně subkutánně. Při poslední návštěvě bylo léčeno GA (20 mg) celkem 81,2 % pacientů, z čehož se v 70,3 % jednalo o první léčivý přípravek. Celkem 18,8 % pacientů bylo léčeno při poslední návštěvě v r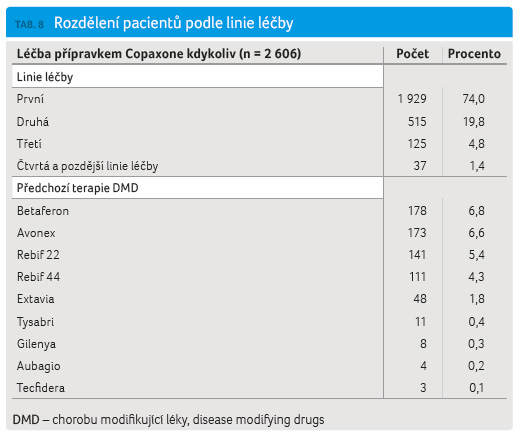 oce 2015 GA (40 mg), z toho u 11,5 % se jednalo o první léčivý přípravek ze skupiny DMD
oce 2015 GA (40 mg), z toho u 11,5 % se jednalo o první léčivý přípravek ze skupiny DMD 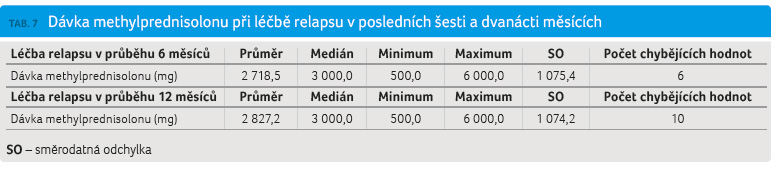 (tab. 9). Glatiramer acetát v dávce 40 mg byl představen odborné veřejnosti a uveden na trh 1. září 2015.
(tab. 9). Glatiramer acetát v dávce 40 mg byl představen odborné veřejnosti a uveden na trh 1. září 2015.
Podrobnější analýza všech variant změny léčby GA ve sledovaném období ukázala, že celkem 6,5 % pacientů bylo převedeno na jinou léčbu DMD nebo IVIG a celkem 1,6 % pacientů ukončilo léčbu GA, resp. DMD nebo IVIG. Vysvětlením je přerušení léčby nebo definitivní ukončení terapie (tab. 10). Naopak ve sledovaném období dvanácti měsíců zahájilo léčbu GA 191 pacientů (7,3 %), tj. nově diagnostikovaných pacientů s CIS nebo RR formou RS. Dalších 90 (3,5 %) pacientů mělo léčbu převedenu z jiného přípravku ze skupiny DMD nebo IVIG.
Všechny pop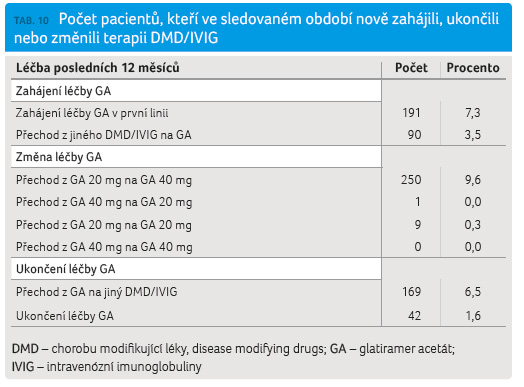 sané skupiny nemocných jsou vztaženy k celé sledované kohortě pacientů, kteří byli kdykoliv dříve léčeni GA. Jedná se o zahájení, změnu a ukončení léčby ve sledovaném období dvanácti měsíců před exportem dat. Někteří pacienti mohou být zařazeni ve více skupinách, pokud ve sledovaném období vícekrát změnili léčbu.
sané skupiny nemocných jsou vztaženy k celé sledované kohortě pacientů, kteří byli kdykoliv dříve léčeni GA. Jedná se o zahájení, změnu a ukončení léčby ve sledovaném období dvanácti měsíců před exportem dat. Někteří pacienti mohou být zařazeni ve více skupinách, pokud ve sledovaném období vícekrát změnili léčbu.
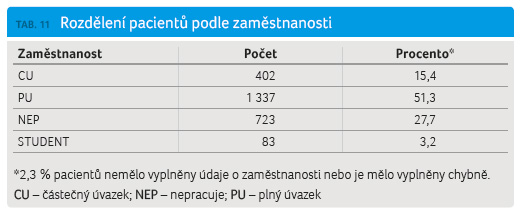
Zcela nové informace poskytuje registr ReMuS v oblasti zaměstnanosti a pobírání sociálních dávek. Zaměstnanost a pobírání sociálních dávek byly vyhodnoceny z údajů z poslední návštěvy pacientů v roce 2015. Výsledky byly hodnoceny v celé kohortě pacientů, kteří byli kdykoliv dříve léčeni GA. Z důvodu přehlednosti a smysluplnosti těchto informací byly stanoveny kategorie pro zaměstnanost: CU – částečný úvazek, PU – plný úvazek, NEP – nepracuje (nezávisle na důvodu a případných sociálních dávkách) a STUDENT – studuje (sociální a zdravotní pojištění platí stát). Více než polovina pacientů léčených GA pracuje na plný úvazek (51,3 %) a dalších 15,4 % pacientů pracuje na částečný úvazek (tab. 11, graf 6).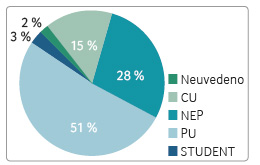
Struktura sociálních dávek byla zjednodušena a byla zvolena vždy pouze nejdůležitější dávka v případě, že pacient pobírá více dávek. Zásadní byla analýza tří stupňů invalidního důchodu (ID1, ID2, ID3), další dávky byly analyzovány pro úplnost: MD – mateřská dovolená, SD – starobní důchod, NEZAM – sociální dávky v nezaměstnanosti (tab. 12, graf 7). Celková doba trvání nemoci byla v průměru 10,3 roku, medián byl 8,6 roku (tab. 13).
Diskuse
U pacientů léčených GA byl zaznamenán vyšší podíl žen než v celém souboru pacientů léčených DMD nebo IVIG registrovaných v registru ReMuS (78 % vs. 72 %) a velmi podobné rozložení podle věku. Glatiramer acetát je preferován u dětí, mladých žen a v případech, kdy se předpokládá nebo je prokázána intolerance interferonu beta (IFNß). U dívek a mladých žen se dává přednost GA zejména z toho důvodu, že je přípravek hodnocen Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) z hlediska teratogenity kategorií B oproti IFNß, který je v kategorii C.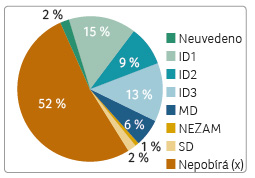
Průměrný věk v době začátku onemocnění byl o pět let nižší než průměrný věk v době zahájení léčby GA. Vysvětlením může být fakt, že GA patří mezi jedny z prvních přípravků ze skupiny DMD na trhu a teprve v posledních letech je schválena léčba CIS a pravidla k časnému zahájení léčby RS (do čtyř týdnů od stanovení diagnózy RS podle vládního nařízení č. 307/2012 Sb. s účinností od 1. 1. 2013). Není to jistě jediné možné vysvětlení. Také lze zaznamenat mírně vyšší roční počet relapsů (ARR) v kohortě GA oproti celému souboru nemocných léčených DMD a registrovaných v registru ReMuS (0,301 vs. 0,270). Analýza ukazuje očekávané zjištění, že GA je typickým přípravkem ze skupiny DMD první linie [12]. Dalších téměř 20 % pacientů bylo převedeno z jiného DMD. Zde je možné předpokládat, že se bude jednat o změnu z důvodu intolerance nebo nižší účinnosti předchozí léčby. Očekávaně byla v drtivé většině případů jako předchozí linie DMD zaznamenána léčba interferony beta. U více než 6 % pacientů byl GA nasazován jako třetí nebo vyšší volba terapie. Data rovněž ukazují, že v posledním období probíhá u určitého procenta pacientů switch z GA v dávce 20 mg na GA v dávce 40 mg a tento trend vzhledem ke zvýšení míry adherence k terapii bude nepochybně ve sho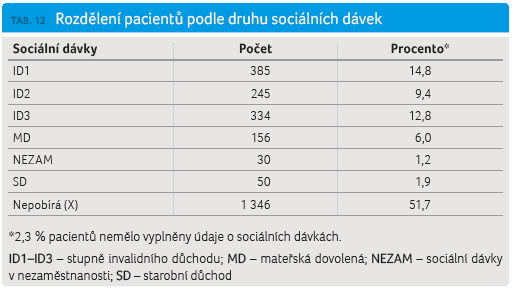 dě s písemnictvím pokračovat [13–15]. Data jsou pouze předběžná s ohledem k uvedené skutečnosti, že GA (40 mg) byl představen odborné veřejnosti a uveden na trh 1. září 2015, avšak k vyhodnocení jsou nezbytné údaje z dlouhodobého sledování.
dě s písemnictvím pokračovat [13–15]. Data jsou pouze předběžná s ohledem k uvedené skutečnosti, že GA (40 mg) byl představen odborné veřejnosti a uveden na trh 1. září 2015, avšak k vyhodnocení jsou nezbytné údaje z dlouhodobého sledování.
Hodnocení zaměstnanosti a pobírání sociálních dávek provedené v rámci registru ReMuS přineslo nové argumenty oprávněnosti časné léčby RS přípravky ze skupiny DMD. Více než polovina pacientů léčených GA pracuje na plný úvazek (51,3 %) a dalších 15,4 % pacientů pracuje na částečný úvazek (tab. 11, graf 6). V klinické kohortě GA je mírně nižší počet pacientů, kteří jsou zaměstnáni na plný úvazek, v porovnání se všemi pacienty léčenými DMD a vedenými v registru ReMuS (51,3 % vs. 55,7 %). Vysvětlením tohoto rozdílu je velké procento pacientů léčených GA již více než 10 let a rovněž doba trvání nemoci. Práceschopnost nepřímo vyjadřuje kvalitu života pacientů léčených DMD a oprávněnost indikace nákladné léčby.
Závěr
Prezentovaná analýza byla provedena z dat celostátního registru pacientů s roztroušenou sklerózou ReMuS, který k 31. prosinci 2015 obsahoval údaje o více než 7 000 pacientech léčených DMD nebo IVIG. Sledovaná podskupina nemocných, která byla kdykoliv v záznamech v registru ReMuS léčena přípravkem GA, zahrnovala 2 606 pacientů. Analýza léčby těchto pacientů s RS prokázala oprávněnost postavení GA v první linii léčby RS a příslib zvýšení adherence k terapii přechodem na podávání GA v dávce 40 mg třikrát týdně subkutánně. Míra zaměstnanosti pacientů léčených GA (téměř 52 %), kteří pracují a nepobírají žádné sociální dávky, je argumentem oprávněnosti nákladné léčby přípravky ze skupiny DMD.
Práce byla podpořena MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPI, 00669806).
Tabulky a grafy upraveny podle:
Mimořádný výstup z registru ReMuS – léčba přípravkem Copaxone, 11. 4. 2016.
Seznam použité literatury
- [1] Hesle D, Sorensen PS. Swing measurements of neutralizing antibodies: the challenge of IFN‑b therapy. Eur J Neurol 2007; 8: 850–859.
- [2] Polman CH. Recommendations for clinical use of data on neutralising antibodies to IFN‑b therapy in MS. Lancet Neurol 2010; 9: 740–750.
- [3] Polman CH, Reingold SC, Banwell B, et al. Diagnostic criteria for multiple sclerosis: 2010 Revisions to the McDonald Criteria. Ann Neurol 2011; 69: 292–302.
- [4] Kappos L, Polman CH, Freedman MS, et al. Treatment with interferon beta‑1b delays conversion to clinically definite and McDonald MS in patiens with clinically isolated syndromes. Neurology 2006; 67: 1242–1249.
- [5] Bertolotto A. Neutralizing antibodies to IFN‑b: implications for the management of MS. Curr Opin Neurol 2004; 17: 241–246.
- [6] Cleriso M, Faggiano F, Palace J, et al. Recombinant interferon beta or glatiramer acetate for delaying conversion of the first demyelinating event to multiple sclerosis. Cochrane diabase of systematic rewiews (Online) 2008; 2: CD005378.
- [7] Comi G, Filippi M, Barkhof F, et al. Effect of early interferon treatment on conversion to definite multiple sclerosis: a randomised study. Lancet 2001; 357: 1576–1582.
- [8] Jacobs LD, Beck RW, Simon JH, et al. CHAMPS Study Group. Intramuscular interferon beta‑1a therapy initiated during a first demyelinating event in multiple sclerosis. N Engl J Med 2000; 343: 898–904.
- [9] Kappos L, Freedman MS, Polman CH. BENEFIT Study Group. Long term effect of early treatment with interferon beta‑1b after first clinical event suggestive of multiple sclerosis:5‑years active treatment extension of the phase 3 BENEFIT trial. Lancet Neurol 2009; 8: 987–997.
- [10] Zapletalová O. Léčba časných stadií roztroušené sklerózy mozkomíšní. Remedia 2009; 19: 198–204.
- [11] Wiendl H, Toyka KV, Rieckmann P, et al. Multiple Sclerosis Therapy Consensus Group (MSTCG). Basic and escalating immunomodulatory treatments in multiple sclerosis: current therapeutic recommendations. J Neurol 2008; 255: 1449–1463.
- [12] Jones JL, Scheit DJ, Kaushal RS. Assessing the role of patients support services on adherence rates in patient using glatiramer acetate for relapsing‑remitting multiple sclerosis. J Med Econ 2013; 16: 2013–2220.
- [13] Coyle PL, Cohen BA, Leist T, et al. Therapy Optimization in Multiple Sclerosis: a Prospective Observational Study of Therapy Compliance and Outcomes. BMC Neurol 2014; 2014 Mar 13. doi: 10.1186/1471‑2377‑14‑49.14(49)
- [14] Devonshire V, Lapierre Y, Macdonell R, et al. The Global Adherence Project (GAP): a multicenter observational study on adherence to disease‑modifying therapies in patients with relapsing‑remitting multiple sclerosis. Eur J Neurol 2010, 18: 69–77.
- [15] Ivanova JI, et al. Impact of medication adherence to disease‑modifying drugs on severe relapse, and direct and indirect costs among employees with multiple sclerosis in the US. J Med Econ 2012; 15: 601–609.