Glukagonu podobný peptid 1 a jeho význam pro současnou diabetologii
Glukagonu podobný peptid 1 (glucagon-like peptide 1, GLP-1) patří mezi inkretinové hormony, tedy působky produkované sliznicí tenkého střeva v reakci na průchod potravy, které způsobují zvýšení sekrece inzulinu a snížení sekrece glukagonu v Langerhansových ostrůvcích pankreatu. Sekrece GLP-1 je u řady pacientů s diabetes mellitus 2. typu (DM2) snížená. Terapeutické přístupy založené buď na zvýšení endogenních hladin GLP-1 nebo na podávání tzv. GLP-1 agonistů vedou proto ke snížení glykemie a ke zlepšení kompenzace DM2. Tato tzv. inkretinová léčba diabetu má kromě antidiabetického působení i řadu dalších potenciálně velmi zajímavých účinků včetně snížení hmotnosti, mírného poklesu krevního tlaku a předpokládaných kardioprotektivních a neuroprotektivních účinků. V tomto článku se budeme věnovat mechanismům účinku GLP-1 v lidském organismu a jejich potenciálnímu využití u pacientů s diabetem. Zaměříme se nejen na klasické pankreatické účinky tohoto hormonu, ale také na extrapankreatické účinky GLP-1, jejichž mechanismus a význam v klinické praxi je v současné době předmětem intenzivního výzkumu a řady klinických studií.
Co jsou inkretinové hormony
Inkretiny jsou definovány jako hormony uvolňované ze střeva do krevního oběhu v reakci na stimulaci střevní sliznice potravou. Tyto hormony vedou po svém uvolnění ke zvýšení inzulinové sekrece, a jsou tedy zásadní pro 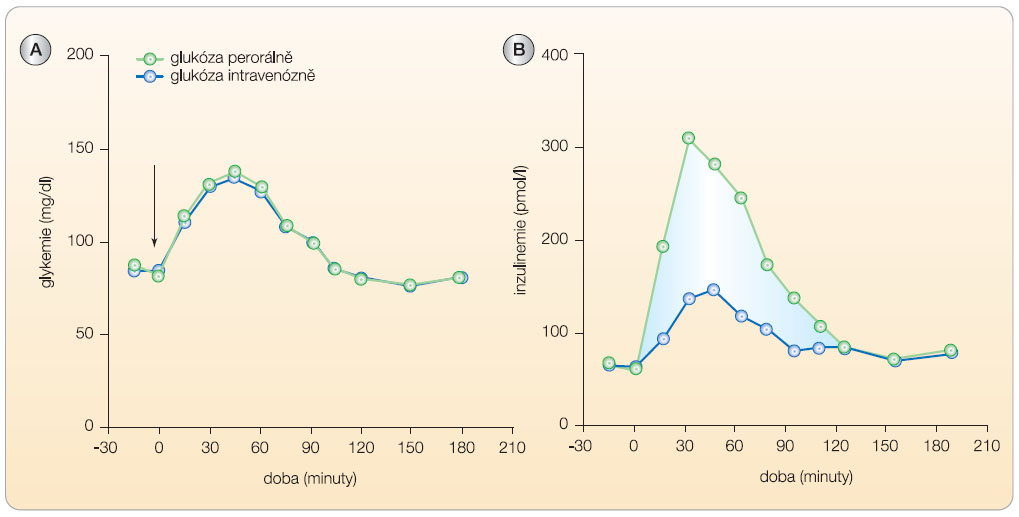 udržení normální glukózové homeostázy [1].
udržení normální glukózové homeostázy [1].
Vliv inkretinů na sekreci inzulinu je často označován jako tzv. inkretinový efekt (graf 1). Provedené studie ukázaly, že inkretinový efekt je zodpovědný za nejméně 50 % celkové inzulinové sekrece po požití potravy [2]. Definici inkretinů splňují v současné době pouze dva hormony: glukagonu podobný peptid 1 (glucagon-like peptide 1, GLP-1) a glukózo-dependentní inzulinotropní polypeptid (glucose dependent insulinotropic polypeptide neboli gastric inhibitory peptide, GIP), obr. 1.
Historie inkretinové léčby
Inkretinová léčba, respektive hypotéza o existenci inkretinů, je stará více než sto let, a má tak dokonce delší historii než podávání inzulinu (přehled [3]). Již v roce 1902 Bayliss a Starling publikovali práci, kde prokázali, že podání kyselého roztoku do trávicího traktu stimulovalo pankreatickou sekreci i při přerušení nervů inervujících žaludek a střevo. V té době šlo o převratné zjištění, neboť do doby, než byla zveřejněna tato práce, se předpokládalo, že pankreatická sekrece je regulována převážně nervovými impulzy z trávicího traktu. Bayliss a Starling na svůj objev navázali další prací, kde podali nitrožilně experimentálním zvířatům extrakty ze střevní sliznice po stimulaci kyselým roztokem. I v tomto případě došlo k vyvolání exokrinní pankreatické  sekrece. Autoři konstatovali, že střevní sliznice uvolňuje látku stimulující pankreatickou sekreci, kterou nazvali sekretin. V roce 1905 použil Starling poprvé pojem hormon jako obecné označení pro faktory uvolňované v jedné části organismu a působící v jiné části organismu po přenosu v cirkulaci. Již v té době vyslovil Starling hypotézu, že střevní extrakty mohou obsahovat i faktor stimulujicí endokrinní sekreci pankreatu.
sekrece. Autoři konstatovali, že střevní sliznice uvolňuje látku stimulující pankreatickou sekreci, kterou nazvali sekretin. V roce 1905 použil Starling poprvé pojem hormon jako obecné označení pro faktory uvolňované v jedné části organismu a působící v jiné části organismu po přenosu v cirkulaci. Již v té době vyslovil Starling hypotézu, že střevní extrakty mohou obsahovat i faktor stimulujicí endokrinní sekreci pankreatu.
V roce 1906 byly provedeny první experimenty s perorálním podáváním střevních extraktů mladým diabetikům 1. typu. Popsány byly překvapivě i určité pozitivní výsledky, ačkoliv podle dnešních znalostí je zřejmé, že perorální podání peptidových hormonů (dojde k jejich rozštěpení již v trávicím traktu) ve skutečnosti nemohlo fungovat. Tyto experimenty je nicméně možné považovat za první pokus o „léčbu založenou na inkretinech“, přestože sami autoři ji takto v té době nenazývali.
Po objevu inzulinu a jeho účinků Bantingem a Bestem v roce 1921 došlo k dalšímu obnovení zájmu o možnost léčby diabetu podáváním extraktů střevní sliznice. Tyto experimenty přinesly různorodé, avšak vesměs nepřesvědčivé výsledky. Zásadním zlomem ve znalostech účinků inkretinů bylo zavedení radioimunoanalytického stanovení hladiny inzulinu v roce 1960. V letech 1964–1967 tři výzkumné skupiny nezávisle prokázaly, že podání glukózy perorálně vyvolává podstatně výraznější vzestup hladin inzulinu než její podání intravenózní a byl tak poprvé jasně potvrzen výše zmiňovaný inkretinový efekt. V roce 1967 pak Brown izoloval a popsal aminokyselinovou sekvenci nového peptidu získaného ze střevní sliznice. Vzhledem k tomu, že exogenní podání tohoto peptidu vedlo k inhibici sekrece kyseliny chlorovodíkové, byla tato látka nazvána gastrický inhibiční peptid (GIP). Stejná skupina vědců posléze zjistila, že GIP má i inzulinotropní účinky, a navrhla název glukózo-dependentní inzulinotropní polypeptid. Zkratka GIP tak mohla být zachována a je používána dodnes. Již v této době bylo prokázáno, že k působení GIP je nezbytné zvýšení glykemie, tedy že účinky tohoto prvního identifikovaného inkretinu jsou na glykemii závislé a neprojeví se při normální nebo snížené glykemii. Další inkretinový hormon – glukagonu podobný peptid 1 (glucagon-like peptide 1, GLP-1) – byl objeven až v roce 1985 jako jeden ze tří štěpných produktů tehdy nově popsané molekuly proglukagonu. Bylo rovněž prokázáno, že i tento faktor má inzulinotropní účinky – tedy že jeho intravenózní podání vede ke zvýšení inzulinové sekrece a také k poklesu glykemie u diabetiků 2. typu. Ve stejné době bylo prokázáno, že podávání GIP není u diabetiků účinné. Tyto objevy otevřely nové směry léčebného výzkumu, na jehož konci stojí vytvoření dvou skupin molekul s účinkem založeným na ikretinovém principu gliptinů (inhibitorů dipeptidyl-petidázy 4) a agonistů GLP-1.
Struktura a mechanismus působení inkretinových hormonů
Přestože jsou známy dva inkretinové hormony, v současné době je využíváno pouze přístupů založených na ovlivnění GLP-1. GIP zde bude proto zmíněn jenom stručně, zejména se zaměřením na odlišnosti jeho účinků ve srovnání s GLP-1.
Glukózo-dependentní inzulinotropní polypeptid (GIP)
GIP je peptid složený ze 42 aminokyselin, který vzniká posttranslačními modifikacemi tzv. GIP genu [4]. Místem produkce GIP jsou enteroendokrinní K-buňky lokalizované především v duodenu a jejunu. Hladiny GIP jsou nalačno relativně nízké (9–12 pmol/l), významně však stoupají po požití potravy (na 50–120 pmol/l). Hlavními složkami potravy, které sekreci GIP stimulují, jsou sacharidy a lipidy, zatímco aminokyseliny stimulují sekreci GIP relativně málo. Inzulin stimulující účinky GIP jsou závislé na aktuální hladině glukózy, a neprojeví se tedy při normální či snížené glykemii. Míra stimulace GIP závisí nejen na typu požité potravy, ale i na velikosti porce (roste s požitím většího množství potravy). Účinky GIP jsou zprostředkovány GIP receptorem (tzv. GIPR). Účinky GIP v organismu jsou velmi mnohočetné a nejsou zdaleka omezeny pouze na pankreas. V b-buňkách Langerhansových ostrůvků pankreatu vede GIP za stavu zvýšení hladiny glukózy po požití potravy k vyplavení inzulinu do cirkulace. GIP vede také ke zvýšení transkripce inzulinového genu a tím ke zvýšení syntézy inzulinu. Bylo také prokázáno, že GIP má na b-buňky významné růstové a antiapoptotické účinky. Působí tedy v experimentu zvýšení proliferace b-buněk 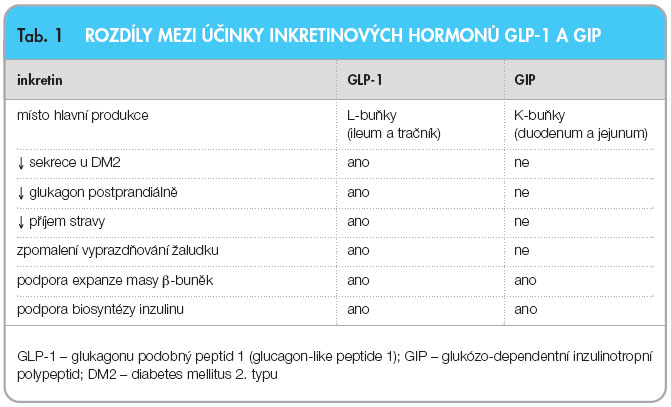 a zároveň je chrání před buněčnou smrtí vyvolanou například dlouhodobě zvýšenou hladinou glukózy, ektopickým ukládáním lipidů v pankreatu, ale také před zničením při experimentálním podávání cytostaticky působícího streptozotocinu. Na rozdíl od GLP-1 však jsou hladiny GIP u diabetiků 2. typu normální nebo zvýšené a jeho podávání nevede k poklesu glykemie a ke zlepšení kompenzace diabetu. Předpokládá se, že v případě GIP je u diabetu mellitu 2. typu (DM2) přítomna necitlivost na jeho účinky, pravděpodobně v důsledku snížení exprese jeho receptorů nebo na postreceptorové úrovni. Rozdíly mezi účinky GLP-1 a GIP jsou uvedeny v tab. 1.
a zároveň je chrání před buněčnou smrtí vyvolanou například dlouhodobě zvýšenou hladinou glukózy, ektopickým ukládáním lipidů v pankreatu, ale také před zničením při experimentálním podávání cytostaticky působícího streptozotocinu. Na rozdíl od GLP-1 však jsou hladiny GIP u diabetiků 2. typu normální nebo zvýšené a jeho podávání nevede k poklesu glykemie a ke zlepšení kompenzace diabetu. Předpokládá se, že v případě GIP je u diabetu mellitu 2. typu (DM2) přítomna necitlivost na jeho účinky, pravděpodobně v důsledku snížení exprese jeho receptorů nebo na postreceptorové úrovni. Rozdíly mezi účinky GLP-1 a GIP jsou uvedeny v tab. 1.
Cirkulující GIP je degradován enzymem dipeptidyl-petidázou 4 (DPP-4), který se vyskytuje jak v solubilní formě, tak i vázaný na lymfocyty (zde je DPP-4 označována jako CD-26). Poločas cirkulujícího GIP je u lidí 5–7 minut.
Glukagonu podobný peptid 1 (GLP-1)
GLP-1 vzniká jako produkt posttranslačního štěpení proglukagonového genu účinkem enzymu – prohormonální konvertázy [1]. Kromě GLP-1 jsou dalšími produkty posttranslačních modifikací a štěpení pro-glukagonového genu vlastní glukagon a glukagonu podobný peptid 2 (GLP-2). GLP-1 byl pojmenován na základě podobnosti s glukagonem (jedná se o více než padesátiprocentní shodnost v sekvenci aminokyselin). GLP-2 nemá na rozdíl od GLP-1 vliv na inzulinovou sekreci ani na hladiny glukózy, a není proto považován za inkretin.
Nejvíce GLP-1 je produkováno v enteroendokrinních L-buňkách tenkého střeva (především distálního ilea) a v proximální části colon. V cirkulaci se GLP-1 vyskytuje v několika formách. Obě představují tzv. zkrácenou formu GLP-1, zatímco kompletní forma je biologicky neúčinná. Zkrácená forma vzniká ve střevních L-buňkách účinkem enzymu prohormonální konvertázy.
GLP-1 působí přes specifický receptor, tzv. GLP-1R. Tento receptor je exprimován v Langerhansových ostrůvcích pankreatu, v mozku, srdci, ledvinách a gastrointestinálním traktu včetně parietálních buněk žaludku. Vysoká exprese GLP-1R je však přítomna také v myokardiálních buňkách a v buňkách cévní stěny, což může vysvětlovat jeho předpokládáné kardioprotektivní a vaskuloprotektivní účinky.
Primárními fyziologickými stimuly produkce GLP-1 jsou jídla s vysokým obsahem sacharidů a tuků, případně i jednotlivé nutrienty typu glukózy a dalších cukrů, umělá sladidla, mastné kyseliny, aminokyseliny a vláknina obsažená v potravě. Stimulace potravou vede k bifázickému vzestupu hladin GLP-1 s časným vzestupem 5–15 minut po požití potravy a druhým vzestupem 30–60 minut po požití potravy. Kromě stimulace potravou se na aktivaci sekrece GLP-1 podílí také nervová regulace – stimulace zprostředkovaná vlákny nervus vagus. Sekreci GLP-1 mohou dále zvyšovat některé hormony (například leptin a inzulin), zatímco somatostatin produkci GLP-1 inhibuje. Hladiny GLP-1 nalačno jsou nízké (obvykle v rozmezí 5–10 pmol/l), požití potravy vede k jejich zvýšení na dvoj- až trojnásobek bazálních hladin.
Biologicky aktivní GLP-1 je podobně jako GIP v řádu 1–2 minut degradován DPP-4 na GLP-1 9-36, který již neovlivňuje inzulinovou sekreci. Studie prokázaly, že pravděpodobně pouze 10–15 % z celkového GLP-1 pronikne do systémové cirkulace. Zbytek je degradován již ve střevní mikrocirkulaci nebo v játrech.
V pankreatu vede GLP-1 po navázání na receptor GLP-1R ke zvýšení glukózo-dependentní inzulinové sekrece. Ke stimulaci sekrece inzulinu tedy nedochází, jsou-li hladiny glukózy normální nebo snížené.
GLP-1 vede dále v experimentu ke stimulaci syntézy a zvýšení zásob inzulinu v sekrečních granulích. Zvyšuje také stabilitu inzulinové mRNA, transkripci a expresi inzulinového genu. Dalším experimentálně prokázaným účinkem GLP-1 je stimulace proliferace β-buněk pankreatu a inhibice jejich apoptózy. Podávání GLP-1 vedlo také ke zvýšení proliferace β-buněk a zvýšení obsahu inzulinu v Langerhansových ostrůvcích pankreatu.
Neméně důležitým účinkem GLP-1 je snížení sekrece hyperglykemizujícího glukagonu, jehož hladiny jsou u diabetiků 2. typu zvýšeny. Tento děj probíhá prostřednictvím stimulace GLP-1 receptorů na α-buňkách Langerhansových ostrůvků pankreatu.
Kromě pankreatických účinků vede GLP-1 také ke zpomalení vyprazdňování žaludku, ke snížení sekrece pankreatických trávicích enzymů a snížení příjmu potravy. Tyto účinky jsou dány především přímou interakcí GLP-1 s vagovými zakončeními v tenkém střevě. V menší míře může jít i o přímé centrální působení GLP-1 v centrálním nervovém systému. Podíl přímého centrálního působení je však nejistý vzhledem ke krátkému poločasu GLP-1 v cirkulaci.
Léčba založená na ovlivnění GLP-1
Podrobná charakteristika léčiv založených na ovlivnění GLP-1 není předmětem této kapitoly, zde se zaměříme pouze na základní principy inkretinové terapie. Jak bylo zmíněno výše, poločas GLP-1 v cirkulaci je velmi krátký a endogenní GLP-1 je během 1–2 minut degradován účinkem ubikviterního enzymu DPP-4. Využití syntetického GLP-1 jako léčiva tedy není výhodné, protože by musel být podáván kontinuálně.
Terapeutické přístupy využívající inkretinové léčby jsou založeny na dvou principech. Prvním je farmakologická inhibice DPP-4 pomocí inhibitorů tohoto enzymu nazývaných souhrnně gliptiny [5]. Dosažené hladiny GLP-1 jsou při použití tohoto přístupu srovnatelné nebo mírně vyšší než za normálních okolností. V současné době je na trhu k dispozici celá řada gliptinů, které se liší chemickou strukturou a biologickým poločasem, jsou však v zásadě srovnatelné z hlediska antidiabetických účinků. V České republice je na trhu sitagliptin a vildagliptin, nově byl na trh uveden také saxagliptin. Ve vývoji je pak přinejmenším pět dalších látek z této skupiny. Gliptiny mají oproti stávajícím antidiabetikům dvě výhody: minimum nežádoucích účinků včetně faktu, že nezpůsobují hypoglykemii, a neutrální vliv na tělesnou hmotnost, kterou jinak většina antidiabetik zvyšuje. Koncentrace glykovaného hemoglobinu při podávání gliptinů klesá o 0,5–1 %, vlivy na krevní tlak a lipidy lze označit za neutrální až mírně pozitivní [5, 6].
Druhým, z hlediska ovlivnění kompenzace diabetu účinnějším přístupem je podání tzv. agonistů GLP-1, tedy látek, které se váží na receptor pro GLP-1 a zároveň jsou rezistentní na účinky DPP-4 [7, 8]. Existují dvě základní strukuturální skupiny těchto látek: látky založené na exendinu 4 (molekule původně objevené ve slinách ještěra korovce jedovatého s menší strukturální podobností s endogenním GLP-1), jejichž hlavním zástupcem je exenatid, a látky strukturou bližší endogennímu GLP-1, jejichž hlavním představitelem je liraglutid. Agonisté GLP-1 mají podobné účinky jako gliptiny, přičemž vliv na kompenzaci diabetu je výraznější (pokles koncentrace glykovaného hemoglobinu v rozmezí 0,8–1,5 %). Ani agonisté GLP-1 v monoterapii nezpůsobují hypoglykemii, musí se však aplikovat injekčně a mají poněkud více nežádoucích účinků (především gastrointestinálních) než gliptiny. Kromě účinků podobných gliptinům vedou agonisté GLP-1 navíc ke zpomalení vyprazdňování žaludku, snížení příjmu potravy a k poklesu tělesné hmotnosti. Konzistentně též snižují krevní tlak a mají pozitvní vliv na lipidové parametry a v některých studiích též snižují subklinickou zánětlivou reakci. Kromě exenatidu, léčiva první generace, které se aplikuje 2krát denně, je na českém trhu k dispozici liraglutid s aplikací 1krát denně. Ve vývoji je celá řada dalších látek z této skupiny, např. lixisenatid, albiglutid a také exenatid s aplikací jednou týdně.
Extrapankreatické účinky GLP-1
Účinky na nervový systém a příjem potravy
GLP-1 je nejen gastrointestinální hormon, ale také neurotransmiter syntetizovaný v centrálním nervovém systému [9]. Předpokládá se, že GLP-1 uvolňovaný do střevních kapilár působí lokálně na aferentní senzorická nervová zakončení z nodózních ganglií a vede tak k ovlivnění aktivity nervus vagus. Tento neuroendokrinní mechanismus může významnou měrou ovlivnit endokrinní sekreci pankreatu a gastrointestinální motilitu včetně vyprazdňování žaludku a ovlivnění příjmu potravy.
Centrální podání GLP-1 intracerebrálně vede ke snížení pocitu hladu a příjmu potravy. Na centrálním působení GLP-1 se může podílet jak jeho centrální produkce, tak i reflexní působení přes ovlivnění periferních nervů [10]. Existuje také možnost, že část periferně produkovaného GLP-1 proniká do centrálního nervového systému například přes subfornikální orgán nebo area postrema, kde je hematoencefalická bariéra prostupnější. Na druhé straně je otázkou, zda se za normálních okolností do CNS může dostat významnější množství periferně produkovaného GLP-1, který je velmi rychle degradován účinkem DPP-4 ve tkáních i v cirkulaci.
Zajímavým experimentálně prokázaným poznatkem je, že centrální podání GLP-1 vede také ke snížení příjmu tekutin a stimulaci renální exkrece tekutin a sodíku. Studie s infuzním podáním GLP-1 u diabetiků 2. typu prokázaly podobné účinky. Dlouhodobé podávání agonistů GLP-1 však příjem tekutin a jejich exkreci výrazněji neovlivňuje.
Behaviorální a neuroprotektivní účinky
GLP-1 receptor je exprimován v celé řadě oblastí centrálního nervového systému (CNS). Experimentální studie prokázaly, že transgenní myši se zvýšenou expresí GLP-1 receptoru v CNS se vyznačují změnami chování včetně zvýšení pohybové aktivity a aktivity při hledání potravy. Zlepšeny byly u těchto zvířat i výsledky některých funkčních motorických testů, což svědčí pro možnost, že centrální působení GLP-1 může hrát roli v regulaci lokomotorické aktivity.
Ještě zajímavější z hlediska možného terapeutického využití se jeví experimentálně prokázané poznatky, že GLP-1 má v CNS podobně jako v pankreatu proliferativní, neogenní a antiapoptotické účinky na neurony. Naopak myši s vyřazením GLP-1 receptoru se vyznačují poruchami učení a při experimentálním poškození mozku je u nich průběh a rozsah změn v CNS výraznější. Podávání agonistů GLP-1 má ve stejných modelech na poškození CNS protektivní účinky. Agonisté GLP-1 by podle těchto experimentálních výsledků mohli mít příznivý vliv u neurodegenerativních chorob typu vaskulární demence, Alzheimerovy nemoci, demence v důsledku prodělaných cévních mozkových příhod a u Parkinsonovy nemoci. Klinická data však zatím nejsou k dispozici.
Exprese GLP-1 receptorů byla prokázána také v neuronech periferních nervových ganglií, což otevírá možnost vlivu GLP-1 či jeho agonistů i na periferní nervový systém. V jedné experimentální studii bylo prokázáno, že podávání exendinu 4 (protein, jehož struktura byla základem pro syntézu agonisty GLP-1 exenatidu) vedlo u potkanů k částečnému zlepšení neuropatie vyvolané pyridoxinem. Všechny uvedené poznatky byly však zatím prokázány pouze v experimentu a otázka, zda budou přítomny i při podávání agonistů GLP-1 u lidí, tak zůstává otevřená.
Kardiovaskulární účinky
GLP-1 je exprimován v kardiomyocytech a studie s exogenním podáváním GLP-1 myším prokázaly pozitivně inotropní i chronotropní účinky [11]. V jiné studi na hlodavcích vedlo podávání GLP-1 ke zvýšení krevního tlaku a tepové frekvence. V experimentech u anestezovaných potkanů bylo prokázáno, že podávání GLP-1 zvyšuje krevní tlak i puls, a to při centrálním i periferním podání [12]. U potkanů bez anestezie nebyly tyto vlivy jednoznačně prokázány. Dlouhodobé podávání GLP-1 či jeho agonistů u diabetických experimentálních modelů spojených s hypertenzí vede naopak k poklesu krevního tlaku.
Přímý důkaz o působení GLP-1 v srdci přinesly studie na myších s knockoutem genu pro GLP-1 receptor, u kterých se postupně rozvíjí hypertrofie levé komory, zhoršení její kontraktility a diastolické funkce. Na modelech reperfuzního poškození myokardu bylo prokázáno, že podání GLP-1 vede ke zmenšení velikosti infarktového ložiska jak in vitro, tak in vivo. Ve studiích na psím modelu dilatační kardiomyopatie bylo prokázáno, že infuze GLP-1 vede ke zlepšení funkce levé komory, tepového objemu a snížení tzv. end-diastolického plnicího tlaku, rovněž dlouhodobé podávání GLP-1 v kontinuální infuzi u potkaního modelu DM2 a arteriální hypertenze vedlo k významnému prodloužení přežití a k ochraně před rozvojem dilatované kardiomyopatie [13].
K dispozici je i několik klinických studií zaměřených na vlivy GLP-1 na srdeční funkci u lidí. V první studii Sokose a spoluautorů bylo prokázáno, že pětiměsíční infuzní podávání GLP-1 vedlo k signifikantnímu zlepšení ejekční frakce a kardiovaskulární výkonnosti u pacientů se srdečním selháním [14]. V jiné randomizované studii provedené u pacientů podstupujících srdeční bypass vedlo podávání agonistů GLP-1 ke snížení množství podávaných inotropně působících léčiv [15]. Ve stejné studii byla také snížena celková dávka inzulinu u skupiny léčené infuzí GLP-1.
Otevřenou otázkou stále zůstává přesný mechanismus, jakým vede podávání GLP-1 ke zlepšení srdeční fukce. V úvahu připadá přímé působení prostřednictvím GLP-1 receptoru, případně nepřímé vlivy prostřednictvím zlepšení hladin glukózy a inzulinu. Studie na myších a potkaních srdcích provedené in vitro a in vivo svědčí spíše pro přímé působení prostřednictvím GLP-1 receptorů. Stále však není jasné, zda je toto zlepšení dáno zvýšením vychytávání glukózy v kardiomyocytech a stimulací glykolýzy, nebo jinými signálními kaskádami, které dosud nebyly plně zdokumentovány.
Kromě studií zaměřených na podávání exogenního GLP-1 se podobně efektivní zdá být i podávání agonistů GLP-1, které vede k podobným účinkům jako aplikace GLP-1. Podání exenatidu před experimentálním vyvoláním ischemie u prasečího modelu vedlo ke zmenšení velikosti infarktového ložiska a k prevenci zhoršení systolické a diastolické funkce [16]. Podání jiného agonisty GLP-1 liraglutidu tyto parametry v jedné studii neovlivnilo, v jiné však bylo rovněž spojeno s podobně pozitivními vlivy jako podávání exenatidu [17, 18]. Velké mortalitní studie, které by měly prokázat, nakolik jsou tyto vlivy agonistů GLP-1, případně i gliptinů, klinicky relevantní, právě probíhají. Otevřenou otázkou také zůstává, zda jsou pozitivní vlivy agonistů GLP-1 prokazatelné pouze u pacientů s diabetem, nebo zda je možné je očekávat i u pacientů se srdečními onemocněními bez diabetu. Vzhledem k poněkud jinému mechanismu účinku, který je však spojen se zvýšením produkce endogenního GLP-1, by mohly být některé výše popsané nemetabolické účinky přítomny i po podání gliptinů.
Perspektivy využití GLP-1 nejen v diabetologii
Dosavadní poznatky naznačují, že podávání léčiv založených na inkretinovém principu může velmi významně pomoci nejen při zlepšení dlouhodobé kompenzace diabetu, ale může také potenciálně vést ke snížení kardiovaskulárních komplikací a ochraně centrálního nervového systému před rozvojem neurodegenerativních onemocnění. Agonisté GLP-1 navíc významně snižují hmotnost, a není tedy vyloučeno, že tyto léky budou v dohledné budoucnosti podávány i jako antiobezitika pacientům s obezitou bez diabetu. Komplexní pozitivní účinky agonistů GLP-1 (snížení krevního tlaku, zlepšení lipidového profilu, snížení subklinického zánětu) otevírají také možnost jejich podávání ve stadiu prediabetu jako prevence rozvoje manifestního diabetu. Přes velmi nadějné dosavadní výsledky, které máme k dispozici, musíme i zde vyčkat na potvrzení výše uvedených předpokladů dostatečně rozsáhlými klinickými studiemi. Studie zaměřené na ovlivnění kardiovaskulárního rizika inkretinovou léčbou již probíhají. Studie se zaměřením na problematiku neurodegenerativních onemocnění se dosud nacházejí v méně pokročilých stadiích. V každém případě můžeme již dnes konstatovat, že farmakoterapie založená na inkretinovém principu velmi významně rozšiřuje naše možnosti léčby DM 2. typu a řady jeho přidružených komplikací.
Originální studie autora zaměřené na účinky agonistů GLP-1 byly podporovány MZOVFN2005.
Seznam použité literatury
- [1] Holst JJ, Gromada J. Role of incretin hormones in the regulation of insulin secretion in diabetic and nondiabetic humans. Am J Physiol Endocrinol Metab 2004; 287: E199–206.
- [2] Nauck MA. Glucagon-like peptide 1 (GLP-1) in the treatment of diabetes. Horm Metab Res 2004; 36: 852–858.
- [3] Haluzík M, Svačina Š. Inkretinová léčba diabetu. Praha: Mladá fronta, 2010.
- [4] Drucker DJ. The biology of incretin hormones. Cell Metab 2006; 3: 153–165.
- [5] Drucker DJ. Dipeptidyl peptidase-4 inhibition and the treatment of type 2 diabetes: preclinical biology and mechanisms of action. Diabetes Care 2007; 30: 1335–1343.
- [6] DeFronzo RA, Okerson T, Viswanathan P, et al. Effects of exenatide versus sitagliptin on postprandial glucose, insulin and glucagon secretion, gastric emptying, and caloric intake: a randomized, cross-over study. Curr Med Res Opin 2008; 24: 2943–2952.
- [7] Cervera A, Wajcberg E, Sriwijitkamol A, et al. Mechanism of action of exenatide to reduce postprandial hyperglycemia in type 2 diabetes. Am J Physiol Endocrinol Metab 2008; 294: E846–852.
- [8] Zinman B, Gerich J, Buse JB, et al. Efficacy and safety of the human glucagon-like peptide-1 analog liraglutide in combination with metformin and thiazolidinedione in patients with type 2 diabetes (LEAD-4 Met+TZD). Diabetes Care 2009; 32: 1224–1230.
- [9] Ahrén B. GLP-1 and extra-islet effects. Horm Metab Res 2004; 36: 842–845.
- [10] Williams DL. Minireview: finding the sweet spot: peripheral versus central glucagon-like peptide 1 action in feeding and glucose homeostasis. Endocrinology 2009; 150: 2997–3001.
- [11] Ban K, Noyan-Ashraf MH, Hoefer J, et al. Cardioprotective and vasodilatory actions of glucagon-like peptide 1 receptor are mediated through both glucagon-like peptide 1 receptor-dependent and -independent pathways. Circulation 2008; 117: 2340–2350.
- [12] Barragan JM, Rodriguez RE, Blazquez E. Changes in arterial blood pressure and heart rate induced by glucagon-like peptide-1-(7-36) amide in rats. Am J Physiol 1994; 266 (3 Pt 1): E459–466.
- [13] Nikolaidis LA, Elahi D, Hentosz T, et al. Recombinant glucagon-like peptide-1 increases myocardial glucose uptake and improves left ventricular performance in conscious dogs with pacing-induced dilated cardiomyopathy. Circulation 2004; 110: 955–961.
- [14] Sokos GG, Nikolaidis LA, Mankad S, et al. Glucagon-like peptide-1 infusion improves left ventricular ejection fraction and functional status in patients with chronic heart failure. J Card Fail 2006; 12: 694–699.
- [15] Sokos GG, Bolukoglu H, German J, et al. Effect of glucagon-like peptide-1 (GLP-1) on glycemic control and left ventricular function in patients undergoing coronary artery bypass grafting. Am J Cardiol 2007; 100: 824–829.
- [16] Timmers L, Henriques JP, de Kleijn DP, et al. Exenatide reduces infarct size and improves cardiac function in a porcine model of ischemia and reperfusion injury. J Am Coll Cardiol 2009; 53: 501–510.
- [17] Kristensen J, Mortensen UM, Schmidt M, et al. Lack of cardioprotection from subcutaneously and preischemic administered liraglutide in a closed chest porcine ischemia reperfusion model. BMC Cardiovasc Disord 2009; 9: 31.