Hyperfosfatemie
Souhrn:
Hyperfosfatemie je součástí klinického obrazu chronického onemocnění ledvin. Dnes je chápána jako součást minerálové a kostní poruchy při chronickém onemocnění ledvin (chronic kidney disease‑mineral and bone disorder, CKD‑MBD). Ta je spojena se závažnými kardiovaskulárními komplikacemi, především se vznikem kalcifikací cév a měkkých tkání, s rozvojem hypertrofie levé komory srdeční a s oxidačním stresem a mikrozánětem; rovněž zásadním způsobem zvyšuje morbiditu a mortalitu pacientů s onemocněním ledvin. Podle nových poznatků je manifestní hyperfosfatemie až pozdním projevem CKD‑MBD, k retenci fosfátů se všemi prognosticky negativními důsledky dochází již v časných stadiích této choroby. V léčbě hyperfosfatemie, jež je nedílnou součástí komplexní léčby chronického onemocnění ledvin, se vedle dietních opatření a adekvátní dialyzační dávky uplatňuje farmakoterapie vazači fosfátů. Jsou uvedeny patofyziologické principy včetně nových poznatků a shrnuty současné možnosti léčby poruch kalciofosfátového metabolismu.
Key words: CKD (chronic kidney disease) – chronic kidney disease‑mineral and bone disorder – hyperphosphatemia – phosphate binders – FGF‑23.
Summary:
Hyperphosphatemia is a part of chronic kidney disease clinical presentation. Nowadays, it is seen as a part of mineral and bone disorder accompanying chronic kidney disease (chronic kidney disease‑mineral and bone disorder, CKD‑MBD). It is associated with severe cardiovascular complications, especially with calcifications in vessels and soft tissues, left ventricular hypertrophy, oxidative stress, and microinflammation; it also hugely increases the morbidity and mortality of patients with kidney disease. According to the recent findings, manifest hyperphosphatemia represents a late feature of CKD‑MBD while the retention of phosphates with all – prognostically negative – consequences occurs since early stages of the disease. The treatment of hyperphosphatemia, forming an integral part of complex therapy of chronic kidney disease, includes not only dietary requirements and adequate hemodialysis but also pharmacotherapy with phosphate binders. We describe pathophysiological principles and relevant recent findings and we characterize the current therapeutic armamentarium available in cases of calcium‑phosphate metabolism disorders.
Úvod
Minerálová a kostní porucha při chronickém onemocnění ledvin (chronic kidney disease mineral and bone disorder, CKD MBD) je komplexní metabolické onemocnění, které je součástí klinického obrazu chronické renální insuficience [1]. Mezi projevy CKD MBD patří porucha kalciofosfátového metabolismu (typicky hypokalcemie, hyperfosfatemie), zvýšení koncentrace parathormonu, snížení koncentrace aktivního vitaminu D, porucha kostního obratu a kostní mineralizace a také tvorba kalcifikací cév a měkkých tkání. Prognosticky závažné cévní kalcifikace jsou způsobeny jednak depozicí vápníku a fosfátu v cévní stěně, jednak rozvojem endotelové dysfunkce a oxidačního stresu. Hyperfosfatemie dále koreluje se zvýšením nákladů na zdravotní péči, s nižší kvalitou života a s potřebou hospitalizace [1,2].
Patofyziologie hyperfosfatemie
U zdravých osob je koncentrace sérového fosfátu regulována souhrou gastrointestinální resorpce, kostního obratu a renální exkrece. Ještě v devadesátých letech minulého století byla hyperfosfatemie u nemocných s renální insuficiencí chápána jako součást sekundárního hyperparatyreoidismu, k jehož rozvoji dochází společně s postupným zánikem nefronů a s progresí renální insuficience [1,2]. Snížený počet nefronů vede k poklesu eliminace fosfátů, zároveň se snižuje tvorba aktivního vitaminu D, dochází k hypokalcemii a hyperfosfatemii. Kompenzačním mechanismem je zvýšení produkce parathormonu v příštítných tělískách a rozvoj kostní choroby (dříve „renální osteodystrofie“) a kalcifikací cév a měkkých tkání. V roce 2000 byl identifikován FGF 23 (fibroblastový růstový faktor 23, fibroblast growth factor), což je substance bílkovinné povahy, která hraje zásadní roli v patofyziologii kalciofosfátového metabolismu [3]. Fibroblastový růstový faktor 23 zvyšuje fosfaturii a potlačuje tvorbu kalcitriolu, čímž normalizuje koncentraci fosfátů až do pozdních stadií renální insuficience, zároveň však vede dosud ne zcela jasným mechanismem k paralelním komplikacím – byla prokázána korelace mezi zvýšenými sérovými koncentracemi FGF 23 a prozánětlivým stavem, postižením cév kalcifikacemi, rozvojem endotelové dysfunkce, albuminurií a progresí renální insuficience, zvýšením kardiovaskulární morbidity a mortality. Koncentrace FGF 23 se zvyšuje již v počátečních stadiích renální insuficience (G2), progreduje s úbytkem renální funkce a normalizuje se několik měsíců po transplantaci ledviny. Přestože se na základě znalosti této skutečnosti antagonizace FGF 23 nabízí jako potenciálně perspektivní léčebný přístup, v praxi se tento postup zatím neuplatnil ‒ ačkoliv experimentální protilátková suprese FGF 23 na zvířecím modelu příznivě ovlivnila sekundární hyperparatyreoidismus, vedla též k progresi cévních kalcifikací a zvýšila riziko úmrtí, pravděpodobně v důsledku snížení exkrece fosfátů močí a z toho vyplývající nekontrolované hyperfosfatemie [4,5]. Potenciálně perspektivním přístupem je cílené ovlivnění receptoru pro FGF 23 v myokardu.
Současný pohled na patofyziologii
CKD -MBD ukazuje obrázek 1.![OBR. 1 Současný pohled na patofyziologii CKD ‑MBD; podle [4,5] – Gonzalez‑Parra, et al., 2011; Gutiérrez, 2010. CKD ‑MBD –minerálová a kostní porucha při chronickém onemocnění ledvin, chronic kidney disease‑mineral and bone disorder; FGF‑23 – fibroblastový růstový faktor 23, fibroblast growth factor; PTH – parathormon](https://www.remedia.cz/photo-a-31193---.jpg)
Léčba hyperfosfatemie
Dietní opatření
Nezbytnou součástí léčby hyperfosfatemie je omezení příjmu fosfátů. Při preskripci nízkofosfátové diety je však nutné zohlednit možné riziko malnutrice, jež je u pacientů s CKD rovněž spojena s horší prognózou. V dietě je vedle obsahu fosfátů nutné vzít v úvahu i jejich biologickou dostupnost. Lépe se absorbuje fosfát z potravin živočišného původu, naopak z potravin rostlinného původu hůře. Přínosem vegetariánské stravy s omezením bílkovin je příznivý vliv na acidobazickou rovnováhu a zpomalení progrese renální insuficience, dieta středomořského typu zřejmě též vede ke zpomalení aterosklerózy. Relativně novým poznatkem je, že velmi rychle a téměř úplně se absorbují anorganické fosfáty z polotovarů s potravinovými aditivy (např. instantní kávové směsi, tavené sýry, uzeniny, masové polotovary, kolové nápoje s obsahem kyseliny fosforečné), proto se nově doporučuje je z diety zcela vyloučit [6,7].
Farmakoterapie
Vazače fosfátů při správném užití (tj. s jídlem) působí pokles sérových koncentrací fosfátu, což je výsledkem sníženého vstřebávání z potravy. Ideální vazač fosfátů by měl být dobře tolerován a neměl by vyvolávat gastrointestinální nežádoucí účinky, z hlediska compliance je pak výhodnější, pokud lze účinné dávky dosáhnout při podávání co nejnižšího počtu tablet. Pacienti léčení dialýzou užívají v průměru 19 tablet denně, z čehož přibližně polovina připadá na vazače fosfátů. Zároveň celosvětově až 50 % dialyzovaných pacientů nedosahuje cílových hodnot fosfatemie [8,9], což je pravděpodobně způsobeno mj. vysokým počtem tablet a dále pak případnými nežádoucími účinky této léčby.
V současnosti jsou k dispozici
vazače fosfátů (tab. 1) aluminiové (aluminium hydroxid
gel, tč. v České republice nedostupný), kalciové (uhličitan
vápenatý ‒ kalciumkarbonát, octan vápenatý –
kalciumacetát) a nekalciové (lanthankarbonát,
sevelamerhydrochlorid/sevelamerkarbonát a hydroxid oxid
železitý se sacharózou a škrobem). Aktuálně mají v léčbě
pacientů s CKD největší význam nekalciové vazače fosfátů,
postavení zlatého standardu má sevelamer [4,8,9].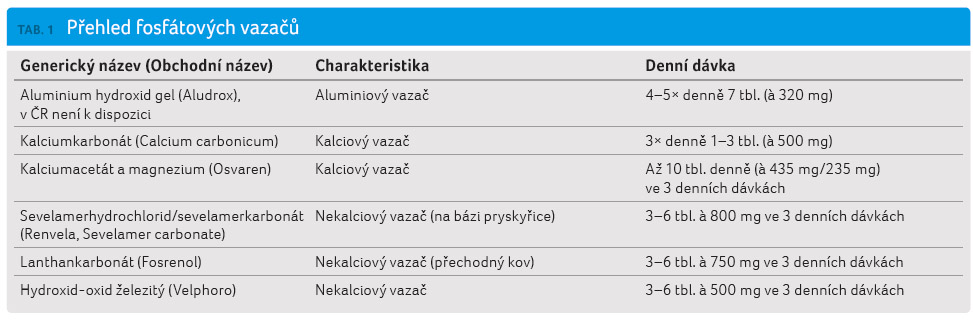
Aluminium hydroxid gel váže velmi efektivně fosfát, ale jeho podávání je spojeno s rizikem závažných neurotoxických účinků, a proto se již užívá jen raritně – indikován může být pouze krátkodobě při extrémně vysokých koncentracích fosfátu, a to za frekventních kontrol aluminemie. V České republice však již není k dispozici.
Podávání kalciových vazačů fosfátů vede k účinnému snížení koncentrace fosfátu, je však spojeno s rizikem pozitivní kalciové bilance (především u kalciumkarbonátu). Míra expozice vápníku závisí na parametrech metabolismu vitaminu D a nelze ji snadno odhadnout z kalcemie. Nověji je k dispozici vazač fosfátů s kalciumacetátem a magneziem, který obsahuje nižší množství vstřebatelného vápníku, a magnezium, které vykazuje inhibiční vliv na cévní kalcifikace. Nespornou výhodou léčby kalciovými vazači fosfátů je jejich ekonomická nenáročnost. Nevýhodou kalciumkarbonátu a v menší míře i kalciumacetátu je obstipační účinek [10].
Z nekalciových vazačů fosfátů je v současnosti užíván především sevelamerhydrochlorid nebo sevelamerkarbonát, což je substance na bázi iontoměničových pryskyřic. Účinnost sevelameru je podobná jako u kalciových vazačů, byla potvrzena více studiemi. Ke kalcifikacím docházelo méně často než v případě léčby kalciovými vazači. Je třeba zmínit tzv. pleiotropní účinky sevelameru (snížení koncentrace FGF 23, zvýšení koncentrace fetuinu A – substance s inhibičním účinkem na cévní kalcifikace – a snížení koncentrace LDL cholesterolu) a také jeho bezpečnost, která je dána skutečností, že se sevelamer nevstřebává. Mezi nežádoucí účinky sevelameru patří gastrointestinální obtíže (často obstipace, nauzea, abdominalgie – především u sevelamerhydrochloridu), určitou nevýhodu představuje vysoký počet tablet. Léčba sevelamerem je ekonomicky náročná, nověji jsou však k dispozici vedle originálního přípravku i cenově výhodnější generika [11‒13].
Lanthankarbonát je novější nekalciový vazač fosfátů, který vykazuje podobnou účinnost jako kalciové vazače a jako sevelamer. Jeho výhodou je vysoká účinnost v léčbě fosfatemie při nižším množství tablet než u sevelameru, protože se však deponuje ve skeletu, existují obavy z potenciálních nežádoucích účinků této akumulace, jež však nejsou zatím opodstatněné. Mezi další nežádoucí účinky patří nauzea, zvracení a změny rytmu nebo charakteru stolice. Někteří autoři jej z důvodu akumulace lanthanu ve skeletu nepodávají pacientům, u nichž se předpokládá zařazení do transplantačního programu a zlepšení prognózy quoad vitam. Podobně jako sevelamer vykazuje lanthan pleiotropní účinky, snižuje koncentrace FGF 23 a byl u něj popsán příznivý vliv na histologii kostí u dialyzovaných pacientů. Ekonomická náročnost terapie lanthankarbonátem je o něco nižší než při podávání sevelameru [4,14].
Nejnovějším přírůstkem do skupiny nekalciových vazačů fosfátů je hydroxid oxid železitý (PA 21). Jeho výhodou je absence systémových nežádoucích účinků, vysoká účinnost srovnatelná se sevelamerem a nízký počet tablet potřebný k dosažení adekvátního účinku. Nežádoucí účinky jsou obvykle mírné (nauzea, změny rytmu a charakteru stolice, černé zbarvení stolice). Zkušenosti s hydroxidem oxidem železitým jsou však zatím krátkodobé. Náklady na léčbu hydroxidem oxidem železitým a sevelamerem jsou srovnatelné [15,16].
Závěr
Hyperfosfatemie představuje zásadní rizikový faktor pro kardiovaskulární morbiditu a mortalitu. Léčba hyperfosfatemie zahrnuje omezení fosfátů v dietě (především anorganických fosfátů z potravinářských aditiv v polotovarech), farmakoterapii vazači fosfátů a u dialyzovaných pacientů též intenzifikaci dialyzační léčby. Z vazačů fosfátů jsou nejperspektivnější nekalciové vazače, jež jsou podobně účinné jako kalciové, ale jejich podávání není spojeno s rizikem pozitivní kalciové bilance. Při výběru fosfátového vazače hraje roli tolerance, adherence pacienta k terapii, celková prognóza nemocného, ale i ekonomické aspekty (např. preskripční omezení, podmínky pro úhradu ze zdravotního pojištění). Přestože se zdá, že včasná léčba vazači fosfátů může snížit koncentrace FGF 23, a vést tak ke zlepšení prognózy, není zatím k dispozici dostatek důkazů, jež by tento postup v současnosti opodstatnily. Při preskripci vazačů fosfátů tedy dosud hraje zásadní roli koncentrace fosfátů v séru, přestože jde až o pozdní projev přetížení fosfáty. Ve vývoji je více nových vazačů fosfátů, jejichž účinnost bude třeba prokázat kontrolovanými studiemi.
Seznam použité literatury
- [1] Tentori F, Blayney MJ, Albert JM, et al. Mortality risk for dialysis patients with different levels of serum calcium, phosphorus, and PTH: the Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis 2008; 52: 519−530.
- [2] Giachelli CM. The emerging role of phosphate in vascular calcification. Kidney Int 2009; 75: 890–897.
- [3] Sigrist MK, Taal MW, Bungay P, McIntyre CW. Progressive vascular calcification over 2 years is associated with arterial stiffening and increased mortality in patients with stages 4 and 5 chronic kidney disease. CJASN 2007; 2: 1241–1248.
- [4] Gonzalez Parra E, Gonzalez Casaus ML, Galan A, et al. Lanthanum carbonate reduces FGF23 in chronic kidney disease Stage 3 patients. Nephrol Dial Transplant 2011; 26: 2567–2571.
- [5] Gutiérrez OM. Fibroblast growth factor 23 and disordered vitamin D metabolism in chronic kidney disease: updating the „trade off“ hypothesis. Clin J Am Soc Nephrol 2010; 5: 1710–1716. doi: 10.2215/CJN.02640310. Epub 2010 May 27.
- [6] Noori N, Kalantar Zadeh K, Kovesdy CP, et al. Association of dietary phosphorus intake and phosphorus to protein ratio with mortality in hemodialysis patients. CJASN 2010; 5: 683–692.
- [7] Lynch KE, Lynch R, Curhan GC, Brunelli SM. Prescribed dietary phosphate restriction and survival among hemodialysis patients. CJASN 2011; 6: 620–629.
- [8] US DOPPS Practice Monitor, October 2013; http://www.dopps.org/DPM/
- [9] Tonelli M, Neesh P, Braden M. Oral phosphate binders in patients with kidney failure. NEJM 2010; 362: 1312–1324.
- [10] Qunibi WY, Hootkins RE, McDowell LL, et al. Treatment of hyperphosphatemia in hemodialysis patients: The Calcium Acetate Renagel Evaluation (CARE Study). Kidney Int 2004; 65: 1914–1926.
- [11] Wrong O, Harland C. Sevelamer. Nephrol Dial Transplant 2008; 23: 2108.
- [12] Delmez J, Block G, Robertson J, et al. A randomized, double blind, crossover design study of sevelamer hydrochloride and sevelamer carbonate in patients on hemodialysis. Clin Nephrol 2007; 68: 386–391.
- [13] Rastogi A. Sevelamer revisited: pleiotropic effects on endothelial and cardiovascular risk factors in chronic kidney disease and end stage renal disease. Ther Adv Cardiovasc Dis 2013; 7: 322−342.
- [14] D’Haese PC, Spasovski GB, Sikole A, et al. A multicenter study on the effects of lanthanum carbonate (Fosrenol) and calcium carbonate on renal bone disease in dialysis patients. Kidney Int Suppl 2003; 85: S73–S78.
- [15] Umanath K, Sika M, Niecestro R, et al. Rationale and study design of a three period, 58 week trial of ferric citrate as a phosphate binder in patients with ESRD on dialysis. Hemodial Int 2013; 17: 67–74.
- [16] Floege J, et al. Efficacy and safety of an iron based phosphate binder, PA21, in hyperphosphatemic CKD patients on dialysis; Poster SA PO1103, ASN congress 2012, San Diego.