Imunogenicita biologických léčiv a monitorování farmakokinetiky v klinické praxi
Souhrn:
Biologická léčba přípravky anti‑TNFα je velmi účinnou terapií idiopatických střevních zánětů. Klinickým problémem je častá ztráta primárně dobré odpovědi na tuto léčbu. Jednou z příčin ztráty účinnosti je nízká koncentrace léčiva v séru, na níž se může podílet tvorba protilátek proti léku. Intenzifikace léčby (navýšení dávky nebo zkrácení intervalu mezi aplikacemi) může u části pacientů obnovit původní účinnost, část pacientů má naopak prospěch ze změny přípravku anti‑TNFα a u jiných nemocných je nutno dosavadní léčbu ukončit a zahájit terapii s jiným mechanismem účinku. Monitorování koncentrací a lékových protilátek se zdá být u části pacientů přínosné při optimalizaci léčby v případě ztráty odpovědi na terapii anti‑TNFα.
Key words: anti‑TNFα – antibodies – concentration – pharmacokinetics – biologic therapy.
Summary:
Biologic therapy with anti‑TNFα agents represents a very effective treatment modality in inflammatory bowel diseases. Secondary loss of response to anti‑TNFα treatment is an important problem in clinical practice, possibly caused by low levels of the drug in serum. Development of anti‑drug antibodies may be responsible for low drug levels in some patients. Dose intensification (dose increase and/or shortening of application interval) may restore the primary efficacy in some patients while the others benefit from switch to another anti‑TNFα agent. In some patients, anti‑TNFα therapy has to be stopped and the treatment with other mechanism of action is required. Pharmacokinetic monitoring seems to be beneficial in optimisation of anti‑TNFα treatment in some patients with loss of response to biologic therapy.
Úvod
Idiopatické střevní záněty (inflammatory bowel disease, IBD) – Crohnova nemoc (CN) a ulcerózní kolitida (UC) – jsou chronická zánětlivá onemocnění gastrointestinálního traktu ne zcela jasné etiopatogeneze [1]. V současné době neexistuje kauzální léčba a onemocnění je medikamentózně nevyléčitelné. Cílem současné terapie je navození a udržení klidového stadia nemoci a prevence recidivy zánětu. Zavedení biologické léčby přípravky ze skupiny anti tumor nekrotizujícího faktoru alfa (anti tumor necrosis factor alpha, anti TNFα) koncem devadesátých let minulého století do klinické praxe představovalo velký zlom v léčbě IBD. Biologická léčba je velmi účinná, s rychlým nástupem účinku a má ve srovnání se systémovými kortikosteroidy výrazně lepší bezpečnostní profil. Na druhé straně se po zavedení biologické léčby začaly objevovat nové, pravděpodobně imunopatologicky podmíněné nežádoucí účinky (lupusový syndrom, psoriáza, vaskulitida), které se jen zcela ojediněle vyskytovaly u konzervativní terapie [2].
Primární účinnost terapie anti TNFα se v klinické praxi pohybuje kolem 71–89 % u pacientů s CN a 63–85 % u pacientů s UC [3–13]. Nicméně 10–30 % nemocných na léčbu neodpoví a jsou označováni jako tzv. primární non respondeři. Z klinického hlediska je však závažnějším problémem sekundární ztráta původně dobré primární odpovědi, která se popisuje u 11–50 % pacientů, v závislosti na typu studie a na délce sledování [11,14–16].
V současné době jsou v České republice k dispozici tři přípravky anti TNFα: infliximab, adalimumab a golimumab.
Imunogenicita přípravků anti TNFα
Jednou z příčin primárního nebo sekundárního selhání biologické léčby je nedostatečná koncentrace přípravku anti TNFα v krvi, která může být zapříčiněna: a) vysokou aktivitou zánětu, jenž vede k vysoké koncentraci TNFα a k následnému nadměrnému vychytávání protilátek anti TNFα, b) nepříznivým katabolickým stavem pacienta spojeným s degradací bílkovin nebo c) vysokými ztrátami proteinů včetně anti TNFα do lumen střeva při těžkém zánětu [17–20]. Dalším významným mechanismem, který snižuje dostupnost léčiva v krvi, je tvorba protilátek proti léku (anti drug antibodies, ADA). Tyto protilátky mohou mít buď přímý neutralizační účinek a blokovat specifické vazebné místo pro molekulu TNFα, nebo mohou mít nepřímý účinek prostřednictvím vazby na jiné než specifické vazebné místo, čímž dochází ke zvýšenému odbourávaní léčiva z krve. Výskyt protilátek proti infliximabu a adalimumabu se v závislosti na typu použité laboratorní metody a na délce sledování popisuje u 20–46 %, resp. 9–17 % léčených pacientů [9,21–26]. U 90 % nemocných, kteří vyvinou protilátky proti infliximabu, jsou tyto přítomny již v prvním roce léčby [22].
Koncentrace přípravků anti TNFα se v klinické praxi stanovují jako tzv. trough levels (TL), tedy těsně před aplikací další dávky léčiva, a to obvykle v udržovací fázi léčby. V současnosti neexistuje jednoznačně stanovené terapeutické rozmezí koncentrací přípravků anti TNFα a v jednotlivých studiích se v závislosti na použité detekční metodě a na terapeutickém cíli pohybovala dolní hranice koncentrace léku v rozmezí 0,5–5,5 µg/ml pro infliximab a v rozmezí 2,8–5,9 µg/ml pro adalimumab [21,27–34]. K detekci koncentrací a protilátek byly ve většině studií použity komerční nebo tzv. home made metody ELISA (enzyme linked imunnosorbent assay), popř. metody radioimunoanalýzy [21,27–34].
Využití monitorování farmakokinetiky anti TNFα v klinické praxi
Do současné doby bylo publikováno množství převážně retrospektivních studií, které se zabývaly vztahem mezi farmakokinetickými ukazateli léčby anti TNFα (koncentrace a ADA) a její účinností [21,22,28,30,31,33,34]. Většina studií poměrně konzistentně prokázala pozitivní vztah mezi „terapeutickou“ koncentrací léku a krátkodobou nebo dlouhodobou klinickou, biologickou (C reaktivní protein [CRP]) či endoskopickou odpovědí na biologickou léčbu. Naopak výskyt protilátek proti přípravkům anti TNFα byl spojen s vyšším rizikem ztráty odpovědi na léčbu [28,35].
V klinické praxi se farmakokinetické monitorování zdá být využitelné pro optimalizaci terapie u pacientů s neadekvátní odpovědí na léčbu nebo se ztrátou původně dobré odpovědi [27,36–38]. První studie, která zkoumala vztah mezi koncentrací anti TNFα, výskytem ADA a odpovědí na intenzifikaci biologické léčby, byla americká retrospektivní analýza pacientů s IBD, u nichž selhávala terapie infliximabem [36]. Výsledkem studie bylo, že intenzifikace léčby infliximabem byla nejúčinnější u pacientů s nízkou koncentrací léku a s negativitou ADA. Naopak pacienti s nízkou koncentrací léku a s přítomností ADA měli největší prospěch ze změny přípravku anti TNFα [36]. Následně byly publikovány další studie, které se zabývaly využitím farmakokinetické monitorace infliximabu i adalimumabu k intenzifikaci/optimalizaci léčby u pacientů se ztrátou odpovědi [27,37,38]. Výsledky většiny prací byly víceméně shodné s výše citovanou studií a na základě toho byl navržen algoritmus managementu pacientů se ztrátou odpovědi na anti TNFα s pomocí farmakokinetického monitorování (tab. 1). Je však třeba zmínit, že část pacientů (asi 10–30 %) má dobrou odpověď na intenzifikaci léčby stávajícím přípravkem i přes přítomnost ADA nebo přes dostatečnou koncentraci anti TNFα, či naopak nereaguje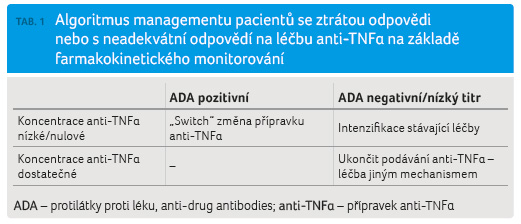 na strategii úpravy terapie, která je z farmakokinetického hlediska optimální [36,37]. Navíc, podle retrospektivní francouzské studie, jež hodnotila účinek intenzifikace léčby infliximabem na základě koncentrací anti TNFα a ADA, byla odpověď na intenzifikaci nezávislá na koncentraci léku nebo na přítomnosti ADA [39].
na strategii úpravy terapie, která je z farmakokinetického hlediska optimální [36,37]. Navíc, podle retrospektivní francouzské studie, jež hodnotila účinek intenzifikace léčby infliximabem na základě koncentrací anti TNFα a ADA, byla odpověď na intenzifikaci nezávislá na koncentraci léku nebo na přítomnosti ADA [39].
Otázkou zůstává pravidelné, tzv. proaktivní monitorování koncentrací anti TNFα u pacientů, kteří jsou v remisi nemoci. Cílem tohoto monitorování je úprava dávky léku podle farmakokinetických parametrů k dosažení optimálních koncentrací anti TNFα v séru. Tento přístup vychází právě z výsledků publikovaných studií, jež prokazují pozitivní vztah mezi koncentrací anti TNFα a odpovědí na biologickou léčbu.
Význam proaktivního monitorování zkoumala belgická randomizovaná studie (TAXIT), která srovnávala dva režimy léčby infliximabem u pacientů s CN v klinicky stabilizovaném stavu, jimž byla podávána udržovací léčba [31]. V první skupině byl infliximab dávkován podle klinického stavu pacienta, ve druhé skupině se dávka infliximabu upravovala na základě koncentrací tak, aby bylo dosaženo cílové hodnoty infliximabu v rozmezí 3–7 µg/ml. V jednom roce léčby však nebyl pozorován statisticky signifikantní rozdíl v dosažení klinické a biologické remise (CRP ≤ 5 mg/l) mezi skupinou s využitím farmakokinetického monitorování a bez něj (CN 62,6 % vs. 54,9 %, p = 0,35; UC 83,8 % vs. 87,8 %, p = 0,75). Nicméně, pacienti ve skupině bez farmakokinetického monitorování měli v průběhu roku 2,5násobně vyšší riziko relapsu oproti skupině nemocných, u nichž se dávka upravovala na základě pravidelného měření koncentrací infliximabu (RR [relative risk] 2,5, 95% CI [confidence interval] 1,2–5,1; p = 0,02) [31].
Druhou studií zabývající se využitím „proaktivního“ monitorování léčby byla prospektivní randomizovaná, kontrolovaná, dvojitě zaslepená multicentrická studie (TAILORIX), která zahrnula pacienty s CN po indukční léčbě infliximabem [40]. Nemocní byli randomizováni do tří skupin: ve dvou skupinách se intenzifikace dávky prováděla na základě klinického stavu, biologických ukazatelů a koncentrací infliximabu, ve třetí skupině se intenzifikace řídila pouze klinickým stavem pacienta. Na konci 54týdenního sledování nebyl pozorován statisticky signifikantní rozdíl v dosažení klinické remise bez kortikosteroidů, endoskopické remise nebo v potřebě intenzifikace léčby mezi jednotlivými skupinami [40].
Závěr
Biologická léčba protilátkami anti TNFα je účinnou terapií IBD s vysokou primární účinností, avšak s klinicky významným rizikem ztráty původně dobré odpovědi. Farmakokinetické monitorování se zdá být přínosné pro optimalizaci léčby u pacientů s neadekvátní odpovědí nebo se ztrátou odpovědi na terapii anti TNFα. Je však třeba zdůraznit, že na rozdíl od malých molekul není u biologických přípravků vztah mezi jejich dávkou, koncentrací a účinkem lineární, a proto je farmakokinetika biologických léčiv víceméně nepředvídatelná. To spolu s faktem, že není známé optimální terapeutické rozmezí koncentrací léků, může přispívat k diskrepancím ve výsledcích jednotlivých studií. Z toho důvodu je i využití farmakokinetické monitorace v klinické praxi do určité míry omezené a čtvrtina až třetina pacientů má dlouhodobě dobrou odpověď na biologickou léčbu nebo pozitivně reaguje na intenzifikaci dávkování stávajícího přípravku i přes nepříznivý farmakokinetický profil (nízké koncentrace, pozitivita ADA). Přínos proaktivního farmakokinetického monitorování je zatím nejednoznačný a je potřeba provést další studie k ověření účinnosti tohoto postupu.
Seznam použité literatury
- [2] Bortlík M, Ďuricová D, Kohout P, et al. Doporučení pro podávání biologické terapie u idiopatických střevních zánětů: třetí, aktualizované vydání. Gastroenterologie a Hepatologie 2016; 70: 11–27.
- [3] Sands BE, Anderson FH, Bernstein CN, et al. Infliximab maintenance therapy for fistulizing Crohn’s disease. N Engl J Med 2004; 350: 876–885.
- [4] Sandborn WJ, Rutgeerts P, Enns R, et al. Adalimumab induction therapy for Crohn disease previously treated with infliximab: a randomized trial. Ann Intern Med 2007; 146: 829–838.
- [5] Rutgeerts P, Sandborn WJ, Feagan BG, et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005; 353: 2462–2476.
- [6] Reinisch W, Sandborn WJ, Hommes DW, et al. Adalimumab for induction of clinical remission in moderately to severely active ulcerative colitis: results of a randomised controlled trial. Gut 2011; 60: 780–787.
- [7] Colombel JF, Sandborn WJ, Rutgeerts P, et al. Adalimumab for maintenance of clinical response and remission in patients with Crohn’s disease: the CHARM trial. Gastroenterology 2007; 132: 52–65.
- [8] Hanauer SB, Feagan BG, Lichtenstein GR, et al. Maintenance infliximab for Crohn’s disease: the ACCENT I randomised trial. Lancet 2002; 359: 1541–1549.
- [9] Karmiris K, Paintaud G, Noman M, et al. Influence of trough serum levels and immunogenicity on long‑term outcome of adalimumab therapy in Crohn’s disease. Gastroenterology 2009; 137: 1628–1640.
- [10] Ferrante M, Vermeire S, Fidder H, et al. Long‑term outcome after infliximab for refractory ulcerative colitis. J Crohns Colitis 2008; 2: 219–225.
- [11] Oussalah A, Evesque L, Laharie D, et al. A multicenter experience with infliximab for ulcerative colitis: outcomes and predictors of response, optimization, colectomy, and hospitalization. Am J Gastroenterol 2010; 105: 2617–2625.
- [12] Bálint A, Farkas K, Palatka K, et al. Efficacy and safety of adalimumab in ulcerative colitis refractory to conventional therapy in routine clinical practice. J Crohns Colitis 2016; 10: 26–30.
- [13] Christensen KR, Steenholdt C, Brynskov J. Clinical outcome of adalimumab therapy in patients with ulcerative colitis previously treated with infliximab: a Danish single‑center cohort study. Scand J Gastroenterol 2015; 50: 1018–1024.
- [14] Gisbert JP, Panés J. Loss of response and requirement of infliximab dose intensification in Crohn’s disease: a review. Am J Gastroenterol 2009; 104: 760–767.
- [15] Caspersen S, Elkjaer M, Riis L, et al. Infliximab for inflammatory bowel disease in Denmark 1999–2005: clinical outcome and follow‑up evaluation of malignancy and mortality. Clin Gastroenterol Hepatol 2008; 6: 1212–1217; quiz 176.
- [16] Schnitzler F, Fidder H, Ferrante M, et al. Long‑term outcome of treatment with infliximab in 614 patients with Crohn’s disease: results from a single‑centre cohort. Gut 2009; 58: 492–500.
- [17] Bendtzen K, Geborek P, Svenson M, Individualized monitoring of drug bioavailability and immunogenicity in rheumatoid arthritis patients treated with the tumor necrosis factor alpha inhibitor infliximab. Arthritis Rheum 2006; 54: 3782–3789.
- [18] Fasanmade AA, Adedokun OJ, Ford J, et al. Population pharmacokinetic analysis of infliximab in patients with ulcerative colitis. Eur J Clin Pharmacol 2009; 65: 1211–1228.
- [19] Brandse JF, Mathôt RA, van der Kleij D, et al. Pharmacokinetic features and presence of antidrug antibodies associate with response to infliximab induction therapy in patients with moderate to severe ulcerative colitis. Clin Gastroenterol Hepatol 2016; 14: 251–258.e1–2.
- [20] Yarur AJ, Jain A, Sussman DA, et al. The association of tissue anti‑TNF drug levels with serological and endoscopic disease activity in inflammatory bowel disease: the ATLAS study. Gut 2016; 65: 249–255.
- [21] Adedokun OJ, Sandborn WJ, Feagan BG, et al. Association between serum concentration of infliximab and efficacy in adult patients with ulcerative colitis. Gastroenterology 2014; 147: 1296–1307.e5.
- [22] Ungar B, Levy I, Yavne Y, et al. Optimizing anti‑TNFα therapy: serum levels of infliximab and adalimumab associate with mucosal healing in patients with inflammatory bowel diseases. Clin Gastroenterol Hepatol 2015; 14: 550–557.e2.
- [23] West RL, Zelinkova Z, Wolbink GJ, et al. Immunogenicity negatively influences the outcome of adalimumab treatment in Crohn’s disease. Aliment Pharmacol Ther 2008; 28: 1122–1126.
- [24] Seow CH, Newman A, Irwin SP, et al. Trough serum infliximab: a predictive factor of clinical outcome for infliximab treatment in acute ulcerative colitis. Gut 2010; 59: 49–54.
- [25] Maser EA, Villela R, Silverberg MS, Greenberg GR. Association of trough serum infliximab to clinical outcome after scheduled maintenance treatment for Crohn’s disease. Clin Gastroenterol Hepatol 2006; 4: 1248–1254.
- [26] Sandborn WJ, Hanauer SB, Rutgeerts P, et al. Adalimumab for maintenance treatment of Crohn’s disease: results of the CLASSIC II trial. Gut 2007; 56: 1232–1239.
- [27] Steenholdt C, Brynskov J, Thomsen O, et al. Individualised therapy is more cost‑effective than dose intensification in patients with Crohn’s disease who lose response to anti‑TNF treatment: a randomised, controlled trial. Gut 2014; 63: 919–927.
- [28] Paul S, Moreau AC, Del Tedesco E, et al. Pharmacokinetics of adalimumab in inflammatory bowel diseases: a systematic review and meta‑analysis. Inflamm Bowel Dis 2014; 20: 1288–1295.
- [29] Roblin X, Marotte H, Rinaudo M, et al. Association between pharmacokinetics of adalimumab and mucosal healing in patients with inflammatory bowel diseases. Clin Gastroenterol Hepatol 2014; 12: 80–84.e2.
- [30] Cornillie F, Hanauer SB, Diamond RH, et al. Postinduction serum infliximab trough level and decrease of C‑reactive protein level are associated with durable sustained response to infliximab: a retrospective analysis of the ACCENT I trial. Gut 2014; 63: 1721–1727.
- [31] Vande Casteele N, Ferrante M, Van Assche G, et al. Trough concentrations of infliximab guide dosing for patients with inflammatory bowel disease. Gastroenterology 2015; 148: 1320–1329.e3.
- [32] Vaughn BP, Martinez‑Vazquez M, Patwardhan VR, et al. Proactive therapeutic concentration monitoring of infliximab may improve outcomes for patients with inflammatory bowel disease: results from a pilot observational study. Inflamm Bowel Dis 2014; 20: 1996–2003.
- [33] Mazor Y, Almog R, Kopylov U, et al. Adalimumab drug and antibody levels as predictors of clinical and laboratory response in patients with Crohn’s disease. Aliment Pharmacol Ther 2014; 40: 620–628.
- [34] Bortlik M, Duricova D, Malickova K, et al. Infliximab trough levels may predict sustained response to infliximab in patients with Crohn’s disease. J Crohns Colitis 2013; 7: 736–743.
- [35] Vande Casteele N, Khanna R, Levesque BG, et al. The relationship between infliximab concentrations, antibodies to infliximab and disease activity in Crohn’s disease. Gut 2015; 64: 1539–1545.
- [36] Afif W, Loftus EV, Faubion WA, et al. Clinical utility of measuring infliximab and human anti‑chimeric antibody concentrations in patients with inflammatory bowel disease. Am J Gastroenterol 2010; 105: 1133–1139.
- [37] Roblin X, Rinaudo M, Del Tedesco E, et al. Development of an algorithm incorporating pharmacokinetics of adalimumab in inflammatory bowel diseases. Am J Gastroenterol 2014; 109:1250–1256.
- [38] Yanai H, Lichtenstein L, Assa A, et al. Levels of drug and antidrug antibodies are associated with outcome of interventions after loss of response to infliximab or adalimumab. Clin Gastroenterol Hepatol 2015; 13: 522–530.e2.
- [39] Pariente B, Pineton de Chambrun G, Krzysiek R, et al. Trough levels and antibodies to infliximab may not predict response to intensification of infliximab therapy in patients with inflammatory bowel disease. Inflamm Bowel Dis 2012; 18: 1199–1206.
- [40] D’Haens G, Vermeire S, Lambrecht G, et al. Drug‑concentration versus symptom‑driven dose adaptation of infliximab in patients with active Crohn’s disease: a prospective, randomized, multicentre trial [TAILORIX]. J Crohns Colitis 2016; 10(Suppl 1):