Imunoglobuliny v léčbě imunodeficiencí
Imunoglobulinové přípravky jsou vyrobené z krevní plazmy tisíců dárců a upravené k substituční léčbě poruch tvorby protilátek a k imunomodulační léčbě řady onemocnění zejména z oblasti autoimunitních stavů. Tento přehled seznamuje se současným stavem poznání mechanismů působení imunoglobulinů, s jejich historickým uvedením do klinické praxe, především se však zaměřuje na praktické poznatky o možnostech aplikace imunoglobulinů v současné době. V článku jsou uvedeny doporučené postupy léčby intravenózními a subkutánními imunoglobuliny, zkušenosti s převodem z jedné formy aplikace na druhou, metody aplikace a praktické poznámky k dané problematice platné v současné době v České republice.
Úvod a historie
Imunoglobuliny – molekuly patřící k bílkovinám krevní plazmy a tělních tekutin – jsou nyní velmi dobře charakterizované a indikované k léčbě řady onemocnění. K našim současným znalostem se nicméně dospělo dlouhým historickým vývojem. Vůbec první popsanou molekulou podobnou imunoglobulinu byla již v roce 1845 Benceova-Jonesova bílkovina. Od té doby byly za více než století postupně popsány všechny současně známé třídy imunoglobulinů, následně odhalované elektroforézou krevního séra. Jako poslední byla definována molekula IgE v šedesátých letech minulého století. Šedesátá léta byla pro výzkum imunoglobulinů vůbec důležitá, neboť Světová zdravotnická organizace vydala nomenklaturu všech známých izotypů již v podobě, jako je známe dnes – IgG, IgA, IgM, IgD a IgE, jak byly postupně definovány [1]. Postupně se také začaly spojovat funkce protilátkové se strukturou imunoglobulinů a taktéž v šedesátých letech byla sekrece protilátek spojena s B-lymfocyty. Ve spojitosti s Burnetovou teorií klonální selekce byly objeveny procesy rekombinace, přeskupení variabilních částí imunoglobulinů zajišťující široké spektrum specifit imunoglobulinových molekul [2]. Později byly objeveny Fc receptory a vedle vazby antigenu byly imunoglobuliny spojeny i s dalšími imunitními funkcemi zprostředkovanými právě jejich Fc fragmentem.
Simultánně se rozvíjela klinická oblast primárních imunodeficiencí. V dnes již klasické práci z roku 1952 popsal Ogden C. Bruton chlapce s pneumonií a opakovanými respiračními infekcemi, u kterého prokázal tehdy nejmodernější metodou absenci gamaglobulinů. Diagnostikoval tak a popsal první klinickou jednotku z oblasti primárních imunodeficiencí s dědičností vázanou na chromozom X, která od té doby nese jeho jméno (Brutonova agamaglobulinemie). Průkopnická práce položila základy nejenom klinické imunologii, ale i léčbě primárních imunodeficiencí s poruchou tvorby protilátek, neboť u popsaného pacienta byla hned též uplatněna léčba ve formě subkutánního podání imunoglobulinů [3].
Vlastní historii má i příprava imunoglobulinových preparátů. Ta začala na počátku 2. světové války, kdy Cohn zavedl a publikoval metody separace plazmatických proteinů na jednotlivé stabilní frakce [4]. Je pozoruhodné, že základní principy této frakcionace používáme dodnes, v různé podobě, doprovázené purifikací imunoglobulinových přípravků a celou řadou opatření k odstranění virů.
Mechanismy účinku imunoglobulinů
Základní mechanismy účinku imunoglobulinů jsou zprostředkovány jejich vazebným místem pro antigen na Fab fragmentu protilátky (obr. 1). Tyto mechanismy jsou přímočaré a spočívají ve vazbě cílového antigenu Fab fragmentem a v dalších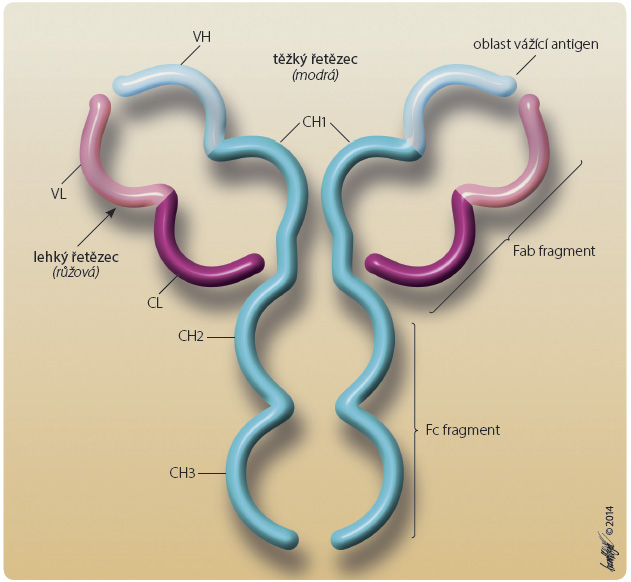 účincích zprostředkovaných Fc fragmentem odpovídajícího izotypu protilátky, jako je opsonizace, aktivace komplementu, iniciace fagocytózy, vazba na NK buňky (NK – natural killer, přirozený zabíječ) a jejich degranulace, vazba na dendritické buňky a následné reakce podle povahy antigenu. Kromě těchto dlouho známých mechanismů se stále objevují nové, které mají zásadní význam pro terapeutické použití imunoglobulinových přípravků, jako je modulace imunitních reakcí indukovaná sítí cytokinů, ovlivnění apoptózy buněk aktivací Fas receptoru, regulace pomocí idiotypové-antiidiotypové sítě a v neposlední řadě významné zásahy do procesů tolerance. S tím souvisí i jejich působení na dendritické buňky, které v závislosti na dávce imunoglobulinů vede k inhibici maturace a diferenciace dendritických buněk [5]. V této souvislosti je vhodné zmínit také publikace z poslední doby popisující tak zvané tregitopy, krátké úseky právě v sekvenci imunoglobulinových molekul, které vedou k indukci tolerance [6]. Jmenovitě zásahy do procesů tolerance jsou podkladem podávání vysokých dávek imunoglobulinů v imunomodulaci a ovlivnění řady hlavně autoimunitních onemocnění.
účincích zprostředkovaných Fc fragmentem odpovídajícího izotypu protilátky, jako je opsonizace, aktivace komplementu, iniciace fagocytózy, vazba na NK buňky (NK – natural killer, přirozený zabíječ) a jejich degranulace, vazba na dendritické buňky a následné reakce podle povahy antigenu. Kromě těchto dlouho známých mechanismů se stále objevují nové, které mají zásadní význam pro terapeutické použití imunoglobulinových přípravků, jako je modulace imunitních reakcí indukovaná sítí cytokinů, ovlivnění apoptózy buněk aktivací Fas receptoru, regulace pomocí idiotypové-antiidiotypové sítě a v neposlední řadě významné zásahy do procesů tolerance. S tím souvisí i jejich působení na dendritické buňky, které v závislosti na dávce imunoglobulinů vede k inhibici maturace a diferenciace dendritických buněk [5]. V této souvislosti je vhodné zmínit také publikace z poslední doby popisující tak zvané tregitopy, krátké úseky právě v sekvenci imunoglobulinových molekul, které vedou k indukci tolerance [6]. Jmenovitě zásahy do procesů tolerance jsou podkladem podávání vysokých dávek imunoglobulinů v imunomodulaci a ovlivnění řady hlavně autoimunitních onemocnění.
Primární imunodeficience
Primární imunodeficience jsou onemocnění charakterizovaná poruchou funkce imunitního systému, k níž došlo na základě vrozené mutace genu a následné poruchy zasahující imunitní systém. Vzhledem ke komplexnosti imunitního systému se výskyt takových onemocnění strmě zvyšuje a nyní se počet dobře definovaných jednotek pohybuje kolem 200. Klasické dělení na imunodeficience přirozené imunity a získané imunity je již zastaralé, sice ve svých obecných rysech platí, ale nepostihuje komplexnost imunitního systému a moderní přístup k němu. Určitý konsenzuální pokus o klasifikaci a přehled primárních imunodeficiencí je možno nalézt v recentním přehledu Bousfihy a kol. [7]. Léčba substitucí imunoglobulinů je indikována u všech imunodeficiencí spojených se snížením či chyběním protilátek či s poruchou jejich funkce. Omezení na danou diagnózu není striktní. Indikace k terapii se řídí klinickým stavem, imunologickým nálezem a ohledem na základní diagnózu. Popis, diagnostiku a zásady léčby uvádí přehled uveřejněný v časopise Vox pediatriae [8].
Imunoglobuliny v léčbě imunodeficiencí
Při imunodeficiencích mají imunoglobuliny substituční efekt, který využívá přítomnosti ohromného množství specificky zaměřených imunoglobulinových molekul v imunoglobulinových preparátech připravených z plazmy tisíců dárců. Jak je uvedeno výše, imunoglobuliny se používají v této indikaci více než půlstoletí. Jedná se o zcela základní použití imunoglobulinů, které je možno aplikovat ve formě intravenózní či subkutánní. Intramuskulární podání je sice také možné, ale je vyhrazeno pro zcela specifické a vzácné situace, u primárních imunodeficiencí v substituční léčbě už nemá, až na zvláštní výjimky, své místo.
Ohledně léčby primárních imunodeficiencí imunoglobuliny probíhá opakovaně a téměř kontinuálně velká diskuse. Jsou k dispozici různá doporučení různých seskupení, většinou garantovaná odborníky a odbornými společnostmi. Ve světě se tato doporučení většinou diverzifikují podle kontinentů, kdy v souvislosti s imunoglobuliny jsou v Evropě respektována doporučení Evropské společnosti pro imunodeficience (European Society for Immunodeficiencies, ESID), v USA se řídí většinou doporučeními Americké společnosti pro alergii, astma a imunologii (American College of Allergy, Asthma and Immunology, ACAAI), další skupinu představují doporučení zemí Asie a Austrálie a dále doporučení Jižní Ameriky. Kromě toho je organizováno mnoho akcí, které se specificky věnují tomuto tématu, většinou historicky a opakovaně. Jedno z posledních setkání na toto téma se uskutečnilo v německém městečku Wildbad Kreuth pod názvem Optimal Use of Immunoglobulins and Clotting Factors. Toto setkání zaštítěné EU má svou skupinu expertů právě v oblasti terapie imunoglobuliny, která na základě recentního jednání vydává svůj konsenzus (v recenzním řízení, European Journal of Immunology, 2014). Dokumenty z tohoto jednání jsou ke stažení na http://www.edqm.eu/en/proceedings-international-conference-83.html. Imunoglobuliny jsou zde hodnoceny z celkového pohledu – ukazuje se, že jejich spotřeba ve světě strmě stoupá; v Evropě nyní dosahuje asi 28 tun, ve světě dokonce přes 100 tun imunoglobulinových přípravků za rok. Spotřeba se za posledních 15 let ztrojnásobila a již několikrát jsme zažili naštěstí relativně krátká a přechodná období nedostatku těchto léčiv. I z tohoto důvodu se ve světě začínají uplatňovat různé postupy, jak určit priority v podávání imunoglobulinů. Ve všech těchto systémech jsou primární imunodeficience na prvním místě, neboť jsou to onemocnění, kde je podávání nezbytné a jako jediné plně opodstatněné z dlouhodobého hlediska. V době vzplanutí nemoci jsou potom imunoglobuliny plně indikované u pacientů s Kawasakiho syndromem, s aloimunní trombocytopenií (ATP), s chronickou inflamatorní demyelinizační polyradikuloneuropatií (CIDP) a u pacientů s Guillainovým-Barréovým syndromem. Ostatní indikace mají vždy nižší prioritu a jsou předmětem diskuse.
Zahájení léčby imunoglobuliny
Zahájení léčby imunoglobuliny je určeno indikujícím lékařem po domluvě s pacientem. Indikační kritéria zahrnují všechny imunodeficience spojené s poruchou tvorby a funkce protilátek, což v současné době představuje celou řadu diagnostických jednotek z kategorií protilátkových a kombinovaných imunodeficiencí. Před zahájením léčby musí být provedena i další vyšetření spojená nejenom s diagnostikou imunodeficience, ale právě s dlouhodobou terapií a jejím monitorováním. Specificky je před zahájením terapie doporučeno vyšetření markerů hepatitid B a C. Před zahájením léčby a poté při jejím monitorování je doporučen následující soubor vyšetření: hladiny IgG, jaterní testy, krevní obraz a diferenciální rozpočet leukocytů, klinický stav, plicní funkce, eventuálně další vyšetření podle konkrétních obtíží pacienta; HRCT (high resolution computed tomography, počítačová tomografie s vysokým rozlišením) plic a SG (ultrasonografie) břicha se doporučují, také podle základní diagnózy a výsledku klinického vyšetření, při zahájení terapie a dále podle klinického stavu pacienta. Opakování HRCT je konsenzuálně doporučováno u pacientů s klinickými příznaky jednou za čtyři roky.
Dávkování intravenózních imunoglobulinů je zpočátku určeno podle doporučeného dávkovacího schématu a posléze upraveno podle hladin IgG a klinického stavu nemocného. Při léčbě subkutánními imunoglobuliny používají některá pracoviště k dosažení základních hladin imunoglobulinů jejich úvodní intravenózní podání, jinde volí pro stejný účel častější subkutánní aplikace v úvodu léčby. Při nižších dávkách a lehčích projevech imunodeficitu není tato korekce nutná.
Léčba intravenózními imunoglobuliny
Podávání intravenózních imunoglobulinů (IVIG, intravenous immunoglobulins) je standardem imunoglobulinové terapie, uvedené do klinické praxe v osmdesátých letech [9]. Princip terapie využívá biologického poločasu imunoglobulinu, který je mimořádně dlouhý, přibližně tři týdny, také díky úloze neonatálního Fc receptoru (FcRn), jenž molekulu imunoglobulinu částečně recykluje. Podává se tedy v měsíčních intervalech, vzácněji v některých případech i v kratších, 2–3týdenních intervalech, v doporučených dávkách, které se nyní uvádějí v rozmezí 0,4 g/kg až 0,8 g/kg za měsíc. Jak o délce intervalu, tak o velikosti dávky se stále vede neutuchající diskuse. Výsledkem řady studií a rozvah je nyní individuální přístup k pacientovi a definování určité individuální biologické dostupnosti a účinnosti imunoglobulinu. Primárním cílem terapie je zabránit opakovaným infekcím typickým pro imunodeficitní stavy. Vodítkem, ale ne striktním určujícím faktorem v léčbě jsou hladiny imunoglobulinů v době před podáním infuze, které se mají pohybovat ve fyziologickém rozpětí. Individuální je také volba určitého přípravku, a hlavně setrvání v léčbě přípravkem, který pacient toleruje. Podávání intravenózních imunoglobulinů může být provázeno nežádoucími účinky, které jsou relativně časté, v některých pracích se jejich výskyt udává u 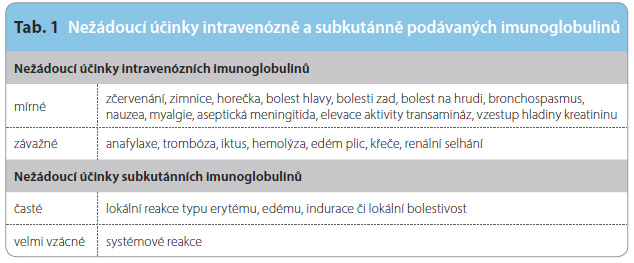 více než poloviny pacientů [10] (tab. 1). Reakce mohou být časné, spojené přímo s podáváním a vznikající během podávání nebo do několika hodin po podání, nebo oddálené až pozdní. Nejčastějším příznakem jsou bolesti hlavy, teploty, někdy symptomy obdobné jako při počínajícím virovém onemocnění. Anafylaktické reakce jsou extrémně vzácné. Z pozdějších příznaků opětovně dominuje perzistující bolest hlavy, v delším horizontu se může objevit i syndrom aseptické meningitidy a v poslední době hodně diskutované tromboembolické nebo hemolytické reakce, související s přítomností protilátek proti erytrocytům v imunoglobulinových přípravcích. Tyto závažnější reakce jsou výjimečné, řeší se individuálně podle okolností. Určitou rizikovou okolností vzniku reakcí je počáteční úvod do terapie, eventuálně změna přípravku. I proto je všeobecně uznáváno i zakotveno v dokumentech medicínských agentur, že imunoglobuliny nejsou volně zaměnitelnými generiky. Vzhledem k odchylnostem ve výrobě má každý přípravek své unikátní vlastnosti, volné záměny jsou do určité míry možné, ale nejsou doporučovány, zvláště ne u rizikových pacientů. K těm patří i nemocní vytvářející IgG protilátky proti IgA, který je v imunoglobulinových přípravcích stopově přítomen.
více než poloviny pacientů [10] (tab. 1). Reakce mohou být časné, spojené přímo s podáváním a vznikající během podávání nebo do několika hodin po podání, nebo oddálené až pozdní. Nejčastějším příznakem jsou bolesti hlavy, teploty, někdy symptomy obdobné jako při počínajícím virovém onemocnění. Anafylaktické reakce jsou extrémně vzácné. Z pozdějších příznaků opětovně dominuje perzistující bolest hlavy, v delším horizontu se může objevit i syndrom aseptické meningitidy a v poslední době hodně diskutované tromboembolické nebo hemolytické reakce, související s přítomností protilátek proti erytrocytům v imunoglobulinových přípravcích. Tyto závažnější reakce jsou výjimečné, řeší se individuálně podle okolností. Určitou rizikovou okolností vzniku reakcí je počáteční úvod do terapie, eventuálně změna přípravku. I proto je všeobecně uznáváno i zakotveno v dokumentech medicínských agentur, že imunoglobuliny nejsou volně zaměnitelnými generiky. Vzhledem k odchylnostem ve výrobě má každý přípravek své unikátní vlastnosti, volné záměny jsou do určité míry možné, ale nejsou doporučovány, zvláště ne u rizikových pacientů. K těm patří i nemocní vytvářející IgG protilátky proti IgA, který je v imunoglobulinových přípravcích stopově přítomen.
Aplikace intravenózních přípravků bývá spojena i s takzvaným syndromem ze spotřebování, který označuje klinický stav před koncem intervalu mezi dávkami. V důsledku poklesu hladin mezi infuzemi již někteří pacienti udávají klinické příznaky, které je upozorní na blížící se termín další infuze. Klinicky se projevuje většinou příznaky základní imunodeficience, náchylností k infekcím, někteří pacienti ho popisují jako nepřesně definovaný stav celkového zhoršení spojený s očekáváním další aplikace. Kromě objektivních známek je jistě spojen i s psychickou reakcí dlouhodobě léčeného pacienta. Těmto stavům se předchází zkrácením intervalů mezi aplikacemi a pečlivým udržováním dostatečných sérových hladin imunoglobulinů. Jak bude ukázáno dále, tento stav se u subkutánních aplikací nevyskytuje.
Z praktického hlediska je aplikace intravenózních imunoglobulinů v České republice dobře organizována a již historicky osvědčena. Aplikace probíhá ve zdravotnickém zařízení, nejčastěji ve specializovaném stacionáři, pod dohledem lékaře a zdravotnického personálu. Tento režim umožňuje též nutné kontroly a monitorování zdravotního stavu i laboratorních hodnot nutných k řízení léčby imunodeficience a stanovení optimální individuální dávky. Podání ve zdravotnickém zařízení taktéž umožňuje efektivní zvládání případných systémových reakcí na aplikace, eventuálně předcházení těmto reakcím při jejich případném předchozím výskytu. Intravenózní imunoglobuliny jsou k dispozici v koncentracích 5 % a 10 %. V prevenci popsaných nežádoucích reakcí jsou intravenózní imunoglobuliny podávány pomalou infuzí,
zpočátku rychlostí 1 ml/kg/h, po 30 minutách rychlostí 2 ml/kg/h, u dlouhodobě sledovaných pacientů s dobrou tolerancí je možné i rychlejší podávání. V komplikovaných případech lze taktéž podat premedikaci antipyretiky, antihistaminiky či kortikoidy.
Pro poskytovatele jsou intravenózní imunoglobuliny tzv. zvlášť účtovanými léčivými přípravky (ZÚLP), vlastní režim jejich účtování a vykazování potom určí konkrétní zdravotnické zařízení. Jedná se o léčbu nákladnou, nicméně velmi účinnou, jejímž hlavním cílem je prevence infekcí a komplikací spojených se základní imunodeficiencí.
Léčba subkutánními imunoglobuliny
Subkutánní imunoglobuliny (SCIG, subcutaneous immunoglobulins) mají kratší historii než intravenózní, přesto jsou  v klinickém používání hlavně v Evropě již déle než 25 let. Recentně byl publikován výborný souhrn jejich historie a podávání, který připomíná průkopnické práce pocházející ze Švédska, země s dosud nejvyšším podílem použití subkutánních imunoglobulinů u primárních imunodeficitů [11]. Subkutánní imunoglobuliny si zejména v Evropě získávají rychle své místo především v oblasti primárních imunodeficiencí, neboť právě při jejich dlouhodobém podávání v substituční terapii vystupují jejich výhody. Patří mezi ně hlavně možnost domácí aplikace, dále prakticky absence systémových vedlejších účinků při pomalém vstřebávání z podkoží, stabilní hladina bez větších výkyvů a výborný efekt v prevenci infekcí. Výhodou je také psychologický přístup pacientů, z nichž většina dává přednost této možnosti domácí dlouhodobé aplikace. Na rozdíl od intravenózních imunoglobulinů se při podávání subkutánních přípravků ve větší míře projevují lokální reakce v místě vpichu, a to ve formě erytému či otoku s různou, většinou krátkou dobou přetrvávání. Úvodní obtíže lze obvykle zvládnout změnou aplikačního místa či sklonem jehly tak, aby podání bylo striktně hluboko podkožně. Aplikovat lze do podkoží břicha, steh
v klinickém používání hlavně v Evropě již déle než 25 let. Recentně byl publikován výborný souhrn jejich historie a podávání, který připomíná průkopnické práce pocházející ze Švédska, země s dosud nejvyšším podílem použití subkutánních imunoglobulinů u primárních imunodeficitů [11]. Subkutánní imunoglobuliny si zejména v Evropě získávají rychle své místo především v oblasti primárních imunodeficiencí, neboť právě při jejich dlouhodobém podávání v substituční terapii vystupují jejich výhody. Patří mezi ně hlavně možnost domácí aplikace, dále prakticky absence systémových vedlejších účinků při pomalém vstřebávání z podkoží, stabilní hladina bez větších výkyvů a výborný efekt v prevenci infekcí. Výhodou je také psychologický přístup pacientů, z nichž většina dává přednost této možnosti domácí dlouhodobé aplikace. Na rozdíl od intravenózních imunoglobulinů se při podávání subkutánních přípravků ve větší míře projevují lokální reakce v místě vpichu, a to ve formě erytému či otoku s různou, většinou krátkou dobou přetrvávání. Úvodní obtíže lze obvykle zvládnout změnou aplikačního místa či sklonem jehly tak, aby podání bylo striktně hluboko podkožně. Aplikovat lze do podkoží břicha, steh en, paží či do laterální části kyčle. V České republice používáme subkutánní imunoglobuliny od roku 2006. Indikace subkutánních imunoglobulinů jsou v oblasti primárních imunodeficiencí totožné s indikacemi intravenózních imunoglobulinů (tab. 2, 3). Podle současných trendů je i dávkování v kumulativní měsíční dávce stejné jako u intravenózních přípravků. Množství imunoglobulinu na jednu aplikaci je samozřejmě menší a vyplývá z celkového indikovaného množství imunoglobulinu u daného pacienta a z kapacity jeho podkoží, kam se imunoglobulin aplikuje. Celková měsíční dávka se většinou dělí do 4 dávek s aplikací jednou týdně, ale možná je i aplikace adekvátně menšího množství dvakrát týdně, nebo naopak lze aplikovat vyšší dávku jednou za dva týdny. Schéma aplikací určuje ošetřující lékař po posouzení základní indikace k léčbě imunoglobuliny, klinického stavu pacienta, výsledků jeho laboratorních vyšetření, podle kontroly dosažených hladin IgG a podle dalších individuálních okolností. Aplikace se provádí buď speciálním aplikátorem (obr. 2), nebo metodou aplikace z ruky, anglicky a v literatuře nazývanou „rapid push“, kdy si rychlost podávání řídí nemocný sám podle své individuální tolerance [12]. Obě tyto metody jsou uznávané, obě je možné používat v domácím podávání, pro něž jsou subkutánní imunoglobuliny primárně určeny. Volba me
en, paží či do laterální části kyčle. V České republice používáme subkutánní imunoglobuliny od roku 2006. Indikace subkutánních imunoglobulinů jsou v oblasti primárních imunodeficiencí totožné s indikacemi intravenózních imunoglobulinů (tab. 2, 3). Podle současných trendů je i dávkování v kumulativní měsíční dávce stejné jako u intravenózních přípravků. Množství imunoglobulinu na jednu aplikaci je samozřejmě menší a vyplývá z celkového indikovaného množství imunoglobulinu u daného pacienta a z kapacity jeho podkoží, kam se imunoglobulin aplikuje. Celková měsíční dávka se většinou dělí do 4 dávek s aplikací jednou týdně, ale možná je i aplikace adekvátně menšího množství dvakrát týdně, nebo naopak lze aplikovat vyšší dávku jednou za dva týdny. Schéma aplikací určuje ošetřující lékař po posouzení základní indikace k léčbě imunoglobuliny, klinického stavu pacienta, výsledků jeho laboratorních vyšetření, podle kontroly dosažených hladin IgG a podle dalších individuálních okolností. Aplikace se provádí buď speciálním aplikátorem (obr. 2), nebo metodou aplikace z ruky, anglicky a v literatuře nazývanou „rapid push“, kdy si rychlost podávání řídí nemocný sám podle své individuální tolerance [12]. Obě tyto metody jsou uznávané, obě je možné používat v domácím podávání, pro něž jsou subkutánní imunoglobuliny primárně určeny. Volba me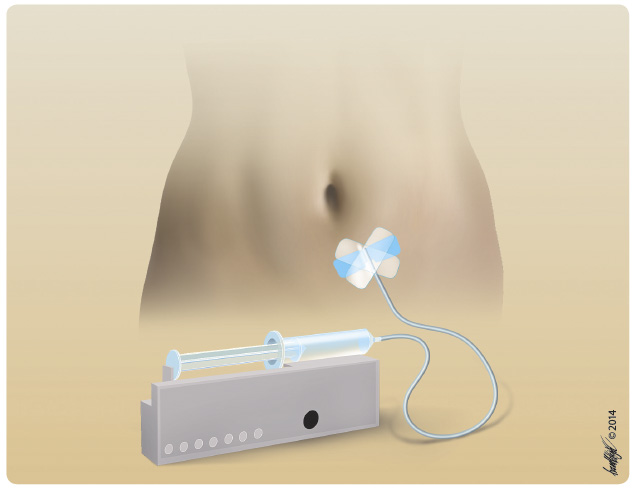 tody záleží na rozhodnutí indikujícího lékaře v těsné spolupráci s pacientem a na zvážení všech okolností (dostupnost aplikátoru, jeho ovladatelnost pacientem, výše dávek a frekvence jejich podávání, spolupráce pacienta či rodiny, schopnost zaučení do metod aplikace, snášenlivost metody a další možné ovlivňující faktory). Subkutánní imunoglobuliny se podávají aplikátorem doporučenou rychlostí 20 ml/h, posléze po zaučení i rychlostí vyšší (30–35 ml/h), maximální objem aplikovaný do jednoho místa je doporučen na
tody záleží na rozhodnutí indikujícího lékaře v těsné spolupráci s pacientem a na zvážení všech okolností (dostupnost aplikátoru, jeho ovladatelnost pacientem, výše dávek a frekvence jejich podávání, spolupráce pacienta či rodiny, schopnost zaučení do metod aplikace, snášenlivost metody a další možné ovlivňující faktory). Subkutánní imunoglobuliny se podávají aplikátorem doporučenou rychlostí 20 ml/h, posléze po zaučení i rychlostí vyšší (30–35 ml/h), maximální objem aplikovaný do jednoho místa je doporučen na
15–20 ml a je korigován podle pacienta, u dětí se podává i nižší dávka. V případě potřeby vyšší dávky je možno aplikovat imunoglobuliny do více míst současně (většinou se jedná o dvě, ale někdy až čtyři místa v určených oblastech podbřišku či stehen).
Z praktického hlediska je aplikace subkutánních imunoglobulinů v České republice dobře zajištěna. Přípravky jsou předepisovány na recept a po zacvičení ve specializovaných centrech si je pacienti aplikují doma, méně často jsou podávány ve zdravotnickém zařízení. K dispozici jsou přípravky s koncentrací imunoglobulinu 16 % a 20 %, jejich volba záleží opět na rozhodnutí ošetřujícího lékaře ve spolupráci s pacientem, může být ovlivněna lokálními regulačními předpisy zdravotnických zařízení a pojišťoven. Všechny subkutánní imunoglobulinové přípravky lze skladovat při pokojové teplotě, což znamená výhodu umožňující komfort domácího podávání i eventuálního cestování. Léčba je sice prováděna v domácím prostředí, ale je řízena lékařem. Obvyklé návštěvy spojené s klinickou kontrolou pacienta, s odběry a kontrolou jeho hladin imunoglobulinů a stavu imunodeficience jsou většinou plánovány po třech měsících, s úpravou podle aktuálního stavu.
Nová forma léčby, subkutánní podání spojené s aplikací hyaluronidázy Určitou novou možnost v léčbě imunoglobuliny představuje podání vyšší dávky, která je ekvivalentní množství podávanému při intravenózní aplikaci, do podkoží. K tomuto účelu byla vytvořena a Evropskou lékovou agenturou schválena kombinace hyaluronidázy a 10% imunoglobulinu. Hyaluronidáza je enzym, který štěpí kyselinu hyaluronovou i některé další mukopolysacharidy tvořící základ mezibuněčné hmoty pojivových tkání. Aplikace hyaluronidázy do podkoží tedy zvyšuje propustnost vazivových tkání a urychluje resorpci subkutánně aplikovaných léčiv. Ve spojení s imunoglobulinem se podává několik minut před aplikací imunoglobulinu s cílem zlepšit jeho biologickou dostupnost při subkutánním podání. Tímto způsobem je mož-
né aplikovat do podkoží výrazně vyšší dávky imunoglobulinu a tím prodloužit aplikační interval až na měsíc, obdobně jako při intravenózním podání. Přípravek je v klinickém zkoušení, které prokázalo udržitelnost hladin a jeho účinnost. V České republice právě probíhá registrační řízení.
Přechod z intravenózní aplikace na subkutánní či změna přípravku
S nástupem subkutánních imunoglobulinů a častějším převáděním pacientů z původní intravenózní léčby na subkutánní podání byla zkoumána otázka dávky. Původně doporučované navýšení dávky subkutánních imunoglobulinů oproti intravenózním se neukázalo jako nutné a v současné době provádíme tento převod v poměru 1 : 1. Stejně tak při převodu z léčby 16% subkutánním přípravkem na podávání 20% přípravku zachováváme celkovou měsíční dávku v gramech v poměru 1 : 1.
Závěr
Tento článek shrnuje recentní poznatky o léčbě protilátkových deficiencí imunoglobuliny a seznamuje se současnými možnostmi jejich používání. Přes dlouhou historii přinášejí imunoglobuliny stále nové až překvapivé možnosti, hlavně v oblasti svého imunomodulačního působení. V tomto přehledu se soustřeďujeme na praktické otázky léčby primárních imunodeficiencí.
Práce je podpořena MZ ČR – RVO, FN Motol 00064203.
Autorka děkuje prof. MUDr. Jiřímu Litzmanovi, CSc.,
z Ústavu klinické imunologie a alergologie Fakultní
nemocnice u sv. Anny v Brně za recenzi rukopisu.
Seznam použité literatury
- [1] Black CA. A brief history of the discovery ofthe immunoglobulins and the origin of the modern immunoglobulin nomenclature. Immunol Cell Biol 1997; 75: 65–68.
- [2] Jung D, Alt FW. Unraveling V(D)J Recombination: Insights into Gene Regulation. Cell 2004; 116: 299–311.
- [3] Bruton OC. Agammaglobulinemia. Pediatrics 1952; 9: 722–728.
- [4] Cohn EJ. Blood proteins and their therapeutic value. Science 1945; 101: 51–56.
- [5] Ephrem A, Misra N, Hassan G, et al. Immunomodulation of autoimmune and inflammatory diseases with intravenous immunoglobulin. Clin Exp Med 2005; 5: 135–140.
- [6] Su Y, Rossi R, De Groot AS, Scott DW. Regulatory T cell epitopes (Tregitopes) in IgG induce tolerance in vivo and lack immunogenicity per se. J Leukoc Biol 2013; 94: 377–383.
- [7] Bousfiha AA, Jeddane L, Ailal F, et al. A phenotypic approach for IUIS PID classification and diagnosis: guidelines for clinicians at the bedside. J Clin Immunol 2013; 33: 1078–1087.
- [8] Šedivá A. Primární imunodeficience v pediatrii – popis, diagnostika a léčba. Vox pediatriae 2013; 13: 15–20.
- [9] Bonagura VR. Using intravenous immunoglobulin (IVIG) to treat patients with primary immune deficiency disease. J Clin Immunol 2013; 33 (Suppl 2): S90–94.
- [10] Stiehm ER. Adverse effects of human immunoglobulin therapy. Transfus Med Rev 2013; 27: 171–178.
- [11] Chapel H, Gardulf A. Subcutaneous immunoglobulin replacement therapy: the European experience. Curr Opin Allergy Clin Immunol 2013; 13: 623–629.
- [12] Shapiro RS. Subcutaneous immunoglobulin therapy given by subcutaneous rapid push vs infusion pump: a retrospective analysis. Ann Allergy Asthma Immunol 2013; 111: 51–55.