Imunopatogeneze infekce koronavirem SARS‑CoV‑2
Souhrn:
Krejsek J. Imunopatogeneze infekce koronavirem SARS‑CoV‑2. Remedia 2020; 30: 448–452.
Lidská populace je v současnosti vystavena pandemii nového koronaviru SARS‑CoV‑2. Tento koronavirus s vysokou patogenitou do ní vstoupil na konci roku 2019. Zdrojem jsou velmi pravděpodobně netopýři a k přenosu na člověka došlo zatím neznámým zvířecím vektorem. Virus SARS‑CoV‑2 je vysoce infekční a přenáší se pravděpodobně výlučně respirační cestou. Průběh onemocnění vyvolaného SARS‑CoV‑2 je u většiny lidí mírný, a často dokonce bez klinických příznaků. U malé části infikovaných osob, především u seniorů a pacientů s různými komorbiditami, však infekce probíhá se závažnými klinickými projevy a vede až ke smrti. Tento závažný průběh onemocnění SARS‑CoV‑2 lze vysvětlit nezvládnutou zánětlivou reakcí, která je u disponovaných osob infekcí spuštěna. Infikované epitelové a endotelové buňky jsou ničeny buď cytopatickým efektem viru, nebo obrannou reakcí. To vede k masivnímu uvolnění vzorů vnitřního poškození, jež jsou následně identifikovány buňkami vrozené imunity prostřednictvím PRRs (pattern recognition receptors). Výsledkem je zvýšená tvorba prozánětlivých cytokinů a prozánětlivé formy buněčné smrti, jakými jsou pyroptóza a granulocytární NETóza, jež vedou k respiračnímu selhání.
Summary:
Krejsek J. Immunopathogenesis of coronavirus SARS‑CoV‑2 infection. Remedia 2020; 30: 448–452.
The human population is now facing the pandemic of a new coronavirus SARS‑CoV‑2. This highly pathogenic coronavirus entered it in late 2019, probably transmitted from bats via still unknown animal vectors. SARS‑CoV‑2 is highly infectious, with a predominant respiratory route of transmission. The course of the disease caused by SARS‑CoV‑2 is largely mild in most people, often even without clinical symptoms. In a small subset of people, predominantly in elderly and patients with comorbidities, the infection has a severe course of action, with severe clinical presentation, and leads to death. This severe course of the disease caused by SARS‑CoV‑2 could be explained by an exaggerated inflammatory response evoked in these predisposed patients. Infected epithelial and endothelial cells are destroyed either by direct cytopathic effects of the virus or by the immune response. Damage‑associated molecular patterns that are released from dying cells are subsequently recognized by innate immunity cells via PRRs (pattern recognition receptors). The result is increased production of proinflammatory cytokines and proinflammatory forms of cell death, such as pyroptosis and granulocytic NETosis. Cytokine production and proinflammatory cell deaths are resulting in severe respiratory distress syndrome.
Key words: SARS‑CoV‑2 ‒ immunopathogenesis ‒ inflammatory response.
Úvod
Již více než půl roku je život na Zemi zásadně ovlivněn infekcí koronavirem SARS CoV 2 (SARS 2). K 30. červnu 2020 bylo hlášeno přibližně 10 300 000 prokázaných případů této infekce. Pandemie infekce SARS 2 si vyžádala zhruba 502 000 lidských životů. Její dopady na ekonomiku, politický život i životy jednotlivců jsou enormní a nemají v moderní lidské historii obdobu. Infekce SARS 2 ukázala, jak je na jednu stranu moderní lidská společnost silná, a na druhou stranu, jak rychle mohou být její „jistoty“ ztraceny. Je fascinující, že původce byl identifikován v krátké době po ohlášení prvních případů onemocnění. Byly rychle připraveny metody k rutinní detekci infekce. V různých zemích v různé míře byla přijata protiepidemická opatření, která se ukazují jako účinná. Péče o nemocné s infekcí SARS 2 prověřila robustnost zdravotnických systémů různých zemí. Pandemii SARS 2 prožívá většina lidí na celém světě doslova v „přímém přenosu“. K šíření informací jsou využívány všechny moderní technologie, bohužel často kontraproduktivně. Umožňují totiž rozmáhání se nepravd nebo zkreslených informací o této infekci. Dokonce i odborná veřejnost má někdy obtíže oddělit od sebe pravdivé a nepravdivé informace. Situace v České republice je podobná jako ve světě. I zde se k problému vyjadřují nekompetentní a nekvalifikovaní lidé s cílem zviditelnit se. Zaznívají i hlasy odborníků, lékařů, imunologů. Ani zde však nepanuje jednotný a silný názor, který by byl komunikován odborné i laické veřejnosti. V tomto přehledném sdělení se pokusíme o stručné shrnutí poznatků, které se týkají především imunitní odpovědi indukované infekcí SARS CoV 2.
Koronavirus
SARS CoV 2, imunobiologické charakteristiky
Koronaviry jsou RNA viry, jejichž genom je tvořen pozitivní jednořetězcovou ribonukleovou kyselinou (single strand RNA, ssRNA). Jsou velmi podrobně charakterizovány na genové i molekulové úrovni. Zahrnují viry patogenní pro člověka, savce a ptáky. V současnosti rozeznáváme šest virových druhů koronavirů patogenních pro člověka, které jsou běžnými původci virových respiračních infekcí s maximem výskytu v zimních měsících. Odhaduje se, že přibližně 40 % virových respiračních onemocnění, především u dětí, je způsobeno koronaviry. Tři další druhy koronavirů mají vyšší patogenitu, způsobují závažná onemocnění člověka a mohou být příčinou smrti. Patří sem virus SARS 1 (Severe Acute Respiratory Syndrome), který byl příčinou omezené epidemie v letech 2002–2004 s důsledky pro zhruba 10 000 osob. Druhým je virus MERS, který nakazil menší počet lidí, ale vykazoval ještě vyšší smrtnost. V lidské populaci byl identifikován v roce 2012 a do současnosti bylo hlášeno asi 2 500 případů. Z epidemiologického pohledu je podstatné, že infekce viry SARS 1 a MERS se klinicky zřejmě projevily u všech infikovaných lidí. To je v protikladu k infekci SARS 2, kde u většiny osob probíhá infekce s mírnými klinickými příznaky, které mohou být opomenuty. Nemalá část infikovaných dokonce nemá žádné klinické příznaky. Přesto obě tyto skupiny pacientů s infekcí SARS 2 jsou zdrojem nákazy. Šíření koronavirů SARS 1 a MERS s jasnými klinickými příznaky bylo zabráněno tvrdými protiepidemickými opatřeními a tyto infekce z populace „vymizely“. Bylo doloženo, že zdrojem infekce koronaviry s vyšší patogenitou byli s největší pravděpodobností netopýři, kteří jsou pro své unikátní biologické vlastnosti rezervoárem řady především virových agens. K přenosu na člověka dochází přes mezihostitele, jimiž v případě SARS 1 byly cibetky, v případě MERS plnili tuto roli velbloudi. Pro SARS 2 nebyl zatím mezičlánek identifikován.
Po adaptaci SARS 2 a vstupu do lidské populace dochází k přenosu infekce mezilidským kontaktem. Za jediný efektivní způsob přenosu infekce lze považovat respirační cestu. V kapénkách, které jsou uvolňovány z respiračních cest infikovaného člověka, se nacházejí virové částice. Účinnost přenosu závisí na momentálním stavu infikovaného člověka. Je prokázáno, že nejvyšší míra infekčnosti je na začátku onemocnění, často ještě v období bez klinických příznaků. To významně napomáhá šíření infekce. Pro přenos musí být dosaženo dostatečné virové nálože. Nebezpečné jsou velké kapénky a blízký kontakt s infikovaným člověkem. Virus může přežívat krátkou dobu i na kontaminovaných površích. Není popsán přenos krví. Otázka infekčnosti výkalů je nedořešena. Virové částice v nich byly prokázány a prokázány byly i v odpadních vodách [1].
V různých zemích byl přístup ke zvládání pandemie SARS 2 odlišný. Někde, stejně jako v ČR, byla zavedena přísná protiepidemická opatření omezující mezilidský kontakt a nařizující nošení ochranných pomůcek, především roušek. Pokud porovnáme s odstupem několika měsíců epidemiologickou situaci v zemích, kde byla zavedena přísná protiepidemická opatření, se zeměmi, které zůstaly tzv. otevřené s imunologicky pochybným cílem promořit populaci (viz Švédsko), je zřejmé, že zavedení protiepidemických opatření je účinné a brání šíření infekce. Představa dosažení tzv. populační imunity cestou přirozené expozice infekčnímu agens je z principu chybná. Populační imunity je možné dosáhnout pouze cestou aktivní imunizace, kdy jsou očkováni prakticky všichni. Toho nelze přirozenou cestou docílit a promořením nelze zabránit cirkulaci viru v populaci.
Virus SARS 2 infikuje epitelové buňky dýchacího traktu a pravděpodobně také trávicí soustavy. Nebyla popsána infekce buněk imunitního systému. Nejsou důkazy o viremii spojené s infekcí SARS 2. Podmínkou vstupu do epitelových buněk je interakce mezi povrchovými molekulami SARS 2 označovanými jako „spike“ (S), které prostupují virovým obalem. Proteiny S interagují s receptory angiotenzin konvertujícího enzymu (ACE) 2, které jsou ve vysoké míře vyjádřeny na epitelových strukturách, zvláště plic. Jsou exprimovány také endotelovými buňkami a rezidentními plicními makrofágy. Virové proteiny S jsou heterodimerem, v němž podjednotka S1 určuje buněčný tropismus viru a podjednotka S2 zajišťuje fúzi s membránou epitelové buňky. Po vstupu do cytoplazmy ztrácí SARS 2 plášť a jeho RNA je hostitelskou buňkou replikována a předkládána do virových proteinů. Nakažené buňky jsou likvidovány cytopatickým efektem viru nebo cytotoxickou obrannou reakcí. Virus SARS 2 má, podobně jako jiné patogenní viry, řadu mechanismů úniku imunitnímu dozoru [2]. Výsledkem je infikování dalších epitelových buněk vedoucí k poškození bariérových funkcí epitelu. SARS 2 je v porovnání s jinými respiračními viry unikátní svou schopností v disponovaných jedincích (senioři, pacienti s jinými onemocněními) vyvolat nezvládnutelnou zánětlivou reakci, která postihuje především plíce. Tato schopnost vychází z interakcí SARS 2 s imunitním systémem, který je u každého jedince unikátní [3].
Infekce SARS CoV 2, zánět
obranný a poškozující
Protože většina lidí infikovaných
virem SARS 2 má pouze mírné klinické příznaky nebo infekce
probíhá asymptomaticky, lze obranný zánět indukovaný SARS 2
považovat u většiny osob za účinný. Virové partikule
SARS 2, které byly vdechnuty, prostupují přirozenými
povrchovými bariérami epitelu plic. Jedná se především
o struktury označované jako glykokalyx a mukus, tvořené
membránovými a solubilními proteoglykany. V této vrstvě
se nacházejí antimikrobiální látky, např. charakteru defenzinů,
a u osob po předchozí expozici SARS 2 také
specifické sekreční protilátky imunoglobulinu A (sIgA).
Epitelové buňky jsou integrální součástí obranného zánětu,
protože v nitrobuněčných strukturách (endozom) exprimují
receptory PRRs (pattern recognition receptors), konkrétně receptory
TLR (toll like receptors) 7 a 9, které identifikují
virové nukleové kyseliny jako vzory virové invaze. Výsledkem je
indukce obranného zánětu, v němž sehrává klíčovou úlohu
schopnost rychlé tvorby interferonů I. a III. třídy.
Jejich tvorba neochrání infikovanou buňku, která je produkuje.
Molekuly interferonů po vazbě na specifické receptory
dosud neinfikovaných buněk v nich stimulují procesy, jež
vedou k rezistenci na virovou infekci (non permisivita).
Takto je zabráněno šíření viru v epitelových strukturách.
Bohužel, SARS 2 má jako jeden z nejvýznamnějších
mechanismů úniku schopnost tlumit produkci interferonů
I. a III. třídy. Přítomnost virů a také
vzorů vnitřního poškození epitelových buněk DAMPs
(damage associated molecular patterns) vede lokálně
k akumulaci buněk vrozené imunity, makrofágů a dendritických
buněk. Makrofágy jsou funkčně polarizovány do subsetu M1,
který se za normálních okolností zapojuje do protivirové
obrany. V případě SARS 2 je jejich aktivita přemrštěná
a špatně regulovaná. Může přispět k cytotoxické
aktivitě prohlubující poškození epitelových struktur.
K zesílení prozánětlivých aktivit v případě těžkého
průběhu infekce SARS 2 přispívají rovněž dendritické
buňky, které identifikují PRRs virové vzory a vzory
vnitřního poškození – alarminy. Dendritické buňky
z místa poškození přísně regulovanými procesy migrují
do sekundárních lymfatických tkání, kde předkládají
antigenní fragmenty vzniklé z virových antigenů a také
z DAMPs T lymfocytům. V rámci obranného protivirového
zánětu jsou T lymfocyty specifické pro daný antigen po rozpoznání
prezentovaného antigenu a dosažení kritické koncentrace
kostimulačních interakcí zprostředkovaných dendritickými
buňkami klonálně zmnoženy a funkčně polarizovány. Virová
infekce vede k preferenční polarizaci do subsetu Th1 (T
pomocné lymfocyty), který především tvorbou interferonu gama
(IFNγ) stimuluje cytotoxické CD8+ T lymfocyty a také NK
(natural killers) buňky. Ty následně likvidují virem infikované
epitelové buňky. Cíl této aktivity je součástí obranného
zánětu. Musí však být velmi přesně regulován na mnoha
úrovních. Hovoříme o tzv. homeostatických regulacích.
Jednou z nich je polarizace T lymfocytů do subsetu Treg (T
regulační lymfocyty), které tvorbou homeostatických cytokinů,
jakým je interleukin 10 (IL 10), zmírňují aktivitu nejen
subsetu Th1, ale také subsetu Th17. Ten je za fyziologických
okolností odpovědný za udržování bariérových funkcí
epitelů a reguluje obranný zánět s cílem kontrolovat
bakteriální a fungální patogeny. Pokud je homeostatická
regulace subsetu Th17 narušena, výsledkem může být přesmyk
obranného zánětu do zánětu poškozujícího [4] (obr. 1).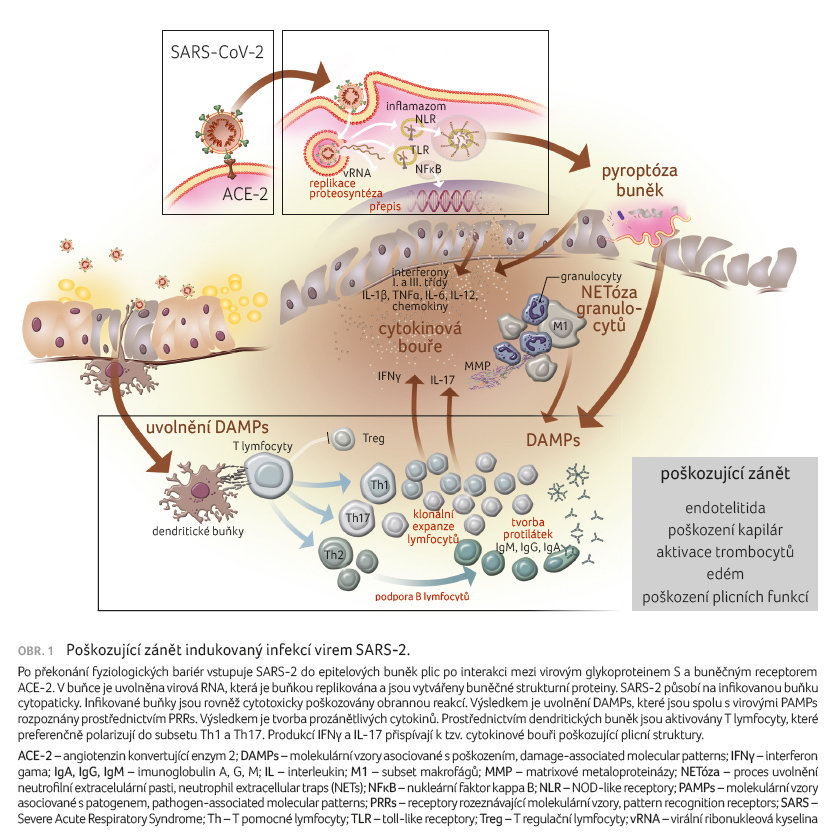
S odstupem zhruba půl roku od začátku pandemie SARS 2 již máme solidní informace, jimiž lze vysvětlit skutečnost, že naštěstí u drtivé většiny infikovaných lidí probíhá infekce SARS 2 s minimální klinickou odezvou, která se podobá odezvě na jiné virové infekce. U těchto osob je dobře zvládnuta regulace obranného zánětu. Jsou schopny ve většině případů eliminovat infekci SARS 2 s minimálními poškozeními vlastních struktur, především respiračního traktu. Zatím nemůžeme jednoznačně vyhodnotit, zda expozice SARS 2 povede k dlouhodobé protektivní imunitní paměti zprostředkované T a B lymfocyty. Specifická buněčná i humorální odpověď zprostředkovaná T a B lymfocyty je detekovatelná již přibližně po jednom týdnu po objevení se klinických příznaků. Proměnnou zde je též skutečnost, že SARS 2 je RNA virus, který jako jeden z nejvýznamnějších mechanismů úniku imunitnímu dozoru využívá rychlou proměnlivost své genetické informace, jež se následně odráží v rychlé proměnlivosti antigenních struktur viru. Zůstává tedy otevřeno, zda promoření aktuálním kmenem SARS 2 bude chránit proti novým kmenům SARS 2, které se pravděpodobně objeví v budoucnosti. To implikuje i potíže s konstrukcí vakcíny, která by proti této infekci chránila. Stále častěji se v souvislosti s infekcí SARS 2 komunikuje dobře doložený fakt, že i vrozená imunita si vytváří v kontaktu s mikrobiálními podněty schopnost lepší a efektivnější odpovědi při příštím setkání s patogeny. Tento fenomén je znám jako tzv. trénovaná imunita. Svou imunobiologickou podstatou se zásadně liší od paměti specifické T a B lymfocytární imunity. Trénovaná vrozená imunita je zaměřena na vzory PAMPs (pathogen associated molecular patterns) sdílené různými patogenními mikroorganismy. Za významný prvek, který takto ovlivňuje vrozenou imunitu, lze považovat očkování vakcínou BCG (Bacillus Calmette Guérin) [5].
Infekce SARS 2 u malé části predisponovaných osob probíhá velmi vážně a může mít fatální důsledky. Nyní je již jednoznačně doloženo, že takovýto průběh je způsoben nepřiměřenou zánětlivou reakcí, v níž dojde k přesmyku od obranného k poškozujícímu zánětu. Poškozující zánět je u těchto pacientů charakterizován zvýšenou aktivitou imunitního systému, kterou můžeme hodnotit ve složce buněčné i humorální. Bez podrobnějšího popisu zdůrazníme, že k rozvoji poškozujícího zánětu výrazně přispívá dezintegrace epitelových struktur plic samotným SARS 2 a rovněž nezvládnutou obrannou reakcí s výsledným uvolněním DAMPs, např. molekuly adenosintrifosfátu (ATP), fragmentů nukleových kyselin, nukleoproteinů, kalprotektinu. Ty jsou identifikovány prostřednictvím membránových i nitrobuněčných PRRs nacházejících se především v buňkách vrozené imunity, makrofágů a dendritických buněk. S odstupem jsou aktivovány i T lymfocyty, především funkčně polarizované do subsetů Th1 a Th17. Výsledkem je oživení nitrobuněčných signálních drah, které vede k aktivaci transkripčních faktorů (nukleární faktor kappa B, NFκB), jež po translokaci do jádra buňky stimulují přepis několika set genů kódujících prozánětlivé působky a regulujících aktivaci buňky. Ve zvýšené míře se tvoří pluripotentní prozánětlivé cytokiny, z nichž zdůrazníme IL 1β, tumor nekrotizující faktor alfa (TNFα), IL 12, IL 18, IFNγ, faktor stimulující granulocytární kolonie (G CSF), faktor stimulující granulocytární a makrofágové kolonie (GM CSF), IL 6 a chemokiny. Pluripotentní prozánětlivé cytokiny IL 1β a IL 18 jsou z latentních forem vytvářeny složitým multimolekulovým cytoplazmatickým komplexem označovaným jako inflamazom. Neregulovaná aktivace inflamazomu je příčinou buněčné smrti – pyroptózy. Pro ni je typické uvolnění prozánětlivých působků, které přispívají k rozvoji zánětlivé reakce.
Neregulovaná produkce prozánětlivých cytokinů, označovaná někdy jako tzv. cytokinová bouře, má dalekosáhlé negativní dopady nejen na imunitu, ale i na další tělní soustavy. Lokálně, především v plicích, zesiluje poškozující zánět. U nemocných s infekcí SARS 2 jsou popisovány pro virovou infekci nezvykle vysoké hodnoty C reaktivního proteinu (CRP) při normální koncentraci prokalcitoninu. Tyto biomarkery odrážejí přítomnost a intenzitu zánětu indukovaného vnitřním poškozením spojeným s uvolněním DAMPs, a ne s bakteriální infekcí.
U pacientů se SARS 2 dochází ke zvýšení hodnoty CRP v důsledku zvýšené koncentrace prozánětlivých cytokinů, především IL 6. Zvýšená lokální i systémová koncentrace prozánětlivých cytokinů vede k akumulaci buněčného substrátu zánětu. Způsobuje vazodilataci, edém a poškození kapilár. Časně v průběhu zánětlivé reakce indukované SARS 2 jsou prostřednictvím prozánětlivých cytokinů, a především chemokinů v plicní tkáni akumulovány a prozánětlivě polarizovány makrofágy. Následuje cílená migrace neutrofilních granulocytů. Neutrofilní granulocyty jsou zde lokálně aktivovány a ze svých cytoplazmatických granulí uvolňují biologicky aktivní látky včetně matrixových metaloproteináz. Ty způsobují rozklad mezibuněčné hmoty a přispívají k edému v intersticiální tkáni plic. V neutrofilních granulocytech je indukována programovaná buněčná smrt – NETóza (proces uvolnění neutrofilní extracelulární pasti, neutrophil extracellular traps, NETs). Fyziologickým cílem NETózy granulocytů je likvidace bakteriálních patogenů, které jsou zachyceny do sítě nukleových kyselin a histonů vymrštěných z neutrofilů v procesu NETózy. V případě infekce SARS 2 však NETóza neutrofilů sehrává negativní úlohu, protože nitrobuněčné struktury neutrofilů, které se dostávají vně buňky, se stávají výraznými DAMPs. Jejich přítomnost zesiluje poškozující zánět. Jsou důkazy, že SARS 2 přímo infikuje endotelové buňky cév a způsobuje jejich poškození s výslednou endotelitidou.
Podstatnou úlohu v poškozujícím zánětu indukovaném v plicní tkáni infekcí SARS 2 sehrávají také abnormálně aktivované trombocyty. Ty ze svých nitrobuněčných granulí a dalších struktur uvolňují biologicky aktivní látky, které se podílejí na poškození kapilárního systému plicní tkáně. Intenzitu poškozujícího zánětu v plicní tkáni zprostředkovaně reflektuje prohlubující se lymfopenie v krvi. Snížení počtu v populacích T a B lymfocytů a v jejich funkčních subsetech je disproporcionální a je podrobně popsáno [6].
Vše dohromady je odpovědné za patofyziologické procesy vedoucí k plicnímu selhání, jež je příčinou vážného klinického stavu, či dokonce smrti u nejtěžších pacientů infikovaných SARS 2. Nejvážnější průběh infekce SARS 2 je popisován u seniorů s různými komorbiditami a také u obézních osob s metabolickým syndromem. U těchto pacientů lze, bez ohledu na infekci SARS 2, stanovením biomarkerů doložit, že jsou v silně prozánětlivém nastavení. Poškozující zánět se podílí etiologicky na jejich základním onemocnění. Infekce SARS 2 do tohoto prozánětlivého fenotypu přidá další prozánětlivé aktivity, které vedou ke ztrátě homeostatických regulací a k přesmyku k poškozujícímu zánětu se všemi negativními důsledky. Smysluplnost této koncepce dokládají výsledky klinických studií, v nichž je pozitivně ovlivněn klinický průběh onemocnění aplikací biologik neutralizujících vybrané prozánětlivé cytokiny. Tento postup, s ohledem na cenu a složitost aplikace, nebude ve větší míře použitelný. Recentní výsledky, které doložily v klinické studii pozitivní efekt aplikace dexametazonu, však otvírají možnost aplikace protizánětlivých postupů v masovém měřítku [7].
Na konci letošního července byly zveřejněny výsledky klinické studie, které jasně prokázaly pozitivní účinek aplikace
rekombinantních interferonů beta na klinický průběh infekce SARS CoV 2. Rekombinantní interferony beta jsou již více než 20 let úspěšně používány v léčbě relabující remitující formy roztroušené sklerózy mozkomíšní. Zde modulačně působí na poškozující zánět. Podobně lze vysvětlit i působení rekombinantních interferonů beta u nemocných s infekcí SARS CoV 2. I zde budou převažovat imunomodulační účinky nad přímým protivirovým efektem [8].
Závěr
Pandemie virem SARS 2 není v historických souvislostech ničím neobvyklým. Infekce se v lidské populaci šířily a často měly přinejmenším lokálně charakteristiky pandemií. Máme historické i molekulárně biologické důkazy o šíření původce moru, Yersinia pestis, či původce syfilis. Z virových infekcí připomínáme virus chřipky, nověji virus zika a současný SARS 2. K přenosu přispívá kontakt lidí, dříve spojený pouze s dálkovým obchodem. Nyní, v rámci globalizace, je přenos těchto infekcí významně usnadněn. To, že se jedná o infekci, která je pro člověka „nová“, také není překvapivé. Představy, že pro člověka nejvýznamnější patogeny provázejí lidstvo od samého vzniku, jsou nesprávné. Brzy budeme „slavit“ 100. výročí vstupu viru lidského imunodeficitu ‒ HIV 1 ‒ do lidské populace. Infekce, které se rychle šíří v populaci, je možné kontrolovat pouze protiepidemickými opatřeními, jež zásadně ovlivňují život lidské společnosti. Vždy se tedy jedná o politické rozhodnutí, jak se bude postupovat. Krátkodobé, především ekonomické cíle mohou převážit a mohou se stát podklady pro nesprávná rozhodnutí s dalekosáhlými dopady na zdraví lidí. Tvrdá protiepidemická opatření jsou snáze prosazována ve společenských systémech, jež mají schopnost vnitřní koheze. V západní civilizaci postavené na tzv. osobních svobodách je jejich prosazování obtížnější a dlouhodobě stěží udržitelné. Bezprostřední řešení zdravotních dopadů SARS 2 je úspěšnější v zemích s výkonným a široce dostupným zdravotním systémem. I bohaté země, např. Spojené státy americké nebo Velká Británie, jejichž zdravotní systémy takto nejsou nastaveny, pandemii SARS nezvládají, jak lze doložit např. vysokým počtem mrtvých s nemocí COVID 19.
Kauzální léčba infekce SARS 2 zatím neexistuje. Je otázkou, zda je možné konstruovat účinnou vakcínu. Pokud ano, lze předpokládat, že protekce získaná očkováním bude v porovnání se stávajícími vakcínami nižší. Nelze zatím odhadnout, zda pomocí aktivní imunizace bude možné v lidské populaci infekci SARS 2 kontrolovat [9]. Mimořádnou pozornost bude zapotřebí věnovat rizikovým skupinám osob, tj. seniorům a chronicky nemocným lidem. To prověří naši vůli a ochotu chránit nejslabší články společnosti, které nejsou produktivní. Z uvedeného je zřejmé, že pandemie SARS 2 má nejen biomedicínský základ, ale implikuje i mnohé závažné společenské konsekvence.
Práce vznikla s podporou projektu UK LF HK PROGRES Q40/10.
Seznam použité literatury
- [1] Guo YR, Cao QD, Hong ZS, et al. The origin, transmission and clinical therapies on coronavirus disease 2019 (COVID‑19) outbreak – an update on the status. Military Med Res 2020; 7: 11.
- [2] Krejsek J, Andrýs C, Krčmová I. Imunologie člověka. Hradec Králové: Garamon, 2016. ISBN 978‑80‑86472‑74‑4; http://www.imunologie‑cloveka‑krejsek.cz.
- [3] Střížová Z, Milota T, Bartůňková J. Aktuální problematika COVID‑19 z pohledu imunologa. Čas Lék Čes 2020; 159: 67‒71.
- [4] Tay MZ, Poh ChM, Rénia L, et al. The trinity of COVID‑19: immunity, inflammation and intervention. Nature Rev 2020; 20: 363‒374.
- [5] Vabret N, Britton GJ, Gruber C, et al. Immunology of COVID‑19: current state of the science. Immunity 2020; 52: 910‒941.
- [6] Cossarizza A, de Biasi S, Guaraldi G, et al. SARS‑CoV‑2, the virus that causes COVID‑19: cytometry and the new challenge for global health. Cytometry Part A 2020; 97A: 340‒343.
- [7] Zabetakis I, Lordan R, Norton C, et al. COVID‑19: The inflammation link and the role of nutrition in potential mitigation. Nutrients 2020; 12: 1466.
- [8] Park A, Iwasaki A. Type I and type III interferons ‒ Induction, signaling, evasion, and application to combat COVID‑19. Cell Host Microbe 2020; 27: 870‒878.
- [9] Ma C, Su S, Wang J, et al. From SARS‑CoV to SARS‑CoV‑2: safety and broad‑spectrum are important for coronavirus vaccine development. Microbes Infect 2020; https://doi.org/10.1016/j.micinf.2020.05.004 [Epub ahead of print].