Imunoterapie v léčbě nádorových onemocnění
Souhrn:
Imunoterapie se dnes již stala uznávanou součástí komplexní onkologické léčby. Imunoterapie je buď antigenně nespecifická (různé stimulátory imunitního systému) nebo antigenně specifická (cílená různými mechanismy na nádorové struktury). Pokroky v základním výzkumu umožňují lépe porozumět interakcím mezi imunitním systémem a nádory na molekulární úrovni, což vede k postupům, které racionálně cílí na jednotlivé struktury nebo mechanismy důležité v karcinogenezi. V článku je podán přehled současných moderních imunoterapeutických přístupů, které jsou již schváleny nebo se dostávají do klinické praxe.
Key words: immune system, immune surveillance of tumours, immunotherapy.
Summary:
Immunotherapy already became an integral part of complex therapy in oncology. Immunotherapy can be both non antigen specific or antigen specific, targeting tumour antigens by various approaches. Progress in the basic research leads to better understanding of mechanisms of interaction between immune system and tumours. This allows us to target the structures or mechanisms involved in the process of carcinogenesis. In this review, we report a list of therapeutic agents which are already approved or are tested in clinical trials.
Úloha imunitního systému v obraně proti nádorům
Imunitní systém hraje významnou úlohu nejen v obraně proti infekcím, ale také v kontrole nádorového růstu. Antiinfekční a protinádorová obrana zahrnuje velmi podobné mechanismy. Strukturní podobnost nádorových buněk s buňkami normálními a celá řada mechanismů úniku nádorově změněné buňky imunitním mechanismům jsou hlavními příčinami toho, že imunitní reakce na nádorové buňky je obecně slabší než na cizorodé antigeny infekčních původců. K pokroku v oblasti imunoterapie došlo především díky porozumění molekulárním interakcím nádorových buněk s imunitním systémem. Vznik nádorového onemocnění je mnohastupňový proces, v němž samotné nádorové buňky představují velmi heterogenní populaci v mikroprostředí nenádorových buněk a tkání – cév, mezibuněčné hmoty, infiltrujících imunitních buněk – a tvoří tak složitý nádorový „ekosystém“. Imunitní systém kontroluje růst nádorových buněk zejména v raných stadiích karcinogeneze i v pozdějším stadiu preneoplazie. S pokročilým růstem nádoru mohou být imunitní mechanismy paralyzovány, a naopak mohou proliferaci nádorových buněk podporovat. Překonat tyto mechanismy na různých úrovních se snaží současné léčebné postupy v onkologii, včetně imunoterapie.
Strategie úniku nádorových buněk kontrole imunitního systému
Nádorové buňky disponují celou řadou strategií, s jejichž pomocí dokáží uniknout kontrole imunitního systému [1]. Řada z nich vykazuje analogii s principy únikových mechanismů infekčních agens. Z mnohých uveďme jako příklad vysokou variabilitu struktur nádorových buněk a vznik mutantních forem, které příslušný nádorový antigen ztratily nebo pozměnily. Stejně tak nízká hustota exprese nádorových antigenů může vést k tomu, že neoplastické buňky jsou složkami imunitního systému přehlíženy – ignorovány. Dalším mechanismem, který zabraňuje rozpoznání nádorových buněk imunitním systémem, je snížená exprese molekul HLA (human leukocyte antigen) I. třídy. Produkcí cytokinů potlačujících protinádorovou imunitní reakci, jako je transformující růstový faktor beta (transforming growth factor beta, TGFβ) a interleukin 10 (IL 10), dochází k přímé inhibici maturace dendritických buněk či k inhibici efektorových T lymfocytů. Některé nádorové buňky exprimují na svém povrchu apoptotický receptor známý jako FasL (ligand Fas). Pomocí této molekuly pak mohou indukovat v protinádorových T lymfocytech apoptózu. Interakce mezi Fas a FasL má však pravděpodobně komplexní důsledky a za určitých okolností může vést jak k potenciaci nádorového růstu, tak k jeho inhibici. Nedostatečnou produkcí kostimulačních molekul dochází k anergii (ztrátě nebo omezení reaktivity) T lymfocytů a změnou v signalizační apoptotické dráze také k inhibici indukce apoptózy. Zvýšenou expresí inhibičních molekul, jako je CTLA 4 (cytotoxic T lymphocyte associated antigen 4, cytotoxický antigen asociovaný s T lymfocyty) nebo PD 1 (programmed cell death 1, membránový protein programované buněčné smrti) na T lymfocytech, dochází k zastavení aktivace T lymfocytů a k jejich anergizaci, což je fyziologický mechanismus předcházející autoimunitnímu poškození. Nádorové mikroprostředí však může indukovat nadměrnou expresi těchto inhibičních molekul, čímž se zabraňuje cytotoxickému působení T lymfocytů na nádorovou buňku. Odolnost nádorových buněk vůči efektorovým mechanismům imunitního systému vede nejen k úniku nádorů z imunitního dohledu, ale může také výrazně ovlivnit účinnost imunoterapie.
Principy imunoterapie nádorových onemocnění
Existuje celá řada postupů, jak využít imunitní systém v boji proti nádorům. Obecně se tyto postupy dají rozdělit na antigenně nespecifické a antigenně specifické.
Antigenně nespecifické mechanismy
Obecný mechanismus nespecifické stimulace spočívá v podpoře základních funkcí imunitního systému nezávisle na specifitě nádorového antigenu. Mezi nespecifické imunostimulační metody, které se v klinické praxi používají již řadu let, patří např. aplikace cytokinů (IL 2 v léčbě renálního karcinomu, interferon alfa u některých hematologických malignit), nespecifická stimulace zánětu (použití BCG vakcíny lokálně u karcinomu močového měchýře), aplikace různých imunostimulačních látek, nejčastěji mikrobiálního původu (bakteriální lyzáty, glukany apod.) [2–4].
Vzhledem ke složitosti mechanismů protinádorové imunity hrozí však při použití těchto postupů nebezpečí aktivace např. tlumivých složek imunity, a tím naopak podpora růstu nádorů. Další limitací terapeutického využití zejména cytokinů je jejich toxicita v protinádorově účinné dávce a nevýhodná farmakokinetika. Tuto nevýhodu se snaží obejít tzv. imunocytokiny, což jsou fúzní proteiny mezi protilátkou a cytokinem. V klinickém zkoušení jsou imunocytokiny obsahující IL 2, tumor nekrotizující faktor (TNF) nebo IL 12 nebo samotný IL 15, který je méně toxický než obdobně působící IL 2 [5]. Dále se zkoušejí látky působící aktivaci dendritických buněk, zejména analoga toll like receptorů (např. CpG).
Antigenně specifické mechanismy
Nejčastějším klinickým využitím tohoto mechanismu je aplikace monoklonálních protilátek cílených proti některým nádorovým antigenům. Příkladem je trastuzumab, monoklonální protilátka proti antigenu Her 2 Neu exprimovanému na některých epiteliálních nádorech, např. na karcinomu prsu, nebo rituximab, monoklonální protilátka proti antigenu CD20 B lymfocytů používaná v léčbě malignit z řady B. Tyto postupy eliminují populace buněk nesoucích příslušný antigen.
Další postupy zahrnují např. expanzi nádorově specifických lymfocytů ex vivo, obvykle získaných přímo z nádoru jako tzv. TIL (tumor infiltrující lymfocyty). Imunizace samotnou nádorovou buňkou nebo nádorovým antigenem je obvykle neúčinná a vyžaduje účinné adjuvans. Běžná adjuvancia používaná v antiinfekčních vakcínách však nejsou příliš účinná, neboť ta indukují zejména protilátkovou odpověď proti příslušnému antigenu. Řada protinádorových vakcín obsahujících nádorové peptidy se sice dostala i do III. fáze klinických zkoušek, ale zatím žádná z nich neprokázala účinnost.
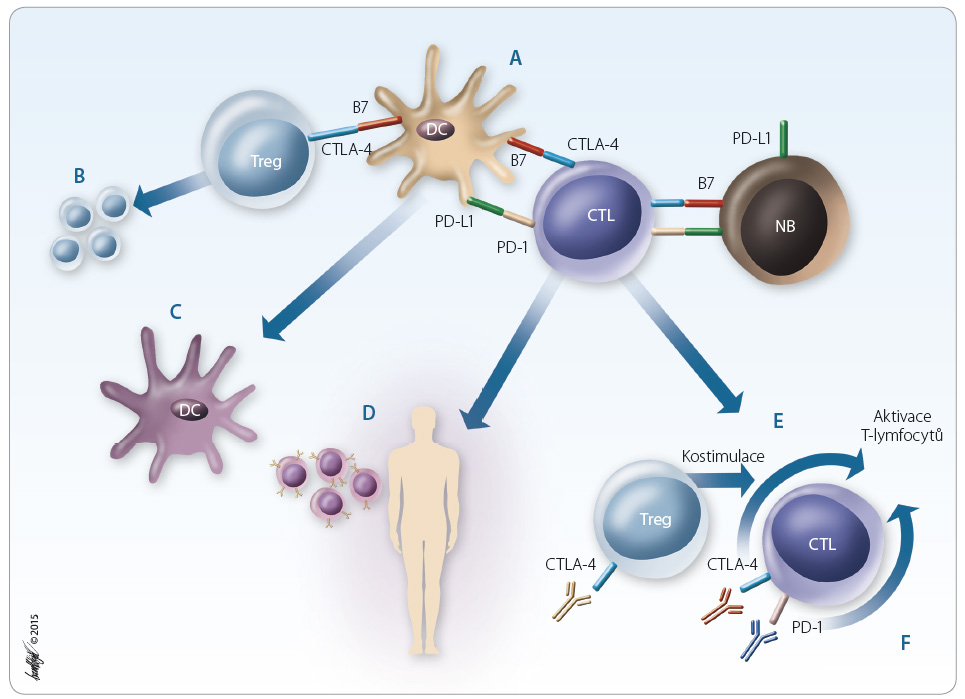
Vzhledem k nutnosti stimulace především buněčných složek imunity se pozornost v posledních letech zaměřila na využití dendritických buněk v imunoterapii nádorů. Velmi zjednodušeně řečeno, dendritické buňky fungují jako určité „adjuvans“, které zajistí rozpoznání nádorové buňky, její zpracování a prezentaci T lymfocytům (princip imunoterapie dendritickými buňkami viz dále). Základní možnosti využití mechanismů protinádorové imunity k imunoterapii na různých úrovních jsou uvedeny níže v rámci přehledu imunoterapeutických přípravků, obr. 1.
Přehled imunoterapeutických přípravků
Vakcíny na bázi virových vektorů
Nejdále v klinickém zkoušení je přípravek PROSTVAC®. Jde o terapeutickou vakcínu určenou k léčbě karcinomu prostaty založenou na rekombinantních atenuovaných virech neštovic (vakcinie) a ptačích neštovic (fowlpox). Tyto viry slouží jako vektory, které exprimují gen pro prostatický specifický antigen (PSA) a tři kostimulační molekuly – B7.1, ICAM 1 a LFA 3. Mechanismus účinku by měl spočívat v tom, že buňky pacienta jsou po nitrosvalové aplikaci infikovány tímto modifikovaným virem a stanou se vhodnými buňkami prezentujícími antigen, které budou exprimovat jak kostimulační molekuly, tak zároveň nádorový antigen PSA. Vzhledem k tomu, že proti buňkám infikovaným viry se vyvíjí cytotoxická reakce T buněk, předpokládá se, že se indukují cytotoxické T lymfocyty, které posléze mohou lyzovat buňky exprimující PSA, tedy nádorové buňky karcinomu prostaty. Použití dvou antigenně odlišných vektorů pro první a následné imunizace by mělo omezit riziko, že dojde ke snížené účinnosti vakcíny v důsledku tvorby neutralizačních protilátek navozených imunizací virem vakcinie. Tomuto postupu se říká heterologní prime/boost strategie. Přípravek PROSTVAC® prošel v posledních deseti letech rozsáhlými studiemi fáze II a byl ověřován u různých stadií karcinomu prostaty i v různých kombinacích [6]. Na základě povzbudivých výsledků studií fáze II byla v listopadu 2011 zahájena studie fáze III u 1 200 pacientů s minimálně symptomatickým kastračně rezistentním karcinomem prostaty.
Přípravky buněčné imunoterapie
Sipuleucel T je dosud jediným imunoterapeutickým přípravkem schváleným americkým úřadem FDA (Food and Drug Administration) pro léčbu pacientů s minimálně symptomatickým metastatickým kastračně rezistentním karcinomem prostaty (metastatic castration resistant prostate cancer, mCRPC), který prodloužil v klinických studiích fáze III medián přežití z 21,7 na 25,8 měsíce, tedy o 1,2 měsíce více než chemoterapie docetaxelem [7]. Tento přípravek vyráběný z autologních buněk pacienta získaných leukaferézou obsahuje aktivované monocyty, které jsou aktivovány fúzním proteinem GM CSF (granulocyte macrophage colony stimulating factor, faktor stimulující kolonie granulocytů a makrofágů) s prostatickou kyselou fosfatázou (prostatic acid phosphatase, PAP). Kromě aktivovaných monocytů obsahuje přípravek i další imunitní buňky periferní krve pacienta. Pacient podstupuje leukaferézu celkem třikrát v odstupu dvou týdnů a přípravek je pacientovi aplikován intravenózně zpět čerstvý, nezamražený.
Aktivní buněčná imunoterapie na bázi dendritických buněk
Dendritické buňky se vyznačují schopností indukovat primární imunitní odpověď prostřednictvím aktivace naivních T lymfocytů. Optimalizace metod pro pří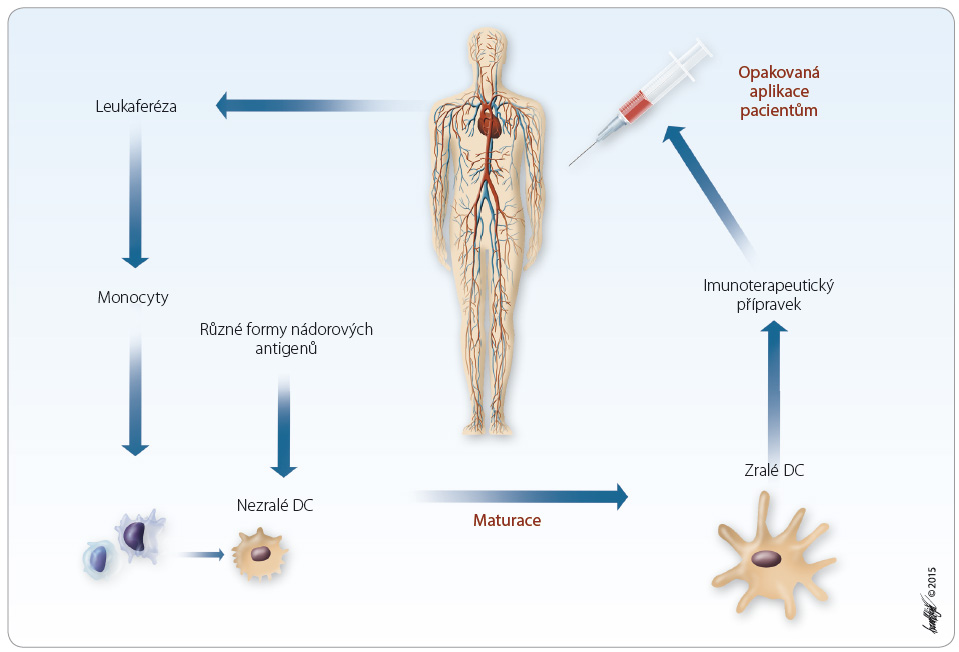 pravu dendritických buněk in vitro přispěly k jejich využití v léčbě nádorových onemocnění [8]. Podstata metody spočívá v ex vivo kultivaci monocytů periferní krve, které byly od pacientů získány v průběhu leukaferézy. Z monocytů se pak v laboratoři připraví nezralé dendritické buňky. V dalším kroku jsou dendritické buňky kultivovány společně s nádorovými antigeny (buď definovanými peptidy, mRNA, apoptotickými buňkami nebo lyzáty). Po pohlcení nádorových antigenů jsou dendritické buňky následně aktivovány, maturovány a poté jako protinádorová vakcína podány zpět pacientovi, obr. 2. Různé výzkumné skupiny nebo biotechnologické firmy se ve výrobním postupu liší a obvykle jsou tyto postupy patentově chráněny.
pravu dendritických buněk in vitro přispěly k jejich využití v léčbě nádorových onemocnění [8]. Podstata metody spočívá v ex vivo kultivaci monocytů periferní krve, které byly od pacientů získány v průběhu leukaferézy. Z monocytů se pak v laboratoři připraví nezralé dendritické buňky. V dalším kroku jsou dendritické buňky kultivovány společně s nádorovými antigeny (buď definovanými peptidy, mRNA, apoptotickými buňkami nebo lyzáty). Po pohlcení nádorových antigenů jsou dendritické buňky následně aktivovány, maturovány a poté jako protinádorová vakcína podány zpět pacientovi, obr. 2. Různé výzkumné skupiny nebo biotechnologické firmy se ve výrobním postupu liší a obvykle jsou tyto postupy patentově chráněny.
Ve většině dosud provedených studií s dendritickými buňkami došlo k laboratorně detekovatelné indukci protinádorové imunitní odpovědi s omezenou klinickou účinností. Zásadním problémem provedených studií je, že do nich byli zahrnuti pacienti ve velmi pokročilých stadiích onemocnění, u kterých byl imunitní systém poškozen jak chemoterapií, tak imunosupresivními mechanismy nádorové tkáně. Hodnocené protinádorové vakcíny s dendritickými buňkami vykazují minimální vedlejší účinky nebo působí bez vedlejších účinků.
Do fáze III postoupil český přípravek DCVAC, který byl vyvinut v Ústavu imunologie 2. LF UK a FN v Motole v Praze [9]. Další vývoj a klinické zkoušení převzala biotechnologická společnost, která podporuje uskutečnění pěti klinických studií fáze II a mezinárodní klinické studie fáze III. Přípravek se testuje jak v monoterapii u pacientů v raných stadiích onemocnění karcinomem prostaty, tak v pokročilejších stadiích rakoviny ve spojení s dalšími léčebnými přístupy (jako je např. kombinovaná terapie s docetaxelem a hormonální terapie u pacientů s karcinomem prostaty, s gemcitabinem a carboplatinou u pacientek s karcinomem ovaria a u pacientů s karcinomem plic).
Adoptivní buněčná terapie T lymfocyty s chimérickým antigenním receptorem
Chimérický antigenní receptor (chimeric antigen receptor, CAR) je rekombinantní T buněčný receptor připravený fúzí části T buněčného receptoru a monoklonální protilátky cílené proti zvolenému povrchovému antigenu. Zabudování CAR (obvykle pomocí lentivirových vektorů) do T lymfocytu vede k vytvoření tzv. CAR T lymfocytů. Velmi důležitý je přitom fakt, že CAR ke své aktivaci nevyžaduje vazbu nádorového antigenu na molekuly hlavního histokompatibilního komplexu. Terapie pomocí CAR T lymfocytů představuje moderní verzi adoptivního buněčného přenosu (adoptive cellular transfer, ACT) a v současnosti se postupně etabluje mezi nadějné imunoterapeutické postupy a rozšiřuje tak portfolio léčebných možností [10].
Metoda umožňuje aktivaci a expanzi protinádorově specifických lymfocytů ex vivo a jejich následné podání. Preklinické, ale i klinické experimenty ukázaly, že účinek terapie lze zvýšit lymfodeplečními režimy před podáním T lymfocytů a současnou aplikací IL 2. Chimérické konstrukty jsou experimentálně využívány zejména u hematologických malignit, např. v léčbě akutní a chronické lymfoidní leukemie nebo folikulárního lymfomu. K zacílení maligních B lymfocytů je využíváno CAR modifikovaných T lymfocytů proti B buněčnému antigenu CD19.
V červenci 2014 udělil FDA status Breakthrough Therapy Designation experimentálnímu léku CTL019 na základě průběžných výsledků studie fáze I/II, v níž 90 % pacientů (27 ze 30) s diagnózou akutní lymfoblastické leukemie dosáhlo kompletní remise. Tento přístup přináší velice slibné výsledky, i když za cenu velké toxicity. V průběhu terapie dochází totiž k tzv. syndromu z uvolnění cytokinů (cytokine release syndrome), který vyžaduje terapii kortikosteroidy. Probíhají klinické testy s použitím nejnovější třetí generace CAR. V poslední době jeví o tuto technologii zájem i velké farmaceutické firmy, přestože nejde o masově vyráběné léčivo, ale jedná se o individuální, tzv. boutique terapii.
Pasivní imunizace zaměřená na blokádu inhibičních molekul
Při studiu základních mechanismů imunitní reakce se staly terčem pozornosti molekuly, které se objevují na cytotoxických T lymfocytech po aktivaci a které slouží k regulaci imunitní reakce, aby se předešlo autoimunitnímu poškození. Jde zejména o molekuly CTLA 4, PD 1 a PD L1,2 (programmed cell death ligand 1,2). Označují se obvykle jako „check point inhibitory“. V nádorovém mikroprostředí dochází často k akumulaci tzv. regulačních T lymfocytů exprimujících tyto molekuly. Regulační T lymfocyty tlumí protinádorovou imunitní odpověď. Zablokování jejich aktivity monoklonálními protilátkami pak vede k převaze aktivity cytotoxických lymfocytů, které se tak mohou déle uplatňovat v protinádorové imunitní reakci.
Terapie anti CTLA 4
Ipilimumab je plně humánní monoklonální protilátka IgG1, která se selektivně váže na antigen CTLA 4 nacházející se na povrchu T lymfocytů. CTLA 4 je klíčovým negativním regulátorem adaptivní imunitní odpovědi. Jeho zablokování vede „k odbrždění“ imunitní protinádorové odpovědi, k delší a silnější aktivaci T lymfocytů a v ideálním případě k napadení a destrukci nádorové tkáně cytotoxickými T lymfocyty. Ipilimumab, schválený FDA v srpnu 2011, v monoterapii nebo v kombinaci s chemoterapií (dacarbazin) dokázal signifikantně prodloužit přežití ve dvou randomizovaných klinických studiích fáze III, a to jak u předléčených‚ tak u nepředléčených pacientů s pokročilým melanomem. Dlouhodobá data ukazují, že při léčbě ipilimumabem přežívá po třech letech kolem čtvrtiny pacientů s metastazujícím melanomem. Od tohoto bodu riziko úmrtí prudce klesá a po sedmi letech je téměř nulové [11,12].
Recentní data z metaanalýzy s téměř 5 000 pacienty ukazují, že se tříleté přežití pohybuje kolem 21 %, což bylo v době podávání samotné chemoterapie nebo kombinace chemoterapie s interferonem alfa a/nebo s IL 2 neobvyklé. Křivky přežití ukazují, že po třech letech dochází k fázi plateau [13]. Ipilimumab se dále podává ve studiích fáze II i fáze III u pacientů s různými typy nádorů (kromě melanomu i u karcinomu prostaty, ledvin, plic). Nevýhodou ipilimumabu jsou jeho závažné nežádoucí účinky vyplývající z mechanismu jeho účinku – prodloužení aktivity cytotoxických lymfocytů, nejen protinádorových, ale i jiných specificit včetně lymfocytů reagujících s autoantigeny. Právě stimulace efektorových T lymfocytů může vyvolávat imunitně zprostředkované nežádoucí účinky, které se označují jako irAEs (immune related Adverse Events). Typické nežádoucí účinky se mohou projevit jako autoimunitní poškození – enteritidy provázené průjmy, kožní exantém s pruritem či vitiligo, endokrinopatie (thyreoiditida, hypofyzitida) či hepatotoxicita. Frekvence a intenzita výskytu nežádoucích účinků potom souvisí s dávkou ipilimumabu. Ke zvládnutí nežádoucích účinků byl vytvořen algoritmus pro jejich diagnostiku a léčbu. Ten zahrnuje především včasnou aplikaci vysokých dávek kortikosteroidů následovaných u endokrinopatií obvykle celoživotní příslušnou hormonální substitucí.
Terapie anti PD 1/PD L1,2
V současné době se jako velmi perspektivní jeví monoklonální protilátky namířené proti inhibiční molekule PD 1 na T lymfocytech – nivolumab a pembrolizumab – nebo proti jejímu ligandu PD L1,2 na nádorových buňkách – přípravky označené jako MPDL3280A a MEDI4736. Protilátky anti PD 1 vykazují výrazný protinádorový účinek u pacientů s pokročilými solidními nádory, včetně nemalobuněčného karcinomu plic, karcinomu ledviny či maligního melanomu.
Nivolumab je plně humánní monoklonální protilátka IgG4, která inhibuje PD 1, což je jeden z kontrolních bodů (tzv. check pointů) protinádorové imunitní reakce, který nádorovým buňkám umožňuje vyhnout se detekci T lymfocyty. V rámci terapie anti PD 1 se o nivolumabu hovoří jako o léku roku 2013. V dřívějších studiích prokázala monoterapie nivolumabem u předléčených pacientů s pokročilým melanomem významnou klinickou aktivitu se zvládnutelnými nežádoucími účinky a velmi slibným celkovým přežitím – kolem 63 % pacientů přežívalo jeden rok, dva roky jich přežilo 48 % a začala se tvořit pro tuto léčbu typická fáze plateau – po třech letech žilo ještě 41 % nemocných [14].
Tento pozitivní výsledek se odrazil i v nedávném vývoji terapie anti PD 1. V červnu 2014 došlo k předčasnému zastavení jiné studie fáze III, která porovnávala nivolumab a chemoterapii s dacarbazinem v první linii léčby pacientů s pokročilým melanomem BRAF tzv. divokého typu (wild type). Interim analýza dat ukázala, že rozdíl v celkovém přežití byl tak evidentní, že by nebylo etické pacienty dále léčit chemoterapií. I nemocní z kontrolní skupiny tedy byli převedeni na léčbu nivolumabem. U nemalobuněčného karcinomu plic probíhají tři studie fáze III zkoumající nivolumab v monoterapii ve srovnání s chemoterapií u již předléčených pacientů a jedna studie fáze III u pacientů chemonaivních.
Vzhledem k očekávané potenciaci protinádorového účinku nových molekul je nivolumab zároveň zkoumán v kombinaci s ipilimumabem u melanomu, metastatického renálního karcinomu, karcinomu tlustého střeva, mnohočetného myelomu a glioblastomu [15].
Pembrolizumab je humanizovaná monoklonální protilátka, která je též namířena proti inhibiční molekule PD 1 na T lymfocytech. Pembrolizumab obdržel v září 2014 od FDA status schválení v režimu „accelerated approval“ v indikaci neresekovatelného pokročilého maligního melanomu u pacientů, u nichž selhala terapie první linie. Pembrolizumab se dále zkouší u pacientů s pokročilým nemalobuněčným karcinomem plic ve studiích ověřujících různá dávkovací schémata, která srovnávají jeho účinnost se standardní chemoterapií [16].
Další z terapeutických protilátek je zaměřena proti proteinovému ligandu anti PD L1 a je označována jako MPDL3280A. I tato protilátka vykazuje zřetelný protinádorový účinek u pacientů s pokročilými solidními nádory. V květnu 2014 udělil FDA tomuto léku statut Breakthrough Therapy Designation, což umožní jeho rychlejší postup schvalovacím řízením [17]. V rámci hledání tzv. biomarkerů – faktorů predikujících léčebnou odpověď na zahájenou terapii anti PD L1 – je zajímavý fakt, že klinická účinnost nesouvisí s úrovní exprese PD L1 v primární nádorové tkáni [18].
Závěr
Imunoterapie se stává součástí komplexní léčby u řady nádorových chorob. Probíhající klinické studie hledají odpovědi na otázky spojené s optimálním načasováním imunoterapie, vhodností terapeutických kombinací a identifikací pacientů, kteří budou mít z dané léčby největší přínos. Moderní léčba s sebou zároveň přináší nové typy klinických reakcí, odlišné od těch, které vídáme při klasické chemoterapii, a nové typy nežádoucích účinků. Většina imunologických přípravků je finančně velmi nákladná, proto do budoucna budou hrát velkou roli farmakoekonomická hlediska. Pro jednotlivé pacienty pak bude třeba vždy na základě dostupných poznatků léčbu individualizovat.
Tato práce byla podpořena granty IGA MZČR NT 11559 5, IGA MZČR NT 12402 5 a MZ ČR – RVO, FN Motol 00064203.
Seznam použité literatury
- [1] Igney FH, Kramer PH. Immune escape of tumors: apoptosis resistance and tumor counterattack. J Leukoc Biol 2002; 6: 907–920.
- [2] Rosenberg SA, Lotze MT, Muul LM, et al. A progress report on the treatment of 157 patients with advanced cancer using lymphokine activated killer cells and interleukin 2 or high dose interleukin 2 alone. N Engl J Med 1987; 15: 889–897.
- [3] Medical Research Council Renal Cancer Collaborators. Interferon α and survival in metastatic renal carcinoma: early results of a randomised controlled trial. Lancet 1999; 353: 14–17.
- [4] Morales A, Eidinger D, Bruce AW. Intracavitary Bacillus Calmette Guerin in the treatment of superficial bladder tumors. J Urol 1976; 2: 180–183.
- [5] List T, Neri D. Immunocytokines: a review of molecules in clinical development for cancer therapy. Clin Pharmacol 2013; 5 (Suppl 1): 29–45.
- [6] Kantoff PW, Schuetz TJ, Blumenstein BA, et al. Overall Survival Analysis of a Phase II Randomized Controlled Trial of a Poxviral Based PSA Targeted Immunotherapy in Metastatic Castration Resistant Prostate Cancer. J Clin Oncol 2010; 28: 1099–1105.
- [7] Kantoff PW, Higano CS, Shore ND, et al. Sipuleucel T Immunotherapy for Castration-Resistant Prostate Cancer. N Engl J Med 2010; 5: 411–422.
- [8] Vachelli E, Vitale I, Eggermont A, Trial watch: Dendritic cell based interventions for cancer therapy. Oncoimmunology 2013; 2: e25771.
- [9] Fucikova J, Rozkova D, Ulcova H, et al. Poly I: C activated dendritic cells that were generated in CellGro for use in cancer immunotherapy trials. J Transl Med 2011; 30: 223.
- [10] Maude SL, Frey N, Shaw PA, et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. N Engl J Med 2014; 16: 1507–1517.
- [11] Hodi FS, O´Day SJ, McDermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010; 8: 711–723.
- [12] Robert C, Thomas L, Bondarenko I, et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med 2011; 26: 2517–2526.
- [13] Schadendorf D, Hodi FS, Robert C, et al. Pooled analysis of long term survival data from phase II and phase III trials of ipilimumab in metastatic or locally advanced, unresectable melanoma. Presented at ESMO, September 27 October 1, 2013, Abstract number LBA24.
- [14] Topalian SL, Sznol M, McDermott DF, et al. Survival, durable tumor remission, and long term safety in patients with advanced melanoma receiving nivolumab. J Clin Oncol 2014; 10: 1020–1030.
- [15] Robert C, Ribas A, Wolchok JD, et al. Anti programmed death receptor 1 treatment with pembrolizumab in ipilimumab refractory advanced melanoma: a randomised dose comparison cohort of a phase 1 trial. Lancet 2014; 9948: 1109–1117.
- [16] Garon EB, Gandhi L, Rizvi N, et al. Antitumor activity of pembrolizumab (Pembro; MK 3475) and correlation with programmed death ligand 1 (PD L1) expression in a pooled analysis of patients with advanced NSCLC. Presented at ESMO 2014: September 26–30, 2014. Abstract number LBA43.
- [17] Powles T, Vogelzang NJ, Fine GD, et al. Inhibition of PD L1 by MPDL3280A leads to clinical activity in pts with metastatic urothelial bladder cancer (UBC). Presented at ASCO Congress, May 31, 2014, Abstract number 5011.
- [18] Mahoney KM, Atkins MB. Prognostic and predictive markers for the new immunotherapies. Oncology 2014; 28 (11 Suppl 3): pii: 202335.