Imunoterapie v léčbě nemalobuněčného karcinomu plic
Souhrn:
Imunoterapie se stává vedle chirurgie, chemoterapie a radioterapie další standardní možností protinádorové léčby, a to i v terapii nemalobuněčného karcinomu plic. Odrazovým můstkem v rozvoji imunoterapie se stal objev kontrolních bodů imunitní reakce. Nádorové buňky jsou schopné uniknout kontrole lymfocytů tím, že si dokáží efektivní imunitní odpověď na úrovni těchto kontrolních bodů vypnout. Jedním z těchto mechanismů je interakce proteinu programované buněčné smrti – PD‑1 – na povrchu imunitních buněk s ligandem PDL‑1 exprimovaným nádorovou buňkou. Novými léčivy schopnými vázat se na PD‑1 a tím blokovat vypnutí lymfocytů jsou protilátky nivolumab a pembrolizumab.
Key words: immunotherapy – non-small cell lung cancer – immune checkpoints – nivolumab – pembrolizumab.
Summary:
Together with surgery, chemotherapy, and radiotherapy, the immunotherapy is being increasingly used as another standard treatment option in cancer management, including the treatment for non-small cell lung cancer. The development of immunotherapy was made possible by discovery of immune checkpoints. Neoplastic cell are able to escape the immune surveillance carried out by lymphocytes in a manner they can shut down the immune response at the level of immune checkpoints. One of these mechanisms is an interaction between programmed cell death protein 1 (PD-1) located on the surface of immune cells with PD-1 ligand expressed by neoplastic cells. Anti-PD-1 antibodies nivolumab, and pembrolizumab are examples of a new drugs targeting PD-1 and thus preventing the immune response to be shutted down.
Úvod
Imunoterapie se vedle chirurgické léčby, chemoterapie a radioterapie pomalu stává další standardní možností léčby nádorových onemocnění. Necílí přímo na vlastní zhoubný karcinom, ale posílením vlastní protinádorové imunity vede k tomu, že je tělo schopno likvidovat nádor samo. Pro pochopení pochodů, s nimiž se v imunoterapii karcinomů setkáváme, je vhodné si na začátku osvěžit některé informace o fungování imunitního systému jako takového.
Homeostatická funkce imunitního systému
Základní funkcí imunitního systému je trvalá snaha o zachování integrity organismu na základě rozlišování „vlastního od cizího“ (vlastní toleruje a cizí se snaží eliminovat), přičemž uvedené rozpoznává na základě makromolekulární, resp. antigenní podobnosti či odlišnosti. Tato makromolekulární identita jedince je představována především molekulami hlavního histokompatibilního komplexu (major histocompatibility complex, MHC; u lidí jsou geny pro MHC označovány jako HLA – lidský leukocytární antigen, human leukocyte antigen). Molekuly MHC I. třídy jsou prezentovány na povrchu všech jaderných buněk v těle, molekuly MHC II. třídy pak především na povrchu tzv. antigen prezentujících buněk (antigen presenting cells, APC). Všechny bílkoviny, resp. fragmenty bílkovin ‒ ať již pocházejí z tělu vlastních, nebo z exogenních buněk ‒ jsou imunitním systémem permanentně porovnávány s tzv. self MHC bílkovinami. Pokud nevybočují z identity MHC, jsou imunologickým systémem tolerovány, v opačném případě (např. vlastní buňky odcizené v důsledku stáří, mutace či kancerogeneze, nebo cizí buňky transplantované či mikrobiální) spouštějí různé formy komplexní imunitní odpovědi.
Imunitní funkce jsou realizovány humorálními a buněčnými složkami fylogeneticky starší imunity nespecifické (vrozené, neadaptivní) a také složkami imunity specifické (získané, adaptivní). Toto dělení je do jisté míry umělé, didaktické – oba systémy se vzájemně prolínají a jejich hranice jsou neostré. Klasickým příkladem nespecifické humorální imunity je např. lysozym ve slinách, příkladem buněčné nespecifické imunity pak neutrofilní granulocyty angažující se při řadě mikrobiálních infekcí a tvořící hlavní složku hnisu. Klasickým příkladem specifické humorální imunity jsou specifické protilátky vůči difterickému jedu, příkladem buněčné imunity pak imunita protituberkulózní. V zásadě však každá imunitní odpověď na „cizí“ zahrnuje složky všechny, pouze v odpovědi vůči různým noxám převažuje ta či ona forma (např. i u protituberkulózní odpovědi jsou produkovány specifické protilátky a uplatňují se rovněž buněčné a humorální mechanismy imunity nespecifické).
V oblasti antitumorózní imunity hrají dle dnešních znalostí rozhodující roli buněčné formy imunitní odpovědi, kde vedle nespecifické složky realizované tzv. NK buňkami je klíčová úloha přisuzována vzájemné kooperaci (T) lymfocytů s makrofágy, resp. APC.
Antigen prezentující buňky a lymfocyty
Mezi APC patří monocyty, makrofágy (tkáňové monocyty) a dendritické buňky. Antigen prezentující buňky jsou schopné na svém povrchu předkládat fragmenty z „pozřelých“ buněk (spolu s antigeny MHC) dalším složkám imunitního systému, zvláště T lymfocytům, které svými receptory permanentně porovnávají jejich vzájemnou shodu či neshodu.
Makrofágy pocházejí z monocytů. Jejich základem je hematopoetická zárodečná buňka. Ve tkáňový makrofág se přeměňuje monocyt tehdy, pokud je usazen v tkáni. V různých tkáních nesou makrofágy různé názvy ‒ představují buňky kůže (histiocyty), buňky jaterních sinů (Kupfferovy buňky), mikroglie v tkáních CNS, osteoklasty v kostech. Jedná se o fagocytující buňky (tzv. velké požírače) pohlcující především tělu vlastní buňky odumřelé v důsledku apoptózy. Tím se účastní zejména obrany proti intracelulárním patogenům, jež mění charakteristiky nebo způsobují smrt hostitelských buněk. Makrofágy, stejně jako dendritické buňky, předkládají dále antigen lymfocytům. Naopak neutrofily (mikrofágy) schopnost předkládat antigen nemají, zato mají schopnost být plně aktivními ihned, bez nutnosti další stimulace. Makrofágy potřebují ke své plné aktivitě zpětnou kostimulaci z lymfocytů (těmito stimulujícími faktory jsou cytokiny, interferon gama [IFNγ], tumor nekrotizující faktor alfa [TNFα]).
Dendritické buňky mají
rovněž původ v hematopoetické zárodečné buňce. Jde
o specifické bílé krvinky vyskytující se s relativně
malou četností zejména v tkáních (kůži, sliznicích
dýchacího a zažívacího traktu). Jsou schopné fagocytovat
odpad z buněk, části bakterií, virů, nádorových buněk,
ale i jiný materiál. Dendritické buňky se dělí na zralé
a nezralé. Zralé dendritické buňky jsou schopné aktivovat
T lymfocyty. Nezralé působí naopak tlumivě a také
zvyšují počet regulačních T lymfocytů a zabraňují tak
rozvoji autoimunitních onemocnění. Zralé dendritické buňky
přestávají fagocytovat (tedy „krmit se“), opouštějí tkáně
a vydávají se do lymfatických uzlin. Zde exprimují mezi
výběžky MHC I. a II. třídy úlomky (peptidové
antigeny) bakterií, virů, nádorových buněk atp. a tím
aktivují do té doby naivní cytotoxické a pomocné T
lymfocyty (obr. 1).
B lymfocyty jsou schopné rozpoznat antigen v nativní
formě přímo, pomocí molekul specifických imunoglobulinů na svém
povrchu, kdežto T lymfocyty potřebují antigen fragmentovat
a předložit prostřednictvím APC.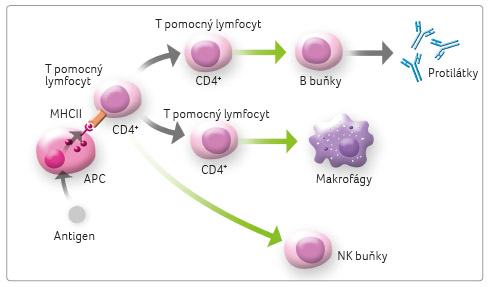
T lymfocyty jsou schopné reagovat na určité nádorové antigeny (podobně jako na antigeny infekčních agens), identifikovat je jako tělu cizí, a spustit tak specifickou antitumorózní komplexní imunitní odpověď, která vyústí v likvidaci nádorové buňky.
Antitumorózní imunita
Antitumorózně zaměřená imunitní reakce začíná internalizací tumorózního antigenu v APC a jeho následným předložením na MHC. Tato prezentace antigenu spouští expresi B7.1 a B7.2 (kostimulačních molekul, které aktivují T lymfocyty) a vyzrálé APC následně migrují do lymfatických uzlin a předkládají antigen neaktivním lymfocytům pomocí antigen specifických receptorů na povrchu T lymfocytů. Díky interakci mezi B7.1, B7.2 a CD28 na povrchu lymfocytů dochází k aktivaci T lymfocytů, které následně opouštějí lymfatické uzliny. Pokud lymfocyt přichází do kontaktu s nádorovou buňkou nesoucí na svém povrchu antigen v asociaci s MHC, začne lymfocyt uvolňovat cytolytické enzymy (perforin a granzym) a také cytokiny atrahující další imunitní buňky, a rovněž začne svou vlastní proliferaci. Výsledkem je destrukce nádorové buňky a vznik paměťových T lymfocytů. Takto funguje nejen antitumorózní imunita, ale rovněž obrana proti virům.
Historie imunoterapie u karcinomu plic
Karcinom plic nepatří mezi typické imunogenní nádory. Studie s BCG vakcínou, interleukinem 2 či s interferonem neprokázaly efekt. Přesto se v poslední době začala objevovat relevantní data dokládající, že určitý význam imunitních buněk ve vztahu ke karcinomu plic nelze přehlížet. Například stromální infiltrace karcinomu plic lymfocyty a také predominance CD8+ lymfocytů představuje u časných stadií karcinomu plic nezávislý prediktivní faktor delšího přežití [1,2]. Na druhé straně infiltrace regulačními (tj. supresorovými) T lymfocyty představuje sníženou antitumorózní aktivitu a je známkou rekurence tumoru [3,4]. Z těchto poznatků pak vyplynul předpoklad, že by manipulace imunitní odpovědi měla vést k ovlivnění vývoje karcinomu plic. Velkým zklamáním byly studie s protinádorovými vakcínami ‒ negativní byla studie s tecemotidem [5] a belagenpumatucelem L [6], ale i rozsáhlá adjuvantní studie s protilátkou proti antigenu MAGE A3 (MAGRIT) [7].
Imunoterapie jako nová léčebná modalita v onkologii
Odrazovým můstkem v rozvoji imunoterapie se stal objev kontrolních bodů imunitní reakce. Jedná se o molekuly na povrchu T lymfocytů, které kontrolují proliferaci lymfocytů a jejich destrukční aktivitu.
Jednou z těchto molekul je CTLA 4, cytotoxický T lymfocytární antigen 4, který se vyskytuje na povrchu lymfoidních buněk. Jde o negativní regulátor interakce APC a T lymfocytů. Molekula CTLA 4 reguluje časnou aktivitu T lymfocytů a je tzv. upregulována po kontaktu s nádorovým antigenem, soutěží s CD28 o vazbu na B7.1 a B7.2 a má mnohem vyšší afinitu. Výsledkem je negativní signál pro T lymfocyty a blokáda kostimulačního signálu pocházejícího z interakce B7.1 a B7.2 s CD28, jež je nutná pro aktivaci T lymfocytů.
Další významnou molekulou je PD 1, protein programované buněčné smrti. Je exprimován na povrchu aktivovaných B a T lymfocytů a je známkou „vyčerpanosti“ těchto buněk. Nádorová buňka pak exprimuje na svém povrchu ligandy (PD L1 a PD L2), které jsou díky vazbě na receptor PD 1 schopny tzv. vypnout aktivní T lymfocyt. Zpětná reakce probíhá cestou PD L1, jenž inhibuje apoptózu nádorové buňky. Na rozdíl od CTLA 4, kdy se jedná o interakci mezi imunitními buňkami, probíhá interakce mezi PD 1 a PD L1 či PD L2 mezi lymfocytem a nádorovou buňkou. Předpokládá se, že za indukci produkce PD L1 je zodpovědný zánět v tumorózním mikroprostředí mediovaný IFNγ. Dalším možným mechanismem je onkogenem řízená exprese PD L1, tedy bez vlivu zánětu. Molekula PD L1 se rovněž může vázat na B7.1. Zajímavé je, že PD 1, ale i PD L1 se mohou vyskytovat i na povrchu jiných imunitních buněk ‒ zde může mít blokování interakce variabilní efekt.
Protilátky proti PD 1 a PD L1 u nemalobuněčného karcinomu plic
Mezi léky schválené v České republice Státním ústavem pro kontrolu léčiv (SÚKL) pro terapii nemalobuněčného karcinomu plic (non-small cell lung cancer, NSCLC) jsou zařazeny protilátky proti PD 1. Prvním registrovaným přípravkem byl nivolumab, později následovaný pembrolizumabem.
Nivolumab je plně humanizovaná IgG4 monoklonální protilátka proti PD 1. Jeho efektivita byla prokázána v řadě studií nejen u NSCLC, ale i u melanomu, karcinomu ledviny, karcinomu hlavy a krku, glioblastomu a u non Hodgkinova lymfomu. U předléčených skvamózních NSCLC (Sq NSCLC) dosahuje míra odpovědí na léčbu (response rate, RR) 20 %, u neskvamózních (Nsq NSCLC) PD 1 pozitivních NSCLC pak 30‒40 %. Naproti tomu chemoterapie v druhé linii terapie dosahuje odpovědi na léčbu v 5‒10 %. Podání nivolumabu je intravenózní, 3 mg/kg v infuzi po dobu 60 minut každé dva týdny. Léčba se podává do progrese onemocnění nebo do projevů nepřijatelné toxicity.
U Sq NSCLC byl dle registrační studie CheckMate 017 [8] medián celkového přežití (overall survival, OS) 9,2 měsíce (95% interval spolehlivosti [CI] 7,3‒13,3) ve skupině s nivolumabem oproti 6,0 měsíce (95% CI 5,1‒7,3) ve skupině s docetaxelem. Riziko úmrtí bylo o 41 % nižší ve skupině s nivolumabem ve srovnání se skupinou s docetaxelem (statisticky signifikantně, p < 0,001). Po jednom roce přežívalo ve skupině s nivolumabem 42 % nemocných, ve skupině s docetaxelem 21 % nemocných. Exprese PD L1 nebyla u Sq NSCLC ani prognostickým, ani prediktivním faktorem efektu léčby nivolumabem. Podíl nežádoucích účinků stupně 3‒4 byl ve skupině s nivolumabem 7 %, ve skupině s docetaxelem 55 %. Výskyt zmírnění příznaků souvisejících s onemocněním měřený pomocí indexu LCSS (Lung Cancer Symptom Scale) byl mezi skupinami s nivolumabem (18,5 %) a docetaxelem (21,2 %) obdobný. Pokračující účinek nivolumabu byl prokázán i po dvou letech léčby (data prezentovaná na konferenci ASCO 2016), kdy ve skupině s nivolumabem přežívalo 23 % pacientů a ve skupině s docetaxelem 8 % nemocných [9].
Publikovaná data u Nsq NSCLC
[10] dokládají medián celkového přežití 12,2 měsíce
(95% CI 9,7‒15,0) ve skupině s nivolumabem oproti 9,5
měsíce ve skupině s docetaxelem (95% CI 8,1‒10,7).
Riziko úmrtí bylo o 27 % nižší ve skupině
s nivolumabem ve srovnání se skupinou s docetaxelem
(statisticky signifikantně, p = 0,002).
Exprese PD L1 je u Nsq NSCLC prediktorem odpovědi
na léčbu i přežití. U exprese PD L1
nádorovými buňkami ve více než 1 % je míra odpovědi
na léčbu udávaná v procentech vyšší – 30,9 %
(u exprese PD L1 > 50 % je RR 40,9 %) ‒
a 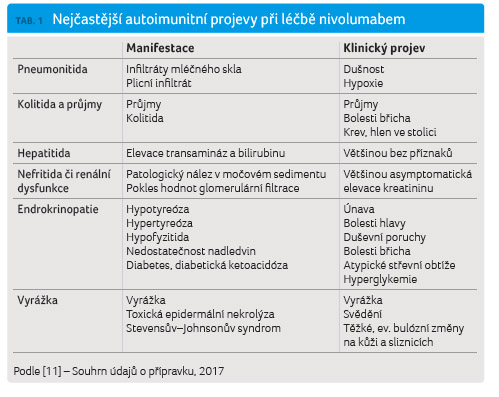 je rovněž doloženo delší přežití. U nemocných
s Nsq NSCLC tumory s nízkou nebo nulovou expresí
PD L1 je hodnota RR při léčbě nivolumabem nižší než při
léčbě docetaxelem a přežití je srovnatelné s docetaxelem.
Také u Nsq NSCLC jsou k dispozici již data
dvouletého přežívání; ve skupině s nivolumabem
přežívalo po dvou letech 29 % a ve skupině
s docetaxelem 16 % pacientů [6].
je rovněž doloženo delší přežití. U nemocných
s Nsq NSCLC tumory s nízkou nebo nulovou expresí
PD L1 je hodnota RR při léčbě nivolumabem nižší než při
léčbě docetaxelem a přežití je srovnatelné s docetaxelem.
Také u Nsq NSCLC jsou k dispozici již data
dvouletého přežívání; ve skupině s nivolumabem
přežívalo po dvou letech 29 % a ve skupině
s docetaxelem 16 % pacientů [6].
Protože přínos imunoterapie
u odpovídajících pacientů bývá dlouhodobý, je u těchto
nemocných obzvlášť důležitý včasný management případných
nežádoucích účinků. Přehled nežádoucích účinků a jejich
doporučenou léčbu shrnují tabulky 1
a 2. Zajímavé
je, že většina úmrtí při terapii nivolumabem nastává
v prvních třech měsících. Z následné komplexní
analýzy vyplynulo, že nemocní s agresivními tumory a horší
prognózou a nižší (méně než 50 %) či nulovou
pozitivitou PD L1 mají vyšší riziko úmrtí v prvních
třech měsících [11]. Dalším důležitým poznatkem je, že
nemocní, kteří jsou nositeli aktivační genové mutace EGFR, ALK
či nekuřáci, mají z léčby nivolumabem menší prospěch,
resp. není doložena statisticky významná preference nivolumabu
před docetaxelem. Nicméně jde o nízká čísla, nelze tedy
z těchto výsledků vyvozovat jednoznačné závěry.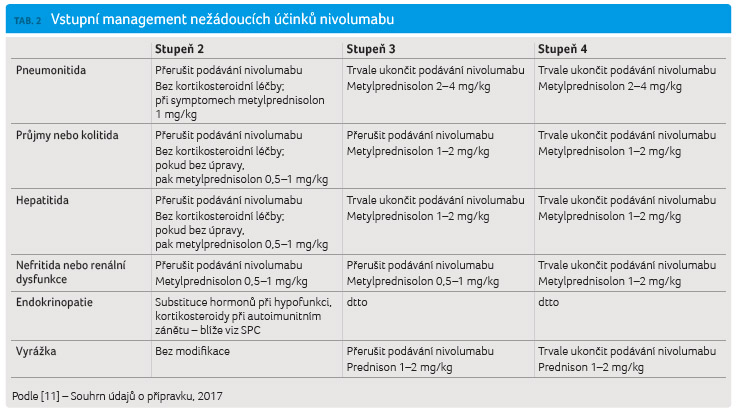
Z literatury je rovněž známo, že karcinomy silných kuřáků mají větší mutační load (zatížení), a tím i větší antigenicitu, tedy schopnost indukovat imunitní odpověď. Pomocí definovaného relativně malého setu genů prostřednictvím metody sekvenování příští generace (next generation sequencing) můžeme vytipovat právě tyto karcinomy s vysokou mutační náloží [12].
Pembrolizumab je humanizovaná monoklonální protilátka IgG4 proti receptoru programované buněčné smrti PD 1. Přípravek je u nás schválen v indikaci NSCLC a melanom. Registrační studií pro NSCLC je KEYNOTE 010 [13]. Byla testována dávka pembrolizumabu 2 mg/kg a 10 mg/kg každé tři týdny oproti docetaxelu ve standardním dávkování. Efekt léčby byl vázán na procento exprese PD L1. Celkem 66 % nemocných mělo expresi PD L1 (skóre nádorového podílu, tumor proportion score, TPS) vyšší než 1 %. Obě dávkování prokázala superioritu nad docetaxelem, a to ve skupině s expresí PD L1 vyšší než 1 % stejně jako ve skupině s expresí PD L1 převyšující 50 %. Míra odpovědi na léčbu se pohybovala mezi 18‒30 %, kdy vyššího RR bylo dosaženo ve skupině s vyšší expresí PD L1. Naopak se procento odpovědi na léčbu nelišilo mezi nižší či vyšší dávkou pembrolizumabu.
Ve skupině s expresí PD L1 vyšší než 1 % bylo dosaženo následujících výsledků: medián přežití v případě dávkování 2 mg/kg činil 10,4 měsíce (95% CI 9,4‒11,9), ve skupině s pembrolizumabem 10 mg/kg byl medián přežití 12,7 měsíce (95% CI 10,0‒17,3). Ve skupině s docetaxelem byl medián přežití 8,5 měsíce (95% CI 7,5‒9,8). Rozdíly v přežití byly statisticky signifikantní (p = 0,0008, resp. p = 0,0001).
Ve skupině s expresí PD L1 vyšší než 50 % byly výsledky ještě slibnější. Medián přežití u dávkování 2 mg/kg činil 14,9 měsíce (95% CI 10,4‒NR; NR = nebylo dosaženo), ve skupině s pembrolizumabem 10 mg/kg byl medián přežití 17,3 měsíce (95% CI 10,8‒NR). Ve skupině s léčbou docetaxelem byl medián přežití 8,2 měsíce (95% CI 6,4‒10,7). Rozdíly v přežití byly statisticky signifikantní (p = 0,0002, resp. p = 0,0001).
U pembrolizumabu podobně jako u nivolumabu je zaznamenáván nižší přínos z léčby u nemocných s aktivačními mutacemi a u nekuřáků. I zde jde ovšem o nízká čísla. Na rozdíl od nivolumabu není u pembrolizumabu doloženo statisticky signifikantní prodloužení přežití u nemocných se Sq NSCLC, což může být ale mimo jiné dáno nízkými počty pacientů (nemocní se Sq NSCLC tvořili jen přibližně 20 %).
Dalšími léky jsou protilátky anti PD L1. Atezolizumab už obdržel schválení Úřadu pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) a na schválení SÚKL zatím čeká. Dalšími přípravky jsou durvalumab a BMS 936559.
Prediktor léčby anti PD 1 a anti PD L1
Problémem do budoucna spojeným
s léčbou anti-PD 1 a anti-PD L1 je hledání
ideálního prediktoru účinnosti léčby. V současné době
se užívá imunohistochemické stanovení exprese PD L1 v tumoru
(TPS; obr. 2). Není
problém zhodnotit tumor s vysokou pozitivitou či tumor
negativní. Problémem jsou tumory se středním TPS a dále
fakt, že u jednoho tumoru může být v jednom místě TPS
vysoká a jinde minimální či eventuálně i nulová.
Pokud se tedy jedná jen o malý histologický vzorek, záleží
na tom, ze kterého místa byl odebrán. Ideální je proto
odebrání optimální velikosti histologického vzorku, jež je
ovšem v reálné praxi nedosažitelné. Vzorky, které lze při
bronchoskopickém odběru získat, jsou často malé a nezřídka
také zhmožděné. Navíc může být exprese PD L1 v tumoru
ovlivněna protinádorovou léčbou, proto je pro její stanove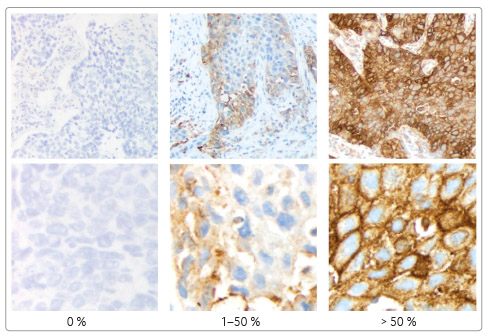 ní
důležité použít co nejrecentnější biopsii [14].
ní
důležité použít co nejrecentnější biopsii [14].
Budoucnost imunoonkologie
V rámci oboru již proběhly studie s podáním imunoterapie jako léčby první linie. Studie CheckMate 026 srovnávala nivolumab u chemonaivních nemocných při běžném dávkování s TPS více než 1 % se standardním platinovým dubletem. Výsledky studie jsou však negativní [15]. Naopak pembrolizumab v první linii s TPS více než 50 % ve studii KEYNOTE 024 prokázal ve srovnání s platinovým dubletem statisticky signifikantně vyšší RR, 45 % vs. 28 %, delší čas bez progrese onemocnění (PFS 10 měsíců vs. 6 měsíců) i delší OS (HR 0,60, 95% CI 0,41‒0,89) [16].
Probíhají rovněž studie, kdy je imunoterapeutikum přidáváno ke standardní chemoterapii, k tyrozinkinázovým inhibitorům, nebo je kombinováno více imunoterapeutik mezi sebou (např. nivolumab a ipilimumab – protilátka anti CTLA 4).
Další vývoj imunoterapie v protinádorové léčbě se týká též hledání spolehlivějšího prediktivního markeru pro účinek terapie anti PD 1 a anti PD L1. Studovanými markery jsou PD L2 (ligand 2 receptoru programované buněčné smrti), IFNγ a genomický profil tumoru.
Závěr
Myšlenka využití imunitního systému v boji proti nádorové chorobě je relativně stará, nyní však prožívá svou renesanci a tento trend se týká i nemalobuněčného karcinomu plic. Nové léčebné přístupy jsou již v reálné praxi využívány a dále se vyvíjejí. Imunoterapie je vedle léčby cílené další velmi slibnou kapitolou terapie karcinomů plic. Změní osud podstatné části pacientů s tímto onemocněním, ale konečné řešení problému patrně také nepřinese.
Seznam použité literatury
- [1] Al‑Shibli KI, Donnem T, Al‑Saad S, et al. Prognostic effect of epithelial and stromal lymphocyte infiltration in non‑small cell lung cancer. Clin Cancer Res 2008; 14: 5220–5227.
- [2] Kawai O, Ishii G, Kubota K, et al. Predominant infiltration of macrophages and CD8+ T cells in cancer nests is a significant predictor of survival in stage IV non‑small cell lung cancer. Cancer 2008; 113: 1387–1395.
- [3] Petersen RP, Campa MJ, Sperlazza J, et al. Tumor infiltrating Foxp3+ regulatory T‑cells are associated with recurrence in pathologic stage I NSCLC patients. Cancer 2006; 107: 2866–2872.
- [4] Shimizu K, Nakata M, Hirami Y, et al. Tumor‑infiltrating Foxp3+ regulatory T cells are correlated with cyclooxygenase‑2 expression and are associated with recurrence in resected non‑small cell lung cancer. J Thorac Oncol 2010; 5: 585–590.
- [5] Butts C, Socinski MA, Mitchell PL, et al. Tecemotide (L‑BLP25) versus placebo after chemoradiotherapy for stage III non‑small‑cell lung cancer (START): a randomised, double‑blind, phase 3 trial. Lancet Oncol 2014; 15: 59–68.
- [6] Giaccone G, Bazhenova LA, Nemunaitis J, et al. A phase III study of belagenpumatucel‑L, an allogeneic tumour cell vaccine, as maintenance therapy for non‑small cell lung cancer. Eur J Cancer 2015; 51: 2321–2329.
- [7] Vansteenkiste JF, Cho BC, Vanakesa T, et al. Efficacy of the MAGE‑A3 cancer immunotherapeutic as adjuvant therapy in patients with resected MAGE‑A3‑positive non‑small‑cell lung cancer (MAGRIT): a randomised, double‑blind, placebo‑controlled, phase 3 trial. Lancet Oncol 2016; 17: 822–835.
- [8] Brahmer JR, Reckamp KL, Baas P, et al. Nivolumab versus docetaxel in advanced squamous‑cell non‑small‑cell lung cancer. N Engl J Med 2015; 373: 123–135.
- [9] Borghaei H, Brahmer J, Horn L, et al. Nivolumab (nivo) vs docetaxel (doc) in patients (pts) with advanced NSCLC: CheckMate 017/057 2‑y update and exploratory cytokine profile analyses. J Clin Oncol 2016; 34 (Suppl): 9025 (Abstr).
- [10] Borghaei H, Paz‑Ares L, Horn L, et al. Nivolumab versus docetaxel in advanced nonsquamous non‑small‑cell lung cancer. N Engl J Med 2015; 373: 1627–1639.
- [11] Opdivo (nivolumab, Souhrn údajů o přípravku. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/003985/WC500189765.pdf [navštíveno dne 12. 1. 2017]
- [12] Roszik J, Haydu LE, Hess KR. Novel algorithmic approach predicts tumor mutation load and correlates with immunotherapy clinical outcomes using a defined gene mutation set. BMC Med 2016; 14: 168.
- [13] Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD‑L1‑positive, advanced non‑small‑cell lung cancer (KEYNOTE‑010): a randomised controlled trial. Lancet 2015; 387: 1540–1550.
- [14] Sheng J, Fang W, Yu J, et al. Expression of programmed death ligand‑1 on tumor cells varies pre and post chemotherapy in non‑small cell lung cancer. Scientific Reports 2016; 6: 20090.
- [15] Socinski M, Creelan B, Horn L, Reck M. CheckMate 026: A phase 3 trial of nivolumab vs investigator’s choice (IC) of platinum‑based doublet chemotherapy (PT‑DC) as first‑line therapy for stage iv/recurrent programmed death ligand 1 (PD‑L1)‑positive NSCLC. ESMO 2016; LBA7.
- [16] Reck M, Rodríguez‑Abreu D, Robinson AG, et al. Pembrolizumab versus chemotherapy for PD‑L1‑positive non‑small‑cell lung cancer. N Engl J Med 2016; 375: 1823–1833.