Indikace ranibizumabu v oftalmologii
Intravitreální aplikace ranibizumabu, rekombinantní humanizované monoklonální protilátky blokující VEGF-A (Vascular Endothelial Growth Factor A), je účinnou léčbou vlhké formy věkem podmíněné makulární degenerace, makulárního otoku při okluzi sítnicových žil a diabetického makulárního edému. Blokáda VEGF-A vede k ovlivnění propustnosti sítnicových a choroidálních cév, angiogeneze a proliferace choroidálních cév, produkce cytokinů a k ovlivnění zánětlivé odpovědi. Rozšířené použití ranibizumabu zajišťuje i dobrý
bezpečnostní profil léku, který je charakterizován minimálními lokálními i celkovými nežádoucími účinky i při nutnosti opakovaného
intravitreálního podávání léku.
Úvod
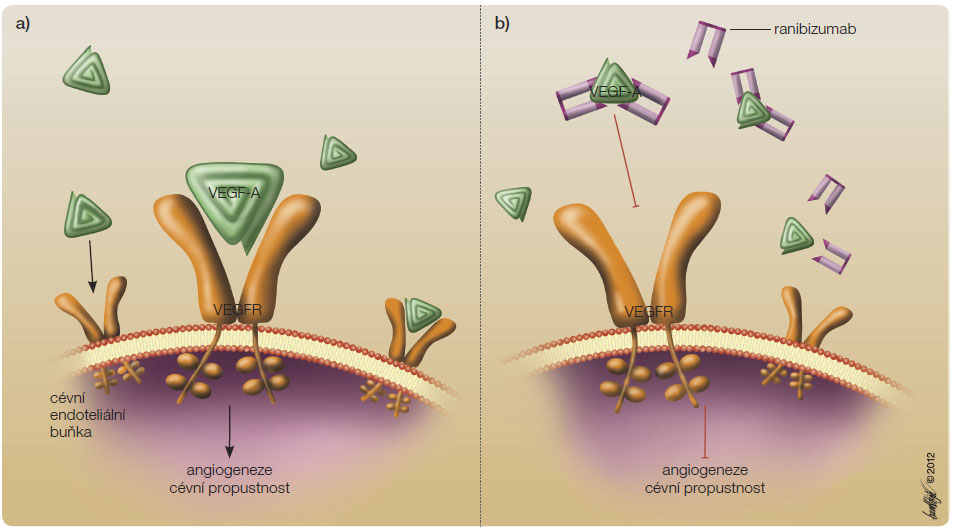 Ranibizumab je rekombinantní humanizovaná monoklonální protilátka o velikosti 48 kDa zaměřená proti všem izoformám VEGF-A – cévního endoteliálního růstového faktoru (vascular endothelial growth factor A). VEGF je homodimerický glykoprotein s monomery postavenými proti sobě. Dosud je známo šest podtypů VEGF, a to VEGF-A, -B, -C, -D, -E a P1GF (placenta growth factor). VEGF-A se váže na povrch endoteliálních buněk přes receptory VEGFR1 a VEGFR2, jeho zvýšená tvorba byla zjištěna v buňkách retinálního pigmentového epitelu (RPE) již v počínajících stadiích věkem podmíněné makulární degenerace (VPMD) a zvýšená koncentrace byla prokázána také v extrahovaných choroidálních neovaskulárních membránách (CNV) a ve sklivci u pacientů s VPMD [1]. Byla prokázána také u pacientů s diabetickým makulárním edémem (DME) a s otokem po žilní sítnicové okluzi [2, 3]. Zvýšená vazba VEGF na endoteliální buňky vede k angiogenezi, lymfangiogenezi a produkci cytokinů a proteáz (IL -2, granulocyte macrophage colony stimulating factor) [4]. VEGF-A hraje roli ve vývoji i udržení funkce cévního řečiště. Zvyšuje cévní propustnost [5–7], účastní se inhibice trombogeneze [8], zvyšuje produkci cytokinů, inhibuje apoptózu a má prozánětlivý efekt [5] (obr. 1).
Ranibizumab je rekombinantní humanizovaná monoklonální protilátka o velikosti 48 kDa zaměřená proti všem izoformám VEGF-A – cévního endoteliálního růstového faktoru (vascular endothelial growth factor A). VEGF je homodimerický glykoprotein s monomery postavenými proti sobě. Dosud je známo šest podtypů VEGF, a to VEGF-A, -B, -C, -D, -E a P1GF (placenta growth factor). VEGF-A se váže na povrch endoteliálních buněk přes receptory VEGFR1 a VEGFR2, jeho zvýšená tvorba byla zjištěna v buňkách retinálního pigmentového epitelu (RPE) již v počínajících stadiích věkem podmíněné makulární degenerace (VPMD) a zvýšená koncentrace byla prokázána také v extrahovaných choroidálních neovaskulárních membránách (CNV) a ve sklivci u pacientů s VPMD [1]. Byla prokázána také u pacientů s diabetickým makulárním edémem (DME) a s otokem po žilní sítnicové okluzi [2, 3]. Zvýšená vazba VEGF na endoteliální buňky vede k angiogenezi, lymfangiogenezi a produkci cytokinů a proteáz (IL -2, granulocyte macrophage colony stimulating factor) [4]. VEGF-A hraje roli ve vývoji i udržení funkce cévního řečiště. Zvyšuje cévní propustnost [5–7], účastní se inhibice trombogeneze [8], zvyšuje produkci cytokinů, inhibuje apoptózu a má prozánětlivý efekt [5] (obr. 1).
U člověka se VEGF-A vyskytuje v několika izoformách: VEGF-A121, VEGF-A145,VEGF-A165,
VEGF-A189 a VEGF-A206. Izoformami nejčastěji se vyskytujícími v lidském oku jsou VEGF-A121
a VEGF-A165 [9–11]. Ranibizumab svou vazbou na molekulu VEGF-A brání účinku cévního endoteliálního růstového f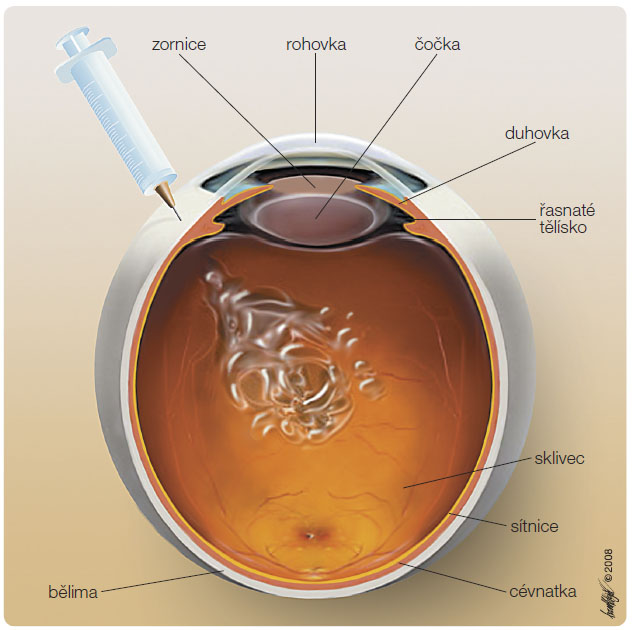 aktoru na své receptory na endoteliálních buňkách choroidálních neovaskulárních membrán a sítnicových cév. Malá velikost jeho molekuly umožňuje po intravitreální aplikaci snadnou prostupnost přes sítnici k cílové CNV a sítnicovým cévám (obr. 2). Jeho další výhodou je krátký plazmatický poločas, což vede k rychlému odbourávání látky z organismu. Účinnost a bezpečnost ranibizumabu jsou ověřeny několikaletým výzkumem. Největší zkušenosti jsou s léčbou vlhké formy VPMD, prokázaný je také účinek u DME a otoku u sítnicových žilních okluzí.
aktoru na své receptory na endoteliálních buňkách choroidálních neovaskulárních membrán a sítnicových cév. Malá velikost jeho molekuly umožňuje po intravitreální aplikaci snadnou prostupnost přes sítnici k cílové CNV a sítnicovým cévám (obr. 2). Jeho další výhodou je krátký plazmatický poločas, což vede k rychlému odbourávání látky z organismu. Účinnost a bezpečnost ranibizumabu jsou ověřeny několikaletým výzkumem. Největší zkušenosti jsou s léčbou vlhké formy VPMD, prokázaný je také účinek u DME a otoku u sítnicových žilních okluzí.
Seznam často citovaných zkratek
VEGF – cévní endoteliální růstový faktor, VPMD – věkem podmíněné makulární degenerace, CNV – choroidální neovaskularizace, DME – diabetický makulární edém, NKZO – nejlépe korigovaná zraková ostrost, ETDRS optotyp – standardizovaný optotyp pro určování zrakové ostrosti, PDT – fotodynamická terapie, OCT – optická koherenční tomografie, CRT – centrální retinální tloušťka, FAG – fluorescenční angiografie
Ranibizumab v léčbě vlhké formy VPMD
VPMD je degenerativní onemocnění s maximem změn v makule. Je nejčastější příčinou praktické slepoty populace starší 65 let ve vyspělých zemích [12]. U většiny pacientů nacházíme pomalu se rozvíjející „suchou“ atrofickou formu VPMD, ale asi v 10 % se vyvine rychle postupující „vlhká“ forma s CNV [13–16], která je v 80–90 % příčinou praktické slepoty [16].
Základními klinickými studiemi ke zjištění účinnosti a bezpečnosti ranibizumabu jsou MARINA a ANCHOR. Studiemi, které ověřují jeho účinnost při různých způsobech dávkování, jsou PIER, EXCITE, SUSTAIN, SAILOR a PrONTO. Efektivitu léčby ranibizumabem v kombinaci s PDT zjišťují studie FOCUS, PROTECT a program SUMMIT, který zahrnuje studie DENALI a MONT BLANC.
V klinické studii The Minimally Classic/Occult Trial of the Anti-VEGF-Antibody Ranibizumab in the Treatment of Neovascular Age-Related Macular Degeneration (MARINA) byla zjištěna u pacientů s minimálně klasickou CNV nebo okultní CNV u VPMD při měsíční aplikaci 0,5 mg ranibizumabu intravitreálně během dvou let ztráta nejlépe korigované zrakové ostrosti (NKZO) o méně než 15 písmen ETDRS optotypů u 90 % pacientů ve srovnání s 52,9 % neléčených pacientů. Statisticky významné zlepšení NKZO o 15 a více písmen bylo zjištěno u 33,3 % očí ve srovnání s 3,8 % u skupiny s placebem. Výskyt endoftalmitidy byl zaznamenán ve skupině léčených 0,5 mg ranibizumabu ve třech případech. Během dvou let bylo zjištěno 4,6 % arteriálních tromboembolických příhod u pacientů léčených ranibizumabem ve srovnání s 3,8 % u pacientů neléčených [17, 18].
V klinické studii The Anti-VEGF-Antibody for the Treatment of Predominantly Classic Choroidal Neovascularization in Age-Related Macular Degeneration (ANCHOR), která trvala dva roky, byla porovnávána účinnost ranibizumabu v léčbě klasické CNV při VPMD ve srovnání s účinností fotodynamické terapie (PDT) s verteporfinem. Ve skupině léčených měsíční intravitreální injekcí 0,5 mg ranibizumabu bylo 96,4 % pacientů se zhoršením NKZO o méně než 15 písmen ETDRS optotypů za jeden rok ve srovnání s 64,3 % pacientů léčených PDT. NKZO se statisticky významně zlepšila o 15 a více písmen u 40,3 % pacientů léčených 0,5 mg ranibizumabu ve srovnání s 5,6 % léčených PDT. Ve skupině pacientů léčených ranibizumabem byl zaznamenán výskyt endoftalmitidy ve dvou případech a těžké uveitidy v jednom případě [19]. V obou studiích bylo po léčbě ranibizumabem prokázáno zmenšení centrální retinální tloušťky (CRT) na optické koherenční tomografii (OCT), snížení prosakování z CNV při fluorescenční angiografii (FAG) a zabránění růstu CNV.
Ve studii Efficacy and Safety of Ranibizumab in Patients With Subfoveal Choroidal Neovascularization (CNV) Secondary to Age-Related Macular Degeneration (EXCITE) byl zjišťován účinek a bezpečnost ranibizumabu podávaného v dávce 0,3 mg a 0,5 mg ve třech injekcích aplikovaných vždy po jednom měsíci a poté čtvrtletně ve srovnání s 0,3 mg ranibizumabu podávaného vždy jednou za měsíc po dobu jednoho roku. Ve skupině pacientů léčených 0,3 mg ranibizumabu čtvrtletně byl zjištěn zisk 4,9 písmene za 12 měsíců při snížení CRT o 96 µm, ve skupině léčených 0,5 mg čtvrtletně byl zjištěn zisk 3,8 písmene za 12 měsíců při snížení CRT o 105,6 µm a ve skupině léčených 0,3 mg měsíčně zisk 8,3 písmene při snížení CRT o 105,3 µm [20].
Study of Ranibizumab in Patients with Subfoveal Choroidal Neovascularization Secondary to Age-Related Macular Degeneration (SUSTAIN) byla nezaslepená, multicentrická studie, která zjišťovala účinnost a bezpečnost intravitreálně podávaného ranibizumabu u všech typů CNV při VPMD. Do studie byli zařazeni i pacienti, kterým byl podáván ranibizumab nebo PDT v rámci studie ANCHOR. Léčba byla zahájena úvodními třemi injekcemi po měsíci (loading phase), další injekce byla podána měsíčně při splnění předem daných kritérií v režimu dávkování „podle potřeby“ („pro re nata“, PRN). Při této léčbě bylo zjištěno zlepšení NKZO o 3,6 písmene za 12 měsíců při poklesu CRT o 91,5 µm a při průměrném počtu 5,7 injekce [21].
Studie Prospective Optical coherence tomography imaging of patients with Neovascular AMD Treated with intra-Ocular ranibizumab (PrONTO) byla dvouletá, nezaslepená, prospektivní studie, která zjišťovala účinnost a bezpečnost různého dávkování ranibizumabu s důrazem na hodnocení OCT. Ranibizumab 0,5 mg byl aplikován po úvodních třech měsíčních injekcích v režimu PRN. Pacienti měli měsíční kontroly včetně OCT, každé tři měsíce byla provedena FAG. Zlepšení o 3 a více řádků optotypů bylo po dvou letech zjištěno u 43 % pacientů při poklesu CRT v průměru o 215 µm a průměrném počtu 9,9 injekce za dva roky. Nebyl pozorován žádný oční ani systémový nežádoucí účinek léčby [22].
Kombinace léčby ranibizumabem a PDT s verteporfinem byla sledována v klinické dvouleté, multicentrické, randomizované studii RhuFab V2 Ocular Treatment Combining the Use of Visudyne to Evaluace Safety (FOCUS). Výsledky ukázaly dosažení lepší NKZO u pacientů, kteří podstoupili kombinovanou léčbu ranibizumabem a PDT s verteporfinem oproti pacientům, kteří byli léčeni pouze PDT s verteporfinem [23].
Klinická studie MONT BLANC porovnávala účinnost kombinované léčby a monoterapie s ranibizumabem při dávkování PRN. U obou skupin pacientů se zlepšila NKZO (ve skupině s kombinovanou léčbou o 2,5 písmene, ve skupině s monoterapií o 4,4 písmene) a zmenšila se CRT (o 115,3 µm, resp. 107,7 µm). Nebylo prokázáno snížení počtu aplikací ranibizumabu ve skupině s kombinovanou léčbou (4,9 injekce ranibizumabu ve skupině s kombinovanou léčbou a 5,2 injekce ranibizumabu ve skupině s monoterapií) [24].
Ranibizumab v léčbě DME
Diabetická retinopatie a DME jsou nejčastější komplikací cukrovky. Klinicky signifikantní DME postihuje 6 % až 10 % pacientů s cukrovkou a je spolu s diabetickou retinopatií nejčastější příčinou slepoty osob ve věku 20–74 let ve vyspělých průmyslových zemích [25]. V případě lehké neproliferativní diabetické retinopatie se vyskytuje až v 6 % a jeho výskyt se zvyšuje s progresí retinopatie. U proliferativní diabetické retinopatie se popisuje u 74 % nemocných. Prevalence edému narůstá s délkou onemocnění, s vyšší hladinou glykovaného hemoglobinu a s proteinurií [26].
Základními klinickými studiemi, které prokázaly účinnost ranibizumabu u DME, byla studie RESOLVE a RESTORE. Hlavním cílem studie RESOLVE bylo zjistit, zda je ranibizumab účinný u pacientů s DME. Ranibizumab byl podáván v režimu PRN, průměrně bylo nutno podat 10 injekcí za rok. V hodnocených skupinách s 0,5 mg a 0,3 mg ranibizumabu bylo zjištěno významné zlepšení NKZO ve srovnání s placebem, průměrný zisk byl 7,8 písmene. Také pokles CRT byl statisticky významný. Počet ani charakteristika závažných nežádoucích účinků nebyly odlišné mezi skupinou léčených ranibizumabem a skupinou s placebem [27].
Ve studii RESTORE bylo zjišťováno, zda je ranibizumab účinný v monoterapii, nebo v kombinaci s laserem ve srovnání s monoterapií laserem. Design studie byl podobný jako u studie RESOLVE, indikace laserového ošetření závisela na rozhodnutí jednotlivých zkoušejících. Při léčbě ranibizumabem, ať už v monoterapii, nebo v kombinaci s laserem, bylo dosaženo zlepšení NKZO o 3 a více řádků ETDRS optotypů ve 23 %. Průměrný zisk byl při monoterapii 6,8 písmene a při kombinované léčbě 6,4 písmene. Pokles CRT byl podobný v obou skupinách s ranibizumabem a byl významně vyšší než u pacientů léčených monoterapií laserem. Průměrný počet aplikací ranibizumabu, ať už v monoterapii, nebo při kombinaci s laserem, byl 7 injekcí za rok. V celé studii nebyla hlášena žádná endoftalmitida [28].
V klinické studii READ-2 byl při průměrném počtu 9,3 injekce ranibizumabu v monoterapii zjištěn zisk 7,7 písmene za 24 měsíců, při kombinované léčbě s laserem byl zjištěn zisk 6,8 písmene [29].
Ranibizumab v léčbě makulárního otoku při žilních sítnicových okluzích
Žilní sítnicové okluze jsou druhým nejčastějším cévním sítnicovým onemocněním po diabetické retinopatii. Podle místa cévního uzávěru se rozlišují dvě základní formy: kmenová okluze sítnicové žíly (KOSŽ) a větvová okluze sítnicové žíly (VOSŽ), která se vyskytuje častěji a tvoří asi 80 % všech sítnicových žilních okluzí. V roce 2008 bylo podle prevalence dostupných relevantních klinických studií vztažených na počet obyvatel postiženo okluzí sítnicové žíly 16,4 milionu obyvatel, z toho 13,9 milionu trpělo větvovou okluzí a 2,5 milionu kmenovou okluzí [30–32].
Účinek ranibizumabu v léčbě makulárního otoku u žilních sítnicových okluzí byl prokázán dvěma randomizovanými, multicentrickými, kontrolovanými klinickými studiemi. V klinické studii BRAVO (Ranibizumab for the treatment of macular edema following branch retinal vein occlusion) byl zjišťován efekt a bezpečnost 0,3 mg ranibizumabu a 0,5 mg ranibizumabu podávaného měsíčně intravitreálně pacientům s otokem makuly při VOSŽ ve srovnání s kontrolní skupinou bez léčby. Po šesti měsících léčby byl průměrný zisk 16,6 písmene ve skupině očí léčených 0,3 mg ranibizumabu a 18,3 písmene u léčených 0,5 mg ranibizumabu. Zlepšení zraku a pokles CRT byly maximální po první injekci v prvním týdnu léčby. Ve studii nebyl zjištěn žádný nežádoucí účinek ranibizumabu, který by nebyl zjištěn v předchozích studiích s ranibizumabem u VPMD [33].
V klinické studii CRUISE (Ranibizumab for the treatment of macular edema after central retinal vein occlusion) byl zjišťován efekt a bezpečnost 0,3 mg ranibizumabu a 0,5 mg ranibizumabu podávaného měsíčně intravitreálně pacientům s makulárním edémem při KOSŽ ve srovnání s kontrolní skupinou bez léčby. Časový plán a podmínky opakované léčby byly stejné jako u studie BRAVO. Po šesti měsících léčby byl průměrný zisk 12,7 písmene ve skupině očí léčených 0,3 mg ranibizumabu a 14,9 písmene u léčených 0,5 mg ranibizumabu. Zlepšení zraku a pokles CRT byl také maximální po první injekci v prvním týdnu léčby. Ve studii byl zjištěn jeden případ neovaskularizací duhovky ve skupině léčených 0,5 mg ranibizumabu, jinak se neobjevil žádný nežádoucí účinek, který by nebyl přítomen v předchozích studiích u VPMD [34].
V klinické studii ROCC (Randomized study comparing ranibizumab to sham in patients with macular edema secondary to central retinal vein occlusion) byl zjišťován efekt ranibizumabu při dávkování první tři měsíce po měsíci, poté každý měsíc v případě přetrvávání makulárního otoku. Během šesti měsíců léčby byl průměrný zisk u léčených pacientů 12 písmen a pokles CRT 304 µm při průměrném počtu 4,3 injekce [35].
Závěr
Ranibizumab působením na VEGF-A prokazatelně blokuje růst a zvětšování choroidální neovaskularizace, zmenšuje tvorbu otoku makuly redukcí prosakování retinálních kapilár a podporuje vstřebávání sítnicových krvácení. V současné době je jediným anti-VEGF přípravkem, u něhož byl několika multicentrickými, randomizovanými klinickými studiemi prokázán účinek na zlepšení NKZO u pacientů s neovaskulární formou VPMD, makulárním otokem při okluzi sítnicových žil nebo s DME. Z výsledků získaných dotazníkovým šetřením u pacientů subjektivně hodnotících kvalitu zrakových funkcí po léčbě ranibizumabem vyplynulo, že u léčených došlo ke zlepšení při činnostech, jejichž provádění je závislé na zraku, ke zlepšení vidění do blízka i do dálky a ke zvýšení kvality života.
Ranibizumab je podáván intravitreálně jednou měsíčně do doby, kdy je pacientova zraková ostrost stabilní po tři po sobě jdoucí měsíční vyhodnocení. Jestliže nenastane zlepšení zrakové ostrosti po podání prvních tří injekcí, nedoporučuje se v léčbě pokračovat. Po dosažení stabilizace NKZO je doporučeno její sledování jednou měsíčně. Léčba je znovu zahájena, pokud je při sledování pacienta zjištěno zhoršení zrakové ostrosti léčeného onemocnění.
Seznam použité literatury
- [1] Kaiser PK. Perspective Antivascular Endothelial Growth Factor Agents and Their Development. Therapeutic Implications in Ocular Diseases. Am J Ophthalmol 2006; 142: 660–668.
- [2] Funatsu H, Yamashita H, Noma H, et al. Increased levels of vascular endothelial growth factor and interleukin-6 in the aqueous humor of diabetics with macular edema. Am J Ophthalmol 2002; 133: 70–77.
- [3] Campochiaro PA. Anti-vascular endothelial growth factor treatment for retinal vein occlusions. Ophthalmologica 2012; 227 Suppl 1: 30–35.
- [4] Ferrari N, Gerber HP, LeCouter J. The biology of VEGF-And its receptors. Nat Med 2003; 9: 669–676.
- [5] Takahashi H, Shibuya M. The vascular endothelial growth factor (VEGF)/VEGF receptor system and its role under physiological and pathological conditions. Clin Sci 2005; 109: 227–241.
- [6] Qaum T, Xu Q, Joussen AM, et al. VEGF-initiated blood-retinal barrier breakdown in early diabetes. Invest Ophthalmol Vis Sci 2001; 42: 2408–2413.
- [7] Tolentino MJ, Miller JW, Gragoudas ES, et al. Intravitreous injections of vascular endothelial growth factor produce retinal ischemia and microangiopathy in an adult primate. Ophthalmology 1996; 103: 1820–1828.
- [8] Zachary I, Mathur A, Yla-Herttuala S, et al. Vascular protection: A novel nonangiogenic cardiovascular role for vascular endothelial growth factor. Arterioscler Thromb Vasc Biol 2000; 20: 1512–1520.
- [9] Neufeld G, Cohen T, Gengrinovitch S, et al. Vascular endothelial growth factor (VEGF) and its receptors. FASEB J 1999; 13: 9–22.
- [10] Robinson CJ, Stringer SE. The splice variants of vascular endothelial growth factor (VEGF) and their receptors. J Cell Sci 2001; 114: 853–865.
- [11] Shima DT, Gougos A, Miller JW, et al. Cloning and mRNA expression of vascular endothelial growth factor in ischemic retinas of Macaca fascicularis. Invest Ophthalmol Vis Sci 1996; 37: 1334–1340.
- [12] Seddon JM, Chen CA. The epidemiology of age-related macular degeneration. Int Ophthalmol Clin 2004; 44: 17–39.
- [13] Berger JW, Fine SL, Maguire MG. Age-related Macular Degeneration. Mosby, Inc., New York, 1999. 463 s.
- [14] Boguszaková J. Věkem podmíněná makulární degenerace. Prakt Lék 2001; 81: 310–314.
- [15] Landy J, Brown GC. Update on Photodynamic Therapy. Curr Opin Ophthalmol 2003; 14: 163–168.
- [16] Visudyne®, product monograph, third edition, Chameleon Medical Communications Ltd, London, 2003. 92 s.
- [17] Boyer DS, Antoszyk AN, Awh CC, et al. Subgroup Analysis of the MARINA Study of Ranibizumab in Neovascular Age-Related Macular Degeneration. Ophthalmology 2007; 114: 246–252.
- [18] Rosenfeld P, Brown DM, Heier JS, et al. Ranibizumab for Neovascular Age-Related Macular Degeneration. N Engl J Med 2006; 355: 1419–1431.
- [19] Brown DM, Kaiser PK, Michels M, et al. Ranibizumab versus Verteporfin for Neovascular Age-Related Macular Degeneration. N Engl J Med 2006; 355: 1432–1444.
- [20] Schmidt-Erfurth U, Eldem B, Guymer R, et al. Efficacy and safety of monthly versus quarterly ranibizumab treatment in neovascular age-related macular degeneration: the EXCITE study. Ophthalmology 2011; 118: 831–839.
- [21] Holz FG, Amoaku W, Donate J, et al. Safety and efficacy of a flexible dosing regimen of ranibizumab in neovascular age-related macular degeneration: the SUSTAIN study. Ophthalmology 2011; 118: 663–671.
- [22] Fung AE, Lalwani GA, Rosenfeld PJ, et al. An Optical Coherence Tomography – Guided, Variable Dosing Regimen with Intravitreal Ranibizumab (Lucentis) for Neovascular Age-related Macular Degeneration. Am J Ophthalmol 2007; 143: 566–583.
- [23] Antoszyk AN, Tuomi L, Chung CY, et al. Ranibizumab Combined With Verteporfin Photodynamic Therapy in Neovascular Age-related Macular Degeneration (FOCUS): Year 2 Results. Am J Ophthalmol 2008; 145: 862–874.
- [24] Larsen M, Schmidt-Erfurth U, Lanzetta P, et al. Verteporfin plus ranibizumab for choroidal neovascularization in age-related macular degeneration: twelve-month MONT BLANC study results. Ophthalmology 2012; 119: 992–1000.
- [25] Chen E, Looman M, Laouri M, et al. Burden of illness of diabetic macular edema: literatura review. Curr Med Res Opin 2010; 26: 1587–1597.
- [26] Sosna T, Švancarová R, Netuková M, et al. Současný pohled na diabetický makulární edém. Čes a slov Oftal 2012; 3: 91–96.
- [27] Massin P, Bandello F, Garweg JG, et al. Safety and efficacy of ranibizumab in diabetic macular edema (RESOLVE study). Diabetes Care 2010; 33: 2399–2405.
- [28] Mitchell P, Bandello F, Schmidt-Erfurth U, et al. The RESTORE study. Ranibizumab monotherapy or combined with laser versus laser monotherapy for diabetic macular edema. Ophthalmology 118; 2011: 615–625.
- [29] Nguyen QD, Shah SM, Khwaja AA, et al. Two--year outcomes of the Ranibizumab for Edema of the mAcula in Diabetes (READ-2) study. Ophthalmology 2010; 117: 2146–2151.
- [30] McIntosh RL, Rogers SL, Lim L, et al. Natural history of central retinal vein occlusion: an evidence-based systematic review. Ophthalmology 2010; 117: 1113–1123.
- [31] Rogers SL, McIntosh RL, Lim L, et al. Natural history of branch retinal vein occlusion: an evidence-based systematic review. Ophthalmology 2010; 117: 1094–1101.
- [32] Řehák J, Rehák M, et al. Venózní okluze sítnice. Grada Publishing, 2011, 144 s.
- [33] Campochiaro PA, Heier JS, Feiner L, et al. Ranibizumab for macular edema following branch retinal vein occlusion: six-month primary end point results of a phase III study. Ophthalmology 2010; 117: 1102–1112.
- [34] Brown DM, Campochiaro PA, Singh RP, et al. Ranibizumab for macular edema following central retinal vein occlusion: six-month primary end point results of a phase III study. Ophthalmology 2010; 117: 1124–1133.
- [35] Kinge B, Stordahl PB, Vegard F, et al. Efficacy of ranibizumab in patients with macular edema secondary to central retinal vein occlusion: results form the sham-controlled ROCC study. Am J Ophthalmol 2010; 150: 310–314.