Infekce virem hepatitidy C
Virus hepatitidy C byl identifikován až v roce 1989, byl zařazen do čeledi Flaviviridae jako jediný zástupce rodu Hepacivirus. Obsahuje RNA pozitivní polarity, která kóduje protein o zhruba 3 000 aminokyselinách. Základní genetickou charakteristikou viru hepatitidy C je jeho nestabilita. Nejdůležitější cestou přenosu v současné době je intravenózní toxikomanie. Protivirová terapie je indikována jak v případech akutní, tak chronické HCV infekce. Doporučuje se podávání konvenčních interferonů v denním dávkování, není ale přesně stanovena optimální délka této léčby. Standardní terapií chronické infekce virem hepatitidy C je v současné době kombinace pegylovaných interferonů alfa a ribavirinu.
Základní fakta
Virus hepatitidy C byl identifikován až v roce 1989, byl zařazen do čeledi Flaviviridae jako jediný zástupce rodu Hepacivirus. Obsahuje RNA pozitivní polarity, která kóduje protein o zhruba 3 000 aminokyselinách. Tento prekurzor je s pomocí viru vlastních proteáz, ale i s pomocí enzymatické výbavy hostitelské buňky postupně štěpen na 7–8 dosud známých proteinů. Dva proteiny jsou tzv. strukturální, zbytek jsou proteiny nestrukturální, které se účastní především virového replikačního cyklu. Funkce některých těchto nestrukturálních proteinů není dosud známa. Základní genetickou charakteristikou viru hepatitidy C (HCV) je jeho nestabilita. Podle úrovní genetické shody jsou rozlišovány tzv. genotypy HCV (shoda 50–70 %), subtypy (70–80 %) a při shodě vyšší hovoříme o kvazidruzích. Nejdůležitější cestou přenosu infekce do roku 1992 bylo přijetí krevního derivátu, po roce 1992, kdy se na transfuzních stanicích začaly používat detekční sety k průkazu anti-HCV protilátek, klesla incidence potransfuzní hepatitidy C téměř na nulu. Nejdůležitější cestou přenosu v současné době je intravenózní toxikomanie (přibližně 60 % nově vzniklých případů), ale nemalou měrou se na šíření infekce podílí i zdravotní péče. Z dalších cest přenosu se jedná o přenos pohlavním stykem, vzácnější je přenos z matky na plod či přenos profesionální (zdravotničtí pracovníci). Základním sérologickým markerem infekce HCV jsou anti-HCV protilátky (anti-HCV). Tyto protilátky jsou ukazatelem kontaktu člověka s virem, neznamenají automaticky prodělanou infekci. Spíše naopak. Protože infekce virem hepatitidy C přechází do chronického stadia až v 85 % případů, znamená pozitivita anti-HCV většinou aktivní infekci virem hepatitidy C. K průkazu aktivní infekce je nezbytně nutný pozitivní průkaz virové nukleové kyseliny v séru vyšetřované osoby. K detekci protilátek jsou dnes užívány sety EIA (MEIA) III. generace, které mají vysokou senzitivitu i specificitu, k průkazu virové nukleové kyseliny v krvi (HCV RNA) je používána především metoda polymerázové řetězové reakce (PCR). Pomocí PCR lze stanovit i virémii, která patří mezi nejdůležitější virologické parametry infekce HCV. Chronická infekce HCV má velmi individuálně rozdílný průběh z pohledu závažnosti jaterního postižení. Na základě dostupných údajů se má za to, že infekce HCV může v průběhu let až několika (2–3) desetiletí dospět do stadia jaterní cirhózy přibližně ve 20–30 % případů. Určit však riziko rozvoje cirhózy v konkrétním individuálním případě je většinou velmi obtížné. Vodítkem může být identifikace několika faktorů, o nichž je známo, že riziko rozvoje cirhózy výrazně zvyšují. Jsou to: mužské pohlaví, věk v okamžiku přenosu infekce vyšší nežli 40 let, současná koinfekce s dalšími viry (zejména HBV, HIV), konzumace alkoholu či hepatotoxických léčiv. Nejpřesnější odhad rizika rozvoje jaterní cirhózy umožňuje provedení jaterní biopsie a histologické hodnocení stadia procesu (tj. fibrózy) v iniciální biopsii v okamžiku stanovení diagnózy infekce HCV. Protivirová terapie je indikována jak v případech akutní, tak chronické infekce HCV. U akutních infekcí HCV nejsou naše znalosti tak dokonalé jako u chronické infekce. Doporučuje se podávání konvenčních interferonů v denním dávkování, není ale přesně stanovena optimální délka této léčby. Není ani jasné, jak dlouho či zda vůbec by po této denní terapii (indukční léčba) měla následovat terapie „udržovací" s intermitentním podáváním interferonu. Zkušenosti s pegylovanými interferony u akutní infekce HCV nejsou dosud vůbec žádné. Standardní terapií chronické infekce virem hepatitidy C je v současné době kombinace pegylovaných interferonů α a ribavirinu. Touto terapeutickou variantou je dosahováno trvalé eliminace viru v přibližně 60 % případů. Délka terapie se řídí genotypem HCV v daném případě, virémie do určité míry může ovlivňovat použitou dávku ribavirinu. Kombinační terapie má celou řadu různě závažných nežádoucích účinků. Standardním NÚ při podávání pegylovaných interferonů je leukopenie a různě vyjádřený soubor chřipkovitých příznaků (tzv. flu-like syndrom). Ribavirin vyvolává hemolytickou anémii, která se může celkově podílet na výrazně větší únavě pacientů během protivirové terapie. Dalšími NÚ mohou být nejrůznější kožní příznaky, zažívací obtíže, průjmy. Nastávají i poruchy spánku a změny psychického ladění – pacienti mají sklon k depresím, jsou emočně labilní. U infekce virem hepatitidy C dosud nemáme dostupnou specifickou preexpoziční ani postexpoziční profylaxi. Jedinou prevencí přenosu infekce je proto předcházení všem rizikovým faktorům přenosu, a to zejména při poskytování zdravotní péče.
Původce
Virus hepatitidy C (HCV) byl popsán v roce 1989 [1]. V následujících letech se ukázalo, že jde o virus zodpovědný za cca 95 % všech „potransfuzních" hepatitid, tj. hepatitid vzniklých v souvislosti s podáním některého krevního derivátu. Přechod akutní infekce do chronické je popisován v cca 85 % případů. Určit přesně toto riziko není jednoduché, protože akutní infekce je v naprosté většině asymptomatická, a procento přechodů do chronicity je tudíž odvozeno od dokumentovaných případů potransfuzní akutní hepatitidy non-A, non-B [2]. V současné době je genetickými metodami rozlišováno 6 základních genotypů a řada subtypů HCV [3]. Shoda genetického materiálu (nukleotidových sekvencí RNA) se u genotypů pohybuje kolem 50–70 %, u subtypů jde o 70–80 %. Prevalence genotypů a subtypů HCV vykazují geografickou rozdílnost. V Evropě, a tedy i v ČR, jednoznačně dominuje genotyp 1, subtyp 1b. Populace virionů se ale liší také v rámci jednoho hostitele. Jeden lidský organismus bývá většinou infikován jedním genotypem, jedním subtypem, ale jednotlivé viriony se od sebe liší přesnou sekvencí jednotlivých oblastí virového genomu. Shoda je v těchto případech více než 80% a hovoříme o tzv. kvazidruzích (angl. quasispecies).
Epidemiologie a cesty přenosu
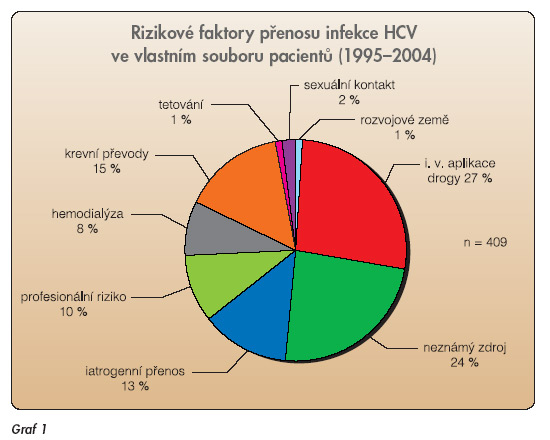
Udává se, že na celém světě je tímto virem infikováno zhruba 180–200 milionů osob. Prevalence infekce HCV v České republice na základě prevalence reaktivity anti-HCV protilátek byla stanovena ve statisticky reprezentativním vzorku naší populace (sérologický přehled) v průběhu roku 2001 [4]. Reaktivita anti-HCV protilátek byla prokázána u 0,2 % populace. Za nejdůležitější možné cesty přenosu jsou považovány následující možnosti [5]: - Přenos krevními deriváty. - Intravenózní aplikace narkotik. - Pravidelné dialyzační léčení (PDL). - Profesionální riziko expozice HCV. - Iatrogenní přenos – chirurgické výkony, endoskopická vyšetření, srdeční katetrizace apod. - Sexuální kontakt s osobou HCV pozitivní. - Sexuální promiskuita (riziko přenosu signifikantně stoupá při více než 6 partnerech za život). - Rodinný kontakt s osobou HCV pozitivní. - Vertikální přenos z HCV pozitivní matky na novorozence (perinatální přenos). - Transplantační štěpy. Výskyt jednotlivých rizikových faktorů u souboru nemocných s diagnostikovanou infekcí HCV na pracovištích autora v letech 1995–2004 viz graf 1.
Obrácené údaje, tj. výskyt prokázané infekce HCV u osob vystavených určitému rizikovému faktoru, viz tab. 1.
Je patrno, že například pouze 5–6 % osob, které se poraní injekční jehlou použitou u osoby prokazatelně HCV pozitivní, se samo infikuje HCV [6]. Popsány jsou i případy přenosu z lékaře na pacienta, jedná se například o kazuistiky přenosů HCV z ortopeda a anesteziologa na operované pacienty [7,3].
Sérologie HCV
Základním sérologickým markerem infekce HCV je protilátka proti HCV (anti- HCV). Tato protilátka dosahuje prokazatelných titrů v séru již kolem 3. týdne od vzniku infekce. Reaktivita anti-HCV zakládá naléhavé podezření na aktivní infekci HCV u vyšetřované osoby. Protilátky proti HCV jsou prokazatelné totiž i u osob, které jsou nadále infikovány virem (a kterých je většina, protože infekce v cca 85 % případů přechází do chronického stadia). Tyto osoby mají ve svém séru prokazatelnou i virovou nukleovou kyselinu (HCV RNA). Pouze v případě pozitivního průkazu sérové HCV RNA lze hovořit o aktivní infekci u dané osoby. Průkaz anti-HCV je dnes většinou prováděn metodami EIA, či spíše MEIA II.–III. generace. Tyto metody mají až 97% senzitivitu a specificitu ještě vyšší, kolem 99 % [14]. Sérová HCV RNA je běžně prokazována metodou polymerázové řetězové reakce (PCR). Variantou, která není příliš rozšířená, je metoda větvené DNA (bDNA). Obě metody umožňují i kvantitativní hodnocení virémie a určení genotypu HCV. Jde o základní virologické parametry, bez nichž se dnes nelze obejít při rozhodování o zahájení protivirové terapie.
Chronická infekce HCV
O chronické infekci se mluví v případech, kdy infekce trvá prokazatelně déle než 6–12 měsíců nebo kdy není možné délku trvání infekce ani přibližně určit, např. podle expozice některému ze zmíněných rizikových faktorů infekce. Klinický obraz chronické infekce HCV je zcela necharakteristický. V průběhu let se u infikovaných osob mohou střídat stavy vyšší únavnosti, dyspeptické obtíže. Často infekce nevyvolá vůbec žádné příznaky. U těchto nemocných bývá diagnóza stanovena náhodně nebo až velmi pozdě. Není výjimkou, že ke správné diagnóze vedou až příznaky závažného jaterního postižení – jaterní cirhózy. Onemocnění může být odhaleno dokonce až při manifestaci jejích komplikací (hepatocelulární karcinom, krvácení do GIT při portální hypertenzi apod). U chronické infekce velmi často nacházíme extrahepatální manifestace infekce HCV. I tyto projevy mohou být prvním příznakem vedoucím k diagnóze infekce HCV. Základním a v časných stadiích onemocnění také jediným laboratorním příznakem, který je v případech chronické infekce HCV patrný, je elevace ALT. Zvýšení sérové aktivity ALT není většinou nijak extrémní. Nejčastěji nepřesahuje 2–3násobek horní hranice. Z pohledu histologického je charakteristické, že onemocnění asi u 3/4 osob probíhá pod obrazem chronického zánětu (chronické hepatitidy) s různými stupni tvorby vaziva. Jaterní cirhóza se vyvíjí asi u 1/4 infikovaných osob, a to většinou po dlouhém trvání infekce (20 i více let). Riziko rozvoje jaterní cirhózy je v individuálním případě velmi obtížně určitelné. Onemocnění je v průběhu mnoha let ovlivňováno celou řadou faktorů, jejichž spolupůsobení je obtížně určitelné. Jde např. o faktory virologické (genotyp viru), přidružené choroby (koinfekce HIV, HBV), vliv zevních faktorů (konzumace alkoholu). Všechny zmíněné faktory přitom průběh onemocnění spíše urychlují, faktory, které by průběh zpomalovaly (kromě protivirové terapie), nejsou známy [15].
Terapie
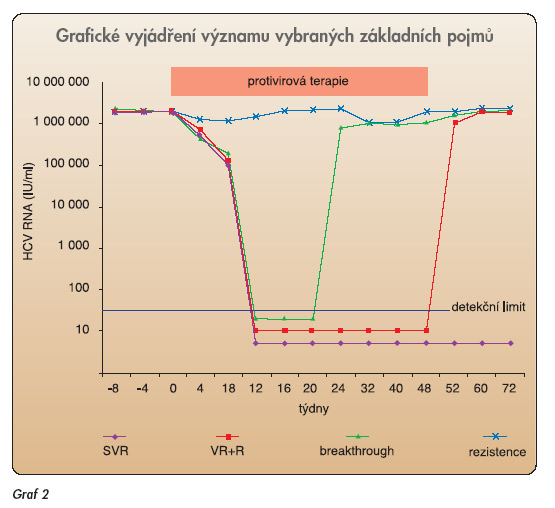
V další části se zaměříme pouze na terapii chronické infekce HCV, která představuje nejčastěji zjišťovanou formu infekce HCV. Pro hodnocení odpovědi na protivirovou léčbu se vžilo několik základních pojmů. Protože se při výkladu o terapeutických možnostech bez těchto pojmů nelze obejít, uvedeme je na tomto místě. Terminologie je převzata z konsenzuání konference NIH o léčbě infekce HCV [16]. Termíny jsou vytištěny tučným písmem. Význam některých pojmů ukazuje graf 2.
Virologická odpověď (VR) V hodnoceném okamžiku je dosaženo negativní sérové HCV RNA metodou PCR se senzitivitou minimálně 50 IU/ml. Odpověď na konci terapie (ETR) Odpověď v okamžiku ukončení protivirové terapie. Posuzována může být zvlášť biochemická (změny sérové aktivity ALT) a zvlášť virologická odpověď. Setrvalá virologická odpověď (SVR) Virologická odpověď trvající i ve 24. týdnu po skončení terapie, tj. negativní sérová HCV RNA stanovená metodou PCR se senzitivitou minimálně 50 IU/ml. Setrvalá biochemická odpověď Normalizace ALT trvající minimálně 24 týdnů po skončení protivirové terapie při současné pozitivní sérové HCV RNA metodou PCR se senzitivitou minimálně 50 IU/ml. Rezistence (Res) V hodnoceném okamžiku přetrvává pozitivita sérové HCV RNA a také je nadnormální sérová aktivita ALT. Posuzovaným okamžikem bývá obvykle 4.–12. týden od zahájení léčby. Časná virologická odpověď (EVR) Negativní sérová HCV RNA nebo její pokles o alespoň 2 log metodou PCR se senzitivitou minimálně 50 IU/ml ve 12. týdnu léčby. Biochemická odpověď V posuzovaném okamžiku terapie je dosaženo normalizace aktivity sérové ALT. Breakthrough fenomén Relaps sérové HCV RNA pozitivity po dosažení VR během terapie. Někteří autoři používají ještě řadu dalších termínů, které se od uvedených různým způsobem liší. Tyto termíny by tedy měly být přesně definovány v úvodu každé takové práce. Jedná se například o rychlou virologickou odpověď, nebo naopak o pomalou virologickou odpověď.
Terapeutické cíle
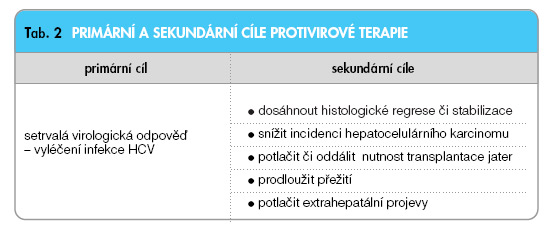
Terapeutické cíle můžeme rozdělit schematicky na cíle primární a sekundární (tab. 2).
Uvědomění si těchto léčebných cílů by mělo být v počátku každé úvahy o indikaci protivirové terapie v konkrétním případě. Jinak řečeno – měli bychom jednoznačně vědět, proč daného nemocného chceme léčit a jaký cíl léčbou sledujeme [17]. Ve většině případů je účelem terapie samozřejmě dosažení setrvalé virologické odpovědi, která podmiňuje naplnění i cílů sekundárních. V některých případech, například u extrahepatálních projevů infekce HCV, je možno se spokojit s potlačením virové replikace, protože řada projevů je závislá přímo na úrovni virové replikace. Příkladem z této skupiny je dlouhodobá terapie smíšené kryoglobulinémie při chronické infekci HCV. Zde je potom možno volit poněkud jinou strategii léčby – monoterapii interferonem, jiné dávky apod.
Užívané preparáty
Základem protivirové terapie v případech chronické infekce HCV je v současné době kombinace interferonu α (IFN) a ribavirinu (RBV). Je zajímavé, že interferon byl užit jako preparát k terapii non-A, non-B hepatitidy již v 80. letech minulého století, a to ještě před popisem viru hepatitidy C [18]. Ribavirin byl poprvé použit k terapii chronické infekce HCV v roce 1991 [19], standardní součástí léčby se stal po roce 1998 na základě výsledků rozsáhlé studie McHutchisona [20]. Interferony mají schopnost inhibovat přímo syntézu virových nukleových kyselin i jednotlivých virových proteinů, strukturálních i nestrukturálních. Tato inhibice je uskutečňována pomocí složité kaskády dějů, která je známa pouze zčásti. Imunomodulační účinek interferonů spočívá v tom, že zvyšují aktivitu cytotoxických T lymfocytů, přirozených zabíječů (NK buněk), a v tom, že stimulují T lymfocyty a makrofágy k tvorbě a sekreci dalších cytokinů. Všechny interferony ovlivňují také expresi HLA antigenů. Interferony zvyšují expresi HLA antigenů I. třídy jak na zdravých, tak na virem infikovaných buňkách. Tímto mechanismem se infikované buňky stávají citlivějšími vůči cytotoxickým T lymfocytům [21].
Pegylované interferony
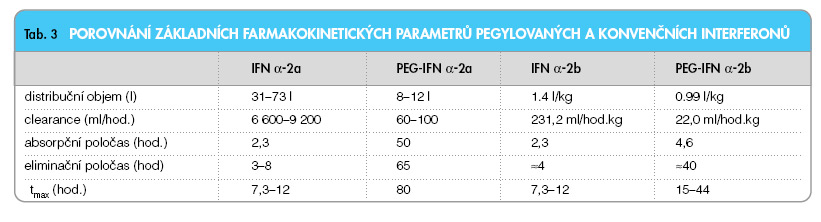
Pegylované interferony představují relativně novou lékovou formu konvenčních rekombinantních interferonů, které jsou zaváděny do terapie infekce HCV od počátku nového tisíciletí. Jsou produktem technologie označované jako pegylace (z angl. pegylation). Jedná se o technologii, kdy je ke zvolené bílkovinné molekule připojena polymerní molekula polyethylenglykolu. Vzniklý konjugát má řadu vlastností, kterými se významně liší od původní molekuly bílkoviny před úpravou – před pegylací. Polyethylenglykol je polymer složený z mnoha podjednotek tvořených molekulami ethylenoxidu. Tento polymer je pomocí terminálních hydroxylových skupin navázán na příslušný řetězec aminokyselin [22]. Základní charakteristiky polymeru (počet molekul PEG vázaných v konjugátu, molekulová hmotnost polymeru, druh vazby polymer– protein) determinují vlastnosti konjugátu. Řada těchto vlastností je ovlivnitelná reakčními podmínkami během pegylace, takže tyto charakteristiky lze cíleně ovlivňovat podle zvoleného a požadovaného cíle. Biologicky nejdůležitějším parametrem je molekulová hmotnost konjugátu. Na molekulové hmotnosti závisí především biologický poločas pegylované molekuly. Čím vyšší je molekulová hmotnost PEG, tím delší je biologický poločas konjugátu. Nevýhodou je skutečnost, že spolu se zvyšováním molekulové hmotnosti klesá protivirová účinnost preparátu. Rozevírají se tak jakési nůžky mezi molekulovou hmotností a účinností. Je třeba najít optimální poměr mezi oběma vlastnostmi [23]. Dalšími výhodnými vlastnostmi pegylovaných proteinů je jejich dobrá rozpustnost ve vodě a snížená imunogenicita proti nepegylovaným proteinům. Na trhu jsou v současné době dostupné dva preparáty, jejich vlastností si proto všimneme podrobněji. Srovnání základních vlastností PEG-IFN α-2a, PEG-IFN α-2b a příslušných konvenčních IFN viz tab 3.
Peginterferon α -2a
Peginterferon α-2a je vytvořen vazbou IFN α-2a a větveného PEG o molekulové hmotnosti 40 kDa. Existuje ve 4 pozičních izomerech, vazba je vždy vytvořena přes aminokyselinu lysin, avšak ve 4 různých pozicích (pozice 31, 121, 131 a 134). PEG-IFN α-2a vykazuje omezený distribuční prostor, nejvyšších koncentrací je dosahováno v játrech [24]. Je vylučován jak játry, tak ledvinami. Ve srovnání s konvenčním IFN má PEG-IFN α-2a asi 10x sníženou renální clearance [25]. Farmakokinetické parametry preparátu u osob s renálním selháním se nijak významně neliší od osob s normální funkcí ledvin.
Peginterferon α -2b
Komerčně vyráběný preparát je z 95 % tvořen jedním ze 14 monopegylovaných pozičních izomerů o molekulové hmotnosti 12 kDa. Tyto izomery se liší pozicí a druhem aminokyseliny, která je užita k vazbě jediného lineárního řetězce PEG. Asi 50 % je tvořeno biologicky nejúčinnějším izomerem, který má PEG vázán na histidin v pozici 34. Tento izomer je sice protivirově nejúčinnější, ale také je nejméně odolný vůči hydrolýze. Bylo prokázáno, že absorpční rychlost preparátu není závislá na dávce ani na délce terapie [26]. PEG-IFN α-2b je eliminován ze 30 % ledvinami, zbytek je metabolizován játry a degradací po interakci s buněčnými receptory IFN. Vylučování je 10x pomalejší u PEG-IFN α-2b nežli u konvenčního IFN α-2b. IFN α-2b je po jednorázovám podání vyloučen do 24 hodin, kdežto kompletní clearance PEG-IFN α-2b v dávce 0,5 µg/kg vyžaduje více než 96 hodin.
Nežádoucí účinky pegylovaných interferonů
Nežádoucí účinky pegylovaných interferonů jsou typově zcela shodné s konvenčními interferony. Zdá se, že pegylace a rozdílné farmakokinetické a farmakodynamické vlastnosti vedou k tomu, že NÚ jsou mírnější, některé z nich se vyskytují i vzácněji ve srovnání s konvenčními interferony. Např. flu-like příznaky nebývají tak intenzivní, mohou však přetrvávat déle. Standardním NÚ obou typů PEG-IFN je různě závažná leukopenie v důsledku myelosupresivního účinku PEG-IFN.
Ribavirin
Ribavirin patří do skupiny tzv. perorálních virostatik. Jde o analog guanosinu (1-β-D-ribofuranosyl-1-2-4-triazole-carboxamid), který byl vyvinut již počátkem 80. let. Mechanismus účinku u infekce HCV spočívá pravděpodobně v inhibici inosin monofosfát dehydrogenázy [27]. Dodnes nebyl objasněn mechanismus synergistického působení ribavirinu s interferonem. Až donedávna se zdálo, že ribavirin sám o sobě nemá protivirovou aktivitu. Pawlotsky a kol. [28] ukázali, že monoterapie ribavirinem vede u člověka k přechodnému, nevelkému, ale statisticky významnému poklesu virémie (<0,5 log cp/ml).
Standardní terapeutický postup
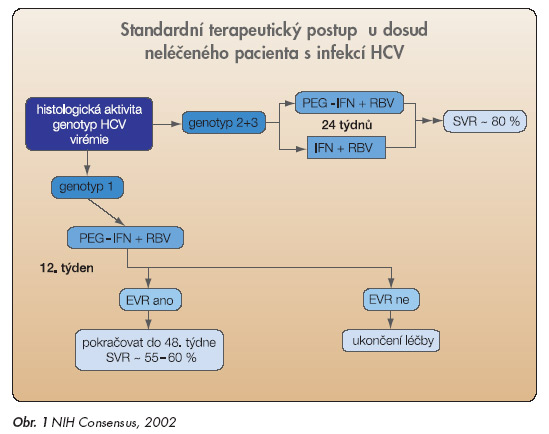
V současné době jsou v literatuře dostupné 3 klíčové studie [29–31], které poskytly velmi přesvědčivé výsledky, a staly se tak oporou pro jednoznačné doporučení kombinace PEG-IFN + RBV jako postupu první volby pro dosud neléčené (tzv. naivní) pacienty s chronickou infekcí HCV. Toto doporučení bylo formulováno nejdříve do závěrů Konsenzuální konference NIH v roce 2002 [32]. V následujících letech se o tato doporučení opřela řada národních společností, mezi nimi i Česká hepatologická společnost a Společnost infekčního lékařství. Standardy byly zveřejněny jak v odborném tisku či na odborných konferencích, tak i na internetové adrese www.ceska-hepatologie. cz. Doporučený postup (obr. 1)
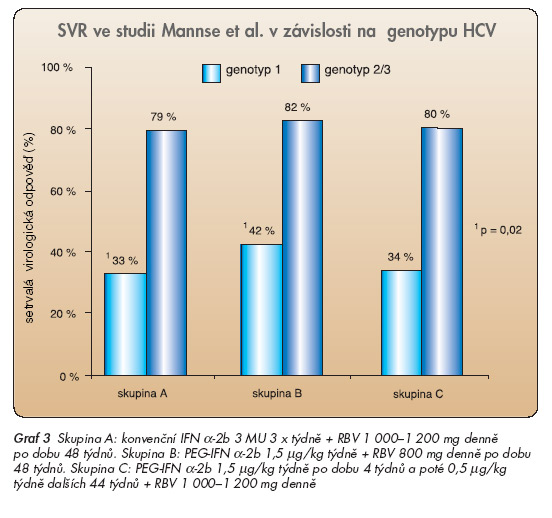
bude v další části blíže popsán. Výše citované studie jednoznačně prokázaly, že nejdůležitějším predikčním faktorem účinku léčby je genotyp HCV, poněkud menší význam je přikládán výchozí virémii. Dalším důležitým parametrem je aktivita jaterní léze. Jde o negativní predikční parametr, takže vyšší stadium (stage, fibróza) je spojeno s významně nižší pravděpodobností dosažení SVR. Z výsledků studií Mannse [29] i Frieda [30] jednoznačně vyplynulo, že kombinace pegylovaného interferonu s ribavirinem je významně účinnější terapeutickou variantou v případech genotypu HCV 1 nežli kombinace konvenčního interferonu s ribavirinem. Mannsova studie ukázala (graf 3), že PEG-IFN v dávce 1,5 µg/kg týdně a ribavirin (skupina B) je statisticky významně účinnější v případech genotypu HCV 1 nežli kombinace konvenčního IFN a ribavirinu (42 % vs 33 %, p = 0,02). Tento výsledek byl potvrzen i ve studii s preparátem PEG-IFN α-2a, kterou vedl Fried. Oba autoři se shodli i v dalším výsledku, který je rovněž patrný na grafu 3.
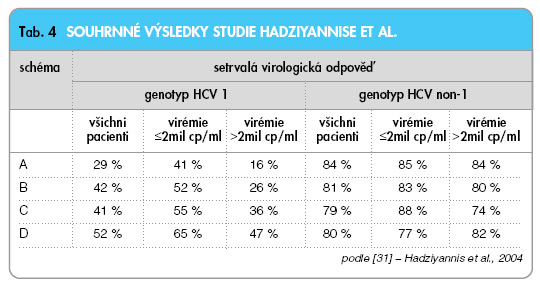
U genotypů HCV 2 + 3 nebylo při použití PEG-IFN dosaženo významného nárůstu účinnosti. Z tohoto výsledku vyplývá rovnocennost konvenčního a pegylovaného interferonu u těchto genotypů (obr. 1). Studie Mannse ani Frieda vzhledem ke svému schématu nebyly schopny identifikovat optimální délky terapie pro jednotlivé genotypy a výchozí virémie. Tyto důležité otázky zodpověděla až studie vedená Hadziyannisem [31]. Hadziyannis použil 4 léčebná schémata, která byla zvolena podle zkušeností s kombinací konvenčních IFN a ribavirinu. Schéma A: peginterferon α-2a 180 µg týdně + ribavirin 800 mg denně 24 týdnů. Schéma B: peginterferon α-2a 180 µg týdně + ribavirin 1000–1200 mg denně 24 týdnů. Schéma C: peginterferon α-2a 180 µg týdně + ribavirin 800 mg denně 48 týdnů. Schéma D: peginterferon α-2a 180 µg týdně + ribavirin 1000–1200 mg denně 48 týdnů. Výsledky této randomizované studie ukazuje tab. 4.
Mezi pacienty infikovanými genotypem HCV 1 bylo nejvyšší účinnosti dosaženo 48týdenní terapií s vyšší dávkou RBV (52 %). Nejvyšší účinnosti tohoto schématu bylo dosaženo pro pacienty s vysokou i nízkou virémií. U pacientů s genotypem HCV non-1 je vysoké a srovnatelné účinnosti dosaženo všemi schématy. Z toho vyplývá, že pro genotyp HCV non-1 je dostatečná dávka RBV 800 mg a dostatečná délka kombinované terapie 24 týdnů. Další prodlužování na 48 týdnů nevede k navýšení SVR.
Nejdůležitější závěry vyplývající z této studie
Pacienti s genotypem HCV 1 (bez ohledu na výchozí virémii) mají být léčeni standardní, tělesnou hmotností definovanou dávkou RBV. Délka terapie má být 48 týdnů. Pacienti s genotypem HCV non-1 (ve studii 2 a 3) mohou být léčeni nižší dávkou ribavirinu (800 mg) po dobu 24 týdnů. Opět bez rozdílu ve výchozí virémii, zde však nelze jednoznačně vyloučit chybu způsobenou relativně nízkým počtem pacientů s nízkou virémií a genotypem non-1. Friedova studie poskytla jako první další velmi podstatný výsledek. Podařilo se ukázat, že reálnou šanci na dosažení SVR mají pouze pacienti, kteří ve 12. týdnu dosáhnou buď negativní sérové HCV RNA, nebo alespoň poklesu výchozí virémie o 2 log (obr. 2). Z této studie tedy byla odvozena definice a význam časné virologické odpovědi, tak jak byla uvedena v úvodu. I tato skutečnost byla v dalším období ověřena pro terapii s PEG-IFN α-2b a ribavirinem. Zde bylo dokonce dosaženo 100% negativní predikční hodnoty při nedosažení EVR – nedosažení EVR ve 100 % případů znamenalo nedosažení SVR. Tyto skutečnosti se staly důvodem, proč je v současné době považováno nedosažení EVR za indikaci k ukončení protivirové terapie.
Nezodpovězené problémy
Základním problémem, na který dosud nebylo uspokojivě odpovězeno, je otázka dalšího postupu u pacientů, 1. u nichž dojde po ukončení terapie PEG-IFN + RBV k relapsu; 2. kteří patří do skupiny bez dosažení EVR. U obou výše zmíněných skupin je třeba zjistit, zda existuje terapeutická možnost, která by vedla k potlačení histologické progrese a k naplnění sekundárních cílů uvedených v tab. 2. Alespoň částečné odpovědi a vodítka pro další úvahy a klinické studie by měly poskytnout právě probíhající dvě klinické studie. Jde o studii vedenou ve Spojených státech pod názvem HALT-C, která užívá PEG-IFN α-2a a analogickou mezinárodní studii EPIC-3 s PEG-IFN α-2b. Obě studie mají podobné uspořádání, užívají dlouhodobě podávaný PEG-IFN v monoterapii nebo v kombinaci s ribavirinem u neúspěšně léčených osob se závažnou jaterní lézí – pokročilou fibrózou či s rozvinutou jaterní cirhózou. Primárními cíli studie HALT-C je dokázat rozdíly mezi léčenými a neléčenými skupinami ve smyslu zpomalení progrese do jaterní cirhózy, ve vzniku hepatocelulárního karcinomu (HCC) a v redukci nutnosti provedení jaterní transplantace (OLT). Dosud byly publikovány pouze výsledky první, úvodní fáze studie [33], nicméně výsledky podstatné a konečné jsou očekávány až v průběhu několika dalších let.
Závěr
Pegylované interferony v kombinaci s ribavirinem představují v současné době terapeutický standard chronické infekce HCV. Kromě citovaných základních prací je dnes dostupné i množství dalších studií, které jsou s těmito většinou v souladu, některé se zaměřují již i na zvláštní populace pacientů – koinfikované osoby HCV/HIV, hemofiliky, dialyzované osoby apod. Velmi důležitou skutečností je průkaz silné asociace časné virologické odpovědi a setrvalé virologické odpovědi. Jde o časný parametr, který umožňuje oddělit skupinu osob, které mají a které nemají reálnou naději na dosažení SVR. Osoby bez EVR by měly ve 12. týdnu ukončit léčbu. Další klíčové zjištění lze spatřovat v ověřené účinnosti pouze 6měsíční léčby pacientů s genotypem HCV 2 + 3, kteří mohou být léčeni i nižší dávkou ribavirinu, ve srovnání s osobami infikovanými genotypem HCV 1. Pro skupinu osob bez EVR a s relapsem HCV po skončení kombinace PEG-IFN + ribavirin je však třeba hledat alternativní postupy, tak jak se o to snaží studie s dlouhodobou protivirovou terapií. Pouze při dodržování těchto standardních postupů lze považovat protivirovou léčbu chronické infekce HCV za „cost-effective", a tudíž za smysluplnou i z pohledu společenského.
Seznam použité literatury
- [1] Choo QL, Kuo G, Weiner AL, et al. Isolation of a cDNA clone derived from a blood borne non-A, non-B viral hepatitis genome. Science 1989;244:359–62.
- [2] Alter MJ. Prevention of spread of hepatitis C. Hepatology 2002;36:S93–S98.
- [3] Ross RS, Viazov S, Roggendorf M, et al. Phylogenetic analysis indicates transmission of hepatitis C virus from an infected orthopedic surgeon to a patient. J Med Virol 2002;4:461–7.
- [4] Němeček V. Sérologický přehled ČR v roce 2001 – virová hepatitida A, B, C. Zprávy CEM 003;12 (příloha 1): 55–61.
- [5] Alter MJ, Kruszon-Moran D, Nainan OV, et al. The prevalence of hepatitis C virus infection in the United States, 1988 to 1994. N Engl J Med 1999;341:556–62.
- [6] Memon MI, Memon MA. Hepatitis C: an epidemiological review. J Viral Hepat 2002;2:84–100.
- [7] Cody SH, Nainan OV, Garfein RS, et al. Hepatitis C virus transmission from an anesthesiologist to a patient. Arch Intern Med 2002;3:345–50.
- [8] Francavilla E, Rinaldi, R, Cattelan, AM, et al. Low prevalence of antibodies to hepatitis C virus hospital employes. Infection 1995; 20:295.
- [9] Lanphear B, Linnemann CC, Cannon CG, et al.: Hepatitis C virus infection in health care workers: Risk of exposure and infection. Infect Control Hosp Epidemiol 1994;15:745–50.
- [10] Alter MJ, Hadler SC, Judson FN, et al. Risk factors for acute non-A, non-B hepatitis in the United States and association with hepatitis C virus infection. JAMA 1990; 264:2231–5.
- [11] Thomas DL, Zenilman JM, Altez HJ, et al. Sexual transmission of hepatitis C virus among patients attending Baltimore sexually transmitted diseases clinics - an analysis of 309 sexual partnerships. J Infect Dis; 1993;167:66–71.
- [12] Puro, V., Girardi, E., Ippolito, G., et al. Prevalence of hepatitis B and C viruses and human immunodeficiency virus infections in women of reproductive age. Br J Obst Gynaecol 1992;99:598–600.
- [13] Niu MT, Coleman PJ, Alter MJ, et al. Multicenter study of hepatitis C virus infection in chronic hemodialysis patients and staff. Am J Kidney Dis 1993;22:568–73.
- [14] Colin C, Lanoir D, Touzet S, et al. Sensitivity and specificity of third-generation hepatitis C virus antibody detection assays: an analysis of the literature. J Viral Hepat 2001;8:87–95.
- [15] Hoofnagle JH. Therapy of acute and chronic viral hepatitis. Advances in Internal Medicine 1994;39:241–75.
- [16] Lindsay K. Introduction to therapy of hepatitis C. Hepatology 2002;36:S114–S120.
- [17] Urbánek P. Infekce virem hepatitidy C. Praha, Galén, 2004.
- [18] Hoofnagle JH, Mullen KD, Jones DB, et al. Treatment of chronic non-A, non-B hepatitis with recombinant interferon-α. A preliminary report. N Engl J Med 1986;315:1575–8.
- [19] Reichard O, Anderson J, Schvarcz R, et al. Ribavirin treatment for chronic hepatitis C. Lancet 1991;337:1058–61.
- [20] McHutchison JG, Gordon SC, Schiff ER, et al. Interferon α2b alone or in combination with ribavirin as initial treatment for chronic hepatitis C. Hepatitis Interventional Therapy Group. N Engl J Med 1998;339:1485–92.
- [21] Lohr HF, Schmitz, D, Arenz, M, et al. The viral clearance in interferon – treated chronic hepatitis C is associated with increased cytotoxic T cell frequencies. J Hepatol 1999; 31:407–15.
- [22] Reddy KR. Controlled-release, pegylated, liposomal formulations: new mechanisms in the delivery of injctable drugs. Ann Pharmacother 2000;34;915–23.
- [23] Katre NV. The conjugation of proteins with polyethylene glycol and other polymers. Adv Drug Delivery Rev 1993;10:91–114.
- [24] Modi MW, Fulton JS, Buckmann, DK, et al. Clearance of pegylated (40kDa) interferon α2a is primarily hepatic. Hepatology 2000;32 (suppl):370A.
- [25] Algranati NE, Sy S, Modi M. A branched methoxy 40 kDa polyethylen glycol (PEG) moiety optimizes the pharmacokinetics (PK) of pegIFN α2a (PEG-IFN) and may explain its enhanced efficacy in chronic hepatitis C (CHC). Hepatology 1999;30:190A.
- [26] Glue P, Fang J, Rouzier-Panis R, et al. Pegylated interferon α2b: pharmacokinetics, pharmacodynamics, safety, and preliminary efficacy data. Clin Pharmacol Ther 2000;68:556–7.
- [27] Lanford RE, Chavez D, Guerra B, et al. Ribavirin induces error–prone replication of GB virus B in primary tmarin hepatocytes. J Virol 2001;74: 8074–81.
- [28] Pawlotsky JM, Neumann AU, Dahari H, et al. Hepatitis C virus (HCV) dynamics during induction therapy with interferon (IFN) α and/or ribiavirin (abstract). Antiviral Ther 2000;5:(suppl 1): 71.
- [29] Manns MP, McHutchison JG, Gordon SC, et al. PEG-interferon α2b in combination with ribavirin compared to interferon α2b plus ribavirin for initial treatment of chronic hepatitis C. Lancet 2001;358:958–65.
- [30] Fried MW, Shiffman ML, Reddy R, et al. Peginterferon α2a plus ribavirin for chronic hepattis C virus infection. N Engl J Med, 2002; 347:975–82.
- [31] Hadziyannis SJ, Sette H, Morgan T, et al. Peginterferon α2a and ribavirin combination therapy in chronic hepatitis C. Ann Intern Med 2004;140:346–55.
- [32] NIH Consensus Development Conference Management of Hepatitis C: 2002. Hepatology 2002;5:( Suppl. 1):S3–S20.
- [33] Shiffman ML, et al. retreatment of HCV nonresponders with peginterferon and ribavirin: results from the lead-in phase of the HALTC Trial. Hepatology 2002;36:295A.