Inhibitory angiotenzin konvertujícího enzymu: přehled a porovnání základních údajů
Článek přehledně shrnuje základní farmakologické vlastnosti inhibitorů angiotenzin konvertujícího enzymu dostupných v ČR. Klinická účinnost jednotlivých látek byla hodnocena pro indikaci: hypertenze, chronické srdeční selhání a infarkt myokardu.
Angiotenzin konvertující enzym (ACE) je enzym vyskytující se v celém organismu (nejvíce v plicním endotelu), který ovlivňuje rovnováhu mezi dvěma systémy regulujícími krevní tlak. Jedná se o systém renin-angiotenzin-aldosteron (RAAS) a systém kalikrein-kinin (KK). Aktivace RAAS vede k zadržování vody a Na+ v organismu a ke zvýšení cévního tonu. Hlavními příčinami aktivace RAAS jsou pokles renálního prokrvení a sympatoadrenergní aktivace, která vede ke zvýšení syntézy reninu (proteáza vznikající v juxtaglomerulárních buňkách ledvin). Renin katalyzuje přeměnu angiotenzinogenu – globulinu vznikajícího v játrech – na dekapeptid angiotenzin I. Ten je účinkem ACE měněn na oktapeptid angiotenzin II. Angiotenzin II je hlavním spouštěčem RAAS se systémovým účinkem. Důsledkem je cévní vazokonstrikce způsobená jeho účinkem na hladkou svalovinu cév a zvýšení aktivity sympatoadrenergního systému. Zvýšení koncentrace angiotenzinu II v plazmě stimuluje syntézu aldosteronu v ledvinách s následnou retencí Na+, aktivací vazopresinu (antidiuretický hormon) a zadržováním vody v organismu. Angiotenzin II má i tkáňový účinek – zvýšení buněčné proliferace a růstu, které se v důsledku projeví jako srdeční a cévní hypertrofie.
Naopak aktivace systému KK zvyšuje koncentrace bradykininu, a tím vede k vazodilataci a vylučování Na+. Hypertrofie kardiovaskulárního systému se netýká pouze svalových buněk, ale dochází i ke zmnožování mezibuněčné hmoty – k intersticiální fibróze. Významnou měrou k ní přispívá také aldosteron. Srdeční hypertrofie zvyšuje u pacientů s arteriální hypertenzí riziko náhlé smrti, srdečního selhání a infarktu myokardu. Aktivace RAAS je zodpovědná i za ztrátu vazodilatační schopnosti cév, tzv. endoteliální dysfunkci. Endoteliální dysfunkce následně zaujímá svoje místo v patofyziologii aterosklerózy. Inhibice ACE vede ke zvýšení plazmatických koncentrací bradykininu, jehož účinky – vazodilatace a natriuréza – jsou opačné než účinky angiotenzinu II.
Inhibice ACE posunuje rovnováhu mezi RAAS a KK ve prospěch RAAS, což vede k vazodilataci, natriuréze a antiproliferativnímu účinku. Dochází ke snížení periferní cévní rezistence beze změn srdeční frekvence. Snižuje se preload, afterload a systolické napětí ve stěně komor se zvýšením srdečního výdeje. Neutrální efekt na tepovou frekvenci je vysvětlován inhibicí účinku angiotenzinu II na sympatoadrenergní systém. Inhibicí angiotenzinu II je bráněno rozpadu vazodilatačních kininů (bradykinin) a snižuje se výdej aldosteronu kůrou nadledvin. Dochází k poklesu tvorby vazokonstrikčního endotelinu z poškozeného endotelu a ke změnám tvorby kolagenu v srdečním svalu a cévních stěnách. Rozhodujícím faktorem pro účinek inhibitorů ACE je plazmatická koncentrace reninu. U pacientů s jeho vysokou hladinou (stenóza renální tepny, chronické srdeční selhání) je odpověď výrazná, naopak u pacientů s nízkou koncentrací reninu (senioři) je odpověď nižší [1, 2].
Inhibitory angiotenzin konvertujícího enzymu (ACEI) se liší ve svých účincích, v biologické dostupnosti, biologickém poločasu a ve způsobu eliminace. Většina ACEI se vyskytuje jako proléčiva, tedy absorbovány jsou jako neúčinné látky, které se stávají účinnými až po své esterifikaci v játrech. Účinné látky vznikající z proléčiv mají pak typickou polyfázickou eliminační kinetiku. Za protrahovanou terminální fázi je zodpovědná silná vazba inhibitoru na ACE, který se z jeho vazebného místa uvolňuje jen pozvolna.
- sulfhydrylová skupina (kaptopril);
- karboxylová skupina (cilazapril, enalapril, imidapril, lisinopril, moexipril, perindopril, quinapril, ramipril, spirapril, trandolapril);
- fosforylová skupina (fosinopril).
Výhodnější pro praxi je však dělení ACEI dle jejich farmakologických vlastností:
- léčivá látka absorbující se jako aktivní a dále se přeměňující metabolit (kaptopril);
- neaktivní léčivá látka aktivující se až po esterifikaci v játrech (cilazapril, enalapril, fosinopril, imidapril, moexipril, perindopril, quinapril, ramipril, spirapril, trandolapril);
- hydrofilní, přímo aktivní a nemetabolizující se léčivá látka (lisinopril).
ACEI snižují u hypertoniků systolický i diastolický tlak snížením periferního cévního odporu, který není provázen reflexní tachykardií ani snížením srdečního výdeje. Ze všech léčiv užívaných v terapii hypertenze ACEI nejúčinněji působí na snížení cévní a srdeční hypertrofie a intersticiální fibrózy. ACEI neovlivňují metabolismus lipidů ani cukrů, naopak příznivě ovlivňují inzulinovou rezistenci a zpomalují progresi diabetické neuropatie. Při současné terapii diuretiky jsou ACEI schopny zabránit ztrátám draslíku. ACEI snižují mortalitu u pacientů s chronickým srdečním selháním a se systolickou dysfunkcí levé komory. U těchto pacientů snižují riziko výskytu fatálního infarktu myokardu. Podání ACEI v akutní fázi infarktu myokardu snižuje aktivitu RAAS i sympatoadrenergního systému, tedy je prospěšné. Měly by být podány v prvních 24 hodinách. U pacientů s ischemickou chorobou srdeční a bez známek srdečního selhávání snižují ACEI riziko kardiovaskulární mortality, infarktu myokardu a srdečního selhání. ACEI snižují riziko nefropatie u diabetiků bez proteinurie a měly by být použity u nemocných v sekundární prevenci cévní mozkové příhody jak u hypertoniků, tak u normotoniků [2]. Nejčastějším nežádoucím účinkem při léčbě ACEI je suchý kašel. Dle různých pramenů se vyskytuje až u 15 % pacientů, pouze ve 3 % je však klinicky natolik významný, aby byl důvodem k přerušení terapie. Pravděpodobnou příčinou kašle je inhibice rozkladu kininů (bradykinin) v bronchiální sliznici. Dalším závažným, ale vzácným nežádoucím účinkem, který je důvodem pro přerušení terapie, je angioedém, který se objevuje až po určité době od zahájení terapie. Podání ACEI při nedostatku Na+ a hypovolémii, např. při terapii diuretiky, může vyvolat masivní pokles krevního tlaku s poruchami mozkového a koronárního prokrvení. Při současném podávání draslíku či kalium šetřících diuretik hrozí rozvoj hyperkalémie. Současné podávání nesteroidních antiflogistik snižuje antihypertenzní účinek ACEI [2].
V případě snížené funkce ledvin je třeba přistupovat k léčbě opatrně a zvážit možné snížení dávek těch ACEI, které jsou vylučovány pouze renálně. U těch, které mají způsob vylučování renální i hepatální, nebývá snížení dávek třeba, druhý orgán zajistí dostatečnou eliminační kapacitu. Kontraindikací podání ACEI je těžká oboustranná stenóza renálních arterií, hypotenze, hypovolémie (viz výše) nebo intenzivní diuretická terapie, aortální stenóza, hypertrofická kardiomyopatie, těžká ledvinná nedostatečnost, nekontrolovatelná hyperkalémie, 2. a 3. trimestr gravidity (malformace a poruchy ledvin plodu) a laktace [1, 2]. Souhrnný přehled farmakologických vlastností ACEI 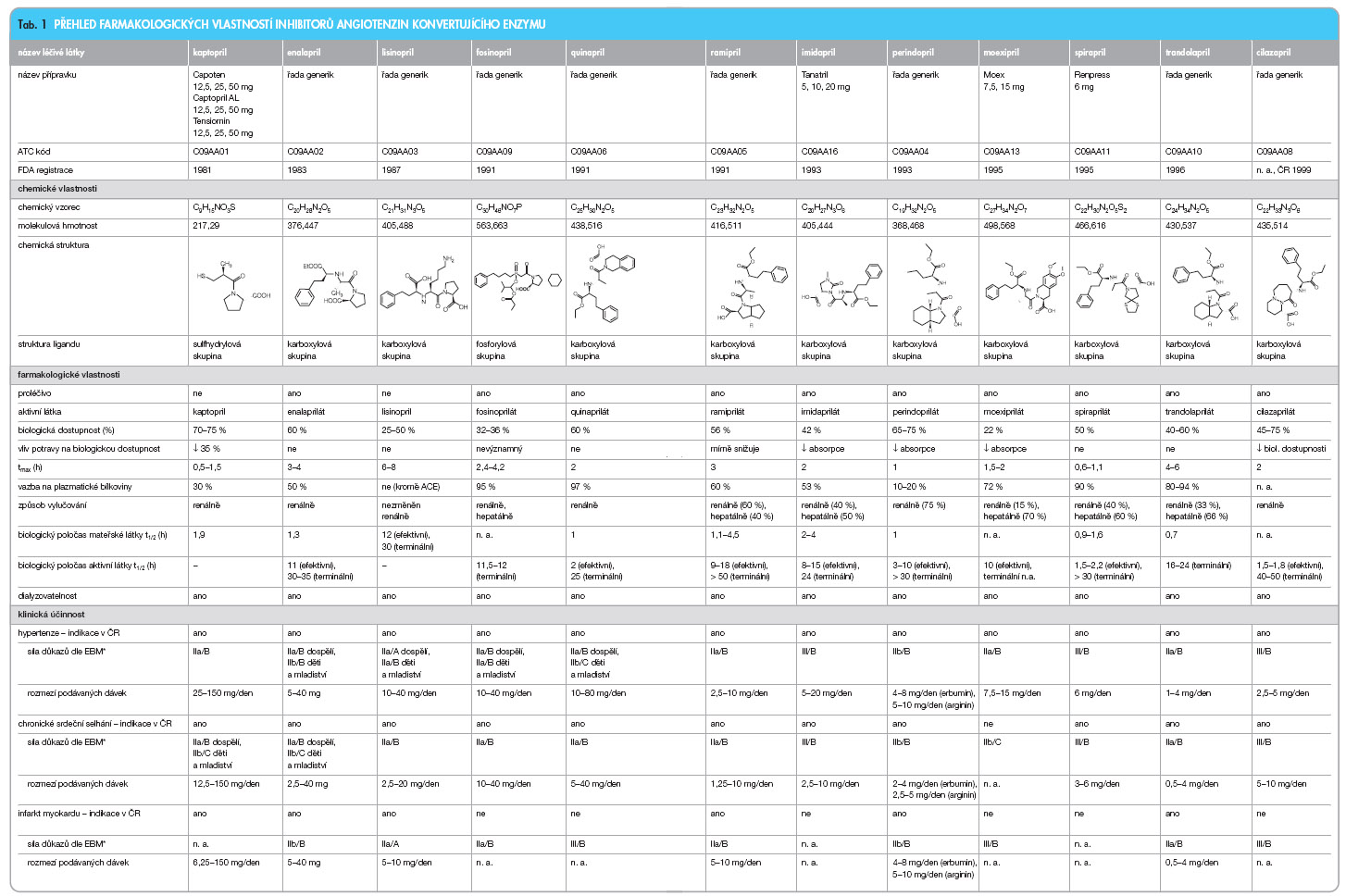 dostupných v ČR je uveden v tab. 1 [3–16]. Klinická účinnost jednotlivých látek byla hodnocena podle databáze MICROMEDEX [4] pro 3 základní indikace: hypertenze, chronické srdeční selhání a infarkt myokardu. Z dosud provedených randomizovaných kontrolovaných klinických studií vyplývá, že ACEI zlepšují přežití u pacientů po akutním infarktu myokardu (AIM). Není však zcela jasné, zda je klinický přínos pro nemocné stejný po podání všech ACEI, neboť nebyly provedeny randomizované studie, které by přímo (head-to-head) srovnávaly jednotlivé ACEI. Rozdílnou mortalitu v klinických studiích s ACEI je možné vysvětlit spíše rozdílnými kritérii při zařazování pacientů než výběrem léčiva.
dostupných v ČR je uveden v tab. 1 [3–16]. Klinická účinnost jednotlivých látek byla hodnocena podle databáze MICROMEDEX [4] pro 3 základní indikace: hypertenze, chronické srdeční selhání a infarkt myokardu. Z dosud provedených randomizovaných kontrolovaných klinických studií vyplývá, že ACEI zlepšují přežití u pacientů po akutním infarktu myokardu (AIM). Není však zcela jasné, zda je klinický přínos pro nemocné stejný po podání všech ACEI, neboť nebyly provedeny randomizované studie, které by přímo (head-to-head) srovnávaly jednotlivé ACEI. Rozdílnou mortalitu v klinických studiích s ACEI je možné vysvětlit spíše rozdílnými kritérii při zařazování pacientů než výběrem léčiva.
Pilote a kol. provedli retrospektivní kohortovou studii se 7512 pacienty staršími 65 let po AIM, kterým byl podán ACEI (enalapril, fosinopril, kaptopril, lisinopril, quinapril, perindopril nebo ramipril) [17]. Z analýzy vyplynulo, že pacienti užívající enalapril, fosinopril, kaptopril či quinapril mají vyšší 1roční mortalitu než pacienti užívající ramipril. Nicméně publikace vyvolala řadu polemik a odborných komentářů, ve kterých bylo poukazováno na metodologické nedostatky studie [18, 19]. Rozdíl v mortalitě ve výše uvedené studii je možné vysvětlit např. rozdílnou komedikací, neboť β-blokátory a statiny nejvíce užívali pacienti, kteří zároveň užívali ramipril.
Naproti tomu Hansen a kol. ve své kohortové studii se 16 068 pacienty staršími 30 let po AIM dospěli k závěru, že riziko mortality je srovnatelné bez ohledu na to, kterým ACEI (enalapril, kaptopril, perindopril, ramipril, trandolapril) byli pacienti léčeni [20]. Pouze u pacientů užívajících kaptopril bylo oproti pacientům léčeným ostatními ACEI zjištěno vyšší riziko reinfarktů. Autoři uzavírají, že spíše než na to, kterým ACEI pacienta léčit, je důležité zaměřit se na to, aby pacient byl léčen doporučenou dávkou konkrétního léčiva.
Podání ACEI rovněž snižuje mortalitu a riziko opětovných hospitalizací u pacientů s městnavým srdečním selháním. Výsledky některých studií head-to-head a metaanalýz dokladují srovnatelnou redukci mortality po podání různých ACEI. Výsledky jiných studií však toto nepotvrzují.
Podobně koncipovanou studii provedli Pilote a kol. u 43 316 pacientů starších 65 let s městnavým srdečním selháním, kterým byl předepsán jeden z uvedených ACEI – cilazapril, enalapril, fosinopril, kaptopril, lisinopril, quinapril, perindopril, ramipril [21]. Mortalita u pacientů užívajících ramipril, fosinopril, lisinopril, quinapril, perindopril a cilazapril byla srovnatelná. Nicméně u pacientů užívajících enalapril nebo kaptopril byla zaznamenána vyšší úmrtnost než u pacientů užívajících ramipril.
Seznam použité literatury
- [1] Basic and Clinical Pharmacology, Bertram G Katzung, 9th edition, McGraw-Hill 2004.
- [2] Farmakoterapie kardiovaskulárních onemocnění. Druhé, přepracované a doplněné vydání. Jiří Vítovec, Jindřich Špinar a kolektiv. Praha, Grada 2004.
- [3] MV AISLP 2008.4, Souhrny údajů o přípravcích (SPC).
- [4] Thomson MICROMEDEX® Healthcare Series Vol. 132.
- [5] Romankiewicz JA, Brogden RN, Heel RC, et al. Captopril: an update review of its pharmacological properties and therapeutic efficacy in congestive heart failure. Drugs 1983; 25: 6–40.
- [6] Todd PA, Goa KL. Enalapril. An update of its pharmacological properties and therapeutic use in congestive heart failure. Drugs 1989; 37: 141–161.
- [7] Simpson K, Jarvis B. Lisinopril: a review of its use in congestive heart failure. Drugs 2000; 59: 1149–1167.
- [8] Murdoch D, McTavish D. Fosinopril. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic potential in essential hypertension. Drugs 1992; 43: 123–140.
- [9] Culy CR, Jarvis B. Quinapril: a further update of its pharmacology and therapeutic use in cardiovascular disorders. Drugs 2002; 62: 339–385.
- [10] Warner GT, Perry CM. Ramipril: a review of its use in the prevention of cardiovascular outcomes. Drugs 2002; 62: 1381–1405.
- [11] Robinson DM, Curran MP, Lyseng-Williamson KA. Imidapril: a review of its use in essential hypertension, Type 1 diabetic nephropathy and chronic heart failure. Drugs 2007; 67: 1359–1378.
- [12] Curran MP, McCormack PL, Simpson D. Perindopril: a review of its use in patients with or at risk of developing coronary artery disease. Drugs 2006; 66: 235–255.
- [13] Brogden RN, Wiseman LR. Moexipril. A review of its use in the management of essential hypertension. Drugs 1998; 55: 845–860.
- [14] Noble S, Sorkin EM. Spirapril. A preliminary review of its pharmacology and therapeutic efficacy in the treatment of hypertension. Drugs 1995; 49: 750–766.
- [15] Peters DC, Noble S, Plosker GL. Trandolapril. An update of its pharmacology and therapeutic use in cardiovascular disorders. Drugs 1998; 56: 871–893.
- [16] Deget F, Brogden RN. Cilazapril. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic potential in cardiovascular disease. Drugs 1991; 41: 799–820.
- [17] Pilote L, Abrahamowicz M, Rodrigues E, et al. Mortality rates in elderly patients who take different angiotensin-converting enzyme inhibitors after acute myocardial infarction: a class effect? Ann Intern Med 2004; 141: 102–112.
- [18] Hennessy S, Kimmel SE. Is improved survival a class effect of angiotensin-converting enzyme inhibitors? Ann Intern Med 2004; 141: 157–158.
- [19] Horton HL. Angiotensin-converting enzyme inhibitors after acute myocardial infarction. Ann Intern Med 2005; 142: 78.
- [20] Hansen ML, Gislason GH, Ko/ber L, et al. Different angiotensin-converting enzyme inhibitors have similar clinical efficacy after myocardial infarction. Br J Clin Pharmacol 2008; 65: 217–223.
- [21] Pilote L, Abrahamowicz M, Eisenberg M, et al. Effect of different angiotensin-converting-enzyme inhibitors on mortality among elderly patients with congestive heart failure. CMAJ 2008; 178: 1303–1311.