Inkretiny na prahu roku 2012
Nová antidiabetika působící na bázi inkretinového systému ovlivňují homeostázu glukózy u diabetu zvýšením sekrece inzulinu glukózodependentním způsobem a korigují i další metabolické abnormality u pacientů s diabetem mellitem 2. typu ( DM2T), včetně kardiovaskulárních rizik. Jsou reálným příslibem, že se nám pomocí těchto nových léků podaří lépe dosáhnout požadovaných terapeutických cílů kompenzace diabetu – normalizace hyperglykemie a minimalizace kardiometabolického rizika. Inkretiny nezpůsobují hypoglykemii, dochází k úbytku hmotnosti, resp. při podávání gliptinů nedochází k přírůstku hmotnosti. Léčba inkretiny by měla být součástí včasné terapie DM2T, která by měla být vždy zahájena metforminem. Při volbě antidiabetika by měla být brána v úvahu dlouhodobost účinku i protektivní vliv inkretinů na B-buňku. Inkretiny nabízejí možnost simultánní terapeutické intervence a pravděpodobně si brzy vynutí změnu ve smyslu patofyziologicky založeného algoritmu léčby DM2T. Každopádně se prostor pro použití inkretinů v algoritmu terapie DM2T v současnosti rozšiřuje.
Úvod
Inkretiny jsou novou skupinou léků zavedenou v posledních několika letech do terapie DM2T. Během této krátké doby bylo publikováno mnoho přesvědčivých i sporných aspektů inkretinové léčby významných pro praxi. Antidiabetika na bázi inkretinového systému změnila významně paradigma terapie DM2T. Jejich přínos ke snížení koncentrace glykovaného hemoglobinu (HbA1c) je nezpochybnitelný, ale stále přibývají poznatky i o dalších pozitivních účincích [1]. Nejenže ovlivňují homeostázu glukózy glukózodependentním způsobem a splňují dosažení optimální kompenzace diabetu bez hypoglykemií, ale navíc korigují i další metabolické odchylky u DM2T a tímto způsobem příznivě ovlivňují mikrovaskulární i makrovaskulární komplikace. Inkretiny si postupně vynucují i změnu algoritmu léčby DM2T a je možno očekávat, že se mohou dostat i na druhé místo, hned po využití příznivých účinků metforminu již v počátečních stadiích onemocnění DM2T [2]. Algoritmy léčby DM2T jsou tvořeny na podkladě nových patofyziologických studií a je v nich zdůrazněno, že léčba má být včasná, komplexní a pokud možno má zamezit progresivní ztrátě funkce B-buňky, chránit B-buňky a korigovat nejenom přítomné abnormality (zvýšenou koncentraci HbA1c), ale i další patofyziologické defekty a abnormality [3].
Léčba založená na inkretinovém principu usnadňuje dosažení optimální kompenzace při minimalizaci rizika hypoglykemie, navíc při snížení hmotnosti, (resp. bez zvýšení hmotnosti – je tzv. hmotnostně neutrální), chrání i B-buňku, takže se inkretiny stávají opravdu příslibem splnění cílů terapie DM2T. Lze očekávat, že zavedením inkretinů do široké praxe se podaří u diabetiků 2. typu častěji docílit požadovaných terapeutických cílů kompenzace diabetu, protože s výjimkou studie ADVANCE je v klinických studiích dosahováno cílové (těsné) kompenzace pouze u poloviny nemocných, maximálně u 60 % z nich. Navíc studie ACCORD, ADVANCE a VADT poukázaly na skutečnost, že snaha o snížení rizika chronických komplikací může být vyvážena negativním rizikem hypoglykemie. Prokázaly, že hypoglykemie je závažnějším fenoménem intenzivní terapie DM2T, než se dříve předpokládalo [4–7].
Mechanismus účinku inkretinového systému
![Inkretinový efekt – hladiny inzulinu v krvi po podání glukózy perorálně a intravenózně u neobézních zdravých osob; upraveno podle [8] – Perley, et al., 1967](https://www.remedia.cz/photo-a-28809---.jpg) Principy inkretinových účinků střevních extraktů byly objeveny již před 120 lety (Bayliss a Starling v roce 1902). V letech 1964–1967 tři na sobě nezávislé skupiny prokázaly, že enterální podání glukózy má za následek potentnější inzulinotropní stimul – ve srovnání s izoglykemickou intravenózní zátěží (tento efekt je u diabetiků 2. typu výrazně redukován). Tento jev je znám jako inkretinový efekt a je přičítán gastrointestinálním hormonům, v současnosti především tzv. inkretinům (graf 1).
Principy inkretinových účinků střevních extraktů byly objeveny již před 120 lety (Bayliss a Starling v roce 1902). V letech 1964–1967 tři na sobě nezávislé skupiny prokázaly, že enterální podání glukózy má za následek potentnější inzulinotropní stimul – ve srovnání s izoglykemickou intravenózní zátěží (tento efekt je u diabetiků 2. typu výrazně redukován). Tento jev je znám jako inkretinový efekt a je přičítán gastrointestinálním hormonům, v současnosti především tzv. inkretinům (graf 1).
Sekrece inzulinu cestou inkretinů je zodpovědná za 1. fázi stimulované postprandiální sekrece inzulinu – dochází k ní dříve, než k sekreci mohou přispět vstřebané živiny, které jsou zodpovědné za 2. fázi stimulované inzulinové sekrece [9]. Účinek inkretinů trvá tak dlouho, jak dlouho je střevo exponováno vstřebávaným živinám, zhruba 2–3 hodiny [10]. Glukózodependentní inzulinotropní peptid (GIP) byl objeven již v 60. letech minulého století a teprve 20 let poté byl objeven glukagon-like peptid-1 (GLP-1) jako jeden ze štěpných produktů (GLP-1, GLP-2 a další proteiny exprimované v alfa-buňkách Langerhansových ostrůvků střeva nebo mozku) nově popsané molekuly proglukagonu. Vzniká posttranslačními modifikacemi tzv. GIP genu a je produkován enteroendokrinními buňkami K. V místě působení se váže na GIP receptor (GIPR). Hlavní rozdíl mezi GIP a GLP-1 (viz tab. 1) je v tom, že GIP nevede u diabetiků 2. typu k poklesu glykemie a ke zlepšení kompenzace diabetu. Z těchto důvodů se zatím v léčbě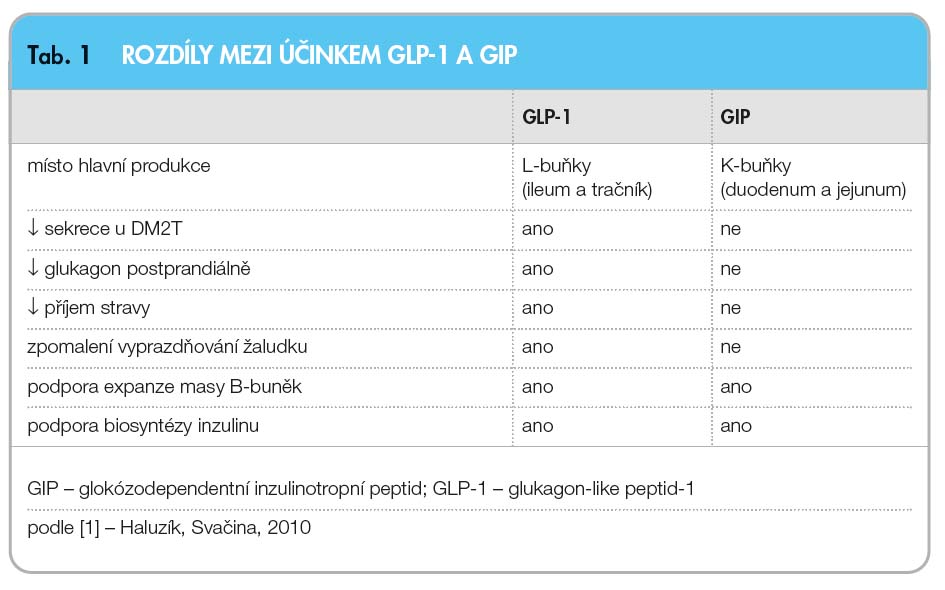 DM2T nepoužívá [1, 3].
DM2T nepoužívá [1, 3].
GLP-1 byl pojmenován na základě podobnosti s glukagonem a vzniká jako produkt posttranslačního štěpení proglukagonového genu účinkem prohormonální konvertázy. Je produkován v enteroendokrinních L-buňkách tenkého střeva (především distálního ilea a proximální části colon). GLP-1 působí přes specifický receptor GLP-1R. Vazba na receptor vede k následné aktivaci adenylátcyklázy, jejímž důsledkem je akumulace cyklického adenozinmonofosfátu (cAMP) v buňce, aktivace proteinkinázy A, zvýšení koncentrací intracelulárního vápníku a mobilizace granulí obsahujících inzulin. Tento mechanismus je přísně glukózodependentní, a proto k němu nedochází při normálních nebo nízkých hodnotách glykemií. Hladiny GLP-1 nalačno se u zdravých jedinců pohybují v rozmezí 5–10 pmol/l, postprandiálně pak stoupají na zhruba trojnásobek těchto hodnot [11]. Plazmatický poločas GLP-1 je kratičký – zpravidla se udává 1–2 minuty [12]. K jeho degradaci dochází štěpením dipeptidylpeptidázou-4 (DPP-4) na fragment GLP-1 9-36, který již není inzulinovým sekretagogem.
Biologické působení GLP-1 může příznivě ovlivnit řadu metabolických poruch a příznivě působit na průběh DM2T:
- zvyšuje citlivost B-buněk k sekrečním podnětům (restartuje 1. fázi inzulinové sekrece);
- snižuje sekreci glukagonu – snižuje výdej glukózy hepatocyty;
- zpomaluje gastrické vyprazdňování;
- zvyšuje inzulinem stimulovaný metabolismus glukózy v tukových tkáních;
- popsány jsou účinky renální, neuroprotektivní a kardioprotektivní.
V experimentu se prokázalo, že GLP-1 snižuje rychlost B-buněčné apoptózy, podporuje diferenciaci prekurzorových buněk, proliferaci/regeneraci B-buňky a vede tak ke zvýšení B-buněčné hmoty [5, 13].
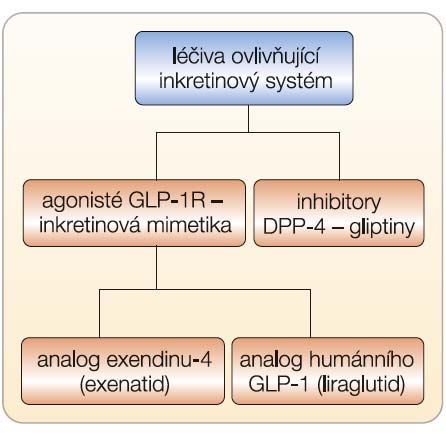
Rychlá proteolytická degradace a inaktivace všudypřítomným enzymem DPP-4 a renální eliminací vedla k vývoji dvou skupin léčiv (obr. 1):
- inkretinových mimetik, která jsou rezis-tentní vůči působení DPP-4. Jsou to agonisté receptoru GLP-1. Agonistou GLP-1R může být molekula částečně podobná GLP-1, která aktivuje GLP-1R (sem patří exenatid – jako analog exendinu-4, prvně představený v roce 2005), a potom skutečný analog GLP-1, tedy pozměněná molekula humánního GLP-1 (např. první humánní analog GLP-1 – lira-glutid);
- inhibitorů dipeptidylpeptidázy-4 (sitagliptin prvně představený v roce 2007), které představují terapeutickou alternativu, jež spočívá v zamezení rychlé degradace GLP-1, čímž se prodlužuje jeho účinek [14–17].
Agonisté GLP-1 v léčbě diabetu 2. typu
Exenatid
Prvním agonistou GLP-1R zavedeným do terapie DM2T byl exenatid. Je syntetickou verzí analoga exendinu-4, objeveného v krvi a izolovaného ze slin ještěrky Heloderma suspectum (korovec jedovatý) jako odpověď na potravu. Exenatid, označený jako inkretinové mimetikum, působí na lidský GLP-1R aktivací stejných signálních kaskád jako endogenní GLP-1. Jeho farmakologické vlastnosti jsou obdobné jako u GLP-1.
Podávání exenatidu bylo odzkoušeno v mnoha velkých klinických studiích ve všech stadiích onemocnění DM2T, a to jak v monoterapii, tak v kombinaci s jinými antidiabetiky (metforminem, deriváty sulfonyl-urey, glitazony) a inzulinem. Ve všech těchto kombinacích vedlo podávání exenatidu ke zlepšení koncentrace HbA1c v průměru o 0,5–1,3 % a k poklesu hmotnosti [18–20]. Zvláště příznivý je trvalý pokles hmotnosti, který se pohybuje v rozmezí od 2 kg do 6,5 kg během půlroční léčby. Exenatid významně ovlivňuje postprandiální glykemii. Je nutno jej podávat injekčně 2krát denně, což vysvětluje jeho výraznější účinnost při snížení postprandiální glykemie a menší efekt na glykemii nalačno [21–24].
Exenatid LAR
Tato nová modifikovaná forma exena-tidu – s prodlouženým uvolňováním (LAR, long-acting release) – byla schválena Evropskou lékovou agenturou v roce 2011. Exenatid LAR poskytuje kontinuální kontrolu glykemie při podávání 1krát týdně a je indikován k léčbě DM2T dospělých pacientů v kombinaci s dalšími běžně předepisovanými perorálními antidiabetiky. Jeho účinnost byla prokázána v rozsáhlých programových klinických studiích. V těchto studiích došlo k významnému poklesu hodnoty HbA1c (o 1,7 %), byl zaznamenán významný pokles hmotnosti léčených (o 3,8 kg během 15 týdnů) a menší výskyt nežádoucích účinků, zvláště gastrointestinálních potíží u pacientů [1, 25, 26].
Liraglutid
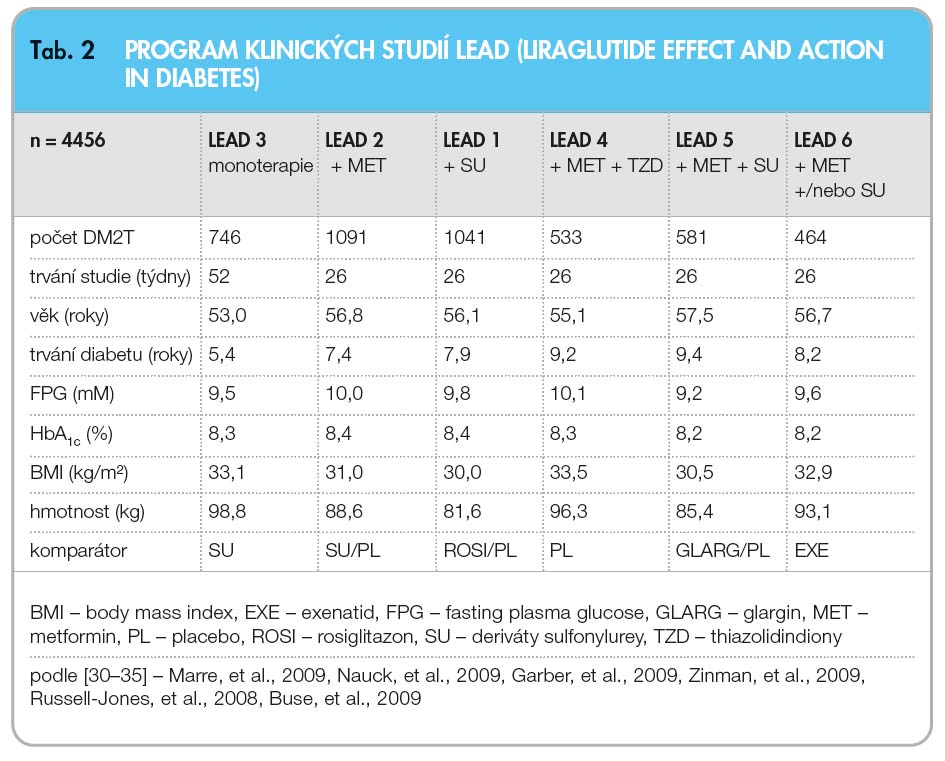 Liraglutid je analog humánního GLP-1. Silná vazba na sérový albumin prodlužuje jeho účinek, a proto může být aplikován pouze jednou denně. Molekula liraglutidu má 97% shodnost struktury s lidským GLP-1. Pokles glykemie nalačno i postprandiálně je závislý na dávce liraglutidu a koreluje pozitivně s výškou vstupní glykemie [27, 28]. Účinky na glykemii nalačno jsou výraznější než účinky na glykemii postprandiální [29]. Účinnost liraglutidu byla podrobně zkoumána sérií klinických studií LEAD 1–6 (Liraglutide Effect and Action in Diabetes), viz tab. 2.
Liraglutid je analog humánního GLP-1. Silná vazba na sérový albumin prodlužuje jeho účinek, a proto může být aplikován pouze jednou denně. Molekula liraglutidu má 97% shodnost struktury s lidským GLP-1. Pokles glykemie nalačno i postprandiálně je závislý na dávce liraglutidu a koreluje pozitivně s výškou vstupní glykemie [27, 28]. Účinky na glykemii nalačno jsou výraznější než účinky na glykemii postprandiální [29]. Účinnost liraglutidu byla podrobně zkoumána sérií klinických studií LEAD 1–6 (Liraglutide Effect and Action in Diabetes), viz tab. 2.
Ve studii LEAD 6, v přímém srovnání liraglutidu s exenatidem, byl liraglutid po-dávaný jednou denně mírně účinnější ve snížení HbA1c než exenatid podávaný 2krát denně (rozdíl 0,23 %), což je dáno pravděpodobně výraznějším vlivem liraglutidu na glykemii nalačno. Vliv na tělesnou hmotnost a krevní tlak byl u obou preparátů srovnatelný. Vzhledem k tomu, že v ČR je plně hrazena pouze dávka 1,2 mg denně, je namístě uvést, že liraglutid byl ve studii užíván v dávce 1,8 mg denně.
Zcela nedávno byla uveřejněna klinická studie primárně non-inferiorní, která porovnávala terapii liraglutidem v dávce 1,2 mg a 1,8 mg denně s terapií sitagliptinem u pacientů s DM2T. Léčba liraglutidem vedla k významnějšímu poklesu hladiny glykovaného hemoglobinu, byla také ale zatížena vyšší incidencí dyspeptických potíží [36].
Nová inkretinová analoga
V řadě studií jsou testovány nové účinné látky:- albiglutid – fúzování molekuly s albuminem umožňuje delší účinek (možnost podávání 1krát týdně až 1krát měsíčně) [37, 38]. Recentně byl vývoj preparátu pro větší incidenci nežádoucích účinků zastaven;
- taspoglutid;
- lixisenatid – struktura lixisenatidu je odvozena od exendinu-4, přípravek se však podává 1krát denně, má za sebou již třetí fázi klinického zkoušení a počítá se s jeho kombinací s inzulinem glarginem v jedné stříkačce [39, 40].
Inhibitory dipeptidylpeptidázy-4 – gliptiny
Gliptiny jsou druhou velmi účinnou cestou využití endogenních inkretinů GLP-1 a GIP v terapii DM2T. DPP-4 je komplexní enzym lokalizovaný na buněčné membráně. Strukturálně náleží do komplexní genové rodiny faktorů, které se ve většině případů podílejí na štěpení bioaktivních peptidů. Důsledkem účinku DPP-4 je degradace řady hormonů a chemokinů.
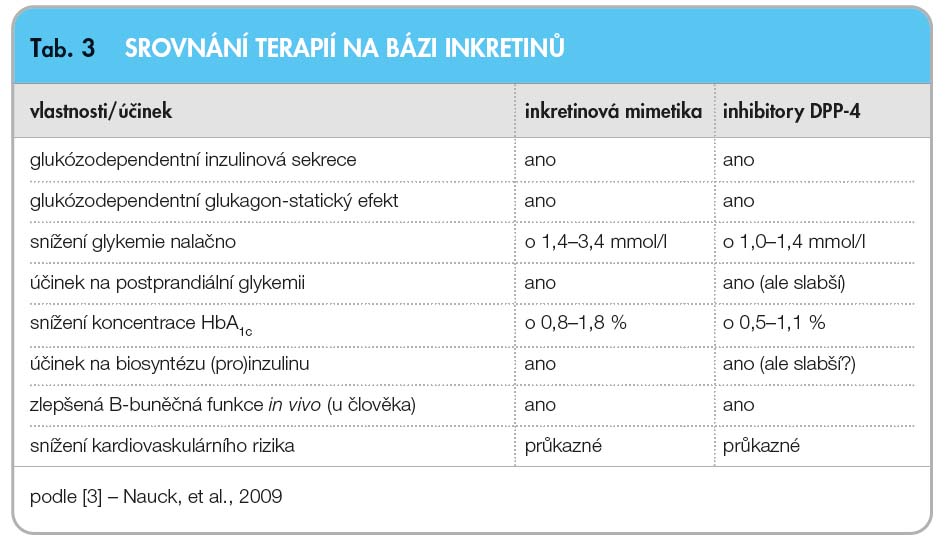 Gliptiny zamezují rychlé degradaci GLP-1, čímž se dosáhne prodloužení biologického poločasu GLP-1 a dochází tím ke snížení glykemie zprostředkované zvýšením sekrece inzulinu (ovlivněné však také snížením koncentrace glukagonu). Velkou výhodou gliptinů je perorální podávání. Plnohodnotný účinek je však vázán na přítomnost dostatečné sekrece vlastního GLP-1. Nejvýznamnějším efektem gliptinů je zvýšení citlivosti B-buněk Langerhansových ostrůvků a obnova první fáze inzu-linové sekrece. Nezvyšují hmotnost pa-cientů a jsou dobře tolerovány. Inhibitory DPP-4 snižují postprandiální exkurze glykemií [42]. Podobnosti i rozdílnosti v terapii na bázi inkretinů byly studovány v řadě prací a jsou shrnuty v tab. 3.
Gliptiny zamezují rychlé degradaci GLP-1, čímž se dosáhne prodloužení biologického poločasu GLP-1 a dochází tím ke snížení glykemie zprostředkované zvýšením sekrece inzulinu (ovlivněné však také snížením koncentrace glukagonu). Velkou výhodou gliptinů je perorální podávání. Plnohodnotný účinek je však vázán na přítomnost dostatečné sekrece vlastního GLP-1. Nejvýznamnějším efektem gliptinů je zvýšení citlivosti B-buněk Langerhansových ostrůvků a obnova první fáze inzu-linové sekrece. Nezvyšují hmotnost pa-cientů a jsou dobře tolerovány. Inhibitory DPP-4 snižují postprandiální exkurze glykemií [42]. Podobnosti i rozdílnosti v terapii na bázi inkretinů byly studovány v řadě prací a jsou shrnuty v tab. 3.
 Současné gliptiny používané v klinické praxi jsou vysoce selektivní inhibitory DPP-4. U neselektivních inhibitorů tohoto enzymu, např. DPP-8, DPP-9, byly pro-kázány závažné nežádoucí účinky, jako např. vztah k progresi růstu maligních nádorů. Avšak u selektivních inhibitorů DPP-4 kauzální vztah k růstu maligních nádorů potvrzen nebyl [1].
Současné gliptiny používané v klinické praxi jsou vysoce selektivní inhibitory DPP-4. U neselektivních inhibitorů tohoto enzymu, např. DPP-8, DPP-9, byly pro-kázány závažné nežádoucí účinky, jako např. vztah k progresi růstu maligních nádorů. Avšak u selektivních inhibitorů DPP-4 kauzální vztah k růstu maligních nádorů potvrzen nebyl [1].
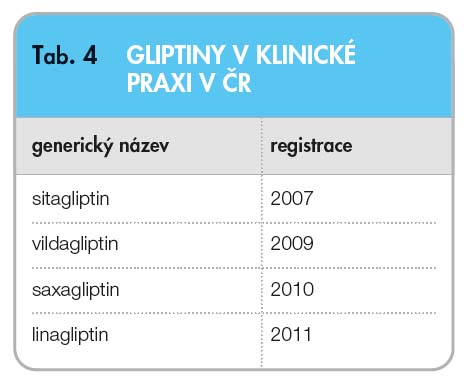
První inhibitor DDP-4 – sitagliptin – byl zaregistrován v Evropě i v ČR již v roce 2007. Od té doby byly do klinické praxe v ČR uvedeny i další gliptiny (tab. 4). Mezi jednotlivými gliptiny nejsou zásadní rozdíly. Při detailnějším studiu rozdílů posuzujeme:
- inhibiční aktivitu – průměrně 70–95% inhibice (a to jak při podání jednotlivé, tak vícenásobné denní dávky);
- přetrvávání 85% inhibice (v hodinách) – souvisí s vyrovnaností hladiny léků (12, 24, 48 hod.);
- redukci HbA1c ve středním dávkování, resp. kombinační terapii;
- možnosti kombinace s perorálními antidiabetiky a s inzulinem;
- redukci/kolísání glykemií v závislosti na dávce;
- redukci lačné a postprandiální glykemie;
- selektivitu pro FPA-a (fibroblast activa-tion protein-alfa);
- zlepšení funkce B-buňky a inzulinové citlivosti;
- chemickou strukturu a vazebnost DPP-4 na bílkoviny, což souvisí s eliminací (renální insuficience);
- různost biotransformace – konverze gliptinů v závislosti na formách cytochromů systému P-450 (jaterní insuficience);
- nežádoucí účinky (nauzea, GIT potíže, respirační či močové infekce, bolesti zad).
Všechny gliptiny, které jsou v ČR na trhu, lze dle SPC kombinovat s ostatními per-orálními antidiabetiky. Nejsou mezi nimi podstatnější rozdíly co do antidiabetických i metabolických účinků – gliptiny jsou vhodné při léčbě časných stadií DM2T.
Je nutná zachovalá sekrece inzulinu, jejich působení na funkci dalších orgánů odpovídá působení GLP-1. Nelze prokázat kauzální spojitost mezi léčbou gliptiny a pankreatitidou, vznikem nádorů, resp. diseminací nádorů. Dle SPC však existují rozdíly při podávání v kombinaci s inzulinem a při jaterním a renálním postižení [43]. Linagliptin lze podávat z důvodů odlišné cesty metabolismu ve všech stadiích renální insuficience bez nutnosti úpravy dávky [44].
Účinky na B-buňku Langerhansových ostrůvků pankreatu
GLP-1 snižuje rychlost B-buněčné apoptózy – má protiapoptotický účinek, přidání GLP-1 do média snížilo apoptózu
B-buněk o 20 % [45]. Podporuje diferen-ciaci prekurzorových buněk, proliferaci/ regeneraci B-buňky a vede tak ke zvýšení objemu buněčné hmoty [5, 13]. Tyto účinky čekají na ověření v klinické praxi.
Extrapankreatické účinky inkretinů
Extrapankreatické účinky inkretinů jsou zkoumány již od začátku zavedení inkre-tinového principu do terapie diabetu.Účinky na myokard a na kardiovaskulární systém
Receptor GLP-1 je exprimován v kardiomyocytech [46] a v experimentu u myší byly při exogenním podávání GLP-1 prokázány pozitivně inotropní i chronotropní účinky. U myší s knockoutovaným receptorem pro GLP-1 byla nalezena jak horší kontraktilita levé komory srdeční, tak i diastolická dysfunkce [47]. V klinické studii byl u pacientů s akutním infarktem myokardu prokázán po podání GLP-1 vzestup ejek-ční frakce [48]. Téhož cíle bylo dosaženo v experimentu na psech s chronickou kardiální nedostatečností. Podávání inkretinů u pacientů s hypertenzí vede k poklesu krevního tlaku [49]. GLP-1 zvyšuje vychytávání glukózy kardiomyocyty a dochází ke zvýšení inzulinové senzitivity srdečního svalu [46]. V klinických studiích bylo u pacientů se srdečním selháním zjištěno zlepšení ejekční frakce a kardiovaskulární výkonnosti [50]. K podobným výsledkům se dospělo v klinické praxi, i pokud byla podávána léčba agonisty GLP-1 [51]. Kardioprotektivní účinek inkretinů (exenatidu) byl prokázán u pacientů se STEMI infarktem myokardu [52]. Tyto studie podporují úvahy o možnosti rozšíření indikací týkajících se prevence a terapie kardiologických onemocnění.
Účinky na nervový systém
GLP-1 působí prostřednictvím ovlivnění vagální aktivity a prostřednictvím nucleus arcuatus snížení pocitu hladu [53]. GLP-1 je syntetizován též v mozkovém kmeni a snižuje glukózový metabolismus v hypotalamu i v mozkovém kmeni. V pokusech u hlodavců stimuloval neurogenezi a měl neuroprotektivní účinek [54]. V experimentu byly opakovaně prokázány proliferativní neurogenní a antiapoptotické účinky na neuronech [55]. Předpokládá se a jsou známy studie o příznivém vlivu agonistů GLP-1 u neurodegenerativních chorob CNS a u Alzheimerovy, Parkinsonovy a Hun-tingtonovy nemoci [2, 56].
Dále jsou zkoumány účinky inkretinů na vyprazdňování žaludku, na energetický příjem [10], použití agonistů GLP-1 u obézních diabetiků i nediabetiků [2, 57].
Závěr
Na kongresech ADA/EASD (American Diabetes Association/European Association for the Study of Diabetes) a IDF (International Diabetes Federation) v roce 2011 zazněla řada přednášek věnovaných patofyziologii inkretinů, terapii na bázi inkretinového systému a byly předneseny zá-věry desítek experimentálních prací. Mezi potenciální faktory, které podporují a vysvětlují snížení inkretinového efektu u DM2T, patří snížení maximální kapacity inzulinové sekrece, redukce sekrece GLP-1, specifická ztráta aktivity GIP, genetický defekt – polymorfismus receptoru GIP (desenzibilita receptorů jako odpověď na hyperglykemii). V současnosti převažuje názor, že defekt inkretinového účinku u pacientů s DM2T nepatří k primárním příčinám onemocnění, ale je následkem hyperglykemie – poruchy homeostázy. Michael Nauck shrnul na kongresu IDF pokroky v inkretinové terapii, rozvedl příznivé aspekty biologických aktivit inkretinové terapie – její dobrou snášenlivost, výhodu, že inkretiny nelze „předávkovat“, že nevyžadují složitou titraci dávek při zahájení léčby, monitoring, nezpůsobují hypoglykemii (jen v případech, kdy jsou kombinovány s antidiabetiky, která sama o sobě způsobují hypoglykemii), dále při terapii inkretiny nedochází ke zvýšení hmotnosti (ba právě naopak), dovolují větší flexibilitu běžného života nemocných s cukrovkou a mají ještě další velmi příz-nivé účinky, které snižují výskyt mikro- a makrovaskulárních komplikací. Nutno však dodat, že k potvrzení snížení výskytu kardiovaskulárních komplikací nutno vyčkat výsledků dlouhodobých studií. V současné době probíhají studie s liraglutidem – LEADER, s exenatidem LAR – EXSCEL, se sita-gliptinem – TECOS a další. Je nutno také dodat, že zatím nebyla prokázána dlouhodobá stabilita kompenzace – pozastavení progrese DM2T.
Seznam použité literatury
- [1] Haluzík M, Svačina Š. Inkretinová léčba diabetu. Praha: Mladá fronta, 2010, 135 s.
- [2] Haluzík M, Urbanová M, Haluzíková D, Trachta
- [3] Nauck MA, Vilsboll T, Gallwitz B, et al. Incretin-Based Therapies. Diabetes Care 2009; 32: S223–S231.
- [4] ADVANCE Collaborative group. Intensive blood glucose control and vascular outcomes in pa-tients with type 2 diabetes. N Engl J Med 2008; 358: 2560–2572.
- [5] Bhushan R, Elkind-Hirch KE, Bhushan M, et al. Improved glycemic control and reduction of cardiometabolic risk factors in subjects with type 2 diabetes and metabolic syndrome treated with exenatide in a clinical practice setting. Diabetes Technol Ther 2009; 11: 353–359.
- [6] Bonds DE, Miller ME, Bergenstal RM, et al.
- [7] Duckworth W, Abraira C, Moritz T, et al. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009; 360: 129–139.
- [8] Perley MJ, Kipnis DM. Plasma insulin responses to oral and intravenous glucose: studies in normal and diabetic subjects. J Clin Invest 1967; 46: 1954–1962.
- [9] Nauck M. The modulating effects of GLP-1 in type 2 diabetes. Br J Diabetes Vasc Dis 2008; 8: S1–2.
- [10] Anděl M, Wildová E, Bojarová A, et al. Znalosti o významu GLP-1 změnily možnosti léčby diabetu, jejich využití však může být mnohem širší. DMEV 2011; 14: 15–21.
- [11] Holst JJ. The physiology of glucagon-like pep-tide 1. Physiol Rev 2007; 87: 1409–1439.
- [12] Visboll T, Agerso H, Krarup T, Holst JJ. Similar
- [13] Bunck MC, Diamant M, Corner A, et al. One-year treatment with exenatide improves beta-cell fiction compared to insulin margine, in metformin treated type 2 diabetes patients: a randomized, controlled trial. Diabetes Care 2009; 32: 762–768.
- [14] Amori RE, Lau J, Pittas AG. Efficacy and safety of incretin therapy in type 2 diabetes: systematic review and meta-analysis. JAMA 2007; 298: 194–206.
- [15] Monami M, Marchionni N, Mannucci E. Glucagon-like peptide-1 receptor agonists in type 2 diabetes: a meta-analysis of randomized clinical trials. Eur J Endocrinol 2009; 160: 909–917.
- [16] Butler PC, Dry S, Elashoff R. GLP-1-based therapy for diabetes: what you do not know can hurt you. Diabetes Care 2010; 33: 453–455.
- [17] Perušičová J. Inkretinová mimetika v léčbě diabetes mellitus 2. typu. In: Perušičová J. a kol. Léčba inzulínem a diabetes mellitus 2. typu.
- [18] Kim D, MacConell L, Zhuang D, et al. Effects of once-weekly dosing of a long-acting release
- [19] McCall AL, Cox DJ, Brodows R, et al. Reduced daily risk of glycemic variability: comparison of exenatide with insulin glargine. Diabetes Technic Ther 2009; 11: 339–344.
- [20] Bergenstal R, Lewin A, Bailey T, et al. Efficacy and safety of biphasic insulin aspart 70/30 versus exenatide in subjects with type 2 diabetes failing to achieve glycemic control with metformin and a sulfonylurea. Curr Med Res Opin 2009; 25: 65–75.
- [21] Klonoff DC, Buse JB, Nielsen LL, et al. Exena-tide effects on diabetes, obesity, cardiovascular risk factors and hepatic biomarkers in patients with type 2 diabetes treated for at lest 3 years. Curr Med Res Opin 2008; 24: 275–286.
- [22] Rybka J. Inkretinový přístup mění paradigmata terapie a prevence diabetu 2. typu i jeho kompli-kací. Medicína po promoci 2010; 11: 76–83.
- [23] Kvapil M. Inkretiny změnily a dále mění strategii léčby diabetu 2. typu. Vnitř Lék 2011; 57: 916–918.
- [24] Rybka J, Kvapil M. Inkretinová léčba diabetu. Postgraduální medicína 2011; 13: 441–450.
- [25] Haluzík M. a kol. Praktická léčba diabetu. Praha: Mladá fronta, 2009, 361 s.
- [26] The International Diabetes Federation Diabetes Atlas. Available at http://www.diabetesatlas. org/content/what-is-diabetes. Accessed 23 March 2011.
- [27] Rosenstock J, Baron MA, Dejager S, et al. Comparison of vildagliptin and rosiglitazone mono-therapy in patients with Type 2 diabetes. Dia-betes Care 2007; 30: 217–223.
- [28] Vilsboll T. Liraglutide: a new treatment for type 2 diabetes. Drugs Today 2009; 45: 101–113.
- [29] Montanya E, Sesti G. A review of efficacy and safety data regarding the use of liraglutide, a once-daily human glucagon-like peptide 1 analogue, in the treatment of type 2 diabetes mellitus. Clin Ther 2009; 31: 2472–2488.
- [30] Marre M, Shaw J, Brändle M, et al. Liraglutide, a once-daily human GLP-1 analogue, added to a sulphonylurea over 26 weeks produces greater improvements in glycaemic and weight control compared with adding rosiglitazone or placebo in subjects with Type 2 diabetes (LEAD-1 SU). Diabet Med 2009; 26: 268–278.
- [31] Nauck M, Frid A, Hermansen K, et al. Efficacy and safety comparison of liraglutide, glimepiride, and placebo, all in combination with metformin, in type 2 diabetes: the LEAD (liraglutide effect and action in diabetes)-2 study. Diabetes Care 2009; 32: 84–90.
- [32] Garber A, Henry R, Ratner R, et al. Liraglutide versus glimepiride monotherapy for type 2 diabetes (LEAD-3 Mono): a randomised, 52-week, phase III, double-blind, parallel-treatment trial. Lancet 2009; 373: 473–481.
- [33] Zinman B, Gerich J, Buse JB. Efficacy and Safety of the Human Glucagon-Like Peptide-1 Analog Liraglutide in Combination With Metformin and Thiazolidinedione in Patients With Type 2 Diabetes (LEAD-4 Met+TZD). Diabetes Care 2009; 32: 1224–1230.
- [34] Russel-Jones D, Vaag A, Schmitz O, et al. Signi-ficantly better glycemic control and weight reduction with liraglutide, a once-daily human GLP-1 analog, compared with insulin glargine: all as add-on to metformin and a sulfonylurea in type 2 diabetes. Diabetes 2008; 57: A159.
- [36] Pratley RE, Nauck M, Bailey T, et al. Liraglutide versus sitagliptin for patients with type 2 dia-betes who did not have adequate glycaemic
- [37] Rosenstock J, Reusch J, Bush M, et al. Albi-
- [38] Tomkin GH. Albiglutid, an albumin-based vision of glucagon-like peptide 1 for the potential
- [39] Christensen M, Knop FK, Holst JJ, et al. Lixisenatide, a novel GLP-1 receptor agonist for the treatment of type 2 diabetes mellitus. Drugs 2009; 12: 503–513.
- [40] Christensen M, Knop FK, Vilsbo/ll T, et al. Lixisenatide for type 2 diabetes mellitus. Expert
- [41] Svačina Š. GLP-1 agonisté v léčbě obezity. In: Haluzík M, Svačina Š. Inkretinová léčba diabetu. Praha: Mladá fronta, 2010: 113–133.
- [42] Mattei P, Boehringer M, Di Giorgio P., et al. Discovery of carmegliptin: a potent and long-acting dipeptidylpeptidase IV-inhibitor for the treatment of type 2 diabetes. Bioorg Med Chem Lett 2010; 20: 1109–1113.
- [43] Bouček P, Kvapil M, Monhart V, et al. Doporučené postupy při diabetickém onemocnění ledvin, revidováno ke dni 14. června 2011, dostupné na www. diab.cz/dokumenty/standard_ledviny.pdf
- [44] Ghatak SB, Patel DS, Shanker N, et al. Lina-gliptin: a Novel Xanthine-Based Dipeptidyl Peptidase-4 Inhibitor for Treatment of Type II Diabetes Mellitus. Curr Diabetes Rev 2011; 7: 325–335.
- [45] Buteau J, El-Assad W, Rhodes CJ, et al. Glucagon-like peptide-1 prevents beta cell glucolipotoxicity. Diabetologia 2007; 47: 806–815.
- [46] Ban K, Nosan-Ashraf MH, Hoefer J, et al. Cardioprotective and vasodilatory actions of glucagon-like peptide 1 receptor are mediated through both glucagon-like peptide 1 receptor-dependent and -independent pathways. Circulation 2008; 117: 2340–2350.
- [47] Gross R, You X, Baggio Ll, et al. Cardiac function in mice lacking the glucagon-like peptide-1 receptor. Endocrinology 2003; 144: 2242–2252.
- [48] Nikolaidis LA, Mankad S, Sokos GG, et al. Effects of glucagon-like peptide-1 in patients with acute myocardial infarction and left ventricular dysfunction after succesful reperfusion. Circulation 2004; 109: 962–965.
- [49] Barragán JM, Rodríguez RE, Blázquez E. Changes in arterial blood pressure and heart rate induced by glucagon-like peptide-1-(7-36) amide in rats. Am J Physiol 1994; 266: E459–E466.
- [50] Sokos GG, Nikolaidis LA, Mankad S, et al. Glucagon-like peptide-1 infusion improves left ventricular ejection fraction and functional status in patients with chronic heart failure. J Card Fail 2006; 12: 694–699.
- [51] Ban K, Kim KGH, Cho CK, et al. Glucagon-like peptide (GLP)-1 (9-36) amide-mediated cytoprotection is blocked by exendin (9-39) yet does not rerquire the known GLP-1 receptor. Endo-crinology 2010; 151: 1520–1531.
- [52] Lonborg J, Vejlstrup N, Kelbaek H, et al. Exenatide reduces reperfusion injury in patients with ST-segment elevation myocardial infarction. Eur Heart J 2011, Epub 2011/09/14.
- [53] Abu-Hamdah R, Rabiee A, Meneilly GS, et al. Clinical review: The extrapancreatic effects of glucagon-like peptide-1 and related peptides. J Clin Endocrinol Metab 2009; 94: 1843–1852.
- [54] Bertilsson G, Patrone C, Zachrisson O, et al. Peptide hormone exendin-4 stimulates subventricular zone neurogenesis in the adult rodent brain and induces recovery in an animal model of Parkinson’s disease. J Neurosci Res 2008; 86: 326–338.
- [55] Abbas T, Faivre E, Hölscher C. Impairment of synaptic plasticity and memory formation in
- [56] McClean PL, Fauly VA, Harriott P, et al. Glucagon-like peptide-1 analogues enhance synaptic plasticity in the brain: a link between diabetes and Alzheimer’s disease. Eur J Pharmacol 2010; 630: 158–162.
- [57] Kielgast U, Holst JJ, Madsbad S. Treatment of type 1 diabetic patients with glucagon-like peptide-1 (GLP-1) and GLP-1R agonists. Curr Diabetes Rev 2009; 5: 266–275.