Ixekizumab v léčbě psoriatické artritidy
Souhrn:
Pavelka K. Ixekizumab v léčbě psoriatické artritidy. Remedia 2021; 31: 206–212.
Biologická léčba blokátory tumor nekrotizujícího faktoru (TNF) přinesla výrazný pokrok do léčby psoriatické artritidy (PsA). Nicméně u 30‒40 % pacientů tato léčba selhává, byly tedy hledány biologické chorobu modifikující léky s jiným mechanismem účinku a prvními úspěšnými se staly blokátory interleukinu (IL) 17A. Ixekizumab (IXE) představuje humanizovanou monoklonální protilátku s vysokou afinitou, která má vysokou specificitu pro IL‑17A. Proběhly tři zásadní klinické studie fáze III v indikaci PsA. Do studie SPIRIT‑P1 byli zařazováni pacienti naivní k biologické léčbě, a to do tří ramen s podáním IXE po čtyřech týdnech, po dvou týdnech a s placebem. Primárního cíle – 20% zlepšení podle American College of Rheumatology (ACR 20) – bylo dosaženo. Ve studii SPIRIT‑P2 byl IXE testován u pacientů se selháním léčby anti-TNF v minulosti. Primárního cíle – ACR 20 v týdnu 24 – bylo dosaženo ve skupině s podáním IXE po čtyřech týdnech u 53 % pacientů, ve skupině s podáním po dvou týdnech u 48 % pacientů a v placebové skupině u 20 % osob. Ve studii SPIRIT‑H2H byl IXE v otevřeném sledování srovnáván s adalimumabem. Primárního cíle – simultánní odpovědi 50% zlepšení podle ACR (ACR 50) a 100% zlepšení podle Psoriasis Area and Severity Index (PASI 100) v týdnu 24 – dosáhlo signifikantně více pacientů léčených IXE oproti adalimumabu a tento rozdíl přetrvával až do týdne 52. Bezpečnostní profil IXE je obdobný jako u anti‑TNF léků. Léčivo, které představuje novou alternativu biologické léčby PsA, může být zvláště výhodné u pacientů s větším rozsahem psoriázy.
Summary:
Pavelka K. Ixekizumab in the treatment of psoriatic arthritis. Remedia 2021; 31: 206–212.
Biological therapy with tumor necrotizing factor (TNF) blockers brought a significant progress in the treatment of psoriatic arthritis (PsA). However, this treatment fails in 30‒40% of patients; therefore, new biological disease‑modifying drugs with a different mechanism of action were investigated, with interleukin (IL) 17A blockers being the first successful ones. Ixekizumab (IXE) represents a humanized monoclonal antibody with high affinity and specificity for IL‑17A. Three pivotal phase III clinical trials for PsA have been conducted. In SPIRIT‑P1 study, patients naive to biological therapy were randomized into three arms, with IXE administered every 4 weeks and every 2 weeks, and with placebo. The primary endpoint – 20% improvement according to American College of Rheumatology (ACR 20) – was reached. In SPIRIT‑P2 study, IXE was evaluated in patients with TNF blocker treatment failure in the past. Primary endpoint – ACR20 in week 24 – was achieved in 53% of patients in the group receiving IXE every 4 weeks, in 48% of patients receiving IXE every 2 weeks and in 20% of patients in the placebo group. In an open‑label SPIRIT‑H2H study, IXE was compared with adalimumab. The primary endpoint – a simultaneous response of 50% improvement according to ACR (ACR50) and 100% improvement according to Psoriasis Area and Severity Index (PASI 100) in week 24 – was reached in significantly more patients treated with IXE compared with adalimumab, with continuation of this difference up to week 52. The safety profile of IXE is comparable to those of anti‑TNF drugs. The drug representing a new alternative in biological therapy of PsA can be especially beneficial in patients with larger psoriatic areas.
Key words: psoriatic arthritis, biologic therapy, ixekizumab.
Úvod
Psoriatická artritida (PsA) je zánětlivé chronické onemocnění, které potenciálně vede k destrukci kloubů, zhoršení jejich funkce, k poklesu kvality života a vyšší mortalitě [1]. Psoriatická artritida je rovněž často doprovázena extraartikulárními projevy a komorbiditami, které dále zvyšují závažnost onemocnění a zátěž pro pacienta i společnost [2].
Problémem léčby PsA je její heterogenita. Dříve se onemocnění často dokonce rozdělovalo do několika typů [3], avšak dnes se takto striktně neklasifikuje. Na druhé straně je ale z hlediska výběru optimální léčby vhodné určitou stratifikaci provést. Z tohoto úhlu pohledu je potřebné rozlišit, zda jde o čistě, či převážně axiální formu PsA, oligoartritidu, polyartritidu, převážně entezitidu a zda jsou přítomny extraartikulární projevy (např. idiopatické střevní záněty nebo uveitida). Důležitý je také samozřejmě rozsah postižení kůže, eventuálně i nehtů.
Heterogenita PsA se odráží i v relativně komplikovaných doporučeních pro léčbu. V evropském prostoru se nejvíce používají Doporučení Evropské ligy proti revmatismu (EULAR) pro léčbu PsA [4], jež jsou nejdůležitějším zdrojem pro tvorbu guidelines národních odborných společností.
Základní strategií terapie PsA je podobně jako u jiných zánětlivých revmatických onemocnění princip léčby k cíli (treat to target, T2T) [5]. Pilíři strategie T2T je měření aktivity PsA pomocí validizovaných ukazatelů, stanovení cíle léčby v určitém časovém intervalu a při jeho nedosažení adjustace léčby. Již zmíněná heterogenita PsA a postižení více systémů jsou příčinou obtíží při hodnocení odpovědi na léčbu, hodnocení stavu nízké aktivity či remise.
Terapie PsA je rozčleněna do několika kroků. Iniciálně se podávají nesteroidní antirevmatika (NSA), přičemž na rozdíl od revmatoidní artritidy může být jejich efekt u řady mírných forem PsA dostatečný. Nesteroidní antirevmatika však nemají vliv na kožní syndrom. V případě monoartritidy nebo entezitidy se mohou NSA doplnit lokální injekcí glukokortikoidů. V případě přetrvávající polyartritidy se doporučují konvenční syntetické chorobu modifikující antirevmatické léky (conventional synthetic disease modifying antirheumatic drugs, csDMARDs), jako jsou metotrexát (MTX), leflunomid nebo sulfasalazin, přičemž nejčastěji používaným csDMARD je MTX. Komise EULAR silně doporučuje používání MTX u PsA, a to navzdory tomu, že dosavadní evidence o účinnosti MTX u tohoto onemocnění byla nekonstantní. Nicméně nová studie SEAM PsA prokázala, že MTX má stejný vliv na kloubní index, postižení kůže, entezitidu a daktylitidu jako etanercept, a dokonce rovněž jako kombinace etanerceptu a MTX [6]. Pokud však nedojde při léčbě MTX k dosažení cíle léčby do šesti měsíců, je indikována léčba biologickými DMARDs (biologic DMARDs, bDMARDs). Toto platí pro pacienty s periferním postižením, u pacientů s čistě axiálním postižením je možné bDMARDs v případě vysoké aktivity indikovat již při selhání NSA. Biologickou léčbu je doporučeno podávat formou blokátorů tumor nekrotizujícího faktoru (TNF), interleukinu (IL) 17 nebo IL 12/23 [7‒9]. Nebyly provedeny srovnávací studie, ale z nepřímé evidence vyplývá podobná účinnost terapie anti TNF a anti IL 17 na pohybový aparát [4]. Nicméně je evidentní vyšší účinnost terapie anti IL 17 na kožní syndrom [4], na druhé straně tato léčba není efektivní v případě přítomnosti idiopatického střevního zánětu. Účinnost inhibitoru IL 12/23 na PsA se zdá být menší [9]. Při onemocnění PsA s nižší aktivitou je také možné podávat inhibitor fosfodiesterázy 4 (PDE4) apremilast [10].
Ixekizumab
Ixekizumab (IXE) je humanizovaná monoklonální protilátka s vysokou afinitou a specificitou pro IL 17A [11], což je prozánětlivý cytokin, který se uplatňuje v patogenezi psoriázy, PsA a spondyloartritid [12]. Ixekizumab prokázal vysokou účinnost v léčbě psoriázy [13], axiálních spondyloartritid [14‒16] a PsA [17].
Klinické studie s ixekizumabem v léčbě psoriatické artritidy
Studie SPIRIT P1
Do studie fáze III SPIRIT P1 byli zařazeni pacienti s PsA naivní k biologické léčbě, kteří v minulosti užívali maximálně jeden csDMARD [17]. Studie měla tři fáze: dvojitě zaslepenou (týden 0‒24), extenzi (týdny 24‒52) a dlouhodobou extenzi (týdny 52‒156). Pacienti splňovali klasifikační kritéria CASPAR pro PsA (Classification Criteria for Psoriatic Arthritis) a měli minimálně tři oteklé a tři citlivé klouby, hodnotu C reaktivního proteinu (CRP) vyšší než 6 mg/l a nejméně jednu erozi. Nemocní byli randomizováni do čtyř skupin, a to k podávání IXE v dávce 80 mg subkutánně (s.c.) každé dva týdny (IXE Q2W), IXE 80 mg každé čtyři týdny (IXE Q4W) ‒ obě dávky IXE po iniciální dávce Q160 mg s.c. ‒, k podávání adalimumabu v dávce 40 mg s.c. každé dva týdny a k podávání placeba. Účinnost byla hodnocena pomocí kritérií odpovědi ACR 20, 50, 70 (20%/50%/70% zlepšení podle American College of Rheumatology), změnou modifikovaného celkového Sharpova skóre podle van der Heijde (modified Total Sharp Score, mTSS), změnou HAQ (Health Assessment Questionnaire) a podílem pacientů, kteří docílili minimálního signifikantního klinického zlepšení.
Celkem bylo do studie zařazeno
417 pacientů s průměrným věkem 49,5 roku, 46 % byli muži,
trvání PsA od diagnózy činilo 6–7 let, počet citlivých
kloubů dosahoval v průměru 20, oteklých kloubů 11, hodnota
CRP se pohybovala mezi 12‒15 mg/l. Přibližně 63‒69 %
nemocných užívalo současně csDMARD a 55‒57 % osob
užívalo současně MTX. Primárního cíle bylo dosaženo v týdnu
24, kdy bylo kritérium ACR 20 signifikantně častější
v obou skupinách pacientů léčených IXE oproti placebu (IXE
Q4W 57,9 %, IXE Q2W 62,1 % vs. 30,2 % u placeba;
p < 0,0001), graf 1 [18]. Také ve skupině
s aktivním kontrolním přípravkem adalimumabem bylo docíleno
signifikantně lepší odpovědi ve srovnání s placebem
(57,4 %; p < 0,001). Nástup účinku IXE byl
rychlý; rozdíly v odpovědi ACR byly signifikantně vyšší
oproti placebu již po prvním týdnu. Signifikantních rozdílů
při léčbě IXE oproti placebu bylo docíleno rovněž u většiny
sekundárních ukazatelů účinnosti, včetně ukazatelů
hodnotících funkci a kvalitu života. Ve studii SPIRIT P1
byla hodnocena též strukturální progrese PsA. Změna mTSS byla
v týdnu 24 signifikantně menší v případě léčby IXE
Q2W (0,08 mm) a IXE Q4W (0,10 mm) v porovnání
s placebem (0,49 mm; p < 0,01). Proběhla
subanalýza výsledků léčby IXE podle přítomnosti či
nepřítomnosti současně podávaného MTX. Nezávisle na současném
podávání MTX byly obě dávky IXE účinnější než placebo
podle odpovědi ACR 20, 50, 70 [19].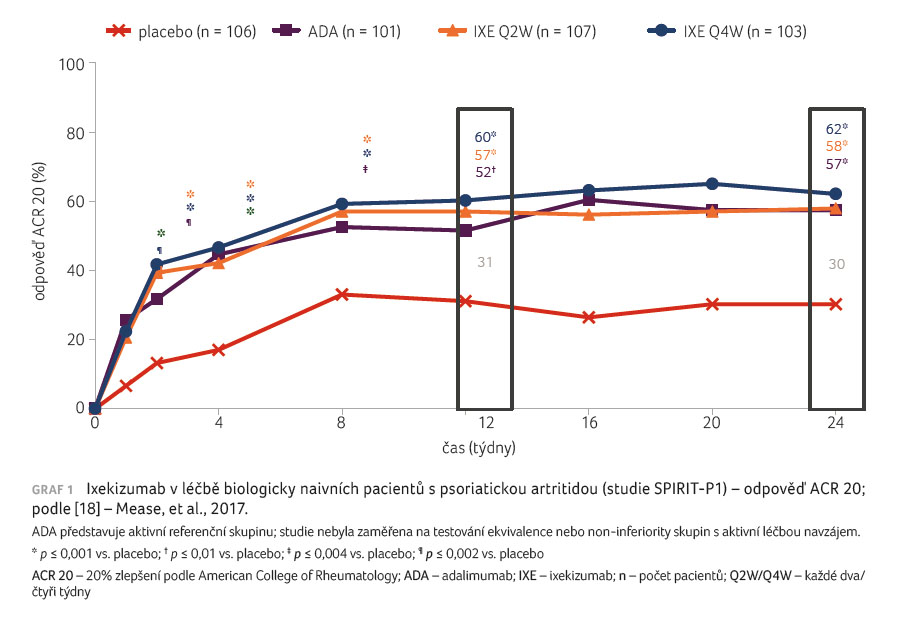
Studie SPIRIT P2
Do dvojitě zaslepené, randomizované, placebem kontrolované multicentrické studie SPIRIT P2 byli zařazeni pacienti s PsA, u nichž v minulosti selhala léčba anti TNF přípravkem, a to jak z důvodů neúčinnosti, tak netolerance. Dále patřilo mezi vstupní kritéria selhání léčby alespoň jedním csDMARD. Další diagnostická a vstupní kritéria byla podobná jako u studie SPIRIT P1. Pacienti byli randomizováni do skupin s IXE v dávce 80 mg každé dva týdny, s IXE v dávce 80 mg každé čtyři týdny s.c. (obojí po iniciální dávce IXE 160 mg s.c.) a do skupiny s placebem. V týdnu 24 byli pacienti z placebové skupiny randomizováni do skupin IXE Q2W a IXE Q4W a pokračovali v léčbě až do týdne 156. Primárním cílovým ukazatelem byl podíl pacientů s ACR 20 v týdnu 24 [20,21].
Do studie bylo zařazeno celkem
363 pacientů s PsA. Průměrný věk činil 52 let, trvání
PsA od diagnózy 7‒10 let.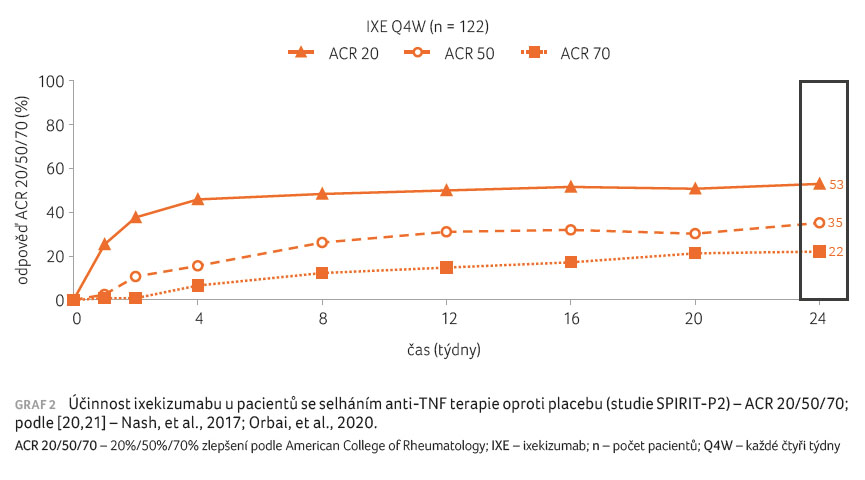 Metotrexát současně užívalo
35‒50 % pacientů. Počet citlivých kloubů byl v průměru
23, oteklých kloubů 12, hodnota CRP se pohybovala mezi 12‒14 mg/l,
celkové skóre PASI (Psoriasis Area and Severity Index) 5‒6.
Primárního cíle ACR 20 v týdnu 24 bylo dosaženo
ve skupině IXE Q4W u 53 % pacientů, míra účinku
33,8 % oproti placebu (p < 0,0001),
u 48 % pacientů ve skupině IXE Q2W, míra účinku
oproti placebu 28,5 % (p < 0,0001), a u 20 %
osob ve skupině s placebem (graf 2) [20,21].
Statisticky významných rozdílů mezi oběma skupinami s IXE
a s placebem bylo dosaženo i v případě
sekundárních ukazatelů účinnosti jako např. ACR 50, 70 a jejich
komponent, daktylitidy a entezitidy, dále HAQ a hodnoty
CRP. V poslední době silně doporučovaného ukazatele
minimální aktivity PsA (minimal disease activity, MDA) v týdnu
24 bylo dosaženo ve 28 % ve skupině s léčbou
IXE Q4W a ve 3,4 % ve skupině s placebem
(graf 3A–C) [20‒23]. Při použití ukazatele DAPSA
(Disease Activity in Psoriatic Arthritis) pak bylo stavu nízké
aktivity dosaženo ve skupině s IXE Q4W ve 4
Metotrexát současně užívalo
35‒50 % pacientů. Počet citlivých kloubů byl v průměru
23, oteklých kloubů 12, hodnota CRP se pohybovala mezi 12‒14 mg/l,
celkové skóre PASI (Psoriasis Area and Severity Index) 5‒6.
Primárního cíle ACR 20 v týdnu 24 bylo dosaženo
ve skupině IXE Q4W u 53 % pacientů, míra účinku
33,8 % oproti placebu (p < 0,0001),
u 48 % pacientů ve skupině IXE Q2W, míra účinku
oproti placebu 28,5 % (p < 0,0001), a u 20 %
osob ve skupině s placebem (graf 2) [20,21].
Statisticky významných rozdílů mezi oběma skupinami s IXE
a s placebem bylo dosaženo i v případě
sekundárních ukazatelů účinnosti jako např. ACR 50, 70 a jejich
komponent, daktylitidy a entezitidy, dále HAQ a hodnoty
CRP. V poslední době silně doporučovaného ukazatele
minimální aktivity PsA (minimal disease activity, MDA) v týdnu
24 bylo dosaženo ve 28 % ve skupině s léčbou
IXE Q4W a ve 3,4 % ve skupině s placebem
(graf 3A–C) [20‒23]. Při použití ukazatele DAPSA
(Disease Activity in Psoriatic Arthritis) pak bylo stavu nízké
aktivity dosaženo ve skupině s IXE Q4W ve 4
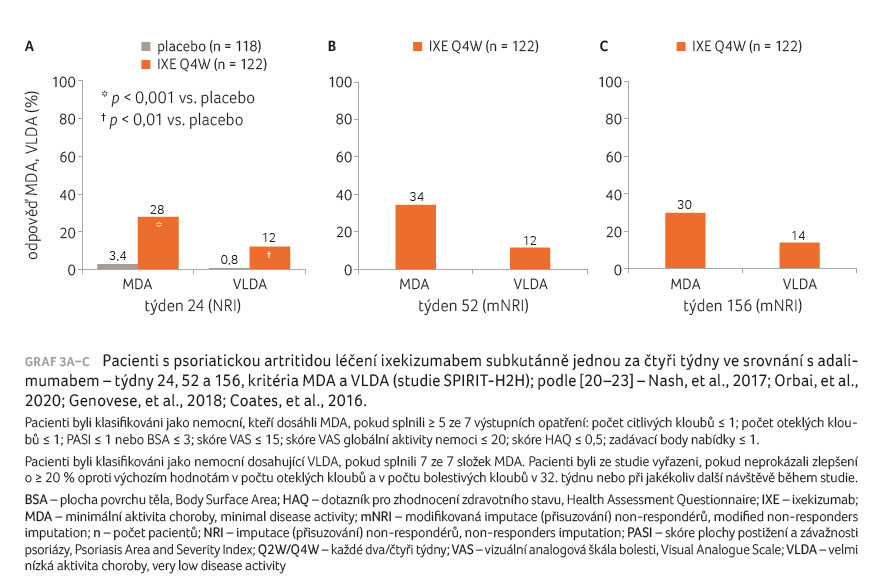
0 % a u placeba ve 12 %. Signifikantní rozdíly ve prospěch obou dávek IXE nastaly i při hodnocení účinku na stav kůže (PASI 75, 90, 100). Výrazně se při obou dávkách IXE ve srovnání s placebem zlepšily rovněž složené ukazatele funkce a kvality života a práceschopnosti (Work Productivity and Activity Impairment, WPAI). Výsledky léčby přetrvávaly i v otevřené fázi do týdne 156 [24].
Studie SPIRIT H2H
SPIRIT H2H byla multicentrická otevřená zaslepená studie v délce 52 týdnů, která srovnávala účinnost a bezpečnost IXE a adalimumabu u nemocných s PsA zatím naivních k biologické léčbě [25]. Pacienti byli randomizováni v poměru 1 : 1 a stratifikováni jednak podle závažnosti psoriázy, jednak podle používání MTX. Předem specifikované cílové ukazatele byly stanoveny pro týdny 24 a 52 a zahrnovaly muskuloskeletální příznaky, psoriázu, kvalitu života a podskupinovou analýzu. Základními vstupními kritérii byly diagnóza PsA dle kritérií CASPAR, tři oteklé a tři citlivé klouby a psoriáza postihující více než 3 % tělesného povrchu. Do studie bylo zařazeno celkem 566 pacientů s průměrným věkem 48 let a s trváním PsA od diagnózy 6‒7 let. Počet citlivých kloubů byl v průměru 20, oteklých kloubů 10, hodnota CRP se pohybovala mezi 10‒11 mg/l, průměrné skóre PASI bylo 8. Současně s biologickou léčbou užívalo csDMARD 68‒70 % pacientů a MTX 59‒60 % pacientů.
Simultánního cíle, tzn. odpovědi
ACR 50 a PASI 100 v týdnu 24, docílilo
signifikantně více pacientů ve skupině s IXE oproti
adalimumabu (36,0 % vs. 27,9 %; p < 0,001)
a tento rozdíl přetrvával až do týdne 52 (39,2 % vs.
26,1 %), graf 4 [24]. Pokud se týká odpovědi ACR,
byly hodnoty mezi IXE a adalimumabem podobné (ACR 20, 50, 70).
Nebyly zjištěny rozdíly v účinnosti mezi IXE a adalimumabem
při hodnocení sekundárních ukazatelů aktivity PsA, jako jsou
např. DAPSA remise, MDA, entezitidy a HAQ. Nicméně při
hodnocení ovlivnění pomocí PASI byl IXE účinnější než
adalimumab (PASI 75: 78,4 % vs. 68,6 %, p = 0,008;
PASI 100: 64,3 % vs. 41,3 %, p < 0,001).
Ixekizumab byl účinnější i při ovlivnění nehtové
psoriázy.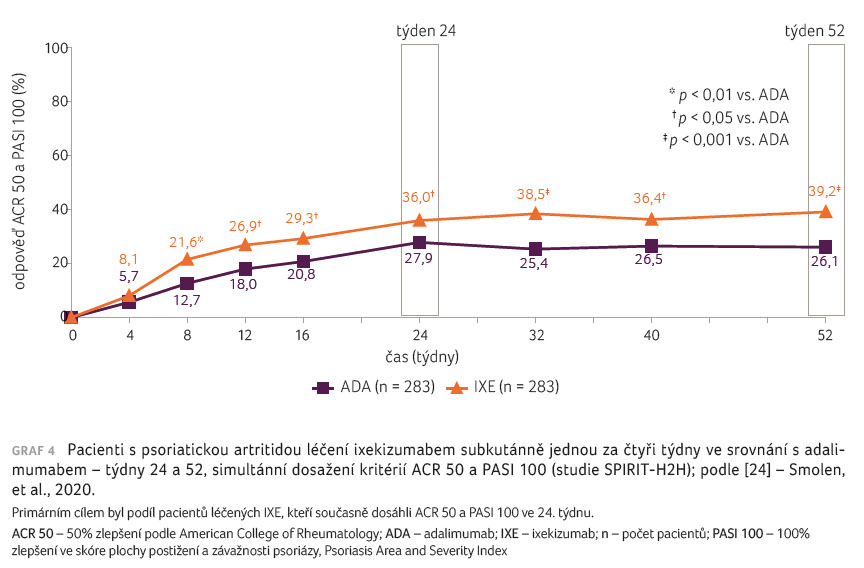
Dále byla provedena podskupinová analýza srovnávající IXE a adalimumab podle toho, zda byl současně podáván MTX, nebo nikoliv [26]. Při léčbě IXE bylo kombinovaného primárního ukazatele ACR 50 a PASI 100 dosaženo ve stejné frekvenci s MTX i bez MTX (38,9 % vs. 39,7 %). Odpověď na léčbu adalimumabem byla numericky větší při současném používání MTX než při monoterapii adalimumabem (30,2 % vs. 20 %). U pacientů, kteří neužívali MTX, bylo primárního cíle dosaženo numericky (ne však signifikantně) častěji při léčbě IXE oproti adalimumabu (38,9 % vs. 30,2 %; p < 0,108). Dále byla hodnocena řada sekundárních ukazatelů, které doložily, že zatímco IXE má konstantní účinnost nezávislou na současném podávání csDMARD, účinnost adalimumabu se při současně podávaném MTX zvyšuje.
Bezpečnost léčby ixekizumabem
Poměrně rozsáhlý klinický program testování IXE u tří diagnóz zánětlivých onemocnění poskytl již dostatek dat pro hodnocení bezpečnosti léčby, a to jak ve dvojitě zaslepených periodách zkoušení oproti placebu, tak v otevřených dlouhodobých extenzích studií a také v přímé srovnávací studii oproti adalimumabu.
Ve studii SPIRIT P1 mělo signifikantně více pacientů nežádoucí účinky ve vztahu k léčbě (target adverse event, TAE) při léčbě IXE (66 %) a adalimumabem (64 %) ve srovnání s placebem (47,2 %). Většina TAE byla mírných a k přerušení léčby vedla pouze ve 2,4 % případů, a to ve stejné frekvenci ve všech skupinách. Závažné TAE byly zaznamenány ve skupině IXE Q4W ve 3,7 %, IXE Q2W ve 4,9 %, ve skupině s ADA v 1,0 % a v placebové skupině v 1,9 % [17]. Nejčastějším TAE byly infekce, které se vyskytovaly v podobné frekvenci (25‒28 %) v obou skupinách s IXE, ve skupině adalimumabu i placeba. Nejvíce se objevily nezávažné infekce horního dýchacího traktu a bronchitida. Závažná infekce se vyskytla jedna ve skupině IXE Q4W a dvě ve skupině IXE Q2W, což bylo stejně jako při léčbě adalimumabem. Nebyl zaznamenán žádný případ tuberkulózy. V obou skupinách IXE byl zachycen jeden případ orální kandidózy, ve skupině s adalimumabem a placebem žádný případ. Poměrně časté, ale většinou nezávažné byly lokální reakce v místě vpichu, konkrétně v 15,7 % pro IXE Q2W, 12,1 % pro IXE Q4W, ve 2 % pro adalimumab a v 0 % pro placebo. Alergické/hypersenzitivní reakce se vyskytly ve 4,9 % při léčbě IXE Q2W a v 1,9 % při léčbě IXE Q4W, takže nebyly častější než při léčbě adalimumabem (4,0 %), u placeba byly zaznamenány ve 2,8 %.
V rámci farmakovigilance se rovněž sledují TAE se zvláštním významem. Řadíme mezi ně jednak některé závažnější TAE, které se obecně objevují při biologické léčbě, jednak některé TAE specifické pro daný typ léku. U blokátorů IL 17 patří mezi obecné TAE se zvláštním významem infekce, nádory, lokální a celkové alergické reakce, kardiovaskulární příhody a jaterní a biochemické abnormality. Mezi TAE specifické pro blokátory IL 17 patří deprese, kandidové infekce a možné vzplanutí IBD. Ve studii SPIRIT P1 byl výskyt těchto specifických TAE nízký. Deprese nebo zhoršení deprese byly zjištěny ve skupinách s IXE ve dvou, resp. jednom případě a ve skupině s adalimumabem v jednom případě. Kandidové infekce byly zachyceny celkem dvě a v kontrolních skupinách žádná. Případ vzplanutí IBD pak nebyl zaznamenán žádný.
Důležité informace o bezpečnosti IXE poskytla dlouhodobá extenze studie SPIRIT P1 v délce tří let, kdy v obou skupinách byla již expozice kolem 440 pacientoroků. Globálně se dá říci, že bezpečnostní profil IXE byl v průběhu tří let konstantní, tzn. nebyla zjištěna žádná kumulativní toxicita ani žádné nové či neočekávané TAE. Při kombinované analýze dvojitě zaslepené a otevřené fáze studie SPIRIT P2 po třech letech došlo k přerušení léčby pro závažný TAE ve 13 %, závažné infekce se vyskytovaly ve 3 %, což je podobné jako u jiných biologických léků. Nevyskytl se ani jeden případ aktivní tuberkulózy a byl zaznamenán pouze jeden případ latentní tuberkulózy. Oportunní infekce se vyskytly v 7 % u léčených pacientů. Kandidové infekce, které byly častější při léčbě IXE v dvojitě zaslepené části oproti adalimumabu, postihly v celém období tří let 3 % léčených pacientů. Lokální reakce v místě vpichu byly časté (21 %), ale většinou nezávažné. Výskyt exacerbace IBD byl zcela ojedinělý (1 pacient, 0,3 %). Výskyt deprese byl zachycen ve 3,6 %, závažnější cytopenie 3. stupně v 1,2 %, hepatální TAE v 7,7 %. Limitací této studie je fakt, že neměla kontrolní skupinu s placebem či aktivním komparátorem a že se týkala TNF naivních pacientů.
Diskuse
Blokátory TNF se staly lékem první volby pro léčbu aktivní PsA rezistentní na léčbu csDMARDs. Nicméně 30‒40 % pacientů nemá na terapii anti TNF dostatečnou odpověď nebo se u nich vyskytují nežádoucí účinky [27]. Z tohoto důvodu byla hledána bDMARDs s jiným mechanismem účinku pro léčbu PsA. Úspěšný byl až vývoj blokátorů IL 17 (sekukinumabu, brodalumabu a IXE) [25,28], které prokázaly účinnost v celém spektru onemocnění PsA a potvrdily důležitost IL 17 v patogenezi PsA.
Ve studii SPIRIT H2H prokázal IXE v terapii pacientů naivních k biologické léčbě robustní účinnost, která byla v případě postižení muskuloskeletálního systému srovnatelná s adalimumabem a výrazně větší v případě projevů psoriázy. Za velmi důležité je nutno považovat zjištění, že účinnost IXE byla konzistentní a nezávislá na současně podávaném MTX, u adalimumabu byla doložena větší účinnost v kombinaci s MTX. Protože je známo, že až 40 % pacientů MTX dlouhodobě netoleruje, může být toto komparativní výhodou IXE.
Výsledky studie SPIRIT H2H mohou přispět i do dlouhodobé diskuse o vhodnosti kombinace MTX s biologickými léky u PsA. K této problematice se vyjadřuje rovněž komise EULAR v rámci inovovaných guidelines [4]. Konstatuje, že vědecká evidence je v tomto směru poněkud konfliktní. V systematickém přehledu studií s podáváním biologických léků v monoterapii vs. v kombinaci s MTX neprokázali Behrens a kol. větší účinnost kombinace anti TNF + MTX oproti monoterapii [29]. V retrospektivní studii z Finska rovněž nebyla prokázána větší účinnost kombinace anti TNF + MTX [30]. Na druhé straně ve studii z norského registru bylo doloženo delší přežívání v léčené skupině při současném použití MTX [31]. V jedné studii byla též doložena snížená tvorba protilátek proti léku při používání anti TNF přípravku, ale klinický význam tohoto zjištění byl minimální [32]. Komise EULAR však v závěru guidelines mírně doporučuje při léčbě PsA pokračovat v podávání kombinace MTX + anti TNF.
Psoriatická artritida představuje velmi heterogenní onemocnění a je důležité, aby potenciální lék pro PsA pokrýval maximum, či nejlépe všechny se vyskytující manifestace choroby. Toto bylo prokázáno pro IXE, když kromě vlivu na artritidu bylo zjištěno také příznivé ovlivnění daktylitidy, entezitidy a nehtové psoriázy, významnější v porovnání s adalimumabem. Studie SPIRIT H2H a další klinická hodnocení potvrdily významný vliv IXE na tzv. pacientem hlášené ukazatele, tzn. funkci, kvalitu života a celkový pocit zdraví. Za určitou limitaci léčby IXE oproti anti TNF je nutno považovat absenci dat o ovlivnění extraartikulárních manifestací PsA, jako jsou uveitida a IBD, kde se diskutuje i možné zhoršení stavu.
Studie SPIRIT P2 hodnotila účinnost IXE u pacientů se selháním 1‒2 anti TNF přípravků v minulosti. Je známo, že účinnost druhého bDMARD u PsA je dobrá, ale horší než u prvního biologického léku. Z tohoto úhlu pohledu je nutné hodnotit účinnost IXE jako velmi dobrou. Uvedená studie dále prokázala až u třetiny těchto refrakterních pacientů dosažení obtížného kritéria MDA, což je stav, kdy nemocný minimálně rentgenově progreduje a nehorší se kvalita života. Sledování doložilo numericky významné zpomalení rentgenové progrese oproti placebu.
Bezpečnostní profil IXE je podobný jako u anti TNF, což dokumentují především výsledky po 52 týdnech ve studii SPIRIT H2H. Výskyt závažných infekcí byl při léčbě IXE nižší než při léčbě adalimumabem, ale naopak byl zaznamenán vyšší výskyt kandidových infekcí. Vyšší byl také výskyt lokálních injekčních reakcí. Výskyt nově vzniklého nebo zhoršeného IBD byl nízký, ale i v případě IXE, podobně jako u celé skupiny blokátorů IL 17, je zachycen určitý signál a jsou v tomto směru třeba další studie.
Závěrem lze říci, že IXE představuje nový biologický lék pro léčbu PsA s jiným mechanismem účinku a dobrým poměrem účinnosti a bezpečnosti.
Podpořeno projektem Ministerstva zdravotnictví ČR koncepčního rozvoje výzkumné organizace 00023728 Revmatologický ústav.
Seznam použité literatury
- [1] Coates LC, Helliwell PS. Psoriatic arthritis: state of the art review. Clin Med 2017; 17: 65‒70.
- [2] Ritchlin CT, Colbert RA, Gladman DD. Psoriatic arthritis. N Engl J Med 2017; 376: 957‒970.
- [3] Moll JM, Wright V. Psoriatic arthritis. Semin Arthritis Rheum 1973; 3: 55‒78.
- [4] Gossec L, Baraliakos X, Kerschbaume A, et al. EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies 2019 update. Ann Rheum Dis 2020; 79: 700‒713.
- [5] Smolen JS, Schoels M, Braun J, et al. Treating axial spondyloarthritis and peripheral arthritis, especially psoriatic arthritis to target. 2017 update of recommendations by an international Task force. Ann Rheum Dis 2018; 77: 3‒7.
- [6] Mease PJ, Gladmann DD, Collier DH, et al. Etanercept and methotrexate as monotherapy or in combination for psoriatic arthritis: primary results from a randomized controlled phase III trial. Arthritis Rheumatol 2019; 71: 1112‒1124.
- [7] Kavanaugh A, Husni ME, Harrison DD, et al. Safety and efficacy of intravenous golimumab in patients with active psoriatic arthritis, results through week twenty‑four of the GO‑VIBRANT study. Arthritis Rheumatol 2017; 69: 2151‒2161.
- [8] McInnes IB, Mease PJ, Kirkham B, et al. Secukinumab, a human anti‑interleukin‑17A monoclonal antibody in patients with psoriatic arthritis (FUTURE 2) a randomised, double blind, placebo‑controlled phase 3 trial. Lancet 2015; 386: 1137‒1146.
- [9] Ritchlin C, Rahman P, Kavanaugh A, et al. Efficacy and safety of the anti‑IL‑12/23 p 40 monoclonal antibody, ustekinumab in patients with active psoriatic arthritis despite conventional non‑biological and biological anti‑tumour necrosis factor therapy: 6‑month and 1 year results of the phase 3, multicentre, double blind, placebo controlled, randomised PSUMMIT 2 trial. Ann Rheum Dis 2014; 73: 990‒999.
- [10] Kavanaugh A, Mease PJ, Gomez‑Reino JJ, et al. Treatment of psoriatic arthritis in phase 3 randomised, placebo‑controlled trial with apremilast, an oral phosphodiesterase 4 inhibitor. Ann Rheum Dis 2014; 73: 1020‒1026.
- [11] Liu L, Lu J, Allan BW, et al. Generation and characterization of ixekizumab, humanized monoclonal antibody that neutralizes interleukin 17A. J Inflamm Res 2016; 9: 39‒50.
- [12] Kirkham BW, Kavanaugh H, Reich K. Interleukin 17A: a unique pathway in immune –mediated diseases: psoriasis, psoriatic arthritis and rheumatoid arthritis. Immunology 2014; 141: 133‒142.
- [13] Gordon KB, Blauvelt A, Papp KA. Phase 3 trials of ixekizumab in moderate‑to severe plaque psoriasis. N Engl J Med 2016; 375: 345‒356.
- [14] van der Heijde D, Cheng‑Chung Wei J, Dougados M, et al. COAST‑V study group. Ixekizumab, an interleukin‑17A antagonist in the treatment of ankylosing spondylitis or radiographic axial spondyloarthritis in patients previously untreated with biological disease‑modifying anti‑rheumatic drugs (COAST‑V): 16 week results of a phase 3 randomised, double‑blind, active‑controlled and placebo‑controlled trial. Lancet 2018; 392: 2441‒2451.
- [15] Deodhar A, Poddubnyy D, Pacheco‑Tena C, et al.; COAST‑W Study Group. Efficacy and Safety of Ixekizumab in the Treatment of Radiographic Axial Spondyloarthritis: Sixteen‑Week Results From a Phase III Randomized, Double‑Blind, Placebo‑Controlled Trial in Patients With Prior Inadequate Response to or Intolerance of Tumor Necrosis Factor Inhibitors. Arthritis Rheumatol 2019; 71: 599‒611.
- [16] Deodhar A, van der Heijde D, Gensler LS, et al.; COAST‑X Study Group. Ixekizumab for patients with non‑radiographic axial spondyloarthritis (COAST‑X): a randomised, placebo‑controlled trial. Lancet 2020; 395: 53‒64.
- [17] Chandran V, van der Heijde D, Feischmann R, et al. Ixekizumab treatment of biologic naive patients with active psoriatic arthritis: 3‑year results from a phase III. Clinical trial (SPIRIT‑P1). Rheumatology 2020; 59: 2774‒2784.
- [18] Mease PJ, van der Heijde D, Ritchlin CT, on behalf of the SPIRIT‑P1 Study Group, et al. Ixekizumab, an interleukin‑17A specific monoclonal antibody, for the treatment of biologic‑naive patients with active psoriatic arthritis: results from the 24‑week randomised, double‑blind, placebo‑controlled and active (adalimumab)‑controlled period of the phase III trial SPIRIT‑P1. Ann Rheum Dis 2017; 76: 79‒87.
- [19] Coates L, Kishimota M, Gottlieb A, et al. Ixekizumab efficacy and safety with and without concomitant conventional csDMARD‑naive patients with active PsA: results from SPIRIT‑P1. RMD Open 2017; 3: e 000567.
- [20] Nash P, Kirkham B, Okada M, et al. Ixekizumab for the treatment of patients with active psoriatic arthritis and inadequate response to tumour necrosis factor inhibitors: results from the 24‑week randomised, double blind, placebo controlled period of the SPIRIT‑P2 phase 3 trial. Lancet 2017; 389: 2317‒2327.
- [21] Orbai AM, Gratacos J, Turkiewicz A, et al. Efficacy and safety of ixekizumab in patients with psoriatic arthritis and inadequate response to TNF inhibitors: 3‑Year follow‑up (SPIRIT‑P2). Rheumatol Ther October 2020; doi.org/10.1000744‑020‑00261‑0.
- [22] Genovese MC, Combe B, Kremer JM, et al. Safety and efficacy of ixekizumab in patients with PsA and previous inadequate response to TNF inhibitors: week 52 results from SPIRIT‑P2. Rheumatology (Oxford) 2018; 57: 2001‒2011.
- [23] Coates LC, Helliwell PS. Defining Low Disease Activity States in Psoriatic Arthritis using Novel Composite Disease Instruments. J Rheumatol 2016; 43: 371‒375.
- [24] Smolen J, Mease P, Tahir H, et al. Multicentre, randomised, open‑label, parallel‑group study evaluating the efficacy and safety of ixekizumab versus adalimumab in patients with psoriatic arthritis naive to biological disease‑modifying antirheumatic drug: final results by week 52. Ann Rheum Dis 2020; 79: 1310‒1319.
- [25] Smolen J, Sebba A, Ruderman EM, et al. Efficacy and safety of ixekizumab with or without MTX in biologic‑naive patients with psoriatic arthritis: 52‑week results from SPIRIT‑H2H Study. Rheumatol Ther 2020; 7: 1021‒1035.
- [26] Smolen JS, Sebba A, Ruderman EM, et al. Efficacy and safety of ixekizumab versus adalimumab (SPIRIT‑H2H) with and without concomitant conventional synthetic disease‑modifying antirheumatic drugs (DMARD) in biologic DMARD‑naive patients with psoriatic arthritis: 52‑week results. Ann Rheum Dis 2020; 79(Suppl 1): 143‒144; Abstr OP0228.
- [27] Rudwaleit M, Van der Bosch F, Kron M, et al. Effectiveness and safety of adalimumab in patients with ankylosing spondylitis or psoriatic arthritis and history of anti‑tumor necrosis factor therapy. Arthritis Res Ther 2010; 12: R117.
- [28] Mease PJ, Genovese MC, Greenwald MW, et al. Brodalumab, an IL‑17R monoclonal antibody in psoriatic arthritis. N Engl J Med 2014; 370: 2295‒2306.
- [29] Behrens F, Canete JD, Olivieri I, et al. Tumour necrosis factor inhibitor monotherapy vs. combination with MTX in the treatment of PsA: a systematic review of the literature. Rheumatology 2015; 54: 915‒926.
- [30] Aaltonen K, Heinonen A, Joenssu J, et al. Effectiveness and drug survival of TNF inhibitors in the treatment of psoriatic arthritis: A prospective cohort study. Seminars Arthritis Rheum 2017; 46: 732‒739.
- [31] Heiberg MS, Koldingsnes W, Mikkelsen K, et al. The comparative one‑year performance of anti‑tumor necrosis factor α drugs in patients with rheumatoid arthritis, psoriatic arthritis and ankylosing spondylitis: results from a longitudinal, observational, multicenter study. Arthritis Rheum 2008; 59: 234‒240.
- [32] Zisapel M, Zisman D, Madar‑Balakirski N, et al. Prevalence of TNF‑α blocker immunogenicity in psoriatic arthritis. J Rheumatol 2015; 42: 73‒78.