Je léčba růstovým hormonem bezpečná?
Kritický pohled na léčbu lidským růstovým hormonem u dětí a dospělých – stanovisko mezinárodních odborných společností
Souhrn:
Růstový hormon se používá v léčbě již téměř šedesát let, rekombinantní lidský růstový hormon od roku 1985 – tedy více než třicet let. O jeho účinnosti není pochyb. Bezpečnost růstového hormonu je však stále předmětem zvýšeného zájmu a ojedinělé zprávy o rizicích spojených s jeho podáváním se objevují opakovaně. Skupina expertů, představitelů významných mezinárodních odborných společností, proto vydala na počátku roku 2016 obsáhlé stanovisko k bezpečnosti léčby růstovým hormonem. Podrobně shrnuje dostupná data o mortalitě, onkologickém, kardiovaskulárním i metabolickém riziku, údaje o některých známých nežádoucích účincích a doporučení pro dávkování a monitorování léčby. V závěru stanovisko konstatuje, že léčba růstovým hormonem má dobrý bezpečnostní profil, pokud je podávána v doporučených dávkách a ve schválených indikacích.
Key words: human growth hormone – safety – dosage – treatment monitoring.
Summary:
Treatment with human growth hormone has been used for nearly 60 years. Of these, recombinant human growth hormone is being used since 1985 – for over 30 years. No doubts about its efficacy occur. However, safety of growth hormone therapy is still a matter of interest and anecdotic reports on its risks appear repeatedly. An expert panel, representing influential international medical societies, elaborated and published an extensive position statement on growth hormone safety in early 2016. It comprises detailed available data on mortality risk, on oncologic, cardiovascular and metabolic risks, on known adverse effects, and on treatment dosage and monitoring. The statement concludes that growth hormone therapy is safe if administered in recommended dosage and in approved indications.
Úvod
Růstový hormon byl poprvé použit v léčbě dítěte před bezmála šedesáti lety. První zprávu o tom publikoval Raben v roce 1958 [1]. Mezi lety 1958 a 1985 se k léčbě používal výhradně extrakční růstový hormon získávaný z kadaverózních lidských hypofýz. V 60.–70. letech se díky organizovanému sběru hypofýz léčba postupně rozšířila a byla dostupná pro závažně růstově handicapované děti s deficitem růstového hormonu [2].
Nad podzim roku 1984 a v prvních měsících roku 1985 se objevily první případy úmrtí mladých dospělých, někdejších příjemců injekcí kadaverózního lidského růstového hormonu, na Creutzfeldtovu–Jakobovu nemoc. Vzhledem k charakteru této explozivní epidemie a vzhledem k mladému věku postižených bylo nade všechnu pochybnost prokázáno, že se jednalo o přenos agens kontaminovaným růstovým hormonem [3]. Toto agens bylo později identifikováno jako prion. Používání kadaverózního lidského růstového hormonu bylo ve většině zemí okamžitě ukončeno.
Téměř současně s těmito nešťastnými událostmi byl uveden na trh první rekombinantní růstový hormon – jako  druhý rekombinantní komerčně vyráběný léčivý přípravek (prvním byl rekombinantní inzulin o několik let dříve). Během následujících desetiletí probíhala řada klinických studií s rekombinantním lidským růstovým hormonem. Jejich cílem bylo ověřit účinnost a bezpečnost růstového hormonu i v nových indikačních oblastech. Rychle narůstal celkový počet léčených pacientů a byly zahájeny extenzivní postmarketingové observační studie, které do současnosti shromáždily data o léčení mnoha desítek tisíc pacientů po mnoho desítek tisíc let léčení („paciento‑roků“).
druhý rekombinantní komerčně vyráběný léčivý přípravek (prvním byl rekombinantní inzulin o několik let dříve). Během následujících desetiletí probíhala řada klinických studií s rekombinantním lidským růstovým hormonem. Jejich cílem bylo ověřit účinnost a bezpečnost růstového hormonu i v nových indikačních oblastech. Rychle narůstal celkový počet léčených pacientů a byly zahájeny extenzivní postmarketingové observační studie, které do současnosti shromáždily data o léčení mnoha desítek tisíc pacientů po mnoho desítek tisíc let léčení („paciento‑roků“).
Přehled současných indikací léčby lidským růstovým hormonem v Evropské unii, podle stanoviska Evropské lékové agentury (European Medicines Agency, EMA), shrnuje tab. 1.
Zájem o bezpečnost léčby rekombinantním lidským růstovým hormonem neustává. Občas se objevují jednotlivé literární zprávy o zvýšeném riziku vzniku leukemie, solidních tumorů, případně o cévních mozkových příhodách [4,5] po léčbě růstovým hormonem – nikdy ale nebyly ověřeny na větších sestavách pacientů. Také proto se v roce 2015 sešla skupina expertů, představitelů významných mezinárodních odborných společností v oblasti endokrinologie dětí i dospělých, spolu se zástupci výrobců růstového hormonu, jejichž úkolem bylo poskytnout expertům data z observačních postmarketingových studií. Cílem setkání bylo kriticky posoudit dostupné údaje o bezpečnosti léčby růstovým hormonem a vydat společné stanovisko. To bylo publikováno na počátku roku 2016 [6] a jeho zásadní závěry shrnují následující odstavce.
Celková a specifická mortalita při léčbě růstovým hormonem
Řada stavů léčených růstovým hormonem v dětství i v dospělosti vede ke zvýšenému riziku úmrtí v důsledku základního onemocnění. Při dlouhodobém sledování je proto obtížné odlišit riziko mortality v důsledku základní nemoci a v důsledku léčení.
Dostupné údaje ale neprokazují zvýšené riziko předčasného úmrtí vlivem léčby. V současné době probíhá mezinárodní multicentrická studie Safety and Appropriateness of Growth hormone treatments in Europe (SAGhE), která nepochybně rozšíří naše znalosti v této oblasti.
Souvislost léčby růstovým hormonem s vybranými onemocněními
Riziko vzniku nového primárního nádoru
Dostupné údaje neukazují na zvýšené riziko vzniku nového primárního tumoru u dětí léčených růstovým hormonem. Tato data pocházejí z observačních postmarketingových studií, z omezeného počtu dalších kohortových studií a z klinických sérií pacientů. I když celkové počty pacientů jsou vysoké (mnoho desítek tisíc), počet dlouhodobě sledovaných je omezený a dostupné údaje mohou být nekompletní. Mezi další slabiny zdrojových dat patří riziko selekční bias, nedostatečná velikost souborů k průkazu nádoru s nízkou incidencí a také chybění adekvátní kontrolní populace.
V současné době ale není důvod ke zvláštnímu onkologickému screeningu u dětí při léčbě růstovým hormonem nebo po jejím ukončení.
Riziko rekurence primárního nádoru nebo druhé či další malignity
Dostupné údaje neprokazují zvýšené riziko rekurence primárního tumoru u dětí léčených růstovým hormonem.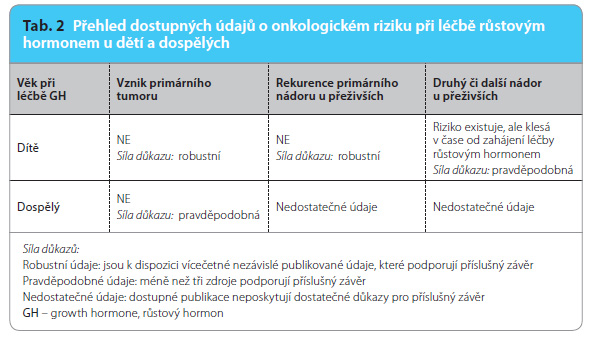
Podle jedné studie hrozí dětem s anamnézou nádorového onemocnění zvýšené riziko vzniku dalšího primárního tumoru, pokud byly léčeny růstovým hormonem. Riziko by mělo být nejvyšší brzy po léčbě růstovým hormonem a poté by mělo klesat. Údaje ale nejsou dostatečně průkazné na to, aby vedly ke stanovení kontraindikace léčby růstovým hormonem u těchto dětí, pokud jsou respektovány schválené indikace.
Zahájení léčby růstovým hormonem po onkologické léčbě
Pro jednoznačné doporučení, kdy zahájit léčbu růstovým hormonem po skončené onkologické léčbě, chybějí spolehlivá data. Proto je vhodné individuálně posoudit typ a charakter tumoru, dobu od skončení léčby a také naléhavost podání růstového hormonu u daného dítěte (např. závažnost růstové retardace).
Dostupné závěry o míře onkologického rizika u dětí i dospělých při léčbě růstovým hormonem shrnuje tab. 2.
Léčba růstovým hormonem u osob se zvýšeným onkologickým rizikem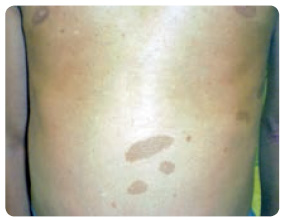
Jednoznačná data o bezpečnosti léčby růstovým hormonem u dětí se zvýšeným onkologickým rizikem nejsou k dispozici. To se týká např. dětských pacientů s neurofibromatózou 1. typu (obr. 1), s Fanconiho anemií nebo s Downovým syndromem. Zahájení léčby by u nich mělo být pečlivě uváženo a prodiskutováno s rodinou.
Cévní mozkové příhody, kardiovaskulární nemoci a metabolické riziko
V současné době neexistuje dostatek údajů pro průkaz vztahu mezi léčbou růstovým hormonem a rizikem vzniku cévní mozkové příhody v mladé dospělosti. V jediné publikované studii [5] byl počet případů s cévní mozkovou příhodou velmi malý, nebyla k dispozici údaj o prevalenci v běžné populaci, chyběla data o rodinné anamnéze a údaje o souběžné medikaci, kouření a hypertenzi. I tak bylo vypočítané riziko velmi nízké – jen 1,6/1 000 osob.
V současné době proto není důvod uvádět cévní mozkovou příhodu mezi potenciálními riziky léčby.
Růstový hormon mění inzulinovou rezistenci – v závislosti na věku, tělesném složení a délce léčby. Glukózová intolerance nebo diabetes se ale projeví u dětí s deficitem růstového hormonu nebo s idiopatickým malým vzrůstem (idiopathic short stature, ISS) velmi vzácně.
I když u dívek s Turnerovým syndromem a u dětí, které se narodily na svůj gestační věk malé (small for gestational age, SGA), je riziko diabetu obecně vyšší než v běžné dětské populaci, při léčbě růstovým hormonem riziko diabetu 2. typu v krátkodobém horizontu nestoupá.
Růstový hormon snižuje obsah viscerálního tuku a posiluje svalovou hmotu. Děti i dospělí s deficitem růstového hormonu mají zvýšené hodnoty markerů kardiovaskulárního rizika; ty při léčbě růstovým hormonem zpravidla klesají. Klesá koncentrace LDL (low density lipoproteins, lipoproteiny o nízké hustotě) cholesterolu, poněkud stoupá koncentrace HDL (high density lipoproteins, lipoproteiny o vysoké hustotě) cholesterolu a klesá tloušťka intimy v karotidách. Tyto změny lze hodnotit jako příznivé – snižující kardiovaskulární riziko.
Při léčbě růstovým hormonem nestoupá krevní tlak.
Benigní nitrolební hypertenze
Nitrolební hypertenze (obr. 2) může 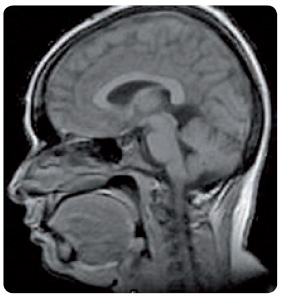 být u dítěte důsledkem léčby růstovým hormonem, zejména brzy po jejím zahájení. Projevuje se bolestí hlavy. Příčinou je retence celkové tělesné vody. Nitrolební hypertenze se ale v těchto případech obtížně prokazuje, ani chybění prominence papil ji nevylučuje. Zpravidla nebývá potřebné provádět vyšetření magnetickou rezonancí.
být u dítěte důsledkem léčby růstovým hormonem, zejména brzy po jejím zahájení. Projevuje se bolestí hlavy. Příčinou je retence celkové tělesné vody. Nitrolební hypertenze se ale v těchto případech obtížně prokazuje, ani chybění prominence papil ji nevylučuje. Zpravidla nebývá potřebné provádět vyšetření magnetickou rezonancí.
Příznaky ustoupí po přerušení léčby. Léčbu lze poté znovu zahájit nižší dávkou, kterou postupně navyšujeme.
Pokud bolesti hlavy přetrvávají, měl by dítě vyšetřit neurolog.
Muskuloskeletální příznaky
Otoky, syndrom karpálního tunelu a muskuloskeletální bolesti mohou být důsledkem retence vody při relativním předávkování růstového hormonu u dospělých s deficitem růstového hormonu. V současné době se vyskytují velmi vzácně, protože dávka růstového hormonu u dospělých se již snižuje v souladu s doporučeným dávkováním. U dětí bývají muskuloskeletální bolesti spíše důsledkem rychlého růstu nebo základního onemocnění. Zpravidla nesouvisejí s léčbou růstovým hormonem.
Skolióza
U pacientů s Turnerovým syndromem a se syndromem Pradera–Williho je skolióza častější bez ohledu na léčbu růstovým hormonem. K progresi skoliózy může přispět rychlý růst (např. pubertální růstový výšvih). Skolióza tedy není přímou komplikací léčby růstovým hormonem. Páteř by měla být klinicky vyšetřena před zahájením léčby i v jejím průběhu. Skolióza není kontraindikací léčby.
Epifyzeolýza hlavice femuru
Při léčbě růstovým hormonem může vzácně dojít k epifyzeolýze hlavice femuru (obr. 3). Příčinou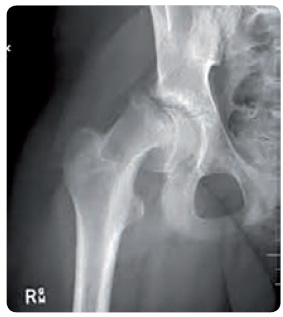 může být náhlé růstové urychlení a/nebo základní onemocnění. Při klinickém podezření je nezbytné provést rentgenové vyšetření kyčelních kloubů a při pozitivním nálezu požádat o spolupráci ortopeda.
může být náhlé růstové urychlení a/nebo základní onemocnění. Při klinickém podezření je nezbytné provést rentgenové vyšetření kyčelních kloubů a při pozitivním nálezu požádat o spolupráci ortopeda.
Obstrukční spánková apnoe
Růstový hormon může stimulovat adenotonzilární růst. Tím přispívá k obstrukční spánkové apnoi, zejména u dětí se syndromem Pradera–Williho a u obézních dospělých s deficitem růstového hormonu.
U dětí se syndromem Pradera–Williho je vhodné provést polysomnografii před začátkem léčby a sledovat ji v jejím průběhu.
Pankreatitida
U dětí se při léčbě růstovým hormonem ojediněle vyskytla pankreatitida. Píše se o tom v příbalovém letáku, i když pankreatitida je extrémně vzácná a spojení s léčbou růstovým hormonem není prokázáno.
Vliv růstového hormonu na metabolismus kortisolu a hormonů štítné žlázy
Růstový hormon zvyšuje tkáňovou konverzi aktivního kortisolu v neaktivní kortison. Zahájení léčby růstovým hormonem při subklinickém deficitu adrenokortikotropního hormonu proto může manifestovat adrenální insuficienci s potřebou substituční léčby.
Růstový hormon zvyšuje periferní konverzi thyroxinu (T4) na trijodthyronin (T3). Jeho podání může demaskovat subklinickou centrální hypothyreózu. Hodnota faktoru T4 (fT4) může klesnout do subnormálního pásma a může být potřeba zahájit nebo upravit substituční léčbu.
U běžného izolovaného deficitu růstového hormonu není třeba rutinně sledovat funkci nadledvin.
U dětí po ozáření centrální nervové soustavy je nutno sledovat thyreoidální i adrenální osu.
Dávkování a monitorování léčby růstovým hormonem
Při diagnóze deficitu růstového hormonu vyšetříme ostatní funkce hypofýzy a provedeme zobrazení magnetickou rezonancí se zaměřením na střední čáru mozku.
Během léčby sledujeme koncentrace izulinu podobného růstového faktoru 1 (insulin‑like growth factor 1, IGF‑1) a snažíme se o jejich normalizaci.
Neexistují přímé důkazy o tom, že příliš vysoké hodnoty IGF‑1 zvyšují riziko vzniku některých nádorů a příliš nízké hodnoty IGF‑1 zvyšují kardiovaskulární riziko. Pokud je růstová odpověď u dětí s Turnerovým syndromem, s chronickou renální insuficiencí nebo u dětí, které se narodily na svůj gestační věk malé (SGA), nedostatečná, dávku růstového hormonu lze zvýšit v mezích doporučeného dávkování.
Při léčbě růstovým hormonem je třeba monitorovat kostní věk, funkci štítné žlázy, funkci nadledvin (u vícečetného deficitu hypofyzárních hormonů), koncentraci glykovaného hemoglobinu (HbA1c) a klinicky sledovat stav páteře.
Po ukončení růstu u dětí s deficitem růstového hormonu znovu testujeme sekreci růstového hormonu. Při pokračujícím deficitu doporučíme léčbu v dospělosti.
Léčba růstovým hormonem u kriticky nemocných
Podávání růstového hormonu v léčbě kriticky nemocných osob zvyšuje mortalitu.
Údaje o léčbě osob s deficitem růstového hormonu ve stavu kritické nemoci nejsou k dispozici. U těchto osob (dětí i dospělých) se doporučuje pokračovat v podávání fyziologických substitučních dávek. U ostatních příjemců růstového hormonu se doporučuje léčbu během kritické nemoci přerušit.
Podávání růstového hormonu mimo schválené indikace (off‑label)
Podávání růstového hormonu mimo schválené indikace (tzv. off‑label) se nedoporučuje. Přesto bývá růstový hormon předepisován pro urychlení růstu u řady jiných stavů – v jednotlivých zemích různě. Například léčba pacientů s idiopatickým malým vzrůstem (ISS), se syndromem Noonanové, při chronické renální insuficienci a při deficitu genu SHOX je schválena jen v některých zemích.
Existují určité informace o příznivém působení růstového hormonu i u některých dalších stavů (cystická fibróza, zánětlivá střevní onemocnění, juvenilní idiopatická artritida, mírné formy kostní dysplazie typu hypochondroplazie). Vztah mezi přínosem a riziky nebyl ale v těchto indikacích stanoven. Léčba může přinášet bezpečnostní riziko (glukózová intolerance u cystické fibrózy, benigní nitrolební hypertenze u hypochondroplazie).
Použití off‑label je proto přípustné jen v klinických studiích. V některých zemích je podání off‑label protiprávní.
Zneužití růstového hormonu
Růstový hormon nelze podávat jako podpůrný prostředek pro zvýšení výkonu, proti stárnutí nebo v dalších nedovolených indikacích. Toxicita takových intervencí se zpravidla nesleduje a nehlásí. To posiluje obavy, že nežádoucí účinky mohou být významné, zejména pokud se růstový hormon kombinuje s dalšími podpůrnými prostředky, např. s anabolickými steroidy.
Závěr
Dlouhodobá sledování desítek tisíc dětí a dospělých po dobu desítek tisíc paciento‑roků ukázala, že bezpečnostní profil růstového hormonu je dobrý. Tyto závěry vycházejí z observačních studií, které ve srovnání se studiemi kontrolovanými placebem mají metodologickáSeznam použité literatury
- [1] Raben MS. Treatment of a pituitary dwarf with human growth hormone. J Clin Endocrinol 1958; 18: 901–910.
- [2] Lebl J. Léčba růstovým hormonem u dětí s jeho deficitem. In: Jenšovský J, Lebl J, Christiansen JS (eds.). Růstový hormon. Praha: Galén, 2000; 142–152.
- [3] Brown P. Human growth hormone therapy and Creutzfeldt Jakob disease: A drama in three acts. Pediatrics 1988; 81: 85–92.
- [4] Carel JC, Butler G. Safety of recombinant human growth hormone. Endocrine Development 2010; 18: 40–54.
- [5] Poidvin A, Touze E, Ecosse E, et al. Growth hormone treatment for childhood short stature and risk of stroke in early adulthood. Neurology 2014; 83: 780–786.
- [6] Allen DB, Backeljauw P, Bidlingmaier M, et al. GH safety workshop position paper: a critical appraisal of recombinant human GH therapy in children and adults. Eur J Endocrinol 2016; 174: P1–P9.