Kardiologické komorbidity roztroušené sklerózy
Souhrn:
Masárová L, Krejčí J, Revendová K, Volný O. Kardiologické komorbidity roztroušené sklerózy. Remedia 2021; 31: 529–533.
Roztroušená skleróza je chronické zánětlivé demyelinizační a neurodegenerativní onemocnění centrálního nervového systému. U pacientů s roztroušenou sklerózou nacházíme zvýšený výskyt kardiovaskulárních komorbidit včetně makrovaskulárních příhod či vzácného syndromu zlomeného srdce. V rámci zahájení chronické terapie je nutné zvážit kardiovaskulární rizika a myslet na možnou kardiotoxicitu terapie.
Summary:
Masarova L, Krejci J, Revendova K, Volny O. Cardiologic comorbidities of multiple sclerosis. Remedia 2021; 31: 529–533.
Multiple sclerosis (MS) is a chronic inflammatory demyelinating and neurodegenerative disease of the central nervous system. In patients with MS, an increased incidence of cardiovascular comorbidities (including macrovascular events or rare syndrome of Takotsubo cardiomyopathy) can be found. When initiating chronic therapy, it is necessary to consider the cardiovascular risks and possible cardiotoxicity of disease‑modifying drugs.
Key words: acute coronary syndrome, Takotsubo cardiomyopathy, alemtuzumab, fingolimod, siponimod
Úvod
Roztroušená skleróza (RS) je chronické zánětlivé demyelinizační a neurodegenerativní onemocnění centrálního nervového systému (CNS) postihující celosvětově více než 2,5 milionu osob [1,2]. Prevalence v České republice je 170/100 000 obyvatel a incidence 11,7/100 000 obyvatel [3]. První klinické příznaky se objevují obvykle mezi 20.-40. rokem života, ženy bývají postiženy dvakrát až třikrát častěji než muži [1,2,4]. U většiny pacientů (85 %) RS v prvních letech probíhá formou relapsů a remisí s různou mírou úpravy neurologického deficitu (tzv. relabující remitující RS; RR RS). Po několika letech nebo dekádách může dojít k přechodu do sekundárně progresivní RS (SP RS) s chronickou progresí invalidity s relapsy nebo bez relapsů [1,2]. U 10-15 % pacientů dochází k progresi invalidity již od začátku nemoci (tzv. primárně progresivní RS, PP RS) [1,2]. Ke stanovení diagnózy RS se používají revidovaná McDonaldova kritéria z roku 2017 [5].
Výskyt kardiovaskulárních komorbidit je u pacientů s RS vzácný.
Autonomní dysfunkce u pacientů
s RS
Autonomní dysfunkce významně ovlivňuje kvalitu života u pacientů s RS a často postihuje více orgánů a systémů včetně močového měchýře, střev, srdce a také sexuální a sudomotorické funkce [6]. Kardiovaskulární autonomní dysfunkce (cardiovascular autonomic dysfunction, CAD) postihuje 19−42 % pacientů s RS [7]. CAD je jedním z hlavních faktorů ortostatické hypotenze (OH) a přispívá k symptomům ortostatické intolerance, jako jsou závratě, které mohou přímo nebo nepřímo zvýšit riziko pádu [8]. Několik observačních studií prokázalo, že demyelinizační léze mozkového kmene, středního mozku, hipokampu a míchy byly spojeny s rizikem kardiovaskulární dysfunkce včetně snížené variability srdeční frekvence (heart rate variability, HRV) a zvýšené variability krevního tlaku [9,10]. Běžná farmakologická léčba používaná u RS, např. imunoterapie, byla rovněž spojena s rizikem rozvoje CAD. Dlouhodobé studie prokázaly, že léčba fingolimodem významně snižuje citlivost HRV a citlivost baroreflexu [11,12]. Podávání vysokých dávek intravenózních kortikosteroidů a polypragmazie mohou rovněž přispívat k CAD u pacientů RS [13]. Dysfunkce baroreflexu zvyšuje riziko rozvoje cévní mozkové příhody (CMP) a infarktu myokardu [14,15]. Příznaky ortostatické nesnášenlivosti/posturální závratě nacházíme u 50–67 % pacientů s RS [16,17]. Prospektivní kohortové studie zdravé populace i populace neurologických pacientů naznačily, že OH vyplývající z baroreflexní a sympatické dysfunkce by mohla vést ke zhoršení kognitivních funkcí (např. prostřednictvím lézí bílé hmoty) v důsledku chronické hypoperfuze a suboptimální autoregulace mozku [18].
Kontrola rizikových faktorů
Pacienti s RS mají ve srovnání s běžnou populací vyšší prevalenci hypertenze a hyperlipidemie a častěji trpí obezitou především kvůli nedostatečné fyzické aktivitě [19,20]. Tito pacienti mají rovněž zvýšené riziko rozvoje tzv. makrovaskulárních příhod, a to CMP a akutního koronárního syndromu, i přes kontrolu známých rizikových faktorů (RF) [19,21]. Hyperlipidemie u pacientů s RS je stále předmětem intenzivního zkoumání.
Mortalita pacientů s RS je ve srovnání s běžnou populací rovněž vyšší, navíc se předpokládá, že ženy s RS mají vyšší riziko vaskulárních komplikací než muži [22,23]. Zásadní otázkou tedy zůstává, zda by pacienti s RS měli prospěch z přísnější kontroly cévních RF. Na tuto otázku byla zaměřena studie Palladina a kol. (12 251 pacientů s RS a 72 572 bez ní), jejímž výsledkem bylo, že pacienti s RS měli zvýšené riziko akutního koronárního syndromu a CMP i navzdory kontrole známých RF. Terapie statiny byla spojena s poklesem mortality u pacientů s RS. Předpokládá se role statinů v neuroprotekci, a to několika mechanismy: přímý vaskuloprotektivní efekt, zlepšení perfuze a snížení produkce volných radikálů. Výsledky studie MS STAT u pacientů se SP RS, kteří užívali vysoké dávky simvastatinu (80 mg), prokázaly snížení roční míry atrofie mozku o 43 % ve srovnání s pacienty, kteří užívali placebo [24].
RS a riziko neurogenního plicního
edému
U pacientů s RS se můžeme vzácně setkat s rozvojem tzv. neurogenního plicního edému. Jedná se o život ohrožující druh plicního edému, který vzniká u pacientů bez preexistující dysfunkce levé komory srdeční a doprovází např. poranění hlavy, generalizovaný (tonicko klonický) epileptický záchvat [25], cerebrovaskulární příhody, hyponatremickou encefalopatii nebo právě RS. Příčinou vzniku je s nejvyšší pravděpodobností katecholaminová bouře, která vede ke kardiopulmonální dysfunkci. Dochází zřejmě ke spojení náhlého vzestupu nitrolebního tlaku a uvolnění katecholaminů s rozvojem katecholaminové bouře. Plicní edém je tedy výsledkem centrální alfa adrenergní stimulace, která způsobuje generalizovanou vazokonstrikci s vysokými systémovými a plicními tlaky. Ke klinickým projevům patří akutní dyspnoe, tachypnoe, hypoxemie; na plicích jsou slyšitelné distanční vrzoty, dále se objevuje tachykardie, hypertenze a zvýšení tělesné teploty. V krevním obraze je přítomna leukocytóza. Na rentgenovém snímku srdce a plic jsou přítomny plicní infiltráty a srdeční stín nemusí být v úvodu zvětšen. Základ léčby představuje mechanická ventilace s vyššími frakcemi kyslíku s cílem snížit nitrolební tlak, kontrolovaná hyperventilace, zvýšená poloha hlavy a osmotická diuréza. V časném stadiu je důležité snížení sympatikotonie, podávají se alfa adrenolytika – fentolamin, fenoxybenzamin, dále urapidil, antiepileptika a chlorpromazin [26,27].
Tako tsubo kardiomyopatie
u pacientů s RS
Výjimečným kardiologickým projevem RS může být i stresová kardiomyopatie, tzv. tako tsubo (TTS) syndrom. Jedná se o syndrom zlomeného srdce, který může být kromě jiných příčin způsoben i akutním nebo chronickým onemocněním CNS. Typické i reverzní TTS byly popsány u pacientů s RS [28,29]. Přesný mechanismus TTS není jasný, předpokládá se, že u TTS dochází ke zvýšení koncentrace katecholaminů, což vede k přímé katecholaminové toxicitě a poškození adrenoreceptorů. Výsledkem je epikardiální a mikrovaskulární koronární vazokonstrikce a/nebo spasmus koronárních cév a zvýšené srdeční zatížení. To indukuje myokardiální postižení a typický obraz tzv. ventrikulárního ballooningu – tedy obraz hyperkontraktilních bazálních částí levé komory a apikální akineze [30,31]. Risseeuw a kol. popsali na kazuistickém případu spojení mezi jedinou kritickou demyelinizační lézí v dorzolaterální části medulla oblongata a TTS. Diagnóza rekurentního TTS v kombinaci se známkami autonomní dysfunkce vyžaduje důkladné vyšetření možného základního nebo souběžného neurologického onemocnění, včetně RS, a to rovněž u starších pacientů s kardiovaskulárními RF [32].
Specifická léčba RS a její
kardiovaskulární nežádoucí účinky a kontraindikace
Léčba RS spočívá v léčbě relapsů nemoci a v chronické terapii léky modifikujícími průběh nemoci (disease modifying drugs, DMDs) s cílem redukce relapsů a progrese disability [2]. Standardní léčbou relapsu je intravenózní podání metylprednisolonu v dávce 3-5 g [33–35]. Druhou linii terapie relapsu představují výměnné léčebné plazmaferézy, které jsou indikovány, pokud pacient na kortikosteroidy nereaguje nebo je netoleruje [1,34]. Pacientům, kteří po první demyelinizační příhodě nesplňují McDonaldova kritéria (tzv. klinicky izolovaný syndrom, CIS), jsou jako DMDs první volby podávány interferon beta 1a (IFNβ 1a), interferon beta 1b (IFNβ 1b) a glatiramer acetát. U pacientů s RR RS jsou DMDs 1. linie IFNβ 1a, IFNβ 1b, glatiramer acetát a teriflunomid; DMDs 2. linie u pacientů s RR RS jsou natalizumab, fingolimod, alemtuzumab, kladribin a okrelizumab, ale mohou být také podávány jako první volba, pokud je onemocnění považováno za vysoce aktivní. U pacientů refrakterních ke konvenční terapii lze zvážit imunoablaci s podporou autologních krvetvorných kmenových buněk. U pacientů se SP RS s aktivitou nemoci je indikován modulátor sfingosin 1 fosfátových receptorů (S1P) siponimod [36]. U pacientů s PP RS je jediným lékem monoklonální protilátka anti CD20 okrelizumab, ale terapie se nezahajuje u dlouhodobě stabilizovaných stavů s vysokým stupněm disability [37].
Kardiovaskulární nežádoucí účinky
DMDs a jejich monitorace
Interferon beta (IFNβ)
Aplikace IFNβ je asociována s možným
rozvojem plicní arteriální hypertenze (PAH) [38], tabulka 1.
Avšak vzhledem k tomu, že celosvětově je IFNβ léčeno více
než 2,3 milionu pacientů s RS, je počet případů PAH nízký
[39]. Je vysoce pravděpodobné, že někteří pacienti s RS
i přes negativní rodinnou anamnézu mají neznámou
predispozici k rozvoji PAH [40]. Souvislost byla popsána
především se dvěma geny, a to ATP13A3 a CYP1B1
[41–43]. V případě, že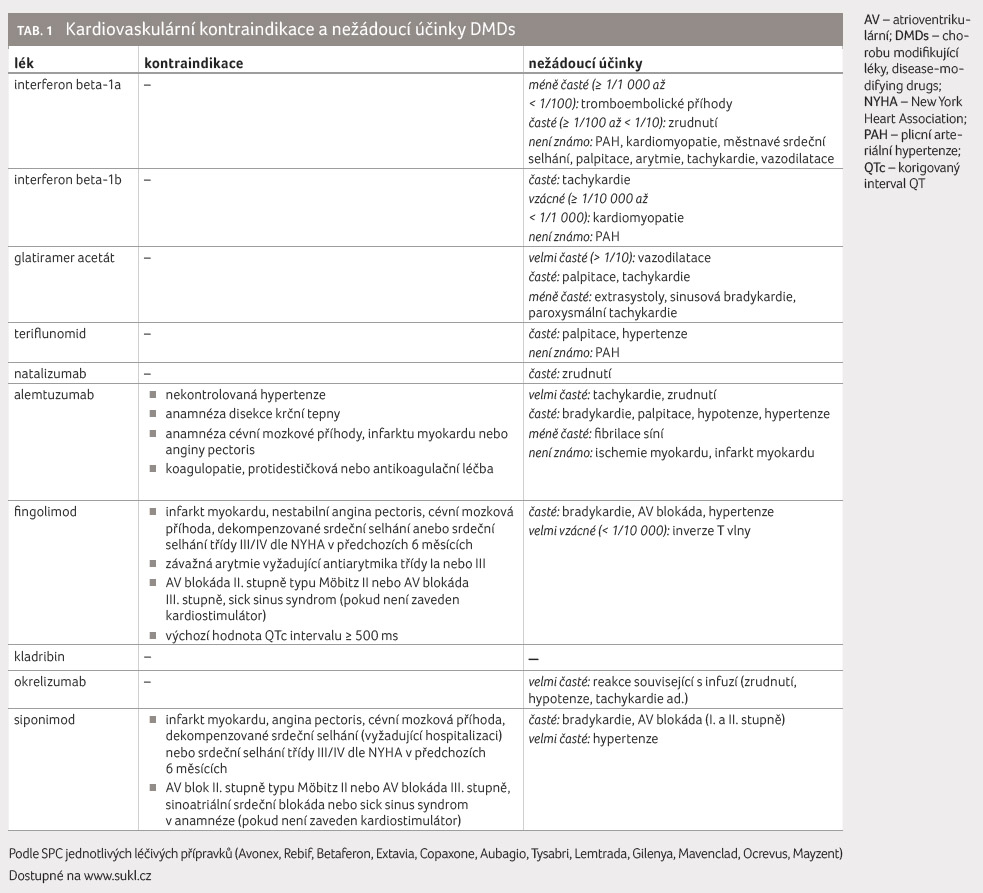 u pacienta léčeného IFNβ
dojde k rozvoji námahové dušnosti, bolesti na hrudi
a případně k otokům dolních končetin, mělo by být
doplněno echokardiografické vyšetření srdce (ECHO). Pokud jsou
přítomny známky PAH, měla by být doplněna pravostranná srdeční
katetrizace. Dle studie Marianne Lerche a kol. u pacientů
s potvrzenou genetickou predispozicí jednoho z uvedených
genů došlo po vysazení IFNβ a nasazení specifické
terapie PAH – antagonistů endotelinových receptorů
a inhibitorů fosfodiesterázy 5 - k postupnému
zmírnění PAH [38,44]. PAH u pacientů s RS léčených
IFNβ představuje reverzibilní proces v případě, že je
včas diagnostikován [45].
u pacienta léčeného IFNβ
dojde k rozvoji námahové dušnosti, bolesti na hrudi
a případně k otokům dolních končetin, mělo by být
doplněno echokardiografické vyšetření srdce (ECHO). Pokud jsou
přítomny známky PAH, měla by být doplněna pravostranná srdeční
katetrizace. Dle studie Marianne Lerche a kol. u pacientů
s potvrzenou genetickou predispozicí jednoho z uvedených
genů došlo po vysazení IFNβ a nasazení specifické
terapie PAH – antagonistů endotelinových receptorů
a inhibitorů fosfodiesterázy 5 - k postupnému
zmírnění PAH [38,44]. PAH u pacientů s RS léčených
IFNβ představuje reverzibilní proces v případě, že je
včas diagnostikován [45].
Glatiramer acetát
Při aplikaci glatiramer acetátu se relativně často objevuje histaminová reakce - vazodilatace (zrudnutí), bolesti na hrudi, dyspnoe, palpitace nebo tachykardie během několika minut po podání léku (tab. 1). Většina z těchto příznaků je krátkodobá a spontánně vymizí bez následků. Navíc současné údaje získané ze sledování souboru těhotných žen nenaznačují žádné malformační účinky nebo fetální/neonatální toxicitu. Výjimečně může dojít k rozvoji kardiálních nežádoucích účinků - zvýšené riziko ischemické choroby srdeční bylo prokázáno u určitých mutací genu pro transformující růstový faktor beta 1 (TGF β1) na chromozomu 19 [46].
Modulátory S1P receptorů
Modulátory S1P receptorů jsou fingolimod a siponimod. Fingolimod se váže na receptory S1P1 a S1P3-5, zatímco selektivnější siponimod na S1P1 a S1P5, což vede k menšímu riziku rozvoje kardiovaskulárních nežádoucích účinků. V srdečních myocytech je exprimován především receptor S1P1, v menším množství S1P2 a S1P3. Před zahájením terapie fingolimodem je nutné posoudit kardiovaskulární riziko a vyloučit kontraindikace (tab. 1). Všichni pacienti musejí mít před zahájením terapie provedeno elektrokardiografické vyšetření (EKG) a změřen krevní tlak. Během šesti hodin po první dávce je doporučeno monitorování pacienta včetně pravidelného měření krevního tlaku a srdeční frekvence v hodinových intervalech s kontinuální monitorací EKG. Krevní tlak by pak měl být pravidelně měřen během léčby. V průběhu aplikace byly pozorovány nežádoucí kardiovaskulární účinky, např. sinusová bradykardie až s možným přechodem do atrioventrikulární (AV) blokády.
Fingolimod byl studován v kombinaci s atenololem a diltiazemem. Pokud byl fingolimod v interaktivní studii zahrnující zdravé dobrovolníky užíván s atenololem, bylo přítomno přídatné 15% snížení srdeční frekvence při zahájení léčby fingolimodem. Uvedený účinek není pozorován u diltiazemu. Léčba fingolimodem nesmí být zahájena u pacientů léčených betablokátory nebo jinými látkami, které mohou snižovat srdeční frekvenci, jako například antiarytmika třídy Ia a III, blokátory kalciových kanálů (jako verapamil nebo diltiazem), ivabradin, digoxin, inhibitory cholinesterázy nebo pilokarpin, kvůli možným aditivním účinkům na srdeční frekvenci. Pokud se u těchto pacientů uvažuje o léčbě fingolimodem, je nutná konzultace s kardiologem ohledně převedení na přípravky nezpomalující srdeční akci nebo ohledně vhodného monitoringu pacienta při zahájení léčby. Pokud léky zpomalující srdeční akci nelze vysadit, doporučuje se přinejmenším monitorování přes noc. Rovněž byl pozorován účinek fingolimodu na funkci levé komory. Při aplikaci fingolimodu došlo k významnému poklesu ejekční frakce levé komory (EF LK) hodnocené pomocí ECHO. Jestliže se jedná o pacienta se známým srdečním selháním, uvedený přípravek není vhodný.
V rámci prevence vzniku nežádoucích účinků je nutné před zahájením léčby siponimodem vyšetřit genotyp cytochromu P450 2C9 (CYP2C9) pro stanovení typu metabolizéra. U pacientů s genotypem CYP2C9*3*3 je siponimod kontraindikován. U pacientů s genotypem CYP2C9*2*3 nebo *1*3 je doporučena redukovaná udržovací dávka 1 mg denně, u pacientů s ostatními genotypy je doporučena udržovací dávka 2 mg. Po zahájení léčby siponimodem dochází k přechodnému poklesu srdeční frekvence, a proto je nutné dodržet na začátku léčby titrační schéma k dosažení udržovací dávky. Pokles srdeční frekvence po první titrační dávce začíná během jedné hodiny a pokles v prvním dni je nejvyšší po dobu přibližně 3-4 hodin. Při pokračování titrace pokles srdeční frekvence přetrvává v následujících dnech, přičemž maximálního poklesu vzhledem k prvnímu dni aplikace (výchozí hodnota) je dosaženo v pátém až šestém dni. Při pokračujícím podávání siponimodu začíná srdeční frekvence stoupat po šestém dni a dosahuje úrovně placeba v průběhu 10 dní od zahájení léčby. V případě potřeby lze pokles srdeční frekvence vyvolaný siponimodem zvrátit parenterálním podáváním atropinu nebo isoprenalinu. Pokud je zvažována léčba siponimodem u pacientů s již existujícím prodloužením QT intervalu nebo u těch, kteří již jsou léčeni přípravky prodlužujícími QT interval se známými arytmogenními vlastnostmi, je před zahájením léčby nezbytná konzultace kardiologa kvůli určení vhodného způsobu monitorování. Siponimod nebyl studován u pacientů s arytmiemi vyžadujícími léčbu antiarytmiky třídy Ia (např. chinidinem, prokainamidem) nebo třídy III (např. amiodaronem, sotalolem). Antiarytmika tříd Ia a III jsou spojena s případy torsade de pointes u pacientů s bradykardií. Protože zahájení léčby vede ke snížení srdeční frekvence, siponimod nesmí být během zahájení léčby užíván současně s těmito antiarytmiky.
Existují pouze omezené zkušenosti u pacientů současně léčených blokátory vápníkových kanálů snižujícími srdeční frekvenci (např. verapamilem nebo diltiazemem) nebo jinými látkami, které mohou snižovat srdeční frekvenci (např. ivabradinem, digoxinem), protože tyto léčivé přípravky nebyly dosud studovány u pacientů léčených siponimodem v klinických studiích. Současné podání těchto látek při zahájení léčby může být spojeno se závažnou bradykardií a srdeční blokádou. U pacientů užívajících stabilní dávky betablokátorů je před zahájením léčby nutné vzít v úvahu klidovou srdeční frekvenci. Pokud je při chronické léčbě betablokátory klidová srdeční frekvence > 50 tepů/min, je možné zahájit léčbu siponimodem [47–51]. Jestliže je klidová srdeční frekvence ≤ 50 tepů/min, je nutné betablokátor vysadit do dosažení srdeční frekvence > 50 tepů/min. Poté je možné zahájit léčbu siponimodem a léčbu betablokátorem lze opakovaně zahájit po titraci siponimodu na cílovou udržovací dávku.
Alemtuzumab
Alemtuzumab je monoklonální protilátka anti CD52. Kazuisticky byly popsány případy akutního koronárního syndromu u mladých pacientů s RR RS, a to bez známé přítomnosti kardiovaskulárního RF, který se rozvinul krátce po aplikaci infuze alemtuzumabu. Konkrétně se jednalo o infarkt myokardu bez ST elevací, tzv. NSTEMI typu 2. U alemtuzumabu není mechanismus účinku zcela jasný, nedá se vyloučit masivní cytokinová bouře [52]. Po aplikaci infuze se mohou objevit i další kardiální nežádoucí účinky: tachykardie, bradykardie, palpitace, fibrilace síní, hypotenze nebo hypertenze, a to především první den aplikace infuze [53], tabulka 1.
Mitoxantron
Mitoxantron je cytostatikum s relativně nízkým kardiotoxickým potenciálem, pokud je dodržena totální kumulativní dávka do 140 mg/m2. Jedním z projevů kardiotoxicity je rozvoj kardiomyopatie s depresí systolické funkce levé komory a rozvoj diastolické dysfunkce. Před zahájením terapie a před každou další infuzí je nutné provést vyšetření ECHO. Před zahájením léčby musí být EF LK > 55 %. Dle současných doporučení pacienti s EF LK < 50 % nemohou být léčeni mitoxantronem. Léčba je přerušena, pokud EF LK klesne pod 50 % nebo jsou přítomny klinické známky srdečního selhání. Pokud je rozdíl vstupní EF LK a EF LK po aplikaci mitoxantronu vyšší než 10 %, infuze s mitoxantronem není aplikována. Po 4-8 týdnech je nutno provést kontrolní vyšetření ECHO, v případě normalizace EF LK nebo souhlasu kardiologa je možné pokračovat v terapii mitoxantronem. V rámci prevence kardiotoxicity je možná konkomitantní kardioprotektivní terapie např. dexrazoxanem [54].
Závěr
Pacienti s RS představují rizikovou skupinu stran přítomnosti a rozvoje kardiovaskulárních komorbidit, a to jak v souvislosti se základním onemocněním centrálního nervového systému, tak následkem chronického užívání DMDs s kardiotoxickými účinky. U léků s prokázaným kardiotoxickým účinkem a u pacientů s RS se známou kardiovaskulární komorbiditou je mezioborová spolupráce mezi neurologem a kardiologem zcela zásadní.
Seznam použité literatury
- [1] Piehl F. Current and emerging disease‑modulatory therapies and treatment targets for multiple sclerosis. J Intern Med 2021; 289: 771−791.
- [2] Montalban X, Gold R, Thompson AJ, et al. ECTRIMS/EAN Guideline on the pharmacological treatment of people with multiple sclerosis. Mult Scler 2018; 24: 96−120.
- [3] Vachová M. Epidemie roztroušené sklerózy ve světě? Cesk Slov Neurol N 2012; 75/108: 701−706.
- [4] Noseworthy JH, Lucchinetti C, Rodriguez M, Weinshenker BG. MS − Clinical course and diagnosis. N Engl J Med 2000; 343: 938−952.
- [5] Thompson AJ, Banwell BL, Barkhof F, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018; 17: 162−173.
- [6] Lensch E, Jost WH. Autonomic disorders in multiple sclerosis. Autoimmune Dis 2011; 2011: 803841.
- [7] Racosta JM, Kimpinski K, Morrow SA, Kremenchutzky M. Autonomic dysfunction in multiple sclerosis. Auton Neurosci 2015; 193: 1−6.
- [8] Magkas N, Tsioufis C, Thomopoulos C, et al. Orthostatic hypotension: From pathophysiology to clinical applications and therapeutic considerations. J Clin Hypertens 2019; 21: 546–554.
- [9] Habek M, Crnošija L, Lovrić M, et al. Sympathetic cardiovascular and sudomotor functions are frequently affected in early multiple sclerosis. Clin Auton Res 2016; 26: 385−393.
- [10] Saari A, Tolonen U, Pääkkö E, et al. Cardiovascular autonomic dysfunction correlates with brain MRI lesion load in MS. Clin Neurophysiol 2004; 115: 1473−1478.
- [11] Racca V, Rovaris M, Cavarretta R, et al. Acute Fingolimod Effects on Baroreflex and Cardiovascular Autonomic Control in Multiple Sclerosis. J Cent Nerv Syst Dis 2019; 11: 1179573519849945.
- [12] Simula S, Laitinen T, Vanninen E, et al. Baroreflex sensitivity in asymptomatic coronary atherosclerosis. Clin Physiol Funct Imaging 2013; 33: 70−74.
- [13] Vasheghani‑Farahani A, Sahraian MA, Darabi L, et al. Incidence of various cardiac arrhythmias and conduction disturbances due to high dose intravenous methylprednisolone in patients with multiple sclerosis. J Neurol Sci 2011; 309: 75–78.
- [14] La Rovere MT, Pinna GD, Raczak G. Baroreflex sensitivity: measurement and clinical implications. Ann Noninvasive Electrocardiol 2008; 13: 191–207.
- [15] Lin CH, Yen CC, Hsu YT, et al. Baroreceptor sensitivity predicts functional outcome and complications after acute ischemic stroke. J Clin Med 2019; 8: 300.
- [16] Flachenecker P, Wolf A, Krauser M, et al. Cardiovascular autonomic dysfunction in multiple sclerosis: correlation with orthostatic intolerance. J Neurol 1999; 246: 578–586.
- [17] Al‑Araji AH, Al‑Mahdawi AM, Mohammad AI. Autonomic dysfunction in multiple sclerosis. Neurosciences 2003; 8: 177–183.
- [18] Dadar M, Fereshtehnejad SM, Zeighami Y, et al. White matter hyperintensities mediate impact of dysautonomia on cognition in Parkinson’s disease. Mov Disord Clin Pract 2020; 7: 639–647.
- [19] Marrie RA, Reider N, Cohen J, et al. A systematic review of the incidence and prevalence of cardiac, cerebrovascular, and peripheral vascular disease in multiple sclerosis. Mult Scler 2015; 21: 318−331.
- [20] Marrie RA. Comorbidity in multiple sclerosis: implications for patient care. Nat Rev Neurol 2017; 13: 375−382.
- [21] Marrie RA, Garland A, Schaffer SA, et al. Traditional risk factors may not explain increased incidence of myocardial infarction in MS. Neurology 2019; 92: e1624−e1633.
- [22] Kingwell E, van der Kop M, Zhao Y, et al. Relative mortality and survival in multiple sclerosis: findings from British Columbia, Canada. J Neuro Neurosurg Psychiatry 2012; 83: 61−66.
- [23] Marrie RA, Patten SB, Tremlett H, et al.; CIHR Team in the Epidemiology and Impact of Comorbidity on Multiple Sclerosis. Sex differences in comorbidity at diagnosis of multiple sclerosis: a population‑based study. Neurology 2016; 86: 1279−1286.
- [24] Palladino R, Marrie RA, Majeed A, Chataway J. Evaluating the Risk of Macrovascular Events and Mortality Among People With Multiple Sclerosis in England. JAMA Neurol 2020; 77: 820−828.
- [25] Bartko D, Drobný M. Neurológia. 3., doplnené vydanie. Martin: Osveta, 1991: 548.
- [26] Vinš P. Plicní edém. Interní Med 2003; 5: 540−547.
- [27] Davison DL, Terek M, Chawla LS. Neurogenic pulmonary edema. 2012 Annual Update in Intensive Care and Emergency Medicine. Vincent J‑L (Ed); Berlin, Springer, 2012: 471–480.
- [28] Biesbroek PS, Nijveldt R, de Jong BA, et al. Reversed tako‑tsubo cardiomyopathy in a patient with new‑onset multiple sclerosis: Cause, link, or just coincidence? Int J Cardiol 2016; 207: 217–219.
- [29] Ghadri JR, Kato K, Cammann VL, et al. Long‑term prognosis of patients with Takotsubo syndrome. J Am College Cardiol 2018; 72: 874–882.
- [30] Pelliccia F, Kaski JC, Crea F, Camici PG. Pathophysiology of Takotsubo syndrome. Circulation 2017; 135: 2426–2441.
- [31] Madias JE. Blood norepinephrine/epinephrine/dopamine measurements in 108 patients with takotsubo syndrome from the world literature: pathophysiological implications. Acta Cardiol 2020; 2020: 1–9.
- [32] Risseeuw F, Masrori P, Baar I, et al. The Brain–Heart Link: A Case Report of a Critically Located Multiple Sclerosis Lesion in the Brainstem Leading to Recurrent Takotsubo Syndrome. Front Cardiovasc Med 2021; 8: 674118.
- [33] Repovic P. Management of multiple sclerosis relapses. Continuum 2019; 25: 655−669.
- [34] Sellebjerg F, Barnes D, Filippini G, et al. EFNS guideline on treatment of multiple sclerosis relapses: Report of an EFNS task force on treatment of multiple sclerosis relapses. Eur J Neurol 2005; 12: 939−946.
- [35] Liu S, Liu X, Chen S, et al. Oral versus intravenous methylprednisolone for the treatment of multiple sclerosis relapses: A meta‑analysis of randomized controlled trials. PLoS One 2017; 12: e0188644.
- [36] Kappos L, Bar‑Or A, Cree BAC, et al. Siponimod versus placebo in secondary progressive multiple sclerosis (EXPAND): a double‑blind, randomised, phase 3 study. Lancet 2018; 391: 1263−1273.
- [37] Riederer F. Ocrelizumab versus placebo in primary progressive multiple sclerosis. Journal für Neurologie, Neurochirurgie und Psychiatrie 2017; 18: 30–31.
- [38] Lerche M, Eichstaedt CA, Hinderhofer K, et al. Mutually reinforcing effects of genetic variants and interferon‑β 1a therapy for pulmonary arterial hypertension development in multiple sclerosis patients. Pulm Circ 2019; 9: 2045894019872192.
- [39] Demerouti E, Karyofyllis P, Athanassopoulos G, et al. Pulmonary arterial hypertension associated with interferon‑beta treatment for multiple sclerosis. Case report and literature review. Mult Scler Relat Disord 2019; 28: 273−275.
- [40] Papani R, Duarte AG, Lin YL, et al. Pulmonary arterial hypertension associated with interferon therapy: a population‑based study. Multidiscip Respir Med 2017; 12: 1.
- [41] Barozzi C, Galletti M, Tomasi L, et al. A Combined Targeted and Whole Exome Sequencing Approach Identified Novel Candidate Genes Involved in Heritable Pulmonary Arterial Hypertension. Sci Rep 2019; 9: 753.
- [42] West J, Cogan J, Geraci M, et al. Gene expression in BMPR2 mutation carriers with and without evidence of pulmonary arterial hypertension suggests pathways relevant to disease penetrance. BMC Med Genomics 2008; 1: 45.
- [43] Johansen AK, Dean A, Morecroft I, et al. The serotonin transporter promotes a pathological estrogen metabolic pathway in pulmonary hypertension via cytochrome P450 1B1. Pulm Circ 2016; 6: 82−92.
- [44] Caravita S, Secchi MB, Wu SC, et al. Sildenafil therapyfor interferon‑β‑1a‑induced pulmonary arterial hypertension: a case report. Cardiology 2011; 120: 187−189.
- [45] Savale L, Chaumais MC, O’Connell C, et al. Interferon‑induced pulmonary hypertension: an update. Curr Opin Pulm Med 2016; 22: 415−420.
- [46] Brænne I, Zeng L, Willenborg C, et al; CARDIoGRAM Consortium; CARDIoGRAMplusC4D Consortium, Willer CJ, Laakso M, Wallentin L, et al. Genomic correlates of glatiramer acetate adverse cardiovascular effects lead to a novel locus mediating coronary risk. PLoS One 2017; 12: e0182999.
- [47] Roy R, Alotaibi AA, Freedman MS. Sphingosine 1‑Phosphate Receptor Modulators for Multiple Sclerosis. CNS Drugs 2021; 35: 385−402.
- [48] Shakeri‑Nejad K, Aslanis V, Veldandi UK, et al. Effects of Therapeutic and Supratherapeutic Doses of Siponimod (BAF312) on Cardiac Repolarization in Healthy Subjects. Clin Ther 2015; 37: 2489−2505.
- [49] Yagi Y, Nakamura Y, Kitahara K, et al. Analysis of Onset Mechanisms of a Sphingosine 1‑Phosphate Receptor Modulator Fingolimod‑Induced Atrioventricular Conduction Block and QT‑Interval Prolongation. Toxicol Appl Pharmacol 2014; 281: 39−47.
- [50] Legangneux E, Gardin A, Johns D. Dose titration of BAF312 attenuates the initial heart rate reducing effect in healthy subjects. Br J Clin Pharmacol 2013; 75: 831−841.
- [51] Fryer RM, Muthukumarana A, Harrison PC, et al. The clinically‑tested S1P receptor agonists, FTY720 and BAF312, demonstrate subtype‑specific bradycardia (S1P₁) and hypertension (S1P₃) in rat. PLoS One 2012; 7: e52985.
- [52] Ahrabian D, Neill L, Bell R, Leary SM. Acute cardio toxicity associated with alemtuzumab infusion for multiple sclerosis. Mult Scler 2020; 26: 735−737.
- [53] Ferraro D, Camera V, Vitetta F, et al. Acute coronary syndrome associated with alemtuzumab infusion in multiple sclerosis. Neurology 2018; 90: 852–854.
- [54] Bernitsas E, Wei W, Mikol DD. Suppression of mitoxantrone cardiotoxicity in multiple sclerosis patients by dexrazoxane. Ann Neurol 2006; 59: 206−209.