Který typ biologické léčby zvolit u pacientů s idiopatickými střevními záněty?
Souhrn:
Ďuricová D, Lukáš M. Který typ biologické léčby zvolit u pacientů s idiopatickými střevními záněty? Remedia 2019; 29: 67–71.
Idiopatické střevní záněty (IBD) jsou chronická zánětlivá onemocnění trávicího traktu. Podobně jako jiná autoimunitní onemocnění nejsou IBD medikamentózně definitivně vyléčitelné. Zavedení biologické léčby do klinické praxe na počátku tohoto století znamenalo velký pokrok v terapii těchto onemocnění. V současnosti jsou k dispozici tři skupiny léčiv s různým mechanismem účinku, který je zodpovědný za specifické vlastnosti jednotlivých přípravků. Při výběru optimálního typu biologické léčby je nutno vždy zohlednit fenotyp pacienta a účinnost a bezpečnost daného léčiva.
Summary:
Duricova D, Lukas M. What type of biological therapy should be chosen in patients with inflammatory bowel diseases? Remedia 2019; 29: 67–71.
Inflammatory bowel diseases (IBD) are chronic inflammatory disorders of gastrointestinal tract. Similarly to other autoimmune diseases, IBD is medically incurable. The introduction of biological therapy to the treatment armamentarium of IBD represented a big progress in the management of IBD patients. Currently, there are three classes of biological therapy with different mechanism of action leading to specific strengths and limitations of particular agents. To choose the optimal biological agent for an individual patient, the phenotype of the disease as well as efficacy and safety of the drug have to be considered.
Key words: inflammatory bowel disease, Crohn’s disease, ulcerative colitis, anti‑TNFα, vedolizumab, ustekinumab
Úvod
Idiopatické střevní záněty (IBD) – Crohnova nemoc (CN) a ulcerózní kolitida (UC) – jsou medikamentózně nevyléčitelná chronická zánětlivá onemocnění trávicího traktu. Idiopatické střevní záněty postihují všechny věkové kategorie, nejčastěji jsou však diagnostikovány v mladém, produktivním věku [1]. Průběh a tíže onemocnění jsou velmi variabilní a přes pokroky v klinickém výzkumu poslední doby zůstávají u většiny nemocných do značné míry nepředvídatelné [1]. Idiopatické střevní záněty představují nejenom medicínský, ale také sociální problém, protože u značné části pacientů vedou ke snížení kvality života a k omezení práceschopnosti [2]. Velký zlom v léčbě IBD znamenalo zavedení biologické terapie a její relativně nedávné rozšíření o nové skupiny léčiv s odlišným mechanismem protizánětlivého účinku, což vedlo k rozšíření léčebných možností u IBD. V souvislosti s tím mohou vznikat nejasnosti ohledně výběru optimálního přípravku pro pacienta. Důvodem je chybění adekvátního srovnání účinnosti jednotlivých skupin léčiv a absence údajů o nových biologických přípravcích v určitých indikacích.
Biologická terapie
Pro léčbu IBD jsou v současné době k dispozici tři skupiny biologických přípravků s odlišným mechanismem účinku. Ve všech případech se jedná o monoklonální IgG1 protilátky zaměřené proti specifickému antigenu.
Prvním představitelem biologické léčby, zavedeným do terapie IBD koncem devadesátých let minulého století, byly monoklonální chimérické protilátky proti prozánětlivému cytokinu TNFα (tumor nekrotizující faktor alfa), který je v průběhu zánětu nadměrně vytvářen imunokompetentními buňkami a má významnou roli v patogenezi IBD a také u jiných autoimunitních onemocnění [3]. V České republice jsou z této skupiny registrovány tři přípravky – infliximab, adalimumab a golimumab.
V roce 2013 byl schválen k léčbě první biosimilární biologický přípravek (CT P13) a v současné době jsou k dispozici tři biosimilární verze infliximabu a pět verzí biosimilárního adalimumabu. I když se jedná o léčiva s malými strukturálními odchylkami od referenčních produktů, jsou jejich klinické efekty, farmakokinetika, imunogenicita a nežádoucí účinky totožné s originálními léčivy [4].
V roce 2014 byl pro léčbu CN i UC schválen vedolizumab – druhý typ biologické léčby s odlišným mechanismem účinku. Jedná se o humanizovanou monoklonální protilátku, která vazbou α4β7 integrinového receptoru na povrchu aktivovaných CD4+ lymfocytů inhibuje jejich migraci z krevního řečiště do sliznice střeva [5].
Třetím biologickým přípravkem, registrovaným od konce roku 2016 pro léčbu CN, je ustekinumab. Mechanismus protizánětlivého účinku je zprostředkován blokádou společné podjednotky dvou cytokinů IL 12 a IL 23 označované symbolem p40 a následným ovlivněním Th1 a Th17 imunitně mediované odpovědi [6]. Ustekinumab je v České republice registrován již od roku 2009 pro léčbu psoriázy a psoriatické artritidy.
Anti TNFα přípravky
a ustekinumab patří mezi tzv. anticytokinové protilátky,
které mají systémový efekt. Vedolizumab se na rozdíl
od obou předchozích skupin vyznačuje převážně selektivním
působením v gastrointestinálním traktu [5].
Přehled jednotlivých přípravků je uveden v tabulce 1.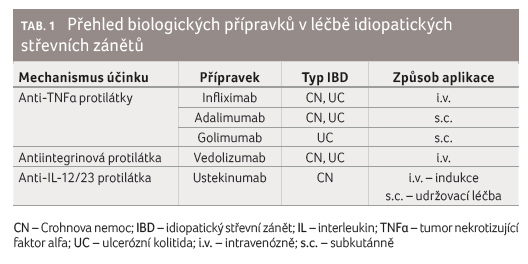
Výběr biologického přípravku
Volba biologického přípravku a léčebné strategie je kompromisem založeným na zhodnocení několika faktorů nemedicínských a odborných. Dostupnost biologika a ochota plátců zdravotní péče zamýšlenou terapii uhradit je zásadním nemedicínským limitem, který se při selekci terapie uplatňuje. Biologická léčba je ekonomicky nákladná, a není proto pochyb o tom, že musí být vybrán takový přípravek, který má nejvyšší šanci na dosažení maximální léčebné odpovědi a na setrvalý efekt. Anti TNFα léčiva byla zavedena do klinické praxe před dvaceti lety a po zavedení biosimilárních verzí se stala biologiky s nejnižšími ekonomickými náklady v porovnání s léky, které byly zavedeny do terapie před několika lety.
V klinické praxi se ukázalo, že správný výběr léčby je současně ekonomicky nejefektivnější strategií. Terapie přípravkem sice nejlevnějším, avšak u konkrétního pacienta nevýhodným pro vyšší riziko nežádoucích účinků nebo nižší klinickou účinnost bývá spojena s dalšími náklady na léčbu při řešení komplikací nemoci nebo nežádoucích účinků léčby a po nutném převedení na další, zpravidla dražší linii léčby. V terapii IBD platí, že léčba zavedená jako první u nemocných, kteří ještě nebyli exponováni biologiku v minulosti, je nejefektivnější, a to bez ohledu na mechanismus protizánětlivého účinku [7–9]. Je li nemocný léčen méně vhodným přípravkem v první linii, pak převedení na druhou nebo třetí linii biologické léčby může být spojeno s významně nižší efektivitou. Jinými slovy chybné „předléčení“ v první linii biologické léčby snižuje vyhlídky na dlouhodobou efektivitu po převedení na léčbu jinými přípravky.
Preference pacienta s ohledem na způsob podání léčiva (intravenózní nebo subkutánní), plány do krátké i vzdálené budoucnosti (např. mateřství, cestování, pracovní zařazení) a ochota k samoléčbě u přípravků podávaných subkutánně nebo odhodlanost docházet pravidelně a někdy relativně často do zdravotnického zařízení jsou dalšími aspekty, které završují celou selekci vhodného biologického léku.
Z hlediska odborného je při výběru optimálního typu biologického přípravku nutno vždy zohlednit charakteristiky pacienta, jako jsou fenotyp nemoci, aktuální aktivita onemocnění, přidružené nemoci a vlastnosti léčiva – jeho účinnost, použití ve speciálních situacích a bezpečnost.
Účinnost
Všechny tři skupiny přípravků
prokázaly v registračních studiích účinnost v indukční
i udržovací fázi léčby středně těžké až těžké
formy IBD v porovnání s placebem [8,10–17].
V současné době chybějí výsledky tzv. head to head studií,
které by přímo porovnaly efektivitu jednotlivých přípravků
v terapii IBD. Určité doplnění této mezery představují
tzv. network metaanalýzy, které prostřednictvím složitých
matematických a statistických modelů umožňují nepřímé
srovnání efektivity několika přípravků nebo intervencí
v případě absence přímého srovnání [18].
Jejich velkou limitací však je, že srovnávají studie s různým
typem uspořádání a s odlišnou populací pacientů.
Závěry těchto studií proto nelze spolehlivě uplatnit v klinické
praxi a je nutno vyčkat na výsledky probíhajících
„head to head“ studií. Při výběru optimálního biologického
přípravku je možné se zatím orientovat podle specifických
vlastností jednotlivých léčiv, jež představují určité
výhody, ale i limitace v konkrétních klinických
situacích (obr. 1).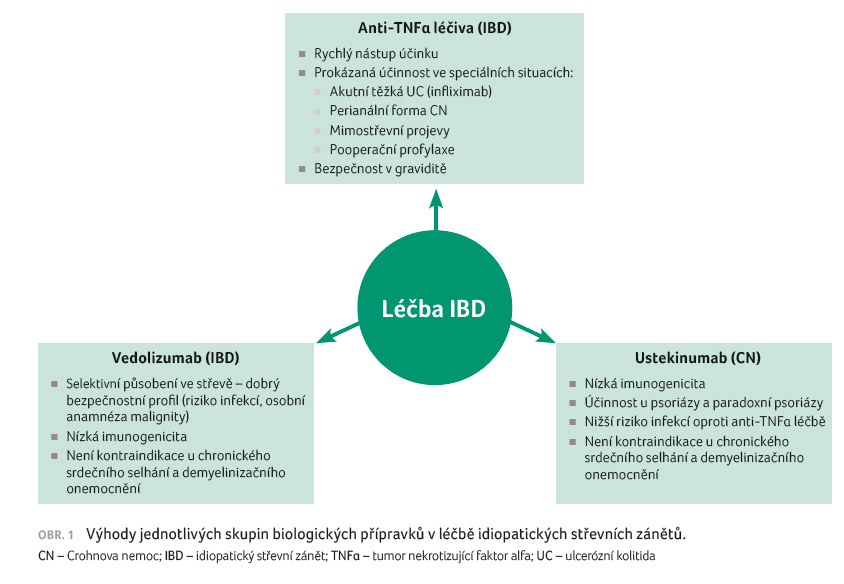
Anti TNFα přípravky, a to především intravenózně podávaný infliximab, se ve srovnání s novými biologickými léčivy vyznačují promptním nástupem účinku. Jsou proto vhodné pro pacienty s vysokou aktivitou nemoci, u nichž je potřeba rychlého navození remise. Specifickou skupinu tvoří pacienti s akutní těžkou UC rezistentní na parenterální léčbu systémovými kortikoidy, u kterých je lékem první volby infliximab v intenzifikovaném režimu [19]. Určitou nevýhodou anti TNFα terapie, a to zvláště u infliximabu, je její klinicky významná imunogenicita s tvorbou protilékových protilátek (infliximab 0–83 %; adalimumab 0–54 %, golimumab 0–19 %) [20]. Ty mohou být zodpovědné za ztrátu odpovědi na léčbu nebo indukovat vznik nežádoucích účinků. Právě snížením tvorby protilékových protilátek se vysvětluje vyšší účinnost dnes doporučené terapie kombinací infliximabu s imunosupresivy oproti monoterapii infliximabem [21–23]. Přínos imunosupresivní terapie v léčbě adalimumabem je s ohledem na rozporuplné výsledky studií nejednoznačný [24]. Výhodou vedolizumabu i ustekinumabu je jejich výrazně nižší imunogenicita, s výskytem protilékových protilátek u méně než 5 % léčených pacientů [5,25]. Nižší imunogenicita inovativních léků dává předpoklad pro dostatečný efekt monoterapie bez potřeby kombinované imunosupresivní léčby.
Speciální situace
Perianální onemocnění
Účinnost v indukční a udržovací léčbě perianální formy CN byla zatím prokázána jenom u anti TNFα přípravků [26]. Dle posledních evropských doporučení jsou infliximab a adalimumab indikovány jako léčba první linie u komplexních perianálních píštělí [27]. Post hoc analýza randomizovaných kontrolovaných studií a některé kohortové studie prokázaly účinnost ustekinumabu v léčbě perianální CN [28]. Podobně v post hoc analýze studie GEMINI 2 numericky vyšší počet pacientů s perianálními píštělemi randomizovaných k terapii vedolizumabem dosáhl remise oproti placebu [26]. Pro zhodnocení pozice nových biologik v této indikaci jsou nutné prospektivní kontrolované studie.
Mimostřevní projevy
Zhruba u třetiny pacientů s IBD se objevují mimostřevní projevy nemoci, nejčastěji s postižením kloubů, kůže nebo očí [29]. Některé mimostřevní projevy jsou vázány na aktivní střevní onemocnění (např. enteropatická artritida I. typu, erythema nodosum nebo episkleritida), jiné jsou nezávislé na přítomnosti zánětu ve střevě (např. uveitida, axiální artropatie) [30]. Účinnost v léčbě mimostřevních projevů, konkordantních i diskordantních se střevní zánětlivou aktivitou, byla prokázána u anti TNFα terapie [31]. V případě nové biologické léčby jsou údaje zatím limitované, lze však předpokládat její efektivitu u projevů vázaných na aktivitu střevní nemoci. Z důvodu systémového efektu ustekinumabu a jeho účinnosti i v léčbě jiných onemocnění (psoriáza, psoriatická artritida) je možno očekávat efekt i v léčbě některých diskordantních mimostřevních projevů. Efektivita vedolizumabu je v této indikaci s ohledem na jeho selektivní působení ve střevě spíše sporná.
Koincidující choroby
Asi u 4–5 % nemocných s IBD, především mladších mužů s UC, se objevuje primární sklerózující cholangitida (PSC). Jedná se o autoimunitně zprostředkované zánětlivé postižení intra a extrahepatálních žlučovodů [31]. Podávání anti TNFα léků u některých nemocných s IBD může zhoršit průběh PSC nebo iniciovat či zhoršit cholestázu a uspíšit potřebu jaterní transplantace (stanovisko transplantačního centra Institutu klinické a experimentální medicíny). Z těchto důvodů je terapie anti TNFα léčivy relativně kontraindikována a jako biologický lék první volby je preferován vedolizumab. Demyelinizační nemoci a roztroušená skleróza se objevují asi u 3–5 % nemocných s CN [32]. Rovněž u těchto nemocných je podávání anti TNFα léčiv považováno za kontraindikaci pro možnost zhoršení demyelinizačního procesu [33]. Léčivy první volby jsou vedolizumab nebo ustekinumab. Rovněž u jiných autoimunitně zprostředkovaných chorob, jako je systémový lupus erythematodes nebo imunokomplexové vaskulitidy, je preferována biologické léčba se selektivním gastrointestinálním působením (vedolizumab) [33].
Nemocní s anamnézou neoplastického onemocnění, především pacienti s maligním melanomem, s lymfoproliferativními a myeloproliferativními chorobami nebo s některými typy solidních nádorů, jako jsou karcinom ledviny, močového měchýře a prsu, mohou být podávanou anti TNFα léčbou destabilizováni, resp. silný systémový imunosupresivní efekt této léčby může potencovat relaps předtím dobře kontrolovaného onkologického onemocnění [33]. Lékem první volby je v těchto případech vedolizumab. U pacientů s prokázanými dysplastickými změnami ve sliznici tlustého nebo tenkého střeva je podávání jakékoliv biologické léčby spojeno s vysokým rizikem akcelerace nádorové transformace.
Pooperační profylaxe a perioperační podávání biologik
V současné době existuje evidence pouze o efektivitě anti TNFα terapie v profylaxi pooperační rekurence u vysoce rizikových pacientů s CN a údaje o účinnosti nových biologických léčiv v této indikaci zatím zcela chybějí [34].
V klinické praxi dochází relativně často k situaci, že u nemocných dlouhodobě léčených biologickými přípravky dojde ke ztrátě klinické odpovědi nebo ke vzniku komplikace a pacient je indikován k akutnímu nebo elektivnímu chirurgickému výkonu. Vyšší výskyt časných, hnisavých pooperačních komplikací u nemocných s UC léčených infliximabem vedl k doporučení, aby u těchto nemocných byl prováděn dvojdobý nebo trojdobý operační výkon (proktokolektomie a ileo pouch anální anastomóza) s přechodnou ileostomií [35]. Zda je hlavní příčinou vyššího výskytu komplikací nepříznivý metabolický stav pacienta v důsledku vysoké aktivity choroby, nebo se větší měrou na jejich vzniku podílí efekt biologické léčby, nebylo jednoznačně objasněno. U nemocných s CN nemá perioperační podání anti TNFα léčby žádný nepříznivý vliv na výskyt časných pooperačních komplikací [36]. I když pro nejmladší inovativní biologickou léčbu chybí definitivní evidence, krátké zkušenosti s ní spíše podporují bezpečnost perioperativního podávání vedolizumabu nebo ustekinumabu [5].
Gravidita
Všechny biologické přípravky (anti TNFα, vedolizumab, ustekinumab) jsou IgG1 protilátky, které od konce druhého trimestru přecházejí transplacentárně aktivním transportem do oběhu plodu, podobně jako jiné mateřské protilátky [37]. Důsledkem toho jsou vyšší koncentrace léčiva v pupečníkové krvi oproti koncentracím léčiva v krvi matky v době porodu [38]. Na základě výsledků dosavadních studií je anti TNFα terapie považována za bezpečnou s ohledem na průběh těhotenství a na vývoj plodu [37]. Navíc přibývají zkušenosti, které prokazují bezpečnost prenatální expozice této terapii i pro další postnatální vývoj intrauterinně exponovaných dětí [39–41]. Doposud publikované údaje o nové biologické léčbě neprokazují jejich jednoznačně negativní vliv na průběh gravidity a vývoj plodu [42–44]. Nicméně kvůli celkově malému počtu studovaných pacientek chybí zatím spolehlivá evidence o bezpečnosti této léčby v těhotenství.
Bezpečnost
Nevýhodou systémového imunosupresivního působení anti TNFα léčby je zvýšené riziko závažných infekcí [45–47]. Toto riziko dále narůstá při použití kombinace biologické terapie s imunosupresivy a kortikoidy [46]. Rizikovou skupinu představují zvláště starší pacienti, u kterých je výskyt závažných a oportunních infekcí 2–3násobně vyšší oproti mladším jedincům [45,46]. Velkou výhodou nových biologických léčiv je jejich příznivější bezpečnostní profil ve srovnání s anti TNFα terapií. V tomto ohledu dominuje vedolizumab z důvodu selektivního působení ve střevě a absence systémového efektu [48]. Vedolizumab proto představuje z hlediska bezpečnosti optimální přípravek pro pacienty se zvýšeným rizikem infekčních komplikací, jako jsou např. pacienti vyššího věku, s přítomností komorbidit nebo s anamnézou infekčních komplikací.
Ustekinumab má podobně jako anti TNFα terapie systémový efekt, avšak dosud publikované údaje z registračních studií a jejich prodlouženého sledování ukázaly příznivý bezpečnostní profil ustekinumabu, včetně minimálního rizika infekcí [49]. Tyto příznivé údaje podporují i výsledky dlouhodobého registru biologické a nebiologické léčby psoriázy (PSOLAR), které neprokázaly zvýšené riziko vzniku závažných infekčních komplikací u pacientů léčených ustekinumabem [50]. Naopak léčba ustekinumabem vykazovala statisticky významně nižší riziko výskytu závažných infekcí ve srovnání s jinou biologickou léčbou (převážně adalimumab a etanercept) [50]. Je však potřeba zdůraznit, že v léčbě psoriázy se používají nižší dávky než v případě CN.
V tabulce 2 je uveden návrh doporučení pro volbu typu
biologického přípravku, který vychází ze současné
dostupné evidence.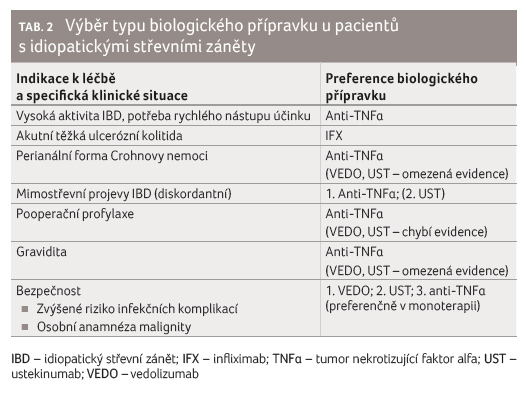
Závěr
Zavedení biologické léčby do terapie IBD a její rozšíření o nové přípravky znamená výrazný pokrok v terapii těchto onemocnění. Optimální způsob léčby pacientů s IBD představuje v současné době tzv. individualizovaná terapie, která prokazuje dlouhodobě vyšší efektivitu, nižší výskyt nežádoucích účinků a v důsledku toho i celkově nejnižší náklady. Při výběru typu biologické léčby bychom proto měli vždy zohlednit charakter a tíži nemoci pacienta, účinnost a bezpečnost konkrétního léčiva a pokud možno i preferenci pacienta.
Seznam použité literatury
- [1] Cosnes J, Gower‑Rousseau C, Seksik P, Cortot A. Epidemiology and natural history of inflammatory bowel diseases. Gastroenterology 2011; 140: 1785–1794.
- [2] Ďuricová D, Pfeiferová M, Bortlík M, et al. Kvalita života pacientů s idiopatickými střevními záněty v České republice – multicentrická studie. Gastroent Hepatol 2018; 72: 1–9.
- [3] Papadakis KA, Targan SR. Tumor necrosis factor: biology and therapeutic inhibitors. Gastroenterology 2000; 119: 1148–1157.
- [4] Gimeno‑Gracia M, Gargallo CJ, Gomollón F. Bioequivalence studies with anti‑TNF biosimilars. Expert Opin Biol Ther 2018; doi: 10.1080/14712598.2019.1561851 [Epub ahead of print].
- [5] Shim HH, Chan PW, Chuah SW, et al. A review of vedolizumab and ustekinumab for the treatment of inflammatory bowel diseases. JGH Open 2018; 2: 223–234.
- [6] Krejsek J. Modulace signálních drah IL‑12/IL‑23 ustekinumabem tlumí poškozující zánět u pacientů s Crohnovou nemocí. Gastroent Hepatol 2018; 72: 334–339.
- [7] Sands BE, Sandborn WJ, Van Assche G, et al. Vedolizumab as Induction and Maintenance Therapy for Crohnʼs Disease in Patients Naïve to or Who Have Failed Tumor Necrosis Factor Antagonist Therapy. Inflamm Bowel Dis 2017; 23: 97–106.
- [8] Feagan BG, Sandborn WJ, Gasink C, et al. Ustekinumab as Induction and Maintenance Therapy for Crohnʼs Disease. N Engl J Med 2016; 375: 1946–1960.
- [9] Taxonera C, Rodríguez C, Bertoletti F, et al. Clinical Outcomes of Golimumab as First, Second or Third Anti‑TNF Agent in Patients with Moderate‑to‑Severe Ulcerative Colitis. Inflamm Bowel Dis 2017; 23: 1394–1402.
- [10] Colombel JF, Sandborn WJ, Rutgeerts P, et al. Adalimumab for maintenance of clinical response and remission in patients with Crohnʼs disease: the CHARM trial. Gastroenterology 2007; 132: 52–65.
- [11] Sandborn WJ, van Assche G, Reinisch W, et al. Adalimumab induces and maintains clinical remission in patients with moderate‑to‑severe ulcerative colitis. Gastroenterology 2012; 142: 257–265.e1‑3.
- [12] Sandborn WJ, Feagan BG, Marano C, et al. Subcutaneous golimumab induces clinical response and remission in patients with moderate‑to‑severe ulcerative colitis. Gastroenterology 2014; 146: 85–95; quiz e14‑5.
- [13] Sandborn WJ, Feagan BG, Marano C, et al. Subcutaneous golimumab maintains clinical response in patients with moderate‑to‑severe ulcerative colitis. Gastroenterology 2014; 146: 96–109.e1.
- [14] Sandborn WJ, Feagan BG, Rutgeerts P, et al. Vedolizumab as induction and maintenance therapy for Crohnʼs disease. N Engl J Med 2013; 369: 711–721.
- [15] Feagan BG, Rutgeerts P, Sands BE, et al. Vedolizumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2013; 369: 699–710.
- [16] Hanauer SB, Feagan BG, Lichtenstein GR, et al. Maintenance infliximab for Crohnʼs disease: the ACCENT I randomised trial. Lancet 2002; 359: 1541–1549.
- [17] Rutgeerts P, Sandborn WJ, Feagan BG, et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005; 353: 2462–2476.
- [18] Tonin FS, Rotta I, Mendes AM, Pontarolo R. Network meta‑analysis: a technique to gather evidence from direct and indirect comparisons. Pharm Pract (Granada) 2017; 15: 943.
- [19] Harbord M, Eliakim R, Bettenworth D, et al. Third European Evidence‑based Consensus on Diagnosis and Management of Ulcerative Colitis. Part 2: Current Management. J Crohns Colitis 2017; 11: 769–784.
- [20] Strand V, Balsa A, Al‑Saleh J, et al. Immunogenicity of Biologics in Chronic Inflammatory Diseases: A Systematic Review. BioDrugs 2017; 31: 299–316.
- [21] Colombel JF, Adedokun OJ, Gasink C, et al. Combination Therapy With Infliximab and Azathioprine Improves Infliximab Pharmacokinetic Features and Efficacy: A Post Hoc Analysis. Clin Gastroenterol Hepatol 2018; doi: 10.1016/j.cgh.2018.09.033 [Epub ahead of print].
- [22] Colombel JF, Sandborn WJ, Reinisch W, et al. Infliximab, azathioprine, or combination therapy for Crohnʼs disease. N Engl J Med 2010; 362: 1383–1395.
- [23] Panaccione R, Ghosh S, Middleton S, et al. Combination therapy with infliximab and azathioprine is superior to monotherapy with either agent in ulcerative colitis. Gastroenterology 2014; 146: 392–400.e3.
- [24] Kopylov U, Al‑Taweel T, Yaghoobi M, et al. Adalimumab monotherapy versus combination therapy with immunomodulators in patients with Crohnʼs disease: a systematic review and meta‑analysis. J Crohns Colitis 2014; 8: 1632–1641.
- [25] Sandborn WJ, Rutgeerts P, Gasink C, et al. Long‑term efficacy and safety of ustekinumab for Crohnʼs disease through the second year of therapy. Aliment Pharmacol Ther 2018; 48: 65–77.
- [26] Lee MJ, Parker CE, Taylor SR, et al. Efficacy of Medical Therapies for Fistulizing Crohnʼs Disease: Systematic Review and Meta‑analysis. Clin Gastroenterol Hepatol 2018; 16: 1879–1892.
- [27] Gionchetti P, Dignass A, Danese S, et al. 3rd European Evidence‑based Consensus on the Diagnosis and Management of Crohnʼs Disease 2016: Part 2: Surgical Management and Special Situations. J Crohns Colitis 2017; 11: 135–149.
- [28] Lee MN, Kang B, Choi SY, et al. Relationship between azathioprine dosage, 6‑thioguanine nucleotide levels, and therapeutic response in pediatric patients with IBD treated with azathioprine. Inflamm Bowel Dis 2015; 21: 1054–1062.
- [29] Duricova D, Leroyer A, Savoye G, et al. Extra‑intestinal Manifestations at Diagnosis in Paediatric‑ and Elderly‑onset Ulcerative Colitis are Associated With a More Severe Disease Outcome: A Population‑based Study. J Crohns Colitis 2017; 11: 1326–1334.
- [30] Vavricka SR, Schoepfer A, Scharl M, et al. Extraintestinal Manifestations of Inflammatory Bowel Disease. Inflamm Bowel Dis 2015; 21: 1982–1992.
- [31] Harbord M, Annese V, Vavricka SR, et al. The First European Evidence‑based Consensus on Extra‑intestinal Manifestations in Inflammatory Bowel Disease. J Crohns Colitis 2016; 10: 239–254.
- [32] Kosmidou M, Katsanos AH, Katsanos KH, et al. Multiple sclerosis and inflammatory bowel diseases: a systematic review and meta‑analysis. J Neurol 2017; 264: 254–259.
- [33] Bortlík M, Ďuricová D, Kohout P, et al. Doporučení pro podávání biologické terapie u idiopatických střevních zánětů: třetí, aktualizované vydání. Gastroent Hepatol 2016; 70: 11–27.
- [34] Bakouny Z, Yared F, El Rassy E, et al. Comparative Efficacy of Anti‑TNF Therapies For The Prevention of Postoperative Recurrence of Crohnʼs Disease: A Systematic Review and Network Meta‑Analysis of Prospective Trials. J Clin Gastroenterol 2018; doi: 10.1097/MCG.0000000000001006 [Epub ahead of print].
- [35] Magro F, Gionchetti P, Eliakim R, et al. Third European Evidence‑based Consensus on Diagnosis and Management of Ulcerative Colitis. Part 1: Definitions, Diagnosis, Extra‑intestinal Manifestations, Pregnancy, Cancer Surveillance, Surgery, and Ileo‑anal Pouch Disorders. J Crohns Colitis 2017; 11: 649–670.
- [36] Fumery M, Seksik P, Auzolle C, et al. Postoperative Complications after Ileocecal Resection in Crohnʼs Disease: A Prospective Study From the REMIND Group. Am J Gastroenterol 2017; 112: 337–345.
- [37] van der Woude CJ, Ardizzone S, Bengtson MB, et al. The second European evidenced‑based consensus on reproduction and pregnancy in inflammatory bowel disease. J Crohns Colitis 2015; 9: 107–124.
- [38] Bortlik M, Machkova N, Duricova D, et al. Pregnancy and newborn outcome of mothers with inflammatory bowel diseases exposed to anti‑TNF‑α therapy during pregnancy: three‑center study. Scand J Gastroenterol 2013; 48: 951–958.
- [39] Duricova D, Dvorakova E, Hradsky O, et al. Safety of Anti‑TNF‑Alpha Therapy During Pregnancy on Long‑term Outcome of Exposed Children: A Controlled, Multicenter Observation. Inflamm Bowel Dis 2018; doi: 10.1093/ibd/izy294 [Epub ahead of print].
- [40] de Lima A, Zelinkova Z, van der Ent C, et al. Tailored anti‑TNF therapy during pregnancy in patients with IBD: maternal and fetal safety. Gut 2016; 65: 1261–1268.
- [41] Chaparro M, Verreth A, Lobaton T, et al. Long‑Term Safety of In Utero Exposure to Anti‑TNFα Drugs for the Treatment of Inflammatory Bowel Disease: Results from the Multicenter European TEDDY Study. Am J Gastroenterol 2018; 113: 396–403.
- [42] Moens A, van Hoeve K, Humblet E, et al. Outcome of Pregnancies in Female Patients With Inflammatory Bowel Diseases Treated With Vedolizumab. J Crohns Colitis 2019; 13: 12–18.
- [43] Lund T, Thomsen SF. Use of TNF‑inhibitors and ustekinumab for psoriasis during pregnancy: A patient series. Dermatol Ther 2017; 30; doi: 10.1111/dth.12454.
- [44] Rowan CR, Cullen G, Mulcahy HE, et al. Ustekinumab Drug Levels in Maternal and Cord Blood in a Woman With Crohnʼs Disease Treated Until 33 Weeks of Gestation. J Crohns Colitis 2018; 12: 376–378.
- [45] Lichtenstein GR, Feagan BG, Cohen RD, et al. Infliximab for Crohnʼs Disease: More Than 13 Years of Real‑world Experience. Inflamm Bowel Dis 2018; 24: 490–501.
- [46] Kirchgesner J, Lemaitre M, Carrat F, et al. Risk of Serious and Opportunistic Infections Associated With Treatment of Inflammatory Bowel Diseases. Gastroenterology 2018; 155: 337–346.e10.
- [47] Lynn AM, Loftus EV. Illuminating the Black Box: The Real Risk of Serious Infection With Inflammatory Bowel Disease Therapies. Gastroenterology 2018; 155: 262–265.
- [48] Bye WA, Jairath V, Travis SPL. Systematic review: the safety of vedolizumab for the treatment of inflammatory bowel disease. Aliment Pharmacol Ther 2017; 46: 3–15.
- [49] Armuzzi A, Ardizzone S, Biancone L, et al. Ustekinumab in the management of Crohnʼs disease: Expert opinion. Dig Liver Dis 2018; 50: 653–660.
- [50] Papp K, Gottlieb AB, Naldi L, et al. Safety Surveillance for Ustekinumab and Other Psoriasis Treatments From the Psoriasis Longitudinal Assessment and Registry (PSOLAR). J Drugs Dermatol 2015; 14: 706–714.