Kvalita života pacientů s roztroušenou sklerózou ve světle klinických studií
Souhrn:
Roztroušená skleróza je chronické zánětlivé onemocnění centrálního nervového systému, které je nejčastějším invalidizujícím onemocněním mladých lidí. Kromě poruch citlivosti, motoriky, stability a dalších měřitelných objektivních příznaků patří k obrazu nemoci i únava, deprese, sociální handicap a další, které výrazně ovlivňují kvalitu života. Léky modifikující průběh onemocnění snižují počet relapsů, zpomalují klinickou progresi a zlepšují i kvalitu života, jejíž hodnocení se stává cílem řady klinických studií. V článku je uveden přehled studií hodnotících tuto entitu u pacientů s roztroušenou sklerózou léčených interferonem beta, glatiramer acetátem, teriflunomidem, dimethyl fumarátem, fingolimodem, natalizumabem a alemtuzumabem.
Key words: multiple sclerosis – quality of life – health-related quality of life – disease modifying drugs.
Summary:
Multiple sclerosis (MS) is a chronic inflammatory disease of the central nervous system, representing the most common cause of disability in young people. Beside the deficits concerning sensitivity, motor skills, stability, and other measurable objective signs, fatigue, depression, social handicap, and other symptoms, which greatly affect the quality of life, form the clinical picture of MS. Disease-modifying drugs reduce the number of relapses, clinical progression, but also improve the quality of life, quantified in many clinical studies now. The article gives an overview of studies evaluating the quality of life in patients with multiple sclerosis treated with interferon beta, glatiramer acetate, teriflunomide, dimethyl fumarate, fingolimode, natalizumab, and alemtuzumab.
Úvod
Roztroušená skleróza (RS) je chronické zánětlivé, imunitně zprostředkované onemocnění centrálního nervového systému s účastí neurodegenerace. Postihuje převážně lidi v mladším věku, více ženy. Incidence se pohybuje v Evropě kolem 4,3 případu na 100 000 obyvatel [1,2]. Onemocnění probíhá v podobě nepředvídatelných epizod – relapsů, k nimž dochází v důsledku demyelinizačních lézí a poškození axonů převážně v bílé hmotě mozku a míchy, jež jsou patrné na magnetické rezonanci (MR) [3]. Nejčastějšími příznaky RS jsou poruchy zraku, poruchy čití, motorické příznaky a poruchy koordinace. Onemocnění vede k různému stupni invalidity, k depresi, k sociální izolaci a ke snížení kvality života (quality of life, QoL) [4].
Léčba RS spočívá v ovlivnění relapsů vysokými dávkami intravenózních kortikosteroidů a v dlouhodobém podávání léků ovlivňujících průběh onemocnění (disease modifying drugs, DMD). Cílem léčby je snížení počtu relapsů hodnocených pomocí parametru ARR (annualised relaps rate, roční výskyt relapsů) a zpomalení progrese onemocnění zhodnocením pomocí EDSS (Expanded Disability Status Scale) nebo MSFC (Multiple Sclerosis Functional Composite score) – stupnic kvantifikujících zdravotní postižení u pacientů s RS. V současné době jsou v dlouhodobé léčbě používány injekční přípravky – interferon beta (IFNβ‑1a a IFNβ‑1b) a glatiramer acetát (GA), perorální přípravky (teriflunomid, dimethyl fumarát, fingolimod) a monoklonální protilátky (natalizumab, alemtuzumab). Symptomatická léčba využívá farmakologické i nefarmakologické postupy, např. rehabilitaci a psychosociální podporu [5,6]. Někteří pacienti se obracejí ke komplementární a alternativní léčbě ve víře, že zvrátí průběh choroby [7].
Péče o pacienta je založena na mezioborové spolupráci. Tým tvoří lékař, specializovaná zdravotní sestra, fyzioterapeut, psychoterapeut, logoped, sociální pracovník a další odborníci, zapojeni jsou i členové rodiny. Sledování se zdravím související QoL (Health‑Related Quality of Life – HR‑QoL) jako součást monitorace léčby usnadňuje vedení léčby, adherenci k ní a snižuje výskyt komplikací souvisejících s nežádoucími účinky léčby [8]. Kvalita života související se zdravím je mnohorozměrný koncept zahrnující sebeposuzování fyzických, psychických, emocionálních a sociálních faktorů. Jeho stanovení může predikovat progresi EDSS [9,10], ale i objem a počet lézí a atrofii na MR mozku [11]. Měření a vyhodnocení HR‑QoL se stalo součástí řady klinických studií.
Škály hodnotící QoL mohou být u pacientů s RS univerzální, nebo orientované na konkrétní onemocnění, mohou být zaměřené na subjektivní či objektivní ukazatele nebo kombinované. Mezi subjektivní parametry patří vnímání příznaků, úroveň fyzické zdatnosti, samostatnosti a nezávislosti na jiných, spokojenost s rodinným životem, prací a s ekonomickou situací, se sociálními a životními podmínkami. Objektivní ukazatele hodnotí vedle toho klinický obraz, sociální situaci a frekvenci a kvalitu sociálních kontaktů. Sociální zapojení je silně asociováno s fyzickou komponentou HR‑QoL, což podporuje možnosti intervence v této oblasti [12].
Mezi nejspolehlivější dotazníky používané při zjišťování QoL, které byly validovány i pro použití u pacientů s RS, patří Medical Outcome Study 36‑Item Short Form Health Survey (SF‑36), European Quality of Life 5‑Dimensions Questionnaire (EQ‑5D), Sickness Impact Profile (SIP), Life Satisfaction Questionnaire (LSQ), WHOQOL BREF a Quality of Well‑Being Scale (QWBS) [13]. Ke specifickým dotazníkům často používaným u RS patří Multiple Sclerosis Quality of Life Instrument (MSQoL‑54), který je modifikací dotazníku SF‑36 doplněného 18 otázkami specifickými pro RS [14]. Dalším využívaným nástrojem je Functional Assessment of Multiple Sclerosis (FAMS) se zaměřením zejména na testování deprese a kognitivních poruch [15].
Jedním z nejčastějších symptomů ovlivňujících QoL je únava. U dvou třetin pacientů s RS je únava, kterou nelze objektivně kvantifikovat, jedním z dominujících příznaků onemocnění [16]. Mezi nejčastěji používané škály patří the Fatigue Severity Scale (FSS) a Modified Fatigue Impact Scale (MFIS) [17]. Deprese se vyskytuje u pacientů s RS v 50 % [18]. Mezi používané dotazníky zabývající se mírou deprese patří Beck Depression Inventory (BDI), Hamilton Depression Rating Scale (HDRS), Hospital Anxiety and Depression Scale (HADS) a Zung Scale a Montgomery-Ăsberg Depression Rating Scale (MADRS) [19–21]. Kognitivní deficit se často objevuje v časných stadiích RS, jeho incidence je udávána mezi 25 % a 59,7 %. V prvních letech po stanovení diagnózy RS nebývají tyto deficity patrné, při klinických kontrolách jsou často podceňovány. V průběhu několika let po začátku RS však může kognitivní dysfunkce negativně ovlivňovat denní aktivity pacienta, jeho zaměstnání a sociální funkce. Včasné rozpoznání toho, že došlo ke zhoršení kognitivních funkcí pacienta s RS, je důležité nejen pro zahájení vhodné léčby, ale slouží také k hodnocení progrese RS a k monitorování léčby. Byla např. validována česká verze baterie BICAMS, neuropsychologických testů zaměřených na vyšetřování kognitivních funkcí [22].
Interferon beta
Jedna z prvních studií srovnávala QoL u pacientů s RS, jimž byl podáván IFNβ‑1b subkutánně (s.c.) obden, s neléčenou skupinou nemocných. U léčených pacientů s hodnotou EDSS < 3,0 byla prokázána QoL výrazně lepší zejména ve čtyřech z osmi parametrů SF‑36: ve funkcích tělesných (+22 %, p = 0,0102), fyzických (+100 %, p = 0,0022), obecně zdravotních (+27 %, p = 0,0070) a sociálních (+19 %, p = 0,0287). Průměrný rozdíl QoL ve skupině s hodnotou EDSS 3,0–6,0 činil 8 % a ve skupině s hodnotou EDSS > 6,0 dosahoval 10 % [23].
Dvanáctiměsíční následná fáze (follow‑up) studie zahrnovala 27 pacientů, kteří si aplikovali IFNβ‑1a jednou týdně intramuskulárně (i.m.). Disabilita, QoL, nezávislost, kognice, deprese, úzkost a únava byly hodnoceny na počátku studie a po 6 a po 12 měsících jejího trvání. Kvalita života se během této doby nezměnila. Progrese disability korelovala s QoL, výskyt nežádoucích účinků léčby QoL neovlivnil [24].
V další studii byla hodnocena QoL u 77 pacientů bez léčby ve srovnání se 41 nemocnými léčenými IFNβ. Byl použit dotazník MSQoL‑54 a mnohorozměrový hierarchický lineární model pro opakovaná měření. Interferon β neovlivňoval QoL v době zařazení do studie, ale pokud byla hodnocena QoL po dvou letech léčby, byla negativně ovlivněna její mentální složka. Deprese a únava negativně ovlivnily komponentu fyzickou (Physical Component, PCS) i psychickou (Mental Component, MCS) QoL, a to jak na začátku, tak i po dvou letech. Míra postižení hodnocená pomocí EDSS korelovala s horší fyzickou komponentou QoL pouze na začátku léčby [25].
Předmětem globální longitudinální studie CogniMS bylo sledování kognitivních funkcí, únavy, depresí a HR‑QoL u pacientů v časných fázích onemocnění RS, kteří byli léčeni IFNβ. Studie se zúčastnilo 1 243 pacientů ze 33 států. Hodnocení bylo prováděno každých šest měsíců po dobu dvou let. Kognitivní funkce byly vyšetřovány pomocí Pace Auditory Serial Addition Task (PASAT) a Faces Symbol Test (FST), únavnost prostřednictvím škály FSS, deprese pomocí škály Center of Epidemiologic Studies Depression Scale (CES‑D) a HR‑QoL byla zkoumána pomocí EQ‑5D. Průměrné skóre PASAT bylo 55,0 (změna mediánu z výchozí hodnoty 3,0). Medián FSS byl 2,3 (změna mediánu z výchozí hodnoty –0,3). Průměrné skóre FSS bylo 3,70 (změna mediánu z výchozí hodnoty 0). Při poslední návštěvě pociťovalo 44 % pacientů únavu. Průměrné skóre CES‑D bylo 10,0 (změna z výchozí hodnoty 0). Depresí trpělo 34 % pacientů. Medián EQ‑5D vizuální analogové škály byl 80,0 (změna z výchozí hodnoty 0). Medián skóre EQ‑5D byl 0,80 (změna z výchozí hodnoty 0). Kognitivní testy korelovaly s věkem a vzděláním pacientů a s hodnotami CES‑D a EQ‑5D. Tato studie umožnila nový pohled na změnu kognitivních funkcí u časné RS. Fyzické postižení se během dvou let neměnilo. Prevalence depresí a únavy a snížení QoL byla výrazná v době zahájení studie, ale nezvyšovala se během dvou let při léčbě. Kognitivní funkce korelovaly s depresemi a s parametry hodnotícími kvalitu života [26].
COGIMUS byla observační tříletá studie posuzující ovlivnění QoL depresí, změnami kognitivních funkcí a únavou u 459 pacientů s relabující‑remitující RS léčených IFNβ‑1a s.c. (168 subjektů si aplikovalo 44 µg, 163 pacientů 22 µg). Výsledky MSQoL se nelišily u obou skupin podle léčebné dávky a vstupní úrovně kognitivních funkcí. Průměrná hodnota skóre HDRS se při podání dávky 44 µg snížila ze 6,8 při zahájení studie na 5,8 ve třetím roce sledování. Průměrné celkové skóre Fatigue Impact Scale bylo nízké (< 30) během celé studie [27].
Prospektivní observační dvouletá kohortová studie vyhodnocovala dopad různých pacientských podpůrných programů včetně strategie zvládání s dopadem na QoL a depresi u pacientů s relabující‑remitující RS. K měření QoL byl použit dotazník FAMS. Depresivní symptomatologie byla hodnocena pomocí CES‑D, strategie zvládání využívala verzi dotazníku Ways of Coping Questionnaire s 66 položkami. V rámci podskupiny vyplňující dotazníky zaměřené na QoL (n = 472) a deprese (n = 363) byla QoL zvýšena (110,4 vs. 115,8, p < 0,001) a podíl pacientů s depresí se snížil z 53,7 % na 43,3 % (p < 0,001). Použití autoinjektoru Betaject® v průběhu času ukázalo pozitivní asociaci s QoL (p = 0,049). Podpora ze strany zdravotní sestry pozitivně korelovala s nižším výskytem depresivních symptomů (p = 0,039). Zvládání strategií „plánovaného řešení problémů“ a „pozitivního přehodnocení“ bylo spojeno s vyšší QoL a se snížením výskytu depresivních příznaků [28].
Celkem 304 pacientů dokončilo dvouletou studii hodnotící MSQoL‑54. Dohromady 152 nemocných bylo léčeno IFNβ‑1a i.m. v dávce 1× týdně, 152 pacientů dostávalo IFNβ‑1a 44 µg s.c. 3× týdně a 90 hodnocených nebylo léčeno vůbec. Po dvou letech došlo k signifikantnímu zlepšení ve fyzickém skóre (Δ = +3,1 v první skupině, Δ = +3 ve druhé skupině, p < 0,05), v mentálním skóre (Δ = +4,7 v první skupině, Δ = +5,5 ve druhé skupině, p < 0,001), u neléčené skupiny došlo k mírnému poklesu v sedmi oblastech [29].
Observační studie fáze IV sledovala změny EDSS, ARR, MSQoL (fyzické i mentální skóre) u pacientů s relabující‑remitující RS léčených IFNβ‑1a v dávce 44 µg nebo 22 µg podávané 3× týdně s.c. Výskyt jednoho nebo více relapsů významně souvisel s nižším MSQoL‑54. Změny EDSS byly významně spojeny s MSQOL‑54, nikoliv ale s jeho MCS [30].
Glatiramer acetát
Do multicentrické observační studie FOCUS, jejímž cílem bylo zhodnotit změny HR‑QoL (Leeds Multiple Sclerosis‑QoL, LMS‑QoL), únavy (Fatigue Impact Scale, FIS) a deprese (Beck Depression Inventory‑Short Form, BDI‑SF) po 6 a 12 měsících léčby GA, bylo zařazeno 197 pacientů s relabující‑remitující RS, z nichž 106 nebylo dříve léčeno. Během sledovaného období se významně zvýšilo průměrné skóre LMS‑QoL. Již v prvním měsíci došlo ke zlepšení HR‑QoL u 43 % pacientů dosud neléčených (nárůst skóre LMS-QoL o 3 nebo více bodů; p < 0,001). Podobně i průměrné skóre FIS bylo sníženo v 6. a 12. měsíci v dosud neléčené skupině (p < 0,01), nikoli u předem léčených pacientů. Ani u jedné skupiny se nezměnilo skóre BDI‑SF. Změny HR‑QoL nebyly patrné u pacientů, kteří ukončili léčbu GA před 12. měsícem léčby (28,4 % pacientů) [31].
Extenze této studie měla za cíl zjistit, zda zlepšení HR‑QoL pozorované v předchozím hodnocení dále přetrvává a zda lze toto zlepšení předvídat v prvních šesti nebo dvanácti měsících. Tato studie byla prospektivní a zahrnovala 67 pacientů (38 dosud neléčených a 29 již s předchozí léčbou) z holandské kohorty. Únava, skóre HR‑QoL, deprese a zdravotní postižení byly měřeny pomocí FIS, LMS‑QoL a BDI‑SF. Dvouleté období léčby GA bylo spojeno se změnami v odchylce průměrných skóre FIS a LMSQoL ve srovnání s výchozími hodnotami (–0,52 a +0,66), zatímco invalidita a nálada zůstaly nezměněny. V případě hodnot zjištěných pomocí dotazníků FIS a LMSQoL byly Pearsonovy korelační koeficienty mezi 6měsíčními změnami a 2letým skóre 0,47 a 0,50, mezi 12měsíčními změnami a 2letým skóre 0,65 a 0,62. Po dvou letech léčby GA bylo zřejmé, že zmírnění únavy a zlepšení HR‑QoL pozorované během prvního roku je trvalé, zatímco invalidita a nálada zůstávají beze změny ve srovnání s výchozím stavem. Kromě toho, míra únavy a skóre HR‑QoL hodnocené po dvou letech léčby GA byly podle předpokladu zlepšené po šesti měsících léčby [32].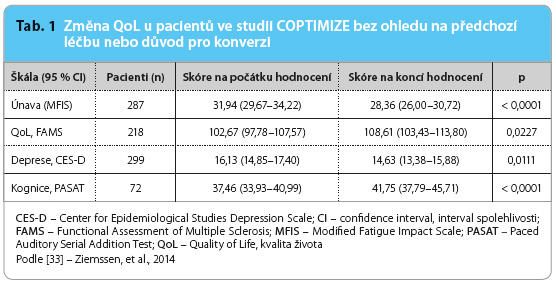
Observační studie COPTIMIZE, trvající 24 měsíců, byla navržena tak, aby zhodnotila průběh onemocnění u pacientů, kteří přešli na léčbu GA z léčby jinými přípravky. Během studie bylo 72,7 % pacientů bez relapsů. Průměrný ARR se snížil z 0,86 (95% interval spolehlivosti [CI]: 0,81–0,91) na 0,32 (95% CI: 0,26–0,40; ![Graf 1a–e Změny EDSS, skóre únavy, kvality života, deprese a kognitivních funkcí ve studii COPTIMIZE; podle [33] – Ziemssen, et al., 2014. a Změna skóre Expanded Disability Status Scale (EDSS). b Změna skóre únavy (Modified Fatigue Impact Scale. c Změna skóre kvality života ( Functional Assessment of Multiple Sclerosis). d Změna skóre deprese (Center for Epidemiological Studies Depression Scale). e Změna skóre kognitivních funkcí (Paced Auditory Serial Addition Test).](https://www.remedia.cz/photo-a-30794---.jpg) p < 0,0001) při ukončení studie. Sekundárními cíli studie bylo hodnocení disability, skóre mobility, únavy, deprese a kognitivních poruch. Podíl pacientů bez prokázané progrese (343/399 pacientů – 86,0 %) byl signifikantně vyšší než podíl pacientů s progresí (56/399 pacientů – 14,0 %; p < 0,0001, binominální test s H0 proportion = 50 %), graf 1a. Většina pacientů (n = 348; 64,2 %) nevykazovala známky progrese disability, rozdíl mezi oběma skupinami nebyl signifikantní (NS) podle binominálního testu H0 proportion = 50 % (p = NS). Průměrné skóre MFIS signifikantně pokleslo s rozdílem −3,59 ± 15,05 bodu z počátku sledování (p < 0,0001), tab. 1. Snížení únavy bylo výraznější u pacientů, kteří změnili léčbu pro pokles účinnosti, než u těch, kteří měli při předchozí léčbě nežádoucí účinky (−2,16 bodu; p = NS), graf 1b. Signifikantní zlepšení vykazovalo skóre QoL (z 5,94 ± 31,57; p = 0,0227), tab. 1. K výraznějšímu zlepšení došlo u pacientů, kteří ukončili předchozí léčbu pro její nežádoucí účinky (+10,81 bodu; p = 0,0120), než u těch, kteří změnili léčbu pro pokles účinnosti (+6,62 bodu; p = NS), graf 1c. Skóre deprese se signifikantně zlepšilo po přechodu na novou léčbu (−1,50 ± 10,84), tab. 1. Znatelnější zlepšení bylo u pacientů se selháním předchozí léčby (−4,48 bodu; p < 0,0001), graf 1d. U pacientů s vyhodnocením skóre PASAT došlo ke zlepšení skóre průměrně o 4,29 ± 9,28 bodu (p < 0,0001), tab. 1. Ke zlepšení došlo jak u pacientů, kteří předchozí léčbu ukončili pro nežádoucí účinky (+3,26 bodu; p = 0,0088), tak u nemo
p < 0,0001) při ukončení studie. Sekundárními cíli studie bylo hodnocení disability, skóre mobility, únavy, deprese a kognitivních poruch. Podíl pacientů bez prokázané progrese (343/399 pacientů – 86,0 %) byl signifikantně vyšší než podíl pacientů s progresí (56/399 pacientů – 14,0 %; p < 0,0001, binominální test s H0 proportion = 50 %), graf 1a. Většina pacientů (n = 348; 64,2 %) nevykazovala známky progrese disability, rozdíl mezi oběma skupinami nebyl signifikantní (NS) podle binominálního testu H0 proportion = 50 % (p = NS). Průměrné skóre MFIS signifikantně pokleslo s rozdílem −3,59 ± 15,05 bodu z počátku sledování (p < 0,0001), tab. 1. Snížení únavy bylo výraznější u pacientů, kteří změnili léčbu pro pokles účinnosti, než u těch, kteří měli při předchozí léčbě nežádoucí účinky (−2,16 bodu; p = NS), graf 1b. Signifikantní zlepšení vykazovalo skóre QoL (z 5,94 ± 31,57; p = 0,0227), tab. 1. K výraznějšímu zlepšení došlo u pacientů, kteří ukončili předchozí léčbu pro její nežádoucí účinky (+10,81 bodu; p = 0,0120), než u těch, kteří změnili léčbu pro pokles účinnosti (+6,62 bodu; p = NS), graf 1c. Skóre deprese se signifikantně zlepšilo po přechodu na novou léčbu (−1,50 ± 10,84), tab. 1. Znatelnější zlepšení bylo u pacientů se selháním předchozí léčby (−4,48 bodu; p < 0,0001), graf 1d. U pacientů s vyhodnocením skóre PASAT došlo ke zlepšení skóre průměrně o 4,29 ± 9,28 bodu (p < 0,0001), tab. 1. Ke zlepšení došlo jak u pacientů, kteří předchozí léčbu ukončili pro nežádoucí účinky (+3,26 bodu; p = 0,0088), tak u nemo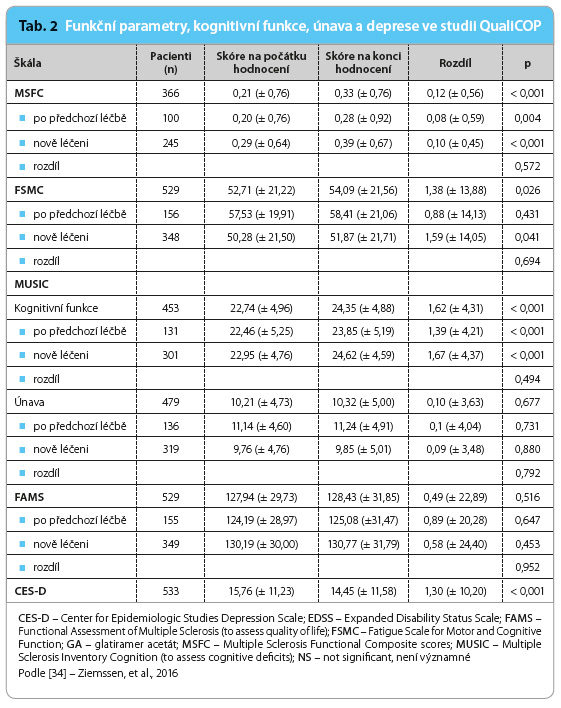 cných, kteří předchozí léčbu ukončili pro její neúčinnost (+4,33 bodu; p = NS), graf 1e [33].
cných, kteří předchozí léčbu ukončili pro její neúčinnost (+4,33 bodu; p = NS), graf 1e [33].
QualiCOP byla observační, neintervenční otevřená studie sledující ARR, progresi onemocnění, QoL, únavu, kognitivní funkce a depresi během dvou let. Do studie bylo zařazeno 754 osob, 481 jich bylo léčeno GA v dávce 20 mg/ml podávaným nově, nebo přecházelo z jiné léčby, nejčastěji z podávání IFNβ. Terapie GA byla spojena s nižším ARR u již dříve léčených (0,98–0,54 relapsu), u pacientů s nově zahájenou léčbou (0,81–0,48 relapsu). Hodnocení MSFC vykazovalo zlepšení u obou kohort (p < 0,01), skóre PASAT a Multiple Sclerosis Inventory Cognition Scale Scores (MSICSS) bylo u obou kohort výrazně zlepšeno (p < 0,001). Celkové skóre Depression Scale vykazovalo signifikantní snížení hodnocení deprese v obou případech (p < 0,001). Stupeň postižení, únava a QoL byly stabilní po celou dobu studie. Funkční parametry, kognitivní funkce, únava a deprese ve studii QualiCOP jsou shrnuty v tab. 2 [34].
Teriflunomid
Post hoc analýza studií fáze III TEMSO a TOWER, které demonstrovaly snížení četnosti a závažnosti relapsů, EDSS a známky aktivity onemocnění na MR při léčbě teriflunomidem proti placebu, ukázala, že HR‑QoL a únava byly ve sloučených kohortách nepříznivě ovlivněny relapsy, což platilo výrazněji u závažných relapsů [35].
Dimethyl fumarát
Integrovanou analýzou studie fáze III DEFINE a CONFIRM autoři zjišťovali vliv dimethyl fumarátu (DMF) na HRQoL. Celkem 2 301 pacientů s relabující‑remitující RS bylo náhodně rozděleno k podávání DMF 240 mg 2× denně nebo 3× denně nebo k podávání placeba po dobu až 96 týdnů. Byla hodnocena HR‑QoL v obou složkách (skóre PCS i MCS), SF‑36, vizuální analogová škála (Visual Analogue Scale, VAS) a EQ‑5D. Průměrné skóre PCS a MCS bylo zpočátku nižší ve srovnání s běžnou populací a o 5 bodů a více nižší u pacientů, kteří měli hodnotu EDSS ≥ 2,5, než u těch, kteří vstupovali do studie s hodnotou EDSS = 0. Rozdíly ve skóre PCS a MCS byly významné ve srovnání s placebem. Podíl pacientů, kteří užívali DMF a vykazovali zlepšení o 5 bodů a více ve skóre SF-36, byl ve srovnání s placebem významně vyšší. Bylo zjištěno, že tyto faktory se jevily jako prediktivní ukazatele zlepšení skóre PCS a MCS po dvou letech u pacientů užívajících DMF s nižší počáteční hodnotou skóre EDSS ve věku 40 let a méně (pouze PCS) a s nižším počátečním skóre PCS nebo MCS. Změny oproti výchozímu stavu při hodnocení VAS byly ve skóre EuroQol‑5D v souladu se změnami ve skóre SF‑36 [36].![Graf 2 Průměrné změny kvality života související se zdravím při podávání fingolimodu hodnocené pomocí Hamburg Quality of Life Questionnaire in Multiple Sclerosis (HAQUAMS); podle [39] – Montalban, et al., 2011. Data jsou prezentována jako ± směrodatná odchylka, * tato skupina přešla na léčbu fingolimodem podávaným v dávce 1,25 mg nebo 5,0 mg ke konci šestého měsíce.](https://www.remedia.cz/photo-a-30796---.jpg)
Studie vycházející rovněž z dat studie DEFINE potvrdila u 1 237 osob, že HR‑QoL se zvyšovala u pacientů s vyšším stupněm EDSS a ARR. Průměrné hodnoty skóre SF‑36 narůstaly během dvou let, ale klesaly ve srovnání s placebem. Změny skóre SF‑36, zejména PCS, během dvouletého období jednoznačně upřednostnily DMF proti placebu (obě dávkování, p < 0,001) [37]. Podobné výsledky byly nalezeny i v analýze HR‑QoL studie CONFIRM [38].
Fingolimod
Hamburský dotazník kvality života (The Hamburg Quality of Life Questionnaire in Multiple Sclerosis, HAQUAMS) a skóre BDI‑II byly vyhodnoceny v průběhu šestiměsíční studie kontrolované placebem u pacientů s relabující‑remitující RS. Výsledky HAQUAMS zaznamenaly zlepšení po zahájení léčby fingolimodem, a naopak zhoršení ve skupině s placebem. Průměrná změna mezi výchozí hodnotou a hodnotou v šestém měsíci studie byla u fingolimodu podávaného v dávce 1,25 mg (p < 0,05 proti placebu) –0,01, u fingolimodu v dávce 5,0 mg proti placebu +0,12. Fingolimod podávaný v dávce 1,25 mg byl též přínosný oproti placebu ve zmírnění únavy a ve zlepšení myšlení v poddoméně HAQUAMS (p < 0,05 vs. placebo). Změna průměrného skóre BDI‑II od výchozího stavu do šestého měsíce a podíl pacientů se skóre, které by svědčilo pro depresi, byly výraznější při podávání fingolimodu 1,25 mg (v obou případech p < 0,05) [39].
Studie EPOC (The Evaluate Patient OutComes) hodnotila lékařem a pacientem udávané parametry QoL u nemocných, kteří přešli z léčby injekčními DMD (iDMD) na léčbu fingolimodem, ve srovnání s těmi, kteří zůstali u původní léčby. Do studie bylo zahrnuto 1 053 pacientů, kteří byli randomizováni v poměru 3 : 1 k léčbě fingolimodem a k léčbě iDMD. Primárním cílovým ukazatelem byla změna Treatment Satisfaction Questionnaire for Medication (TSQM) – celkového skóre spokojenosti. Sekundárními cílovými ukazateli byly změny skóre TSQM v oblasti účinnosti, pohodlí a nežádoucích účinků léčby, dále pak změny BDI‑II, FSS, aktivit Patient‑Reported Outcome Indices for Multiple Sclerosis (PRIMUS), SF‑36, MCS a PCS a průměrné, vyšetřujícím udávané skóre Clinical Global Impressions of Improvement (CGI‑I) na počátku studie a po šesti měsících. Změny celkového skóre spokojenosti TSQM byly příznivější při přechodu na léčbu fingolimodem ze všech dříve podávaných iDMD (p < 0,001). Podobně všechny podškály TSQM byly zlepšeny po přechodu na podávání fingolimodu (p < 0,001), s výjimkou hodnocení nežádoucích účinků při přechodu z léčby GA, kdy rozdíl nebyl signifikantní (p = 0,111). Skóre FSS bylo horší u pacientů léčených IFNβ‑1a s.c. a IFNβ‑1b ve srovnání s léčenými fingolimodem. Skóre BDI‑II bylo lepší u léčených fingolimodem kromě pacientů léčených IFNβ‑1a i.m. Skóre SF‑36 bylo rovněž příznivější u léčených fingolimodem ve srovnání s pacienty léčenými IFNβ‑1b (MCS a PCS; p = 0,030, resp. p = 0,022) a IFNβ‑1a s.c. (pouze PCS, p = 0,024). Průměrné skóre CGI‑I bylo lepší při léčbě fingolimodem ve srovnání s léčbou iDMD (u všech p < 0,001) [40].
Natalizumab
Studie AFFIRM, která hodnotila klinický účinek a bezpečnost léčby natalizumabem proti placebu, se účastnilo 1 113 pacientů s relabující‑remitující RS, ve studii SENTINEL dostávalo 589 pacientů buď natalizumab 300 mg či INFβ‑1a, nebo INFβ‑1b či placebo (n = 315). Skóre na škálách SF‑36 a VAS byla posuzována při zahájení studie a pak ve 14., 52. a 104. týdnu. Předmětem hodnocení byly změny ve výsledcích dotazníku SF‑36 (PCS i MCS) a VAS mezi počátkem studie a jejím 104. týdnem. Počáteční průměrné hodnoty skóre SF‑36 byly signifikantně nižší oproti běžné populaci a korelovaly se skóre EDSS, s celkovou progresí disability, s počtem relapsů a s objemem lézí zaznamenaných na MR mozku. Zlepšení PCS bylo signifikantně patrné již ve 24. týdnu a po celé další období. U pacientů léčených natalizumabem byla významně větší pravděpodobnost výskytu zlepšení PCS při hodnocení pomocí dotazníku SF‑36 i v obou studiích; hodnocení pomocí VAS vykazovalo též zlepšení MR‑QoL ve skupině léčených natalizumabem [41].
Ve studii AFFIRM byla též testována binokulární zraková ostrost (low contrast visual acuity, LCVA) jako ukazatel kvality zrakových funkcí. V těchto post hoc analýzách byl studován vztah zrakových funkcí ke skóre QoL, MR a EDSS. Zpočátku a pak v 52. a ve 104. týdnu byli pacienti testováni pomocí LCVA (1,25% a 2,5% kontrast) a vysokým kontrastem zrakové ostrosti (high contrast visual acuity, HCVA). Zrakově specifická QoL byla hodnocena pomocí Impact of Visual Impairment Scale (IVIS). Vztah mezi QoL a skóre IVIS koreloval s vizuální dysfunkcí ve všech fázích studie (r = –0,25 až –0,45, p < 0,0001 pro LCVA a HCVA). Větší objem T1 a T2 lézí při zobrazení MR rovněž koreloval se zhoršením zrakové ostrosti (p < 0,0001). Progrese LCVA byla zaznamenána u významného počtu pacientů, a to i u těch, u kterých nedošlo k nárůstu EDSS během dvou let (21,9 % progresí LCVA při 2,5% kontrastu; 26,2 % progresí LCVA při 1,25% kontrastu). Skóre HCVA bylo zhoršeno pouze u 3,7 % pacientů bez progrese EDSS. Horšení zrakových funkcí, které je patrné u více než 20 % pacientů s RS, vysoce koreluje s QoL [42].
Alemtuzumab
Ve dvouleté studii fáze III CARE‑MS II sledující pacienty s relabující‑remitující RS s nedostatečnou odpovědí na dosavadní léčbu prokázal alemtuzumab v dávce 12 mg vyšší účinnost a zlepšení QoL proti subkutánně podávanému IFNβ‑1a ve fyzických, mentálních i emociálních aspektech. Hodnota QoL byla sledována ve třetím roce extenze dvouleté studie. Z původně 435 alemtuzumabem léčených subjektů jich 396 pokračovalo v léčbě, 80 z nich bylo přeléčeno další léčebnou dávkou během třetího roku. Průměrná hodnota měřená škálou Functional Assessment of Multiple Sclerosis (rozmezí 1–176) se zlepšila z výchozího stavu (119,1 vs. 124,8; p < 0,0001) v pěti z šesti posuzovaných podškál. Fyzické a mentální celkové skóre dotazníku Mean Short‑Form 36‑Item survey (rozmezí 0–100) vzrostlo z výchozího stavu ve třetím roce (42,7 vs. 44,7; p < 0,0001, respektive 44,9 vs. 46,5; p = 0,042) se zlepšením v šesti z osmi posuzovaných podškál. U 82 %, resp. 73 % pacientů došlo ke stabilnímu zlepšení během třetího roku. Významně příznivější bylo i vizuální analogové skóre EuroQol (70,1 vs. 73,0; p = 0,0045) [43].
Závěr
Hodnocení kvality života se stává nedílnou součástí klinických studií, protože lépe odráží situaci pacienta s roztroušenou sklerózou v běžném životě. Nové přípravky zaváděné do klinické praxe ukázaly významné ovlivnění kvality života, snížení únavy a deprese a zpomalení kognitivních poruch. Pacienti čerpají méně prostředků ze sociálního pojištění díky snížené nemocnosti, odcházejí mnohem později do invalidního důchodu. Neztrácejí sociální kontakty, mohou se věnovat svým zálibám. Dosažení stavu NEDA (no evidence of disease activity), tedy situace, kdy nejsou patrné relapsy onemocnění, nedochází k progresi EDSS a není zaznamenávána aktivita na magnetické rezonanci, významně ovlivňuje kvalitu života a mělo by být předmětem dalších klinických studií.
Seznam použité literatury
- [1] Pugliatti M, Rosati G, Carton H, et al. The epidemiology of multiple sclerosis in Europe. Eur J Neurol 2006; 13: 700–722.
- [2] Koutsouraki E, Costa V, Baloyannis S. Epidemiology of multiple sclerosis in Europe: a review. Int Rev Psychiatry 2010; 22: 2–13.
- [3] Compston A, Coles A. Multiple sclerosis. Lancet 2008; 372: 1502–1517.
- [4] Motl RW, McAuley E, Snook EM, Gliottoni RC. Physical activity and quality of life in multiple sclerosis: intermediary roles of disability, fatigue, mood, pain, self efficacy and social support. Psychol Health Med 2009; 14: 111–124.
- [5] Ben Zacharia AB. Therapeutics for multiple sclerosis symptoms. Mt Sinai J Med 2011; 78: 176–191.
- [6] Burks JS, Bigley GK, Hill HH. Rehabilitation challenges in multiple sclerosis. Ann Indian Acad Neurol 2009; 12: 296–306.
- [7] Yadav V, Shinto L, Bourdette D. Complementary and alternative medicine for the treatment of multiple sclerosis. Expert Rev Clin Immunol 2010; 6: 381–395.
- [8] Olascoaga J. Quality of life and multiple sclerosis. Rev Neurol 2010; 51: 279–288.
- [9] Benito León J, Mitchell AJ, Rivera Navarro J, Morales González JM. Impaired health related quality of life predicts progression of disability in multiple sclerosis. Eur J Neurol 2013; 20: 79–86.
- [10] Baumstarck K, Pelletier J, Butzkueven H, et al. Health related quality of life as an independent predictor of long term disability for patients with relapsing remitting multiple sclerosis. Eur J Neurol 2013; 20: 907–909.
- [11] Mowry EM, Beheshtian A, Waubant E, et al. Quality of life in multiple sclerosis is associated with lesion burden and brain volume measures. Neurology 2009; 72: 1760–1765.
- [12] Mikula P, Nagyova I, Krokavcova M, et al. Self esteem, social participation, and quality of life in patients with multiple sclerosis. J Health Psychol 2016 Jan 12 doi: 10.1177/1359105315621778.
- [13] Bandari DS, Vollmer TL, Khatri BO, Tyry T. Assessing quality of life in patients with multiple sclerosis. Int J MS Care 2010; 12: 34–41.
- [14] Heiskanen S, Meriläinen P, Pietilä AM. Health related quality of life testing the reliability of the MSQOL 54 instrument among MS patients. Scand J Caring Sci 2007; 21: 199–206.
- [15] Cella DF, Dineen K, Arnason B, et al. Validation of the functional assessment of multiple sclerosis quality of life instruments. Neurology 1996; 47: 129–139.
- [16] Lobentanz IS, Asenbaum S, Vass K, et al. Factors influencing quality of life in multiple sclerosis patients: disability, depressive mood, fatigue and sleep quality. Acta Neurol Scand 2004; 110: 6–13.
- [17] Krupp LB. Fatigue in multiple sclerosis: definition, pathophysiology and treatment. CNS Drugs 2003; 17: 225–234.
- [18] Fiest KM, Walker JR, Bernstein CN, et al. Systematic review and meta analysis of interventions for depression and anxiety in persons with multiple sclerosis. Mult Scler Relat Disord 2016; 5: 12–26.
- [19] Beck AT, Ward CH, Mendelson M, et al. An inventory for measuring depression. Arch Gen Psychiatry 1961; 4: 561–571.
- [20] Hedlund JL, Viewig BW. The Hamilton Rating Scale for Depression: a comprehensive review. J Open Psychiatry 1979; 10: 149–165.
- [21] Zigmond A, Snaith RP. The hospital anxiety and depression scale. Acta Psych Scand 1983; 67: 361–370.
- [22] Brief International Cognitive Assessment for Multiple sclerosis. Langdon DW, Amato MP, Boringa J Recommendations for a Brief International Cognitive Assessment for Multiple Sclerosis (BICAMS). Mult Scler 2012; 18: 891–898.
- [23] Rice GP, Oger J, Duquette P, et al. Treatment with interferon beta 1b improves quality of life in multiple sclerosis. Can J Neurol Sci 1999; 26: 276–282.
- [24] Zivadinov R, Zorzon M. Tommasi MA, et al. A longitudinal study of quality of life and side effects in patients with multiple sclerosis treated with interferon beta 1a. J Neurol Sci 2003; 216: 113–118.
- [25] Simone IL, Ceccarelli A, Tortorella C, et al. Influence of Interferon beta treatment on quality of life in multiple sclerosis patients. Health Qual Life Outcomes 2006; 4: 96.
- [26] Langdon D, Wicklein EM, Scherer P, Fredrikson S. Cognition, fatigue, depression and HR QoL in early multiple sclerosis: results from CogniMS, a multinational longitudinal study. 26th Congress of the European Committee for Treatment and Research in Multiple Sclerosis (ECTRIMS), Gothenburg, Švédsko. Prezentováno 14. 10. 2010.
- [27] Patti F, Amato MP, Trojano M, et al. COGIMUS Study Group. Quality of life, depression and fatigue in mildly disabled patients with relapsing remitting multiple sclerosis receiving subcutaneous interferon beta 1a: 3 year results from the COGIMUS (COGnitive Impairment in MUltiple Sclerosis) study. Mult Scler 2011; 17: 991–1001.
- [28] Pozzilli C, Schweikert B, Ecari U, et al. Quality of life and depression in multiple sclerosis patients: longitudinal results of the BetaPlus study. J Neurol 2012; 259: 2319–2328.
- [29] Patti F, Pappalardo A, Montanari E, et al. Interferon beta 1a treatment has a positive effect on quality of life of relapsing remitting multiple sclerosis: results from a longitudinal study. J Neurol Sci 2014; 337: 180–185.
- [30] Vickrey BG, Lee L, Moore F, Moriarty P. EDSS Change Relates to Physical HRQoL While Relapse Occurrence Relates to Overall HRQoL in Patients with Multiple Sclerosis Receiving Subcutaneous Interferon β 1a. Mult Scler Int 2015; 2015: ID 631989.
- [31] Jongen PJ, Lehnick D, Sanders E, et al. FOCUS study group. Health related quality of life in relapsing remitting multiple sclerosis patients during treatment with glatiramer acetate: a prospective, observational, international, multi centre study. Health Qual Life Outcomes 2010; 8: 133.
- [32] Jongen PJ, Lehnick D, Koeman J, et al. FOCUS Extension Study Group Fatigue and health related quality of life in relapsing remitting multiple sclerosis after 2 years glatiramer acetate treatment are predicted by changes at 6 months: an observational multi center study. J Neurol 2014; 261: 1469–1476.
- [33] Ziemssen T, Bajenaru OA, Carrá A, et al. A 2 year observational study of patients with relapsing remitting multiple sclerosis converting to glatiramer acetate from other disease modifying therapies: the COPTIMIZE trial. J Neurol 2014; 261: 2101–2111.
- [34] Ziemssen T, Calabrese P, Penner IK, Apfel R. QualiCOP: real world effectiveness, tolerability, and quality of life in patients with relapsing remitting multiple sclerosis treated with glatiramer acetate, treatment naïve patients, and previously treated patients. J Neurol 2016; 263: 784–791.
- [35] Mäuer M. Impact of severe relapses on disability, fatigue and health related quality of life outcome: a pooled dataset of the phase 3 TEMSO and TOWER studies. Mult Scler 2013; 19: 74–78.
- [36] Kita M, Fox RJ, Gold R, et al. Effects of delayed release dimethyl fumarate (DMF) on health related quality of life in patients with relapsing remitting multiple sclerosis: an integrated analysis of the phase 3 DEFINE and CONFIRM studies. Clin Ther 2014; 36: 1958–1971.
- [37] Kappos L, Gold R, Arnold DL, et al. Quality of life outcomes with BG 12 (dimethyl fumarate) in patients with relapsing remitting multiple sclerosis: the DEFINE study. Mult Scler 2014; 20: 243–252.
- [38] Kita M, Fox RJ, Phillips JT, et al. Effects of BG 12 (dimethyl fumarate) on health related quality of life in patients with relapsing remitting multiple sclerosis: findings from the CONFIRM study. Mult Scler 2014; 20: 253–257.
- [39] Montalban X, Comi G, O‘Connor P, et al. Oral fingolimod (FTY720) in relapsing multiple sclerosis: impact on health related quality of life in a phase II study. Mult Scler 2011; 17: 1341–1350.
- [40] Calkwood J, Cree B, Crayton H, et al. Impact of a switch to fingolimod versus staying on glatiramer acetate or beta interferons on patient and physician reported outcomes in relapsing multiple sclerosis: post hoc analyses of the EPOC trial. BMC Neurol 2014; 14: 220–231.
- [41] Planas R, Martin R, Sospedra M. Long term safety and efficacy of natalizumab in relapsing remitting multiple sclerosis: impact on quality of life. Patient Relat Outcome Meas 2014; 5: 25–33.
- [42] Chahin S, Balcer LJ, Miller DM, et al. Vision in a phase 3 trial of natalizumab for multiple sclerosis: relation to disability and quality of life. J Neuroophthalmol 2015; 35: 6–11.
- [43] Coles A, Giovannoni G, Moreau T, et al. Alemtuzumab improves 3 year quality of life in CARE MS II. J Neurol Neurosurg Psychiatry 2015; 86: e4 doi:10.1136/jnnp