Léčba chronické hepatitidy B
Cílem léčby je dlouhodobá suprese virémie. Časově omezenou léčbou lze dosáhnout přechodu onemocnění z fáze chronické hepatitidy (imunoclearance) do fáze nízké replikace, sérologickým korelátem je HBeAg sérokonverze. Interferon α si stále zachoval přední místo v léčbě chronické hepatitidy B, několikaměsíční léčbou interferonem α lze dosáhnout HBeAg sérokonverze asi u jedné čtvrtiny pacientů. U HBeAg negativní formy chronické hepatitidy lze interferonem α navodit setrvalou virologickou odpověď asi u 20 % pacientů. Nevýhodou interferonu α je nedobrá tolerance a četné kontraindikace. Pegylované interferony α jsou účinnější než konvenční, jsou lépe tolerovány, předpokládá se jejich použití i pro dlouhodobou léčbu. Adefovir dipivoxil je syntetické antivirotikum, relativně netoxické, léčba je velmi dobře tolerována. Vznik mutací rezistentních na adefovir je řídký, jen 3 % po roční léčbě. Adefovir není lepší než interferon α z pohledu navození HBeAg sérokonverze, ale je účinný i při rezistenci na lamivudin a je lékem volby pro dlouhodobou léčbu. Lamivudin je též netoxickým a velmi dobře tolerovaným lékem. Z hlediska navozování HBeAg sérokonverze je srovnatelný s adefovirem, v dlouhodobé léčbě je nevýhodou strmý nárůst rezistentních mutací během léčby. V léčbě chronické hepatitidy B si své místo udržuje díky relativně nízkým nákladům na léčbu.
Virus hepatitidy B
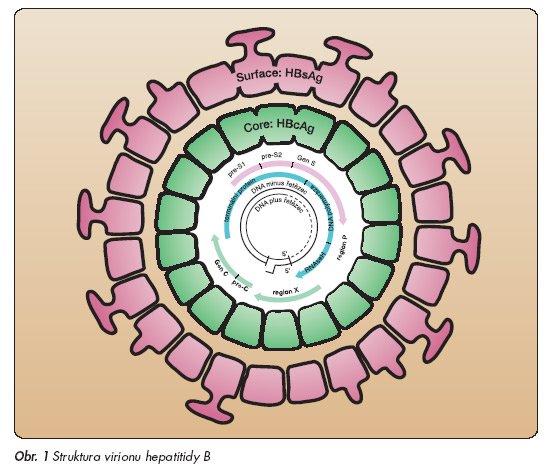
Hepatitis B virus (HBV) patří do čeledi Hepadnaviridae. Virová deoxyribonukleová kyselina (HBV-DNA) tvoří cirkulární parciálně dvojitá DNA, složená z přibližně 3 200 párů bazí (obr. 1).
Ve virovém genomu lze identifikovat 4 zčásti se překrývající otevřené čtecí rámce kódující povrchový (surface) protein (pre-S/S), vnitřní (core) protein (precore/core), polymerázu a X-protein. Pre-S/S otevřený čtecí rámec kóduje 3 varianty povrchového glykoproteinu (HBs antigenu), small (S), middle (M) a large (L). Translací precore/core otevřeného čtecího rámce vzniká precore polypeptid, který se v posttranslační úpravě štěpí na nukleokapsidový, vnitřní protein (HBc antigen) a na sekreční nestrukturální protein (HBe antigen). Replikační cyklus HBV začíná vazbou HBV k hepatocytu. V jádře hepatocytu se dokončí syntéza plus vlákna HBVDNA, čímž je virový genom konvertován v „covalently closed circular" DNA (ccc DNA). cccDNA je templátem pro syntézu pregenomické RNA, která je transkribována do minus vlákna HBVDNA. V jádře obsažená cccDNA pochází ze dvou zdrojů, z virionů vstupujících do buňky a z nově syntetizované HBVDNA v cytoplazmě. V průběhu replikační fáze infekce HBV se v infikovaných hepatocytech syntetizuje a vylučuje velké množství HBs antigenu a HBe antigenu, protilátky anti-HBs a anti-HBe jsou vyvázány v imunokomplexech a nejsou prokazatelné. Prokazatelnými se stávají až při snižování úrovně replikace a poklesu syntézy HBs a HBe antigenů. HBc antigen se do krve nevylučuje ve významném množství, je přítomen na membránách hepatocytů a protilátka anti-HBc je prokazatelná od počátku infekce.
Epidemiologie infekce HBV
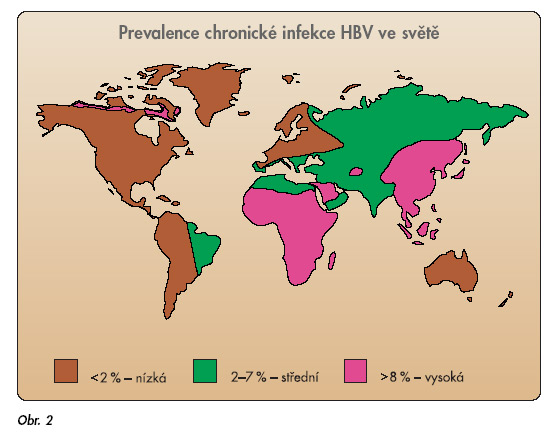
Virem hepatitidy B je celosvětově infikováno asi 350–400 milionů osob. Tři čtvrtiny jich žijí v tzv. endemických oblastech Asie, Jižního Pacifiku, subsaharské Afriky a Středního východu (obr. 2).
V USA je infikováno asi 1,25 milionu osob, v Itálii 900 000, v Japonsku necelé 2 miliony. Prevalence chronické infekce HBV v ČR je podle údajů z roku 2001 0,56 % [1]. Infekce HBV se přenáší parenterální cestou. Přenos je perinatální, transkutánní a sexuální. Kožní afekce a těsný tělesný kontakt jsou příčinou přenosu infekce HBV mezi dětmi v endemických oblastech. HBV si udržuje virulenci po dlouhou dobu i mimo organismus, hepatitis B secretory core antigen (HBeAg) pozitivní jedinci s kožními afekcemi mohou infikovat povrchy v okolním prostředí poměrně velkým množstvím virových partikulí. Riziko přechodu onemocnění do chronicity po akutní expozici klesá od 90 % u novorozenců HBeAg pozitivních matek na 25–30 % u dětí do věku 5 let a na méně než 10 % u dospělých. U dospělých jedinců je vysoké riziko přechodu do chronicity ve skupině imunokompromitovaných.
Přirozený průběh infekce HBV
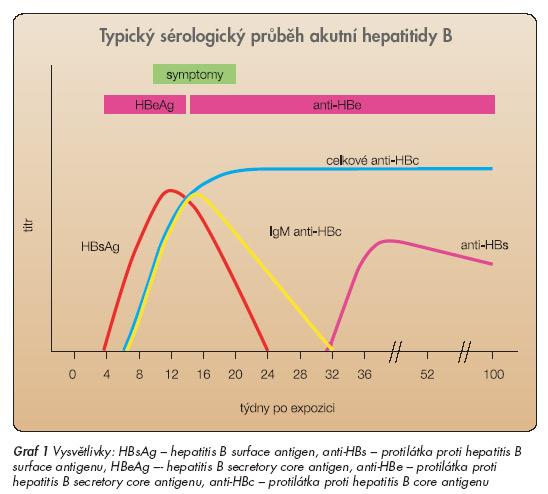
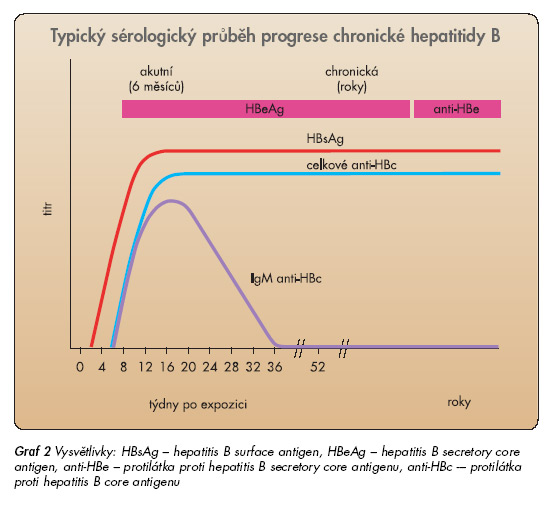
Virus hepatitidy B není cytopatogenní, poškození hepatocytů není přímo způsobeno replikací HBV, ale je zprostředkováno imunitními mechanismy. Hepatitis B surface antigen (HBsAg) a hepatitis B core antigen (HBcAg) na membránách infikovaných hepatocytů spouští imunitní reakci, která končí destrukcí infikovaných hepatocytů. K vyvolání odpovídající imunitní odpovědi a k příznivému průběhu infekce HBV je třeba přítomnosti obou virových antigenů a HLA-I antigenů na membránách infikovaných hepatocytů. Infekce virem hepatitidy B pak proběhne jako infekce akutní bez přechodu do chronicity. Klinickým obrazem destrukce infikovaných hepatocytů je akutní hepatitida B s projevy jaterní dysfunkce (graf 1).
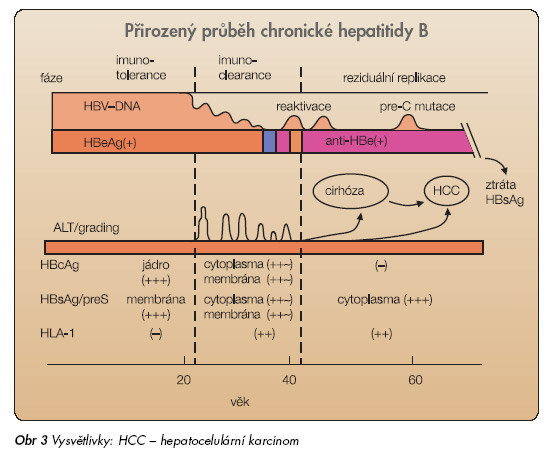
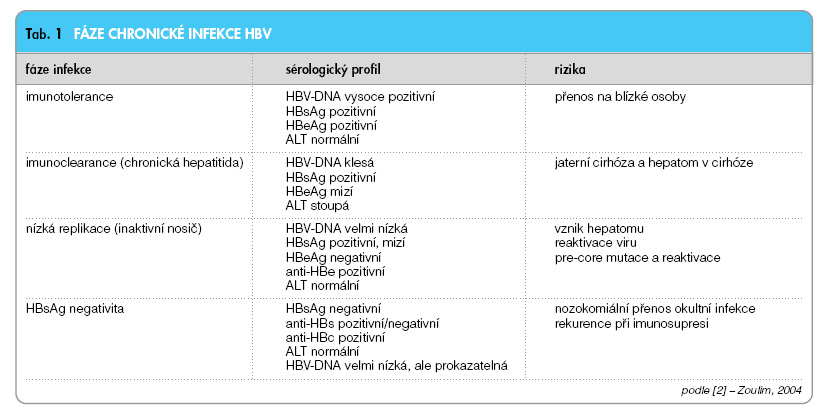
Přechod infekce do chronicity je způsoben imunotolerancí HBV. Imunitní odpověď na HBV chybí nebo je velmi slabá. I při vysoké úrovni replikace HBV není v játrech přítomna zánětlivě nekrotická reakce. Ve fázi imunotolerance nejsou virové antigeny prokazatelné na membránách hepatocytů, ale hlavně v jádře a v cytoplazmě. Fáze imunotolerance trvá i řadu let, žádná dostupná léčba není účinná, neboť není podpořena odpovídající imunitní odpovědí. Vzestup ALT po letech trvání imunotolerance signalizuje přechod do další fáze, tzv. fáze imunoclearance (imunoaktivní fáze, fáze chronické hepatitidy), na membránách hepatocytů se exprimují virové antigeny a HLA-1 antigeny. Morfologickým korelátem je zánětlivá reakce s progredující fibrózou, klinickým korelátem aktivní chronická hepatitida s vývojem směrem k cirhóze a hepatomu. Není-li imunitní odpověď odpovídající k převedení onemocnění do další fáze, tj. fáze nízké replikace, trvá fáze imunoclearance řadu let a končí rozvojem jaterní cirhózy a jejích komplikací. Z klinického pohledu je cílem antivirové léčby infekce HBV časné ukončení fáze imunoclearance a převedení choroby do fáze nízké replikace. Ve fázi nízké replikace opět ustává exprese virových antigenů na membránách, sérologicky dochází k HBeAg sérokonverzi a ALT se normalizuje (obr. 3, graf 2).
Poslední fází příznivého vývoje chronické infekce HBV je fáze HBsAg negativity. Přetrvávání velmi nízké virémie i ve fázi HBsAg negativity se vysvětluje perzistencí virové cccDNA v játrech (tab. 1).
Méně příznivou cestou vývoje chronické hepatitidy B je mutací viru podmíněný přechod do tzv. HBeAg negativní formy chronické hepatitidy B. Bodová mutace v precore/core oblasti virového genomu má za následek syntézu defektního precore proteinu, který je prekurzorem jen HBcAg, HBeAg se dále netvoří. HBeAg negativní forma chronické hepatitidy se vyznačuje vyšší zánětlivou aktivitou a horší odpovědí na léčbu.
Léčba chronické infekce HBV
Cíle a strategie léčby
Rozhodujícím faktorem v indikaci protivirové léčby je úroveň virémie, léčeni mají být pacienti s virémií vyšší než 105 kopií/ ml, u HBeAg negativní formy chronické hepatitidy B se hranice virémie rozhodující pro léčbu posunuje až na 104 kopií/ml. Dalším předpokladem pro zahájení protivirové léčby je zánětlivá aktivita onemocnění nepřímo vyjádřená jako aktivita ALT v séru. U pacientů s normální aktivitou ALT v séru se při rozhodování o indikaci protivirové léčby sleduje progrese fibrózy jater. V současné době lze v léčbě chronické hepatitidy B rozlišit dva základní postupy léčby. V první řadě se jedná o časově omezenou léčbu, jejímž cílem je dosažení HBeAg sérokonverze a dlouhodobé snížení virémie pod 105 kopií/ml, které trvá i po ukončení léčby. Z hlediska vymizení HBeAg či HBeAg sérokonverze po časově omezené léčbě jsou dosud používané léky na chronickou hepatitidu B (tj. interferon α, lamivudin či adefovir) srovnatelné. Léčba interferonem αtrvající 12–24 týdnů vede k vymizení HBeAg u 33 % léčených pacientů a k sérokonverzi HBeAg asi v 18 %, pro léčbu lamivudinem trvající 52 týdnů jsou zmíněné ukazatele účinnosti 32 %, resp. 18 %, a pro léčbu adefovirem trvající 48 týdnů 24 %, resp. 12 %. Na rozdíl od syntetických antivirotik, tj. lamivudinu či adefoviru, lze léčbou interferonem αdosáhnout asi u 7–8 % léčených pacientů i vymizení HBsAg. Účinnost časově omezené léčby je u všech tří zmíněných léků přímo úměrná imunitní odpovědi na virové antigeny, tzn. úspěšnost léčby je přímo úměrná iniciální aktivitě ALT v séru. U HBeAg negativní formy chronické hepatitidy B je cílem časově omezené léčby dlouhodobý pokles virémie pod 104 kopií/ml a normalizace aktivity ALT v séru. V této indikaci je nejúčinnějším lékem interferon α, 6–12měsíční léčba vede k setrvalé odpovědi u 20–25 % léčených, roční léčba lamivudinem či adefovirem vede k setrvalé odpovědi u méně než 10 % léčených pacientů. Interferony α vykazují nejlepší účinnost v časově omezené léčbě HBeAg i anti-HBe pozitivní formy chronické hepatitidy B, jejich použití je ovšem limitováno nežádoucími účinky a nepříliš dobrou tolerancí. Pegylované interferony α jsou lépe tolerovány a jsou i účinnější, jejich zavedení do klinické praxe léčby chronické hepatitidy B se očekává v krátké době. Nepodaří-li se časově omezenou léčbou dosáhnout sérokonverze HBeAg nebo setrvalé virologické odpovědi u HBeAg negativní formy, jsou pacienti s aktivní chronickou hepatitidou či progredující jaterní fibrózou indikováni k dlouhodobé časově neomezené léčbě, jejímž cílem je dlouhodobě suprimovat replikaci HBV a zastavit či zpomalit progresi jaterního onemocnění. Lékem volby pro dlouhodobou léčbu je adefovir, v terapeutických dávkách má minimum nežádoucích účinků, je účinný i při rezistenci na lamivudin. Na adefovir rezistentní mutanty vznikají jen u 3 % léčených pacientů po jednom roce léčby. V praxi je ale dlouhodobá léčba zahajována výrazně levnějším lamivudinem, rezistence na lamivudin se objevuje u necelé poloviny léčených pacientů po dvou letech léčby. Je-li vznik rezistence na lamivudin provázen opětným zvýšením zánětlivé aktivity, je nutno vyměnit lamivudin za adefovir. Alternativou adefoviru může být u pacientů s rezistencí na lamivudin dlouhodobá léčba redukovanou dávkou pegylovaného interferonu α. Pro trvání dlouhodobé léčby chronické hepatitidy B neplatí dosud žádná standardní doporučení, rozhodnutí o ukončení léčby závisí na zhodnocení případu ošetřujícím lékařem. Nepochybně lze léčbu ukončit, dojde-li k vymizení HBsAg, u imunosuprimovaných pacientů je ale nutno počítat s možností závažné rekurence onemocnění i po vymizení HBsAg. Algoritmus rozhodování o vhodném postupu léčby je velmi dobře popsán v Doporučeném postupu léčby vydaném Americkou asociací pro studium chorob jater (AASLD), tab. 2 [3,4].
Sérokonverzi HBsAg, a nikoliv pouhou supresi replikace, považují někteří autoři za konečný cíl léčby chronické hepatitidy B. Dosažení časné HBsAg sérokonverze vlivem současné antivirové léčby je ale naprosto raritním jevem a v praxi je třeba se spokojit s dosažením HBeAg sérkonverze či dlouhodobé suprese virémie. Z dlouhodobého hodnocení výsledků léčby interferonem α vyplynulo, že HBsAg sérokonverze nastává signifikantně častěji u pacientů, kteří byli léčeni, oproti neléčeným. Dosažení HBsAg negativity je u léčených interferonem α asi 6x častější [5]. Z metaanalýzy kontrolovaných klinických studií vyplynulo, že u 71 % pacientů, kteří předchozí léčbou interferonem α dosáhli HBeAg sérokonverze, došlo během sledování (průměr 6,2 roků, rozpětí 1–11 roků) též k vymizení HBsAg [6]. Po roční a ani po delší léčbě lamivudinem k sérokonverzím HBsAg nedochází. Zmíněný rozdíl mezi interferonem α a nukleosidovým analogem je podmíněn rozdílným mechanismem účinku obou skupin léků, účinek interferonu αje komplexní a zasahuje i do imunitních reakcí.
Interferon α
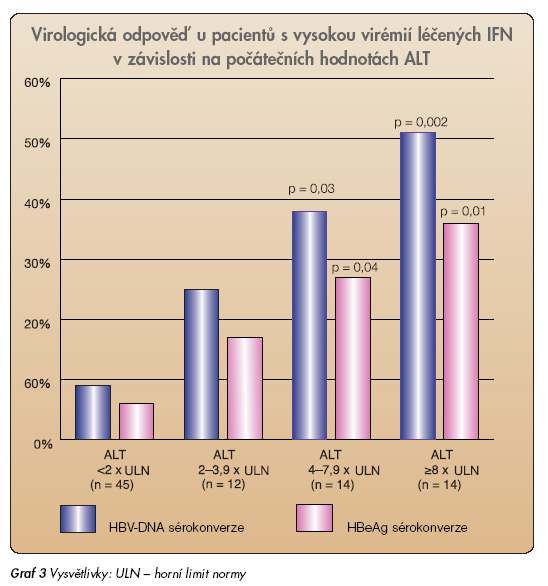
Interferon α (IFN) působí přímo na imunitní systém, zvyšuje expresi HLA-I antigenů na infikovaných buňkách, stimuluje cytotoxickou aktivitu CD8+ T lymfocytů. Jeho přímý antivirový účinek je relativně slabý. Schopnost interferonu α významně ovlivnit i poměrně vysokou replikaci HBV je způsobena zejména vyvoláním odpovídající imunitní odpovědi a destrukcí infikovaných hepatocytů. Klinickým korelátem nástupu dobré imunitní odpovědi je strmý vzestup zánětlivé aktivity (ALT), v anglosaské literatuře označovaný jako „flare-up". Prognosticky příznivý je vzestup ALT nad 5násobek iniciálních hodnot [7]. Obvykle je následován též poměrně rychlým poklesem k normálním hodnotám a krátce předchází HBeAg sérokonverzi. Na druhou stranu výskyt „flare-up" není podmínkou úspěšné léčby a dosažení HBeAg sérokonverze. Výskyt „flare-up" je příznivým prognostickým faktorem i pro dosažení HBsAg sérokonverze, pacienti s „flareup" ALT dosahují po léčbě interferonem α HBsAg sérokonverze 5–10x častěji než pacienti úspěšně léčení bez „flare-up". Vzestup ALT může být ojediněle spojen s projevy jaterní insuficience, ikterem a poruchou proteosyntézy, což limituje použití interferonu α u pacientů s pokročilou jaterní cirhózou. Význam imunitní odpovědi v léčbě chronické hepatitidy podtrhuje skutečnost, že nejdůležitějším pozitivním prognostickým faktorem pro dosažení HBeAg sérokonverze je iniciální aktivita ALT (graf 3).
Stejná závislost platí i pro výsledky léčby lamivudinem či adefovirem. Nevýhodou interferonu α je nedobrá tolerance léčby, léčba je vždy provázena výskytem nežádoucích účinků, i když jejich intenzita široce kolísá. V iniciální fázi léčby se jedná zejména o chřipkové příznaky (flu-like syndrom), v pokračující fázi pak nastupuje zejména únavnost a depresivní ladění, často bývá přítomno nechutenství, padání vlasů a poruchy erekce. Pokles počtu leukocytů a trombocytů je pravidlem, při počtu neutrofilů nad 1,0.109/l probíhá léčba bez závažných infekčních komplikací. Léčba konvenčním interferonem α má trvat 16–24 týdnů v dávce 5–10 MU 3x týdně. U HBeAg negativní formy chronické hepatitidy B má léčba trvat déle, nejméně 48 týdnů.
Pegylovaný interferon α
Pegylované interferony α (PEG-IFN) jsou připraveny navázáním molekuly konvenčního interferonu α na polyethylenglykol. Pegylací je dosaženo delšího biologického poločasu a relativně konstantní hladiny léku. I přes nižší antivirovou aktivitu in vitro jsou pegylované interferony α díky delšímu biologickému poločasu ve skutečnosti účinnější než interferony konvenční. Oba dostupné pegylované interferony, peginterferon α-2a a peginterferon α-2b, se liší způsobem pegylace a velikostí molekuly (40 kDa, resp. 15 kDa), jejich klinická účinnost v léčbě chronických virových hepatitid je ale srovnatelná. Na rozdíl od konvenčních interferonů α s podobnými molekulami mají oba léky odlišné dávkování. Peginterferon α-2a používá dávkování fixní, peginterferon α-2b se dávkuje dle tělesné hmotnosti. Oba léky jsou registrovány pro léčbu chronické hepatitidy C, v současné době probíhá v EU jejich registrace pro léčbu chronické hepatitidy B. Ve studii srovnávající 90, 180 a 270 μg peginterferonu α-2a jednou týdně u chronické HBeAg pozitivní hepatitidy B bylo po 24 týdnech nejlepšího výsledku dosaženo dávkou 90 μg (37 %, 35 % a 29% HBeAg sérokonverzí). V kontrolní skupině léčené interferonem α-2a v dávce 4,5 MU 3x týdně bylo dosaženo jen 25% HBeAg sérokonverzí [8]. V dalších studiích u HBeAg pozitivních i HBeAg negativních pacientů [9,10] byla prokázána účinnost dávky 180 μg peginterferonu α-2a a 100 μg peginterferonu α-2b (s redukcí dávky na 50 μg po 8 měsících léčby).
Nukleosidová analoga (tzv. syntetická antivirotika)
Charakteristika
Nukleosidová analoga jsou strukturálně podobná přirozeným purinovým či pyrimidinovým nukleosidům. Nukleosidová analoga kompetují s přirozenými purinovými či pyrimidinovými nukleosidy ve vazbě na HBV-DNA polymerázu. Podmínkou pro dosažení antivirové aktivity je intracelulární fosforylace na sloučeniny analogické přirozeným deoxyribonukleotidtrifosfátům. Začlenění molekuly nukleosidového analogu, kterému chybí 3-hydroxylová skupina na cukerné složce molekuly, do řetězce HBV-DNA vede k jeho zakončení a znemožňuje další prodlužování HBV-DNA řetězce. Některé z těchto sloučenin (např. lamivudin, emtricitabin a telbivudin) jsou nepřirozené L-enantiomery. Na rozdíl od buněčné DNA polymerázy má virová HBV-DNA polymeráza vyšší afinitu k L-enantiomerům než k přirozeným D-enantiomerům. Zmíněné sloučeniny tak vykazují vysokou antivirovou aktivitu a nízkou toxicitu. Lamivudin a adefovir dipivoxil patří k neobvykle dobře tolerovaným a velmi málo toxickým lékům. Léčba nukleosidovými analogy bohužel příliš neovlivňuje množství intracelulární cccDNA, to je příčinou, proč léčba musí být dlouhodobá, či dokonce trvalá. Antivirový účinek jednotlivých léků lze hodnotit dle průměrné hodnoty suprese HBV-DNA v séru po určité době léčby. Léčba je účinná, klesne-li při ní virémie (HBV-DNA v séru) pod 105 kopií/ml a pod 104 kopií/ml u HBeAg negativní formy. Virémie se u pacientů v replikační fázi chronické hepatitidy B pohybuje v hodnotách 105–108 kopií/ml, účinný lék tak musí snižovat virémii nejméně o 3 log (tab. 3) [11].
Lamivudin
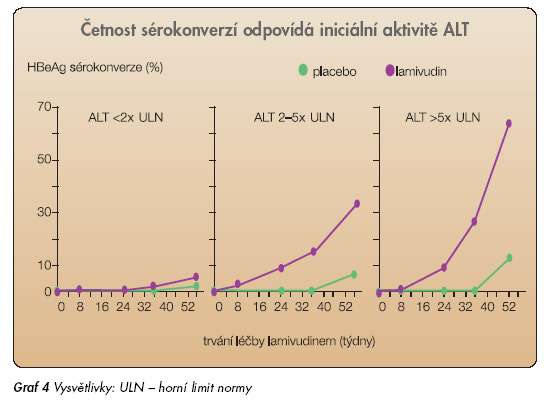
Zavedení lamivudinu (LAM) do klinické praxe znamenalo zásadní obrat v léčbě chronické hepatitidy B, kde byl do té doby jediným účinným lékem interferon α. Lamivudin účinně suprimuje replikaci HBV, jednoduše se užívá a nemá závažné nežádoucí účinky. Roční léčba lamivudinem vede k významné supresi virémie a zlepšení histologického nálezu [12]. Léčba trvající 2 roky je ještě účinnější, vede ke zvýšení podílu pacientů s HBeAg sérokonverzí ze 17 % po jednom roce léčby na 27 % po dvou letech léčby [13] (graf 4).
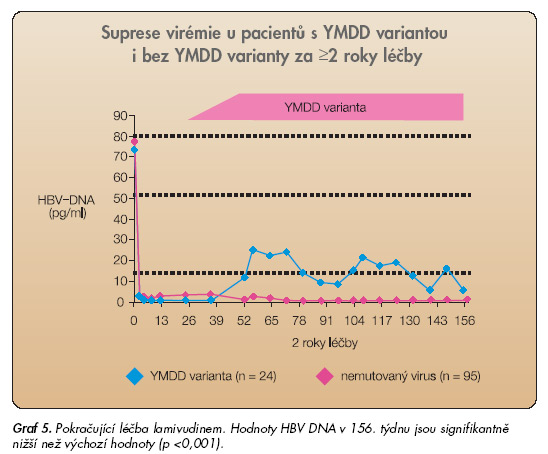
Na druhou stranu je prodlužování léčby spojeno se strmým nárůstem podílu pacientů s mutací rezistentní k lamivudinu (38 % po 2 letech léčby). Čím déle léčba trvá, tím je pacientů s rezistentní mutací více (65 % po 5 letech) [14]. Léčba pokračující déle než 2 roky při rezistenci k lamivudinu již ztrácí účinek na histologický nález a může být provázena vzplanutím zánětu „flare-up" [15]. Rezistence na lamivudin je podmíněna bodovou mutací v genu pro HBV-DNA polymerázu, tzv. YMDD mutací (Y – tyrosin, M – methionin, D – aspartat). K mutaci dochází jen v části z infikovaných hepatocytů, jejichž podíl postupně s pokračující léčbou narůstá. YMDD mutaci lze detekovat přímo PCR metodou, ale i bez přímého průkazu lze snadno rozpoznat rezistenci na lamivudin na základě narůstající virémie při pokračující léčbě lamivudinem (graf 5).
Virémie a zánětlivá aktivita se po vzniku mutace ihned nevrací na iniciální úroveň, tj. na hodnoty před léčbou. Vznik mutace na lamivudin, která není spojena s návratem virémie a aktivity na původní hodnoty, není proto důvodem k ukončování léčby.
Adefovir dipivoxil
Adefovir dipivoxil (ADV) je acyklický analog dAMP. Molekula adefoviru byla syntetizována českým vědcem prof. Holým v laboratořích Akademie věd. Další vývoj léku pak probíhal v USA, kde byl adefovir dipivoxil již v roce 2002 zaregistrován k léčbě HBeAg pozitivní i HBeAg negativní formy chronické hepatitidy B. Jeho účinnost byla ověřena velkými klinickými studiemi v USA, Evropě i v Asii [16,17], kdy po 48 týdnech léčby činila průměrná redukce HBV-DNA 3,52 log u HBeAg pozitivní formy chronické hepatitidy B a 3,91 log u HBeAg negativní formy. K vymizení HBeAg nedocházelo po 52 týdnech léčby adefovirem tak často jako po lamivudinu (24 % vs 32 %). Frekvence HBeAg sérokonverzí i pacientů HBV-DNA zcela negativních při vyšetření metodou PCR stoupla po druhém roce léčby ve srovnání s rokem prvním. Účinnost adefoviru ve smyslu suprese HBV-DNA není závislá na genotypu viru [18]. Zatímco úroveň suprese HBV-DNA dosahovaná léčbou adefovirem je jen lehce nižší než po lamivudinu, v profilu rezistencí se oba léky významně liší. Rezistence k adefoviru je podmíněna bodovými mutacemi v genu pro HBV-DNA polymerázu (A181V, N236T), mutace ovšem byly nalezeny jen u 3 % a 6 % pacientů po 2, resp. 3 letech léčby. Selekce rezistentních mutant je u lamivudinu 15–20x častější po shodném intervalu léčby [19,20]. Izoláty s bodovou mutací N236T zůstavají citlivé na lamivudin a zdají se být citlivými i na entecavir a telbivudin in vitro. Právě nízká frekvence selekce rezistentních mutací v kombinaci s dobrou tolerancí činí z adefoviru lék první volby pro dlouhodobou supresi replikace HBV. Adefovir je virologicky i klinicky účinný i u pacientů s mutacemi HBV rezistentními na lamivudin. Klinická účinnost byla prokázána jak u pacientů s chronickou hepatitidou a s normální funkcí jater, tak u pacientů s dekompenzovanou jaterní cirhózou a u pacientů s rekurencí HBV po transplantaci jater [21–23]. Adefovir je při rezistenci na lamivudin účinný nejen po přidání k lamivudinu, ale i po vysazení lamivudinu v monoterapii. V jedné ze zmíněných studií ovšem došlo asi u třetiny pacientů po převedení na monoterapii adefovirem ke vzplanutí zánětu „flareup". Někteří autoři (Perrillo) se proto kloní k přidání adefoviru k lamivudinu, spíše než k převedení na monoterapii adefovirem. Např. v Doporučeném postupu léčby chronické hepatitidy B vydaném AASLD je doporučováno převedení na monoterapii adefovirem. Jedinou nevýhodou adefoviru je lehká nefrotoxicita, v terapeutických dávkách nepředstavuje problém, ale u pacientů s renální insuficiencí je nutno dávku redukovat.
Emtricitabin
Emtricitabin (FTC) je fluorovaný analog cytosinu, inhibuje HBV-DNA polymerázu a HIV reverzní transkriptázu. V kontrolované studii fáze 3 bylo u naivních pacientů léčbou emtricitabinem trvající 48 týdnů v dávce 200 mg denně dosaženo redukce HBV-DNA v séru v průměru o 3 log kopií/ml a významného zlepšení histologického nálezu. Molekula emtricitabinu má strukturu podobnou molekule lamivudinu, léčba emtricitabinem vede k selekci stejných rezistentních mutat jako léčba lamivudinem. U pacientů léčených 200 mg emtricitabinu denně byla YMDD mutace prokazatelná po 48 týdnech léčby u 9–16 % pacientů a po 96 týdnech léčby u 19–37 % pacientů [24]. Emtricitabin je v současné době registrován v USA, blízká strukturální i klinická charakteristika emtricitabinu s lamivudinem ho činí lékem, jehož uplatnění nebude významné. Emtricitabin by se mohl uplatnit v léčbě pacientů s chronickou hepatitidou B s koinfekcí HIV. Ve studii u pacientů s koinfekcí HIV-1 bylo emtricitabinem dosaženo stejné suprese HBV-DNA jako u pacientů bez koinfekce HIV [25].
Tenofovir disoproxil fumarat
Tenofovir je acyklický nukleotidový inhibitor HBV-DNA polymerázy a HIV reverzní transkriptázy, strukturou je blízký adefoviru. V USA je registrován pro léčbu infekce HIV1, ale jeho antivirová aktivita na HBV je vyšší než aktivita adefoviru [26]. U pacientů léčených tenofovirem byl zaznamenán rychlejší pokles virémie, v průměru o 4,8 log a 6,6 log po 3 a 6 měsících léčby, ve skupině adefoviru virémie poklesla jen o 1,97 log, resp. 1,72 log kopií/ ml. U některých pacientů s velmi dobrou odpovědí na tenofovir došlo po opětném převedení na adefovir k opětnému nárůstu replikace HBV. Rezistence na tenofovir je zkřížená s rezistencí na adefovir, zmíněná N236T mutace je rezistentní na oba léky. Nasazení tenofoviru do léčby hepatitidy B nelze asi v krátké době očekávat, registrován je pro léčbu infekce HIV1 v kombinaci s emtricitabinem. Předpokládá se, že zmíněná kombinace by mohla být racionální i u hepatitidy B, neboť oba léky nemají zkříženou rezistenci.
V současnosti vyvíjená a zkoušená syntetická antivirotika
Entecavir je deoxyguaninový analog, který selektivně inhibuje replikaci HBV. Od předchozích syntetických antivirotik ho odlišuje mechanismus účinku, blokuje priming HBV-DNA polymerázy, a tím i syntézu obou řetězců HBV-DNA, v buněčných kulturách byla jeho intracelulární fosforylace rychlejší než u dalších nukleosidových analog, na zvířecím modelu inhiboval i cccHBV-DNA. Je účinný i na mutace rezistentní na lamivudin. K dispozici jsou výsledky klinických studií fáze 3 u pacientů naivních i u pacientů s rezistencí na lamivudin. Suprese virémie byla po 24 týdnech léčby 0,5 mg entecaviru denně o 1,28 log hlubší než po lamivudinu [27]. Dávka 1 mg denně se ukázala jako ještě účinnější. Rezistence na entecavir byla prokazána jen u 2 pacientů z 500 po 80 a 100 týdnech léčby. Clevudin je pyrimidinový analog, má vysokou antivirovou aktivitu in vitro i in vivo. K dispozici jsou výsledky korejské studie fáze 2, 30 mg a 50 mg clevudinu denně proti placebu. Suprese virémie po 12 týdnech léčby byla -4,2 log, resp. -4,5 log. Výhodou clevudinu je přetrvávající antivirový účinek ještě určitou dobu po vysazení léku, suprese virémie 24 týdnů po ukončení léčby byla -2,6 log, resp. -1,8 log kopií/ml. Přetrvávání antivirového účinku se vysvětluje přetrvávající intracelulární akumulací fosforylovaných aktivních metabolitů, exaktní data v tomto směru však zatím chybějí. B-L-nukleosidy jsou analoga L-deoxythymidinu (LdT, telbivudin) a valyl-L-deoxycytidinu (val-LdC, valtrocitabin). Velmi účinně a selektivně blokují replikaci HBV. Telbivudin in vitro blokuje převážně syntézu druhého vlákna HBVDNA, zatímco valtrocitabin prvního i druhého vlákna. Z mechanismu účinku se předpokládá možný synergický účinek obou léků. Více je již známo o telbivudinu, zpracovány již jsou výsledky studie fáze 2b, 400 mg nebo 600 mg telbivudinu v monoterapii či v kombinaci s lamivudinem [28]. Léčba oběma dávkami telbivudinu vedla k supresi virémie o -6 log kopií/ml, u 64 % pacientů byla HBV-DNA zcela negativní při vyšetření metodou PCR. K vymizení HBeAg došlo u 33 % pacientů. Rezistence na telbivudin byla prokázána jen u 4 % pacientů po roce léčby.
Další imunomodulační léky Thymosin α
-1 je kromě interferonů jediným dalším imunomodulačním lékem, který byl v praxi použit k léčbě chronické infekce HBV. Pochází sice z USA, registrován je ale jen v některých asijských zemích. Thymosin α-1 zvyšuje maturaci T lymfocytů a jejich funkci. Výsledky monoterapie jsou rozporné, účinnost monoterapie nebyla jednoznačně prokázána. V kombinaci s interferonem α-2b byl thymosin α-1 účinnější v léčbě HBeAg negativní formy chronické hepatitidy B, u pacientů léčených kombinací bylo častěji dosaženo setrvalé odpovědi než po monoterapii interferonem α-2b, do studie ovšem bylo zařazeno jen 52 pacientů [29].
Vakcinace proti HBV
Vakcinace je účinným postupem pro zabránění přenosu infekce HBV a z celosvětového hlediska bude rozhodujícím postupem v eradikaci infekce HBV. Očkování je zcela bezpečné, provádí se očkovací látkou obsahující rekombinantní HBs antigen. V současné době je plošné očkování zavedeno ve 135 zemích světa. V ČR se od 80. let očkují rizikové skupiny obyvatelstva (zdravotníci, hemodialyzovaní pacienti, děti HBsAg pozitivních matek). Podle Vyhlášky Ministerstva zdravotnictví 439/2000 Sb., o očkování proti přenosným nemocem bylo zahájeno plošné očkování novorozenců a dětí ve věku 12 let. Standardní očkovací schéma zahrnuje 3 dávky, druhá a třetí dávka se podávají 1 měsíc, resp. 6 měsíců po dávce první. K dispozici je i kombinovaná očkovací látka proti hepatitidě A a B.
Závěr
V posledních 10 letech bylo v léčbě chronické infekce HBV dosaženo významného pokroku. Konvenční interferony αjsou nahrazovány účinnějšími a lépe tolerovanými pegylovanými interferony. Kromě interferonu αjsou k dispozici i nová syntetická antivirotika použitelná i pro dlouhodobou léčbu a pro léčbu imunosuprimovaných pacientů. Dlouhodobá léčba je spojena nejen s úpravou laboratorních parametrů, ale i se zlepšováním histologického nálezu. Na druhou stranu lze dostupnou léčbou dosáhnout jen trvalé či přechodné suprese virémie, nikoliv úplné eradikace viru. Léčba chronické hepatitidy B je stále nesmírně nákladná, a tak i nedostupná v chudých oblastech s nejvyšším výskytem infekce na světě.
Seznam použité literatury
- [1] Němeček V. Sérologický přehled ČR v roce 2001 – virová hepatitida A,B,C. Zprávy CEM 2003;12:55–61.
- [2] Zoulim F. Clinical virology of hepatitis B. In: Marcellin P. (editor): Management of patients with viral hepatitis. APMAHV, Paris, 2004;91–202.
- [3] Lok ASF, McMahon BJ. AASLD Practice Guidelines. Chronic hepatitis B. December 2003. www.aasld.org.
- [4] Lok ASF, McMahon BJ. Chronic hepatitis B: Update of recommendations. Hepatology 2004;39:1–5.
- [5] Wong DK, Cheung AM, O´Rourke K, et al. Effect of alpha-interferon treatment in patients with hepatitis B e antigen-positive chronic hepatitis B. A meta-analysis. Ann Intern Med 1993;119: 312–23.
- [6] Lau DT, Everhart J, Keiner DE, et al. Long-term follow up of patients with chronic hepatitis B treated with interferon alfa. Gastroenterology 1997;113:1660–7.
- [7] Nair S, Perrillo R. Serum alanine aminotransferase flares during interferon treatment of chronic hepatitis B: is sustained clearance of HBV DNA dependent on levels of pretreatment viremia? Hepatology 2001;34:1021-–6.
- [8] Cooksley WGE, Piratvisuth T, Lee SD, et al. Peginterferon alfa-2a (40 kDa): an andvance in the treatment of hepatitid B e antigen-positive chronic hepatitis B J Viral Hepatitis 2003;10:298–305.
- [9] Marcellin P, Lau GKK, Bonino F, et al. A phase III, partially double-blind study evaluating the efficacy and safety of peginterferon alfa-2a (40 kDa) (Pegasys®) alone or in combination with lamivudine vs lamivudine in 537 patients with HBeAgnegative/ anti-HBe positive chronic hepatitis B. 54th Annual Meeting of AASLD, October 24–28, Boston, MA. Abstract 1181.
- [10] Janssen HLA, Sentruk H, Zeuzem S, et al. PegInterferon alfa-2b and lamivudine combination therapy compared with pegInterferon alfa-2b for chronic HBeAg positive chronic hepatitis B: a randomized controlled trial in 307 patients. 54th Annual Meeting of AASLD, October 24–28, Boston, MA. Abstract 246A.
- [11] Perrillo R. New data on hepatitis B treatment. Data on file – on-line. www.clinicaloptions. com/hepatitis.
- [12] Lai CL, Chien RN, Leung NW, et al. A one- -year trial of lamivudine for chronic hepatitis B. N Engl J Med 1998;339:61–8.
- [13] Liaw YF, Leung NWY, Chang TT, et al. Effects of extended lamivudine therapy in Asian patients with chronic hepatitis B. Gastroenterology 2000;119:172–80.
- [14] Lok ASF, Lai CL, Leung N, et al. Long-term safety of lamivudine treatment in patients with chronic hepatitis B. Gastroenterology 2003; 125:1714–22.
- [15] Dienstag JL, Goldin RD, Heathcote JE, et al. Histological outcome during longterm lamivudine therapy. Gastroenterology 2003;124: 105–17.
- [16] Marcellin P, Chang TT, Lim SG, et al. Adefovir dipivoxil for the treatment of hepatitis Be antigen – positive chronic hepatitis B. N Engl J Med 2003;348:808–16.
- [17] Hadziyannis SJ, Tassopoulos NC, Heathcote EJ, et al. Adefovir dipivoxil for the treatment of hepatitis Be antigen – negative chronic hepatitis B. N Engl J Med 2003;348:800–7.
- [18] Westlan C, Delaney W 4th, Yang H, et al. Hepatitis B virus genotypes and virological response in 694 patients in phase III studies of adefovir dipivoxil. Gastroenterology 2003;125:107–16.
- [19] Angus P, Vaughan R, Xiong S, et al. Resistance to adefovir dipivoxil therapy associated with the selection of a novel mutation in the HBV polymerase. Gastroenterology 2003;125:292–7.
- [20] Hadziyannis S, Tassopoulos N, Chang TT, et al. Three year study of adefovir dipivoxil (ADV) demostrated sustained efficacy in presumed precore mutant chronic hepatitis B (CHB) patients in a long safety and efficacy study (LT- -SES). 39th Annual Meeting of EASL, April 11–14, 2004, Berlin, Germany. Abstract 46.
- [21] Perrillo R, Hann HW, Mutimer D, et al. Adefovir dipivoxil added to ongoing lamivudine in chronic hepatitis B with YMDD mutant hepatitis B virus. Gastroenterology 2004;126:81–90.
- [22] Peters MG, Hann HW, Martin P, et al. Adefovir dipivoxil alone or in combination with lamivudine in patients with lamivudine-resistatnt chronic hepatitis B. Gastroenterology 2004;126:343–7.
- [23] Schiff ER, Hadziyannis S, et al. Adefovir dipivoxil therapy for lamivudine resistatnt chronic hepatitis B in pre- and post- liver transplantation patients. Hepatology 2003;38:1419–27.
- [24] Gish R, Leung N, Wang C, et al. Antiviral activity, safety and incidence of resistance in chronically infected hepatitis B patients (CHB) given once daily emtricitabine for 2 years. 53rd Meeting of AASLD, November 1–5, 2002, Boston, MA. Abstract 838.
- [25] Raffi F, Snow A, Borroto-Esoda K, et al. Anti- HBV activity of emtricitabine (FTC) in patients coinfected with HIV and hepatitis B virus. 2nd IAS Conference on Pathogenesis and Treatment. July 13–16, 2003, Paris, France. Abstract 215.
- [26] Van Bommel F, Wunsche T, Schurmann D, et al. A comparison of adefovir and tenofovir in the treatment of lamivudine-resistant hepatitis B virus infection. 54th Annual Meeting of AASLD, October 24–8, 2003, Boston, MA. Abstract 246.
- [27] Lai CL, Rosmawati M, Lao J, et al. Entecavir is superior to lamivudine in reducing hepatitis B virs DNA in patients with chronic hepatitis B infection. Gastroenterology 2002;123:1831–8
- [28] Lai C-L, Leung NWY, Teo E-K, et al. Results of one-year international phase IIB comparative trial of telbivudine, lamivudine, and the combination in patients with chronic hepatitis B. 54th Annual Meeting of AASLD, October 24–28, Boston, MA. Abstract 219.
- [29] Saruc M, Ozden N, Turkel N, et al. Longterm outcomes of thymosin alpha-1 and interferon alpha-2b combination therapy in patients with hepatitis Be antigen (HBeAg) negative chronic hepatitis B. J Pharm Sci 2003;92:1386–95.