Léčba roztroušené sklerózy mozkomíšní – imunomodulační, či imunosupresivní zásahy?
Souhrn:
Roztroušená skleróza mozkomíšní (RS) je závažné imunopatologické a neurodegenerativní zánětlivé onemocnění postihující centrální nervový systém. Jeho patogeneze je komplexní a zahrnuje genové predispozice významně ovlivněné životními podmínkami určujícími individuální imunitní reaktivitu, které v převaze působí epigeneticky. Původní koncept, že se jedná o čistě autoimunitní onemocnění vyvolané rozpoznáním imunodominantních epitopů složek obalu axonu, hlavně myelinového bazického proteinu autoreaktivními T lymfocyty, je významně doplněn o další mechanismy. Ty zahrnují základní biologické procesy v buňce, např. buněčné dýchání a s ním spojený oxidační stres, uvolnění signálů poškození DAMP (endogenní signály nebezpečí, danger associated molecular patterns) a jejich rozpoznání dendritickými buňkami. Tyto buňky předkládají imunodominantní peptidy v kostimulačním „kontextu“ T lymfocytům. Výsledkem je preferenční polarizace T lymfocytů do subsetů Th1 a Th17, které považujeme za klíčové v imunopatogenezi RS. Nově bylo jasně prokázáno i zapojení B lymfocytů, jež jsou podstatnou součástí komplexních struktur nalézaných v mozku nemocných s RS a označovaných jako terciární lymfatické tkáně. Na základě těchto poznatků je v současné době schváleno pro léčbu RS přibližně deset přípravků, které se liší, často zásadně, v mechanismech účinku. Odlišují se i svým dlouhodobým bezpečnostním profilem. Léčiva zahrnují látky s převažujícím imunomodulačním působením i látky s imunosupresivními účinky. Tyto okolnosti musejí být zohledněny při sestavování léčebného plánu s přihlédnutím k terapeutické účinnosti a k dlouhodobé perspektivě použití.
Key words: multiple sclerosis – immunopathogenesis – drugs – immunomodulation – immunosuppression.
Summary:
Multiple sclerosis (MS) is an immunopathological and neurodegenerative disease affecting the central nervous system. The pathogenesis of MS is complex, comprises the involvement of genetic predisposition and is substantially influenced by individual immune reactivity, which is affected by environment via epigenetic mechanisms. Originally thought to be a purely autoimmune process caused by autoreactive T cells recognizing immunodominant epitopes of myelin sheath glycoprotein, such as myelin basic protein, the theory of MS pathogenesis has been enriched by additional, newly identified mechanisms. These mechanisms cover the fundamental biological activities of cell, such as the involvement in oxidative stress and the release of DAMP (danger associated molecular patterns) from injured cells. These signals are processed in dendritic cells and subsequently presented to T cells in costimulatory context. This result in their preferential polarization into Th1 and Th17 subsets, which are the cornerstones of MS immunopathogenesis. These mechanisms are targeted by currently available therapy. There are approximately 10 drugs approved for the treatment of MS. There are the significant differences among these drugs both in their efficacy and long term safety. These drugs could be stratified regarding their effect on immunity. There are largely immunomodulatory drugs on one pole of this spectrum and immunosuppressive drugs on the opposite pole. These facts have to be acknowledged by the physician when completing the therapeutic scheme to achieve the best therapeutic response, safety and long term sustainability of therapy.
Úvod
Roztroušená skleróza mozkomíšní (RS) je závažné imunopatogenetické a neurodegenerativní zánětlivé onemocnění postihující centrální nervový systém. Jeho prevalence je nejvyšší v populaci evropského původu mírného podnebného pásu. Etiopatogeneze RS je komplexní a zahrnuje jak genetické predispozice, tak vliv proměnných faktorů vnějšího světa působících také epigeneticky. Jedná se zřejmě o obtížně uchopitelnou kombinaci všech vlivů, které podmiňují individuální imunitní reaktivitu. U disponovaného člověka vedou neznámé precipitující okolnosti k přesmyku zánětu obranného do zánětu poškozujícího. Roztroušená skleróza patří mezi nejlépe poznaná imunopatologická onemocnění člověka, mimo jiné i proto, že je již desítky roků studován experimentální zvířecí model EAE (experimental autoimmune encephalomyelitis) [1]. Až donedávna bylo zdůrazňováno, že hlavní úlohu sehrává autoreaktivita zaměřená na konkrétní molekulární struktury přítomné v mozku. Ta měla vést k prolomení tolerance a k rozvoji poškozujícího zánětu. Uvedená koncepce je nepochybně platná, protože se stala základem pro vývoj první skupiny léků charakteru DMD (chorobu modifikující léky, disease modifying drugs), které jsou schopny ovlivnit přirozený průběh onemocnění. Nověji se však ukazuje, že imunopatogeneze RS je daleko komplexnější. Zahrnuje i samotné biologické základy funkce buňky, jimiž je buněčné dýchání a oxidační stres. Ve hře jsou i další okolnosti, které náš původní koncept významně modifikují. Tyto poznatky jsou natolik zásadní, že se staly základem pro nově zaváděné léky účinné v léčbě RS. Terapeutické ovlivnění poškozujícího zánětu u RS je efektivní do té míry, že u části nemocných již nyní umožňuje dosáhnout tzv. NEDA (no evidence of disease activity).
Výzkumné úsilí se soustředí i na dříve opomíjenou součást patogenetických procesů u nemocných s RS. Dnes je jasně prokázáno, že od samého počátku je poškozující zánět u nemocných s RS součástí neurodegenerativních procesů. V minulosti bylo paradigma RS odlišné. Začátek onemocnění byl podle něho spojen s poškozujícím imunopatologickým zánětem a procesy neurodegenerace neprobíhaly. V pozdních fázích onemocnění měl poškozující zánět „vyhasínat“ a zesíleny měly být procesy neurodegenerace. Ty jsou zatím léčebně ovlivnitelné velmi omezeně. Potřeba léčebně ovlivnit i tuto složku patogenetických procesů u nemocných s RS je jasná. Dosavadní léčba zaměřená proti poškozujícímu zánětu zásadně zlepšuje kvalitu života a celkové životní očekávání nemocných. Proto je zapotřebí, aby léčba nemocných s RS zahrnovala i omezení procesů, které ruku v ruce se zánětlivým poškozením vedou k neurodegeneraci [2].
Zásadní posun, jehož jsme v léčbě nemocných s RS svědky v uplynulých zhruba dvaceti letech a který dále akceleruje, představuje pro neurology značnou výzvu. Při rozhodování, kterou léčebnou modalitu zvolit, musejí v současnosti sledovat mnohem více ukazatelů než v nedávné minulosti, vždy vyvažovat mezi bezprostředním i střednědobým terapeutickým účinkem indikovaného léku a jeho bezpečností. Tou nemyslíme nežádoucí účinky, jež provázejí při zahájení léčby ve větší nebo menší míře prakticky každý lék. Máme tím na mysli především nežádoucí dopady, jež mohou vést k omezení obranných složek zánětu, s výslednou zvýšenou vnímavostí k infekcím, s rizikem reaktivace endogenních latentních infekcí s často fatálními důsledky. Nejúčinnější z léků mohou dokonce zvýšit riziko rozvoje jiných imunopatologií a malignit. Při svém rozhodování tedy musejí neurologové připravit určitý plán, který umožní přechod na jiné léky a neohrožuje pacienta v dlouhodobém horizontu. Proto je zapotřebí pokusit se léky, jež jsou nyní schváleny pro klinickou aplikaci u nemocných s RS, utřídit na základě jejich účinků na imunitní systém a pokusit se v tomto nepochybně kontinuu definovat, která léčiva působí spíše imunomodulačně a která v převaze imunosupresivně. To vše s vědomím, že léčebná účinnost je přímo korelována s rizikem rozvoje závažných nežádoucích účinků, tj. že nejúčinnější léky jsou zpravidla také v tomto ohledu nejnebezpečnější.
Imunopatogeneze roztroušené sklerózy
Klasicky je RS definována jako imunopatologické onemocnění, při němž dochází k prolomení autotolerance. Výsledkem je rozvoj autoreaktivity, v minulosti spojované především s T lymfocytárním systémem. Nyní máme důkazy – např. v podobě terciárních lymfatických struktur v mozku –, že přinejmenším stejnou měrou je v tomto procesu zahrnuta i B lymfocytární větev specifické imunity. V případě T lymfocytů máme určeny jasné terče. Jsou to imunodominantní epitopy nervových struktur, především myelinového bazického proteinu (MBP), oligodendrocytárního glykoproteinu (MOG) a glykoproteinu asociovaného s myelinem (MAG). Z neznámých důvodů, pravděpodobně jako důsledek poškození nervových struktur, např. infekčním inzultem, jsou tyto potenciálně autoantigenní struktury identifikovány jako „vzory vnitřního poškození“ DAMP dendritickými buňkami [3]. V sekundárních lymfatických orgánech, kam dendritické buňky cíleně migrují, dochází ke zpracování a k následné prezentaci autoantigenních peptidů v kontextu molekul HLA a kostimulačních interakcí T lymfocytárnímu systému. Výsledkem je klonální expanze autoreaktivních T lymfocytů, které se v kontextu poskytovaném prezentujícími buňkami dále abnormálně polarizují do subsetů Th1 a Th17. Tyto dva subsety jsou centrálním bodem řídícím podle současných znalostí poškozující zánět u nemocných s RS. Autoreaktivní T (B) lymfocyty musejí ze sekundárních lymfatických orgánů migrovat zpět do mozku. Přitom musejí prostoupit hematoencefalickou bariérou, která za fyziologických podmínek zajišťuje přísně regulovaný vstup a výstup imunitních buněk do mozku. Ty jsou nezbytné nejen pro ochranu tohoto kompartmentu, ale poskytují i podporu regeneračním a reparačním procesům probíhajícím kontinuálně v mozkové tkáni. U nemocných s RS jsou fyziologické vlastnosti hematoencefalické bariéry alterovány a umožňují vstup abnormálně polarizovaných autoreaktivních T lymfocytů. V mozkové tkáni jsou jimi rozpoznávány autoantigenní struktury. Výsledkem je rozvoj poškozujícího zánětu, v němž jsou zapojeny T lymfocyty všech subsetů, NK buňky, makrofágové elementy i struktury s původem v mozku [4]. Pro zapojení specifické B lymfocytární imunity do imunopatogeneze RS máme desítky roků důkazy v podobě intratékální syntézy oligoklonálních imunoglobulinů. Jejich průkaz v likvoru je využíván v diagnostické rozvaze a podporuje podezření na RS. Dříve bývaly považovány spíše za epifenomén, protože se nepodařilo zjistit, s kterými strukturami mozku reagují. Nedávno však byly v mozku prokázány terciární lymfoidní struktury tvořené především aktivovanými B lymfocyty v těsné kooperaci s T lymfocyty, s fo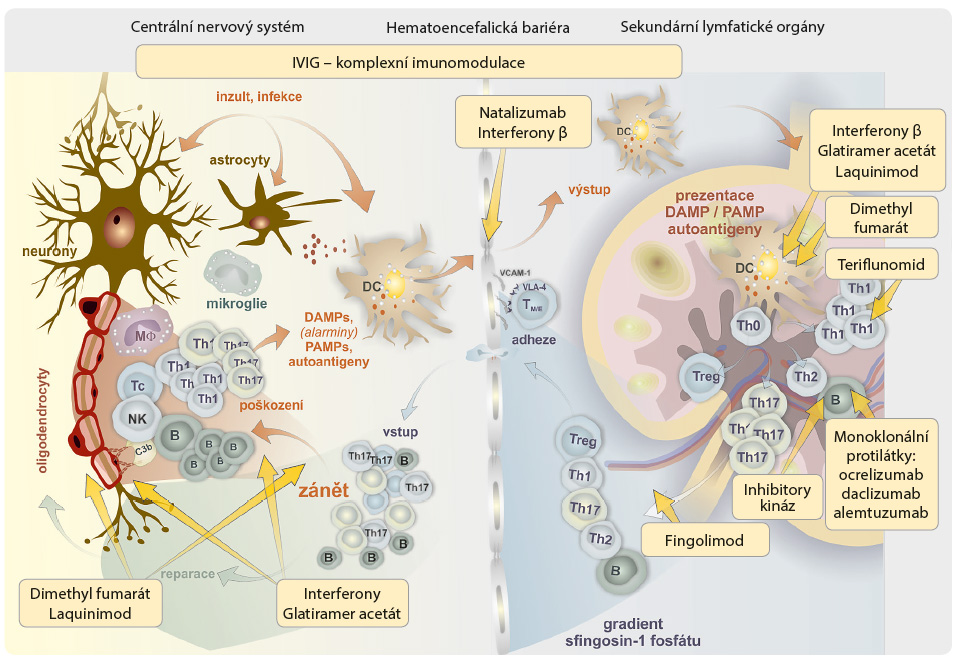 likulárními dendritickými buňkami a s dalšími buněčnými populacemi. Jejich přítomnost má význam v patogenezi RS, protože biologická terapie cílící na B lymfocyty je účinným lékem i u RS. Patofyziologické procesy, které vrcholí poškozujícím zánětem v mozkové tkáni, jsou komplexní. Odehrávají se především v sekundárních lymfatických orgánech, z nichž musejí autoreaktivní T a B lymfocyty cíleně migrovat přes hematoencefalickou bariéru do mozku. Tyto migrační aktivity jsou natolik významné, že se staly cílem léku účinného v terapii RS. Je zřejmé, že naše dosavadní představy o patogenezi RS jsou omezené a v jistém slova smyslu zúžené. Důkaz nám přináší lék, který cílí na fundamentální biologické procesy v buňce, konkrétně na buněčné dýchání a na oxidační stres. Je jisté, že další překvapení stran imunopatogeneze či patogeneze RS budou vbrzku následovat (obr. 1) [5].
likulárními dendritickými buňkami a s dalšími buněčnými populacemi. Jejich přítomnost má význam v patogenezi RS, protože biologická terapie cílící na B lymfocyty je účinným lékem i u RS. Patofyziologické procesy, které vrcholí poškozujícím zánětem v mozkové tkáni, jsou komplexní. Odehrávají se především v sekundárních lymfatických orgánech, z nichž musejí autoreaktivní T a B lymfocyty cíleně migrovat přes hematoencefalickou bariéru do mozku. Tyto migrační aktivity jsou natolik významné, že se staly cílem léku účinného v terapii RS. Je zřejmé, že naše dosavadní představy o patogenezi RS jsou omezené a v jistém slova smyslu zúžené. Důkaz nám přináší lék, který cílí na fundamentální biologické procesy v buňce, konkrétně na buněčné dýchání a na oxidační stres. Je jisté, že další překvapení stran imunopatogeneze či patogeneze RS budou vbrzku následovat (obr. 1) [5].
Léky ovlivňující poškozující zánět u nemocných s RS
Již jsme naznačili, že možnosti léčebného zásahu u nemocných s RS jsou v současnosti v porovnání s nedávnou minulostí poměrně pestré a lékař je u každého individuálního pacienta postaven před složité rozhodování, jaký lék ordinovat s ohledem na terapeutickou účinnost a dlouhodobou perspektivu pacienta. Všechny léky používané v terapii RS cílí na funkce zánětu a imunity. Jsou tedy svou povahou protizánětlivé a imunomodulační. Je velmi obtížné vést oddělující linii mezi protizánětlivými a imunomodulačními přípravky. Kortikosteroidy, které jsou použity na začátku terapie každého nemocného s RS a které budou opakovaně podány při relapsu onemocnění, vykazují nepochybně protizánětlivé účinky. Jistě však indukují i změny, jež můžeme považovat za důsledek modulace imunitního systému. Stejně obtížně můžeme rozdělit léky používané v terapii RS na ty s imunomodulačním a na jiné s imunosupresivním působením. Vždy se jedná o individuální odpověď určenou biologickou podstatou pacienta i charakterem jeho onemocnění. Imunomodulaci můžeme definovat jako léčebný zásah, jehož převažujícím mechanismem je ovlivnění poškozujícího zánětu regulací. Imunomodulační přípravky jsou také provázeny významně nižším rizikem závažných nežádoucích účinků dlouhodobé terapie, jimiž rozumíme především potlačení obranných funkcí, riziko rozvoje autoimunitních a nádorových onemocnění. Naproti tomu jako imunosupresivní můžeme charakterizovat léčebné zásahy, které cílí na konkrétní složku poškozujícího zánětu, již eliminují nebo funkčně blokují. Takovými cílenými zásahy je typická především biologická terapie. Pravděpodobně nejrizikovějšími imunosupresivními léky jsou substance, které ovlivňují buněčnou proliferaci. U nich je vedle již zmíněných nežádoucích účinků při dlouhodobém používání významně zvýšeno riziko maligního zvratu [6].
Pokusíme se stručně seřadit do určité škály léky, které jsou v současnosti schváleny pro léčbu nemocných s RS. Na jednom pólu budou léky se zřetelně převládajícími imunomodulačními účinky. Druhý pól budou tvořit léky se zřetelně imunosupresivními účinky. Je třeba znovu zdůraznit, že toto členění je do velké míry arbitrární. Z principu nelze u žádného z těchto léků provést jednoznačný soud. Domníváme se však, že toto zjednodušené členění by mohlo být užitečné při rozhodování o indikaci konkrétních léčebných přípravků u nemocných s RS.
Léčivem, u kterého výrazně převažuje imunomodulace, jsou intravenózní imunoglobuliny. Ty jsou používány obvykle na začátku léčby u většiny pacientů s RS. Jejich působení je mimořádně komplexní a zčásti popsané. Zřetelně dominují jejich modulační účinky a jejich aplikace žádným způsobem neomezuje nasazení dalších léčiv [7]. Klasickými léky, u nichž máme nejrozsáhlejší klinické zkušenosti, jsou interferony a glatiramer acetát. U obou léků považujeme za převažující jejich imunomodulační účinek. V jeho mechanismu se oba léky liší. Glatiramer acetát svým složením napodobuje imunogenní peptidy odvozené od MBP. Po vazbě na receptory autoreaktivních T lymfocytů (T cell receptor, TCR), jimž není poskytnut dostatečný kontext rozpoznávání, tyto T lymfocyty anergizuje, a může dokonce způsobit jejich apoptózu. Oba léky zasahují i modulačně ve smyslu snížení aktivit subsetu Th1, případně Th17 T lymfocytů a zesílení aktivit regulačních T lymfocytů (regulatory T cells, Treg). Interferony β indukují tvorbu interferonů I. třídy a také proteinu Mx. Svým působením mohou ovlivnit virovou infekci, která stále zůstává jako jedna z možností podílejících se na poškozujícím zánětu u nemocných s RS. Mají však nepochybně modulační účinky na T lymfocytární systém i na další buněčné typy. Výsledky působení interferonů β se velmi podobají již popsaným změnám u nemocných léčených glatiramer acetátem [8]. Na tuto skupinu „klasických“ léčiv bychom mohli navázat novým přípravkem laquinimodem. Ten zatím nebyl schválen pro klinické použití a probíhají klinické zkoušky. Laquinimod lze považovat s převahou za imunomodulační přípravek, který zasahuje do aktivit subsetu Th1 a Th17 s přesmykem k Treg lymfocytům. Ovlivňuje i prozánětlivé aktivity dendritických buněk a makrofágů [9].
Velmi účinným a relativně novým lékem je fingolimod. Mechanismus jeho působení byl překvapivý. Poškozující zánět u nemocných s RS tlumí zásahem do migračních aktivit imunocytů, blokádou receptorů pro sfingosinfosfát. Ty jsou kriticky důležité v součinnosti s receptory pro určité chemokiny, pro výstup aktivovaných T lymfocytů ze sekundárních lymfatických orgánů. Již jsme zdůraznili, že iniciační a amplifikační fáze poškozujícího zánětu u nemocných s RS se odehrává právě zde. Působením fingolimodu jsou buňky poškozujícího zánětu „zadrženy“ v periferních lymfatických tkáních. Fingolimod je považován za relativně bezpečný lék, zvyšuje však riziko omezení obranných funkcí zánětu [10]. Bude u něho zapotřebí, stejně jako v případě dalšího léku dimethyl fumarátu, rozsáhlejších klinických zkušeností v indikaci RS a především delší doby sledování léčených nemocných, abychom se mohli jednoznačně vyjádřit k jejich případným imunosupresivním účinkům. Dimethyl fumarát je chemicky jednoduchá látka, jejímž účinkem je aktivování transkripčního faktoru Nrf2. Ten je následně translokován do jádra buňky, kde pozitivně reguluje přepis stovek genů s protizánětlivými, antioxidačními a detoxikačními účinky. Je otázkou, zda můžeme v případě fumarátů hovořit ještě o imunomodulaci. Pokud ano, děje se tak samozřejmě pouze zprostředkovaně, protože vlastní účinek léku míří na samotnou biologickou podstatu fungování buňky. V různém stupni klinického zkoušení se nacházejí specifické inhibitory tyrosinových kináz, například masitinib. Ty relativně cíleně blokují kinázy s převahou především v signálních drahách aktivovaných T lymfocytů. Jedná se tedy zřetelně o imunomodulační přípravek. Zda je spojen s imunosupresivními dopady, rozhodne delší klinická zkušenost [11].
Nejúčinnějšími léky, jež jsou v současné době k dispozici pro léčbu imunopatologických onemocnění a také některých typů nádorů, jsou tzv. biologika. V našem přehledu se zaměříme pouze na biologickou terapii RS, která je zprostředkována monoklonálními protilátkami. Ty cílí na různé funkčně významné struktury poškozujícího zánětu a jejich neutralizací nebo jeho ovlivněním jej tlumí. Z tohoto pohledu bychom je tedy mohli považovat rovněž za látky imunomodulační. S ohledem na mimořádnou účinnost jejich působení zde však hrozí neoddělitelné riziko, že zasáhnou i do funkcí obranného zánětu, a budou se tedy chovat jako imunosupresiva. Že tomu tak skutečně je, ukazují dlouholeté zkušenosti s aplikací biologické léčby v jiných indikacích. Je obtížné monoklonální protilátky, které jsou schváleny pro léčbu RS, třídit s ohledem na nežádoucí ovlivnění imunity. Do velké míry jsou si podobné. Léčba daclizumabem, monoklonální protilátkou reagující s podjednotkou α receptoru pro IL 2 (CD25), je dlouhodobě využívána především v transplantační medicíně. Je spojena se zvýšeným rizikem vzniku autoimunitních onemocnění, např. autoimunitní hepatitidy nebo kolitidy. Zvyšuje i riziko vzniku malignit. Natalizumab, monoklonální protilátka proti VLA 4, blokuje neselektivně buňky exprimující tuto adhezní molekulu, jež zahrnují i efektorové paměťové autoreaktivní T lymfocyty. Zabrání tak jejich vstupu do mozku přes hematoencefalickou bariéru. Natalizumab je pro svůj mimořádný potenciál používán k léčbě nejzávažnějších forem RS. Zablokování vstupu imunocytů je však natolik účinné, že zvyšuje riziko ztráty kontroly nad endogenními infekčními agens, především virem JC. Důsledkem může být progresivní multifokální leukoencefalopatie. Velmi účinný lék alemtuzumab, který je používán v léčbě lymfoproliferací, vede doslova k „resetu“ imunity pacientů s RS. Je spojen s dosažením kvalitní a dlouhodobé remise. Cenou za to však je poměrně vysoké riziko nezvládnutí obranného zánětu. Ještě větší hrozbu představuje možnost rozvoje autoimunitních trombocytopenií a malignit, například melanomu nebo B buněčného non Hodgkinova lymfomu (B NHL).
Zatím omezené zkušenosti máme s imunosupresivními důsledky léčby monoklonálními protilát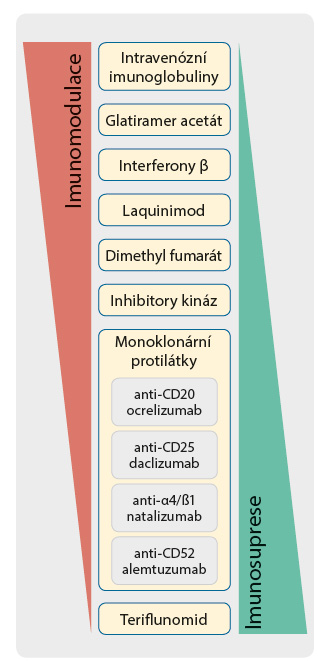 kami proti CD20 exprimovanými na B lymfocytech. Kromě klasické monoklonální protilátky rituximabu jsou v procesu schvalování i další anti-CD20 protilátky, například ocrelizumab. Na základě zkušeností v hematoonkologické indikaci, kde jsou již používány mnoho let u velkého počtu nemocných, existuje zde riziko možnosti reaktivace latentních infekcí, především virových, a riziko obecného snížení obranyschopnosti proti infekčním agens. Opět budeme muset počkat, až získáme dostatečné klinické zkušenosti, a hlavně až budou k dispozici výsledky dlouhodobého sledování nežádoucích účinků terapie anti-CD20 v léčbě RS. Jednoznačně imunosupresivní pól této škály představuje teriflunomid. Ten svoje účinky na poškozující zánět u nemocných s RS uskutečňuje zásahem do replikace nukleových kyselin. Hrozí zde riziko negativního ovlivnění kapacity kostní dřeně jako jediného zdroje imunitních buněk a podobně jako u cytostatik vyšší riziko možnosti maligní transformace buněk (obr. 2).
kami proti CD20 exprimovanými na B lymfocytech. Kromě klasické monoklonální protilátky rituximabu jsou v procesu schvalování i další anti-CD20 protilátky, například ocrelizumab. Na základě zkušeností v hematoonkologické indikaci, kde jsou již používány mnoho let u velkého počtu nemocných, existuje zde riziko možnosti reaktivace latentních infekcí, především virových, a riziko obecného snížení obranyschopnosti proti infekčním agens. Opět budeme muset počkat, až získáme dostatečné klinické zkušenosti, a hlavně až budou k dispozici výsledky dlouhodobého sledování nežádoucích účinků terapie anti-CD20 v léčbě RS. Jednoznačně imunosupresivní pól této škály představuje teriflunomid. Ten svoje účinky na poškozující zánět u nemocných s RS uskutečňuje zásahem do replikace nukleových kyselin. Hrozí zde riziko negativního ovlivnění kapacity kostní dřeně jako jediného zdroje imunitních buněk a podobně jako u cytostatik vyšší riziko možnosti maligní transformace buněk (obr. 2).
Závěr
Pro nemocné s RS je nepochybně obrovským přínosem, že díky hlubokému poznání patofyziologie procesů vedoucích ke vzniku RS máme k dispozici již několik účinných léků. To však klade zvýšené nároky na diagnostické algoritmy, na stratifikaci nemocných s ohledem na další průběh jejich onemocnění, aby léčba každého nemocného s RS byla individualizována a optimalizována. Výsledkem by měl být zřetelný léčebný prospěch s minimalizací bezprostředních a především dlouhodobých nežádoucích účinků terapie [12].
Seznam použité literatury
- [1] Rangachari M, Kuchroo VK. Using EAE to better understand principles of immune function and autoimmune pathology. J Autoimmun 2013; 45: 31–39.
- [2] Lassman H, van Horssen J. The molecular basis of neurodegeneration in multiple sclerosis. FEBS Lett 2011; 585: 3715–3723.
- [3] Ransohoff RM, Brown MA. Innate immunity in the central nervous system. J Clin Invest 2012; 122: 1164–1171.
- [4] Michell‑Robinson MA, Touil H, Healy LM, et al. Roles of microglia in brain development, tissue maintenance and repair. Brain 2015; 138(Pt5): 1138–1159.
- [5] Buzzard KA, Broadley SA, Butzkueven H. What do effective treatments for multiple sclerosis tell us about the molecular mechanisms involved in pathogenesis? Int J Mol Sci 2012; 13:
- [6] Radick L, Mehr SR. The latest innovations in the drug pipeline for multiple sclerosis. Am Health Drug Benefits 2015; 8: 448–453.
- [7] Lünemann JD, Nimmerjahn F, Dalakas MC. Intravenous immunoglobulin in neurology‑mode of action and clinical efficacy. Nat Rev Neurol 2015; 11: 80–89.
- [8] Towfic F, Funt JM, Fowler KD, et al. Comparing the biological impact of glatiramer acetate with the biological impact of a generic. PLoS One 2014; 9(1): e83757.
- [9] Thöne J, Linker RA. Laquinimod in the treatment of multiple sclerosis: a review of the data so far. Drug Des Devel Ther 2016; 10: 1111–1118.
- [10] Hunter SF, Bowen JD, Reder AT. The direct effects of fingolimod in the central nervous system: implications for relapsing multiple sclerosis. SNS Drugs 2016; 30: 135–147.
- [11] Al‑Jaderi Z, Maghazachi AA. Utilization of dimethyl fumarate and related molecules for treatment of multiple sclerosis, cancer, and other diseases. Front Immunol 2016; 7: 278.
- [12] Havrdová E, a kol. Roztroušená skleróza. Praha: Mladá fronta, 2013.