Metabolický syndrom a hypertenze
Metabolický syndrom se vyskytuje v naší populaci ve znepokojivě vysokém podílu, zvláště uvážíme-li závažná rizika kardiovaskulární a cerebrovaskulární morbidity a mortality. Přitom jeho výskyt dále až epidemicky narůstá, a to i v mladších věkových skupinách. Jde tu sice o poruchu s genetickým základem, její vznik a rozvoj je však výrazným způsobem modifikován životním stylem a existují zde i možnosti farmakologického zásahu. Musíme se proto zaměřit na zavedení agresivních preventivních režimových opatření, resp. při již vyvinutých projevech – rizikových faktorech pro vývoj kardiovaskulárních onemocnění – tyto projevy adekvátním způsobem ošetřit farmakologicky. Jedním z častých projevů metabolického syndromu je hypertenze, resp. zvýšený normální krevní tlak. V současnosti jsou k dispozici komplexní doporučení pro její diagnostiku a léčbu, jejíž výběr je třeba pouze přizpůsobit patofyziologickým aspektům metabolického syndromu a případným přidruženým onemocněním konkrétního pacienta.
Úvod
Metabolický syndrom (MS) se stává celosvětově a zejména ve vyspělých zemích jedním z hlavních a stále významnějších zdravotních problémů. Je to dáno jeho narůstajícím zastoupením v populaci v souvislosti s prodlužujícím se věkem a nevhodnou životosprávou (stres, přejídání, nedostatek pohybu, kouření) a jeho prokázaným výrazně negativním vztahem k rozvoji aterosklerózy a ke kardiovaskulární a cerebrovaskulární mortalitě a morbiditě.
Odhaduje se, že ve vyspělých zemích je tímto syndromem postiženo asi 25–40 % bílé populace [1], existují však i populace s vyšším výskytem (např. u Palestinců až 70 %). Podle české epidemiologické studie MONIKA provedené u naší populace ve věku 25–64 let [2] se MS vyskytuje u 24,4 % žen a u 32 % mužů.
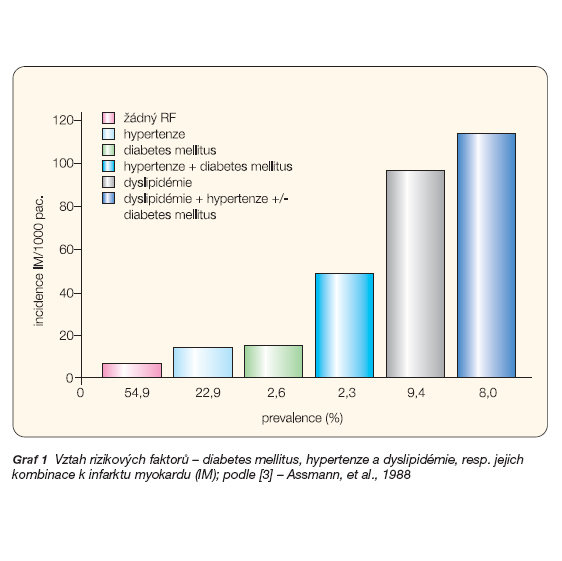
Bylo prokázáno, že postižení MS mají minimálně 2–3krát vyšší úmrtnost na kardiovaskulární onemocnění, tj. především na ischemickou chorobu srdeční nebo cévní mozkovou příhodu (graf 1 [3] ilustrativně uvádí vztah rizikových faktorů – diabetes mellitus, hypertenze a dyslipidémie, resp. jejich kombinace k infarktu myokardu). Přitom jsou známy způsoby účinné prevence vzniku MS a léčby a prevence jeho následků, které by tak mohly představovat významný zdravotní přínos.
Vztah mezi hypertenzí a metabolickým syndromem
Již dříve byla pozorována souvislost mezi hypertenzí a diabetes mellitus 2. typu, který bychom si mohli zjednodušeně představit jako stav akcelerované inzulinové rezis-tence. Manifestaci diabetes mellitus 2. typu (DM2) hypertenze většinou předchází, a to obvykle o několik let [4]. Z dalších epi- demiologických studií vyplynulo, že hypertenze se u diabetiků vyskytuje asi v 50 % [5], což je 2krát častěji než u nediabetiků [6]. Společný výskyt arteriální hypertenze s DM2 přitom prohlubuje kardiovaskulární mortalitu vůči „zdravé" populaci až 6krát [7]. Vyšší výskyt hypertenze je také u osob s nadváhou či obezitou bez projevů DM2 či poruchy glukózové tolerance [8, 9].
Byly také nalezeny společné patogenetické mechanismy současného, resp. vzájemného rozvoje inzulinové rezistence (při metabolickém syndromu), arteriální hypertenze a DM 2. typu. Předpokládá se společný dědičný podklad – determinace – polygenního typu. Studovány jsou tzv. kandidátní geny, např. polymorfismy v genech pro glykogenovou syntetázu, pro receptor angiotenzinu II, pro receptory PPAR (per-oxisome proliferator activated receptor) [10, 11]. Úlohu v rozvoji arteriální hypertenze při inzulinové rezistenci (IR) také hraje retence sodíku v organismu, která je prohlubována hyperinzulinémií, zvýšenou sympatoadrenální aktivitou a zintenzivněním Na+/Glu-kotransportu v ledvinných tubulech [12]. Nespornou zátěž z hlediska rozvoje hypertenze a akcelerace procesů aterogeneze hraje i případná nekompenzovaná glykémie včetně postprandiální hyperglykémie a hyperinzulinémie. Známým mechanismem je například inzulinem stimulovaná proliferace buněk hladké svaloviny arteriální stěny. Popsáno je také narušení vazodilatačně-vazokonstrikčních mechanismů zprostředkovaných oxidem dusnatým (NO) na úrovni arterií a kapilár při IR.
Nejvíce pozornosti je však dnes v rámci hypertenze u metabolického syndromu věnováno úloze renin-angiotenzinového systému, úloze zvýšené aktivity sympatického nervového systému a úloze již zmíněných PPAR-receptorů. Obézní jedinci mají často zvýšený minutový srdeční výdej, celkový a intravaskulární volum. Snížení hmotnosti vede současně k poklesu krevního tlaku a k normalizaci těchto hemodynamických odchylek. U obezity nacházíme i (neuro)humorální změny, z nichž každá sama o sobě může vést ke vzniku hypertenze. Zásadní je zvýšení aktivity sympatického nervového systému, které může být způsobeno jak hyperinzulinémií, tak i zvýšeným přívodem kalorií. Dalším faktorem přispívajícím ke zvýšení krevního tlaku je např. zvýšení hladin leptinu, hormonu uvolňovaného tukovou tkání.
Inzulinová rezistence a zvýšená sympatoadrenální aktivita
Sympatický nervový systém (SNS) a jeho zvýšená aktivita se podílí na vzniku a rozvoji hypertenze (a také poruch sacharidového a lipidového metabolismu) velmi významně. V mladém a středním věku je dokonce považován za hlavní příčinu vzniku a rozvoje hypertenze a kardiovaskulárních onemocnění obecně [13]. Je přitom pozorován vzájemný vztah mezi zvýšenou aktivitou SNS a IR. Z hlediska vzájemné kauzality těchto dvou poruch existují dvě hypotézy, z obou vyplývá vzájemné podmínění vytvářející bludný kruh.
Dle hypotézy Reavena a kol. [14] je na počátku IR podmíněna různými zevními vlivy ve spojitosti s polygenní genetickou zátěží. IR, tj. snížená schopnost tkání (především kosterního svalstva, tukové tkáně a jater) využívat inzulin k promptnímu vychytávání volné glukózy a k jejímu zpracování na zásobní glykogen, vede k rozvoji kompenzatorní hyperinzulinémie. Tato hyper-inzulinémie však zprostředkovává i další – tentokrát již nežádoucí – procesy vedoucí k aterogenní dyslipidémii a k hypertenzi. V rozvoji hypertenze hraje hlavní úlohu inzulinovou rezistencí (při hyperinzulinémii) zprostředkované zvýšení aktivity SNS [15]. Jde o to, že při IR nedochází během lačnění k fyziologickému snižování aktivity centrálního sympatiku (s následnou inhibicí sympatiku periferního) a během jídla se při IR vzhledem k postprandiální hyperglykémii aktivita centrálního sympatiku oproti normálu ještě stupňuje.
Dle hypotézy Julia a kol. [16] je na počátku zvýšená aktivita SNS podmíněna multifaktoriálně stresovými faktory při genetické zátěži. Ta je hlavním akcelerátorem vyššího krevního tlaku, který alteruje mikrocirkulaci a zvyšuje rezistenci (zde zejména v kosterních svalech a tukové tkáni) s následným negativním ovlivněním metabolismu glukózy a účinku inzulinu. Následkem je IR a kompenzatorní hyperinzulinémie. Na této IR a hyperinzulinémii se navíc podílí zvýšená aktivita centrálního sympatiku cestou zpětnovazebného snížení aktivity dřeně nadledvin, resp. hormonu adrenalinu.
Doplňujeme ještě hypotézu Landsbergovu a kol. [17] vysvětlující vztah zvýšené aktivity SNS a IR k rozvoji obezity. IR s hyper- inzulinémií dle těchto autorů směřuje k udržování energetické rovnováhy při příjmu potravy a k prevenci obezity. Stimulace SNS je zde žádoucí, protože zapíná termogenezi, tj. přeměnu přebytků přijaté energie na teplo, čímž brání nežádoucímu ukládání energie ve formě tukových buněk. Současně se stimulací SNS však vzniká a rozvíjí se arteriální hypertenze a další poruchy. Kapacita pro kompenzatorní termogenezi je přitom jen velmi malá, takže vzniku obezity se takto organismus dokáže bránit jen po omezenou dobu.
Inzulinová rezistence a alterace renin-angiotenzinového systému
Dlouhodobá aktivace renin-angiotenzinového systému (RAS), která souvisí do značné míry s výše popsanou zvýšenou aktivitou SNS (bludný kruh vzájemné stimulace), hraje také významnou úlohu v rozvoji hypertenze a v rozvoji nežádoucích orgánových změn a komplikací makrovas-kulárního i mikrovaskulárního typu. Tento poznatek má značný praktický význam a částečně vysvětluje velmi příznivý efekt inhibitorů angiotenzin konvertujícího enzymu (inhibitory ACE), resp. blokátorů AT1-re- ceptoru pro angiotenzin II (blokátory AT1) při léčbě hypertenze u diabetiků a u pa-cientů s MS. Tento příznivý metabolický efekt inhibitorů ACE, resp. blokátorů AT1 lze vysvětlit například zlepšeným prokrvením kosterního svalstva (zvýšená utilizace glukózy) a b-buněk pankreatu (zvýšené vyplavování inzulinu) při snížené vaskulární rezistenci [18] a příznivým ovlivněním fibrinolýzy – především inhibitoru aktivátoru plazminogenu 1 (PAI-1) a von Willebrandova faktoru [19]. Dalším mechanismem je exprese některých klíčových enzymů prostřednictvím ovlivnění tzv. PPAR-receptorů. Tyto receptory hrají důležitou roli v metabolismu lipidů a glukózy, v daném případě zejména na úrovni kosterního svalstva [20].
Inzulinová rezistence a PPAR-receptory
Tzv. PPAR-receptory (peroxisome proliferator activated receptors – receptory aktivované proliferátory peroxizomů) jsou skupinou nukleárních receptorů, jejichž aktiva- ce vede k expresi určitých genů (např. regulačního proteinu ABC-A1, glukózového transportního proteinu 4 – GLUT4), které hrají důležitou úlohu v metabolismu lipidů, v diferenciaci adipocytů a v metabolismu glukózy a inzulinu [11]. Rozlišujeme zejména typ PPAR-a, který se nachází především v játrech, kosterním svalstvu, ledvinách a myokardu a podílí se zejména na metabolismu lipidů [21], a typ PPAR-g, který se nachází především ve střevech a tukové tkáni a kromě metabolismu lipidů se podílí významnou měrou na regulaci metabolismu glukózy [22]. Oba typy se nacházejí také v monocytech, makrofázích, endotelových buňkách a buňkách hladké svaloviny cév [23]. Mutace PPAR-receptorů bývá spojena s obezitou. Zvýšená fosforylace PPAR (navozená např. hyperinzulinémií) vede k nižší inzulinové senzitivitě. Naopak defosforylace navozená stimulací PPAR-receptorů některými endogenními faktory (mastné kyseliny a jejich deriváty), ale i některými léky zvyšuje citlivost tkání pro inzulin. K agonistům PPAR patří například fibráty (agonisté PPAR-a) [24], statiny (agonisté PPAR-a) [25] či thiazolidindiony (agonisté PPAR-g – odtud také název „inzulinové senzitizéry") [26]. Agonistou PPAR-g je také osvědčené antihypertenzivum telmisartan – otázkou je možný „class efect" celé skupiny blokátorů AT1 [20].
Diagnostika hypertenze v rámci metabolického syndromu
V souvislosti s metabolickým syndromem se za rizikový faktor, resp. diagnostické kritérium spadající pod tuto diagnózu považuje již tzv. vysoký normální krevní tlak, tj. 130–139/85–89 mmHg.
Při této „normální" kategorii krevního tlaku v rámci metabolického syndromu – i pokud nebudou přítomna přidružená onemocnění (jako ischemická choroba srdeční, prodělaná ischemická cévní mozková příhoda, chronické renální onemocnění, proteinurie > 300 mg/24 hod. při dvou po sobě jdoucích kontrolách nebo diabetes mellitus) a nebudou přítomny známky poškození cílových orgánů, můžeme s velkou pravděpodobností očekávat kumulaci dalších rizikových faktorů zvyšujících celkové kardiovaskulární riziko na hladinu ≥ 5 % v nejbližších 10 letech, tj. na hladinu tzv. vysokého kardiovaskulárního rizika. Riziko úmrtí na kardiovaskulární onemocnění je u těchto osob v následujících 10 letech (nebo po extrapolaci na věk 60 let do jejich 70. roku života) ≥ než 5 %. Pro klinickou praxi lze v konkrétnosti doporučit nedávno vypracovaný model hodnocení kardiovaskulárního rizika využívající tabulky rizika SCORE [27].
Algoritmus postupu při měření krevního tlaku a stanovení diagnózy hypertenze, resp. směr následného diagnostického (a terapeutického) postupu najdeme v Doporučeních České společnosti pro hypertenzi [28], resp. v nedávno zveřejněných Společných doporučeních českých odborných společností pro prevenci kardiovaskulárních onemocnění v dospělém věku [29].
Měření krevního tlaku se provádí nejlépe konvenčním rtuťovým tonometrem s při- měřeně dlouhou a širokou manžetou u se-dícího pacienta po 10minutovém zklidnění na paži, resp. na obou pažích, s volně podloženým předloktím ve výši srdce. Po odečtu iniciálních hodnot krevního tlaku v ordinaci se stanoví absolutní kardiovas-kulární riziko za použití nomogramů SCORE extrapolovaných na české podmínky a na základě těchto dvou hodnot se určí v souladu s výše uvedenými doporučeními další diagnostický a terapeutický postup.
Pravidelné klinické kontroly tlaku krevního provádíme:
– ‑u stabilizovaných hypertoniků či rizikových osob s normálním vysokým krevním tlakem – stačí jednou za 3 měsíce;
– ‑u komplikovaných nebo nevyrovnaných stavů, na počátku léčby či při změně antihypertenziva kontrolujeme nemocné častěji, např. jednou za 2–4 týdny;
– ‑u hypertoniků s nízkým celkovým kardio-vaskulárním rizikem, u nichž postačuje ke kontrole TK monoterapie, naopak vystačíme s intervalem mezi kontrolami delším, např. jedenkrát za 6 měsíců;
– ‑u osob s vysokým normálním krevním tlakem bez vysokého kardiovaskulárního rizika stačí kontrolovat krevní tlak jednou ročně;
– ‑u normotoniků stačí kontroly až jednou za dva roky.
Léčba hypertenze v rámci metabolického syndromu
Léčba nefarmakologická
Základní režimová opatření zůstávají hlavním předpokladem úspěšné prevence kardiovaskulárních onemocnění v rámci metabolického syndromu spojeného s hypertenzí.
Patří sem především:
– ‑pravidelná životospráva s respektováním cirkadiánního rytmu a prevence psychického stresu;
– ‑racionální, vyvážená a pravidelná střídmá strava – kontrola energetického příjmu, prevence příjmu živočišných tuků a restrikce příjmu solí;
– ‑dostatečná pohybová aktivita, resp. její zvýšení;
– ‑prevence abúzu alkoholu;
– ‑důsledné vystříhání se či zanechání kouření.
Léčba farmakologická
K léčbě rozvinutého MS (před manifestací DM2) obecně přistupujeme tak, že léčíme již vyvinuté rizikové faktory, pře-devším hypertenzi, dyslipidémii a obezitu. Volíme takové léky, o kterých je podle medicíny založené na důkazech známo, že snižují kardiovaskulární a cerbrovaskulární riziko a brání vzniku a rozvoji diabetes mellitus – to vše s požadavkem na minimální nežádoucí účinky.
V souladu se Společnými doporučeními českých odborných společností pro prevenci kardiovaskulárních onemocnění v dospělém věku [27] je indikována farmakologická antihypertenzní léčba obvyk-le již při hladině tzv. vysokého normálního krevního tlaku, tj. dosáhne-li krevní tlak výše 130–139/85–89 mmHg. Je to dáno nakupením rizikových faktorů zvyšujících celkové kardiovaskulární riziko na vysokou hladinu významnosti tj. ≥ 5 % v nejbližších 10 letech, které je tak typické pro metabolický syndrom. V případech, kdy absolutní kardiovaskulární riziko posoudíme jako menší, zahajujeme farmakologickou antihypertenzní léčbu až podle výsledku za-vedených režimových opatření, a to od opakovaně zvýšené hladiny krevního tlaku 140/90 mmHg a výše nebo ji zahajujeme okamžitě při zjištění vysokého stupně hypertenze, tj. 180/110 mmHg a více.
Cílové hodnoty krevního tlaku při antihypertenzní léčbě v rámci metabolického syndromu jsou stanoveny obecně na dosažení hladiny < 130/80 mmHg, tj. stejně jako např. pacientům s manifestním diabetes mellitus 2. typu nebo obecně pacientům s celkovým kardiovaskulárním rizikem vysokého stupně. Pacienti by měli být poučeni o nutnosti dosažení těchto cílových hodnot krevního tlaku a vedeni k pravidelným domácím kontrolám krevního tlaku.
Volba antihypertenziva u pacienta s metabolickým syndromem
V této stati se pokusíme navázat na výše uvedené patogenetické předpoklady vzniku a rozvoje metabolického syndro-mu, resp. inzulinové rezistence ve vztahu k hypertenzi. V další řadě pak přihlédneme k empiricky známému vztahu jednotlivých typů antihypertenziv k metabolismu zejména sacharidů.
1. Inzulinová rezistence a zvýšená sympatoadrenální aktivita
Rozhodující patogenetický podíl zvýšené sympatoadrenální aktivity lze předpokládat zvláště u osob mladšího a středního věku. Jako nejvhodnější typy antihypertenziv se zde jeví ty látky, které mají prokázán centrální účinek na snížení aktivity SAS. Nejpotentnější v tomto smyslu jsou látky ze skupiny b-blokátorů, centrální účinek na SAS však vykazují také inhibitory ACE, blokátory AT1, blokátory kalciových kanálů non-dihydropyridinového typu (verapamil) a I1-imidazolinoví agonisté. U jednotlivých látek z těchto skupin musíme nejprve zvážit, zda dobře pronikají do centrální nervové soustavy – předpokladem je jejich lipofilita.
2. Inzulinová rezistence a alterace renin-angiotenzinového systému (RAS), resp. inzulinová rezistence a PPAR-receptory
Propojení inzulinové rezistence s patologicky zvýšenou aktivitou RAS vysvětluje velmi příznivý efekt inhibitorů ACE, resp. blokátorů AT1 při léčbě hypertenze u diabetiků a u pacientů s MS. Velmi zajímavá je skupina látek ovlivňujících inzulinovou senzitivitu prostřednictvím receptorů PPAR-g, kde je popisován zejména efekt blokátoru AT1 telmisartanu.
3. Vlastnosti antihypertenziv ve vztahu k metabolismu sacharidů
V současné době je dobře empiricky znám dopad určitých typů antihypertenziv na metabolismus sacharidů, resp. lipidů a jejich vztah k metabolické kontrole při manifestním diabetes mellitus 2. typu. Z tohoto hlediska se jako nejlepší jeví inhibitory ACE [30–32], blokátory AT1 [33] a I1-imidazolinoví agonisté [34], kteří zlepšují inzulinovou senzitivitu. V druhé řadě jsou to blokátory kalciových kanálů zejména dihydropyridinového typu [31, 35], které jsou metabolicky neutrální. Metabolicky nepříznivé je naopak působení b-blokátorů [36] a diuretik, zejména thiazidových. Je-li jejich použití, např. pro určitá přidružená onemocnění, přesto žádoucí, je vhodné volit b-blokátory ze skupiny kardioselektivních nebo ze skupiny s ISA aktivitou, které zasahují do metabolismu sacharidů a lipidů méně. Diuretika je pak vhodné volit nejvýše do kombinace v malých dávkách zejména z kalium šetřících látek nebo metabolicky zřejmě neutrálního indapamido-vého typu. V případě b-blokátorů kardioselektivního typu je třeba dodat, že zejména pro pacienty s ischemickou chorobou srdeční jejich kardioprotektivní účinek bude nad nežádoucím metabolickým potenciálem většinou převažovat.
4. Antihypertenziva a oddálení výskytu manifestního diabetes mellitus 2. typu
Existují data, která prokazují, že vhodným výběrem antihypertenzní terapie lze rozvoj inzulinové rezistence do manifestního diabetes mellitus oddálit. Korelují v podstatě s výše uvedeným schématem, tj. setkáme se s nimi u látek z těchto skupin:
1. inhibitory ACE
– ‑studie CAPP (captopril), Captopril Prevention Project – skupina hypertoniků léčená captoprilem vs skupiny léčené konvenčně (b-blokátorem, diuretiky) měla incidenci nově zjištěného diabetu nižší o 22 % [30];
– ‑studie HOPE (ramipril) The Heart Outcomes Prevention Evaluation Study – skupina pacientů s vysokým KV rizikem léčená ramiprilem 10 mg vs skupina na placebu měla incidenci nově zjištěného diabetes mellitus nižší až o 34 % [32];
– ‑studie INVEST (trandolapril) International Verapamil SR-Trandolapril Study – skupina pacientů s prokázanou ischemickou chorobou srdeční a hypertenzí léčená trandolaprilem v kombinaci s verapamilem vs skupina léčená konvenčně (b-blokátorem, diuretiky) měla incidenci nově zjištěného diabetes mellitus nižší o asi 15 % [31];
– ‑studie ASCOT (perindopril) Anglo-Scandinavian Cardiac Outcomes Trial and the Heart Protection Study – skupina hypertoniků s dalšími minimálně třemi rizikovými kardiovaskulárními faktory léčená amlodipinem v kombinaci s perindoprilem vs skupina léčená konvenčně (atenolol a diuretikum) měla incidenci nově zjištěného diabetes mellitus nižší o 30 % tj. ≥ 5 % v nejbližších 10 letech [37];
2. blokátory AT1
– ‑studie LIFE (losartan) Losartan Intervention For Endpoint reduction in hypertension study – skupina pacientů s hypertenzí a hypertrofií levé komory srdeční léčená losartanem vs skupina léčená konvenčně (atenololem) měla incidenci nově zjištěného diabetes mellitus nižší o 25 % [33];
– ‑studie VALUE (valsartan) Valsartan Antihypertensive Long-term Use Evaluation – skupina hypertoniků s vysokým kardiovaskulárním rizikem léčená valsartanem vs skupina léčená amlodipinem měla inciden-ci nově zjištěného diabetes mellitus nižší o 22 % [38];
3. blokátory kalciových kanálů zejména verapamilového typu
– ‑studie INVEST (verapamil) International Verapamil SR-Trandolapril Study – skupina pacientů s prokázanou ischemickou cho-robou srdeční a hypertenzí léčená trandolaprilem v kombinaci s verapamilem vs skupina léčená konvenčně (b-blokátorem, diuretiky) měla incidenci nově zjištěného diabetes mellitus nižší asi o 15 % [31];
– ‑studie ASCOT (amlodipin) Anglo-Scandinavian Cardiac Outcomes Trial and the Heart Protection Study – skupina hypertoniků s dalšími minimálně třemi rizikovými kardiovaskulárními faktory léčená amlodipinem v kombinaci s perindoprilem vs skupina léčená konvenčně (atenolol a diuretikum) měla incidenci nově zjištěného diabetes mellitus nižší o 30 % [37].
Čeká se na výsledky dalších nejméně čtyř velkých klinických studií zkoumajících mj. vliv na metabolickou kontrolu. Jedná se o studie:
– ‑TRANSCEND (telmisartan) Telmisartan Randomized Assessment Study in aCE iNtolerant subjects with cardiovascular Disease;
– ‑ONTARGET (telmisartan, ramipril) Ongoing Telmisartan Alone and in Combination with Ramipril Global Endpoint Trial;
– ‑DREAM (ramipril) Diabetes Reduction Assessment of ramipril and rosiglitazone Mediacation;
– ‑NAVIGATOR (valsartan) Nateglinide and Valsartan in Impaired Glucose Tolerance Outcomes Research.
Shrnutí zásad ve farmakoterapii
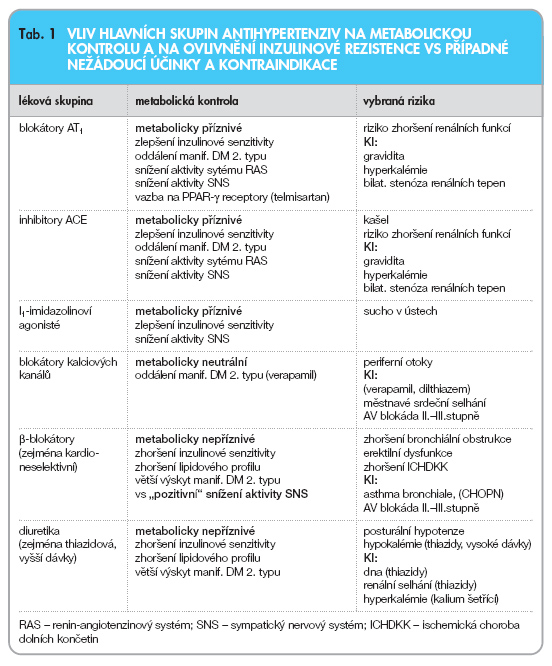
Celkový přehled o vlivu jednotlivých nejpoužívanějších skupin antihypertenziv na metabolickou kontrolu a na ovlivnění inzulinové rezistence vs některá eventuální rizika shrnuje tab. 1.
Jako vhodné skupiny pro první volbu při léčbě hypertenze u metabolického syndromu doporučujeme léčiva ovlivňující RAS (blokátory AT1, inhibitory ACE) a dále léčiva metabolicky neutrální (blokátory kalciových kanálů a I1-imidazolinové agonisty). Vzhledem k obtížnosti dosažení cílových hodnot krevního tlaku je třeba maximálně využívat kombinační terapii, kde základem mají být zmíněné blokátory AT1 nebo inhibitory ACE. Vždy je však vhodné zvážit zahájení léčby b-blokátory zvláště u mladších pacientů bez výrazné metabolické zátěže nebo u pacientů s již manifestním kardiovaskulárním onemocněním.
Seznam použité literatury
- [1] Kereiakes DJ, Willerson JT. Metabolic syndrome epidemic. Circulation 2003; 108: 1552–1553.
- [2] Pelikánová T. Metabolický syndrom. Vnitř Lék 2003; 49: 900–906.
- [3] Assmann G, Schulte H. The Prospective Cardio-vascular Munster (PROCAM) study: prevalence of hyperlipidemia in persons with hypertension and/or diabetes mellitus and the relationship to coronary heart disease. Am Heart J 1988; 116: 1713–1724.
- [4] Modan M, Halkin H, Almog S, et al. Hyperinsulinemia: a link between hypertension, obesity and glucose intolerance. J Clin Invest 1985; 75: 809–817.
- [5] Češka R. Metabolický syndrom, HDL cholesterol, diabetická dyslipidémie a kardiovaskulární riziko. Souč Klin Pr 2002; 1: 5–14.
- [6] Osler JR, Meterson BJ, Epstein M. Diabetes mellitus and hypertension. Cardiovasc Risk Factors 1990; 1: 25–46.
- [7] Morrish NJ, Stevens LK, Head J, et al. A prospective study on mortality among middle-aged diabetic patients II (the London Cohort of the WHO Multinational Study of Vascular Disease in Diabetics): Associated risk factors. Diabetologia 1990; 33: 542–548.
- [8] Wilson PW, D´Agostino RB, Sullivan L et al. Overweight and obesity as deterninants of cardiovascular risk: the Framingham experience. Arch Intern Med 2002; 162: 1867–1872.
- [9] Wilson PW, Kannel WB, Silbershatz H, et al. Clustering of metabolic factors and coronary heart disease. Arch Intern Med 1999; 159: 1104–1109.
- [10] Hamman RF. Genetic and environmental determinants of non-insulin-dependent diabetes mellitus. Diabetes Metab Rev 1992; 8: 287–388.
- [11] Neve B, Fruchart JC, Staels B. Role of the per-oxisome proliferator-activated receptors (PPAR) in atherosclerosis. Biochem Pharmacol 2000; 60: 1245–1250.
- [12] Souček M, Kára T, et al. Klinická patofyziologie hypertenze: genetické pozadí a další obecné mechanismy vzniku hypertenze a diabetes mellitus. Praha, Grada Publishing, 2002.
- [13] Souček M, Kára T, et al. Klinická patofyziologie hypertenze: význam ANS v časných stádiích hypertenze. Praha, Grada Publishing, 2002.
- [14] Reaven GM. Role of insulin resistance in human disease. Diabetes 1988; 37: 1595–1607.
- [15] Reaven GM, Lithell L, Landsberg L. Hypertension and associated metabolic abnormalities – the role of insulin resistance and the symathoadrenal system. A Engl J Med 1996; 334: 374–381.
- [16] Julius S. Current trends in the treatment of hypertension. Amer J Hypertens 1997; 10: 300–305.
- [17] Landsberg L. Diet, obesity, and hypertension: An hypothesis involving insulin, the sympathetic nervous system and adaptive thermogenesis. Q J Med 1986; 61: 1081–1090.
- [18] Karin AM, Jandeleit-Dahm, Christos T, et al. Why blockade of the renin-angiotensin system reduces the incidence of new-oncet diabetes. J Hypert 2005; 23: 463–473.
- [19] Bertrand ME. Provision of cardiovascular protection by ACE inhibitors: a review of recent trials. Cur Med Res 2004; 20: 1559–1569.
- [20] Jacob S, Henriksen EJ, Fogt DL, et al. Effects of trandolapril and verapamil on glucose transport in insulin resistant skeletal muscle. Metabolism 1996; 45: 535–541.
- [21] Fruchart JC, Duriez P, Staels B. Peroxisome proliferator-activated receptor-alpha activators regulate genes governing lipoprotein metabolism, vascular inflammation, and atherosclerosis. Curr Opin Lipidol 1999; 10: 245–257.
- [22] Berger J, Leibowitz MD, Doebber TW, et al. Novel peroxisome proliferator-activated receptor- (PPAR-) and PPAR- ligands produce distinct biological effects. J Biol Chem 1999; 274: 6718–6725.
- [23] Chinetti G, Lestabel S, Bocher V, et al. PPAR-alfa and PPAR- activators induce cholesterol removal from human macrophage foam cells through stimulation of the ABC-A1 pathway. Nat Med 2001; 7: 53–58.
- [24] Staels B, Dallongeville J, Auwerx J, et al. Mechanism of action of fibrates on lipid and lipoprotein metabolism. Circulation 1998; 98: 1088–2093.
- [25] Martin G, Duez H, Blanquart C, et al. Statin-induced inhibition of the Rho-signaling pathway activates PPAR- and induces HDL apoA-I. J Clin Invest 2001; 107: 1423–1432.
- [26] Spiegelman BM. PPAR-: adipogenic regulator and thiazolidinedione receptor. Diabetes 1998; 47: 507–514.
- [27] Conroy RM, Pyorala K, Fitzgerald AP, et al. Estimation of ten-risk of fatal cardiovascular disease in Europe: the SCORE Project. Eur Heart J 2003; 11: 987–1003.
- [28] Cífková R, Horký K, Widimský J st, et al. Doporučení diagnostických a léčebných postupů u arteriální hypertenze – verze 2004. Doporučení České společnosti pro hypertenzi. Vnitř Lék 2004; 50: 709–722.
- [29] Prevence kardiovaskulárních onemocnění v dospě-lém věku – Společné doporučení českých odborných společností. Vnitř Lék 2005; 51: 3–15.
- [30] Hansson L, Lindholm LH, Niskanen L, et al. Effect of angiotensin-converting enzyme inhibition compared with conventional therapy on cardiovascular morbidity and mortality in hypertension: Captopril Prevention Project (CAPP) randomised trial. Lancet 1999; 353: 611–616.
- [31] Pepine CJ, Handberg EM, Cooper DeHoff RM, et al. A calcium antagonist vs a non-calcium antagonist hypertension treatment strategy for patients with coronary artery disease. INVEST Study. JAMA 2003; 290: 2805–2816.
- [32] The Heart Outcomes Prevention Evaluation (HOPE) Study Investigators: Effects of an angiotensin-converting-enzyme inhibitor Ramipril on cardiovascular events in high risk patients. New Engl J Med 2000; 324: 145–153.
- [33] Linholm LH, Ibsen H, Dahlhof B, et al. Cardiovascular morbidity and mortality in patients with diabetes in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol. Lancet 2002; 359: 1004–1010.
- [34] De Luca A, Izzo R, Fontana D, et al. Haemodynamic and metabolic effects of rilmenidine in hypertensive patients with metabolic syndrome X. A double blind paralel study versus amlodipine. J Hypertens 2000; 18: 1515–1522.
- [35] Tatti P, Pahor M, Byington RP, et al. Outcome results of the Fosinopril versus Amlodipine Cardiovascular Events Randomized Trial (FACET) in patients with hypertension and NIDDM. Diabetes Care 1998; 21: 597–603.
- [36] Gress TW, Nieto FJ, Shahar E, et al. Hypertension and antihypertensive therapy as risk factor for type 2 diabetes mellitus. New Engl J Med 2000; 342: 905–912.
- [37] Nadar S, Lim HS, Beevers DG, et al. Lipid lowering in hypertension and heart protection: obser-vation from the Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT) and the Heart Protection Study. J Hum Hypertens 2002; 16: 815–817.
- [38] Julius S, Kjeldsen SE, Weber MA, et al, for the VALUE trial group. Outcomes in hypertensive patients at high cardiovaskcular risk treated with regimens based on valsartan or amlodipine: the VALUE randomised trial. Lancet 2004; 363: 2002-2031. [1] Kereiakes DJ, Willerson JT. Metabolic syndrome epidemic. Circulation 2003; 108: 1552–1553.