Moderní imunomodulace u metastazujícího melanomu
Metastazující maligní melanom se řadí mezi nejobtížněji léčitelné diagnózy s mediánem přežití mezi 6 a 9 měsíci. Přežití 5 a více let se uvádí pouze v 1–2 % případů. Ročně umírá v ČR na melanom téměř 350 osob. Na první pohled se toto číslo nezdá dramatické, ale značně nabývá na významu při skutečnosti, že se jedná obvykle o jedince v produktivním věku. Dosavadním standardem léčby, který slouží k hodnocení účinnosti nových preparátů, je již 35 let dakarbazin, jehož léčebná odpověď se pohybuje v rozmezí 15–20 %. Výsledky klinických studií posledních dvou let zásadně změnily přístup k léčbě metastazujícího melanomu. Jako účinné se ukázaly dva směry, které jsou ve své biologické podstatě zcela odlišné: léčba imunomodulační zaměřená na aktivaci T-lymfocytů (a celého imunitního systému) a léčba cílená zaměřená na blokaci mutace genů v melanomu. Ipilimumab, monoklonální protilátka namířená proti antigenu CTLA-4, dokázal jako první molekula v historii statisticky signifikantně prodloužit celkové přežívání pacientů s metastazujícím melanomem.
Interferon alfa
Již dlouhou dobu se ví, že melanom patří k nádorům, které léčebně reagují na imunoterapii. Interferon alfa je cytokin, který se téměř 30 let využívá k adjuvantní léčbě melanomu. Metaanalýzy klinických studií potvrdily prodloužení období bez relapsu a krátkodobě i pozitivní vliv na celkové přežívání pacientů léčených adjuvantně interferonem [1]. V tuto chvíli se interferon alfa využívá pro pacienty s vysokým rizikem relapsu, tedy ve stadiích IIB až IIIC. Stále nepanuje celosvětový konsenzus o tom, jaká dávka a doba podávání je ideální. Proto se terapeutická schémata značně liší a tato rozdílnost ztěžuje i objektivní vyhodnocování klinických dat. Výzkum se v poslední době zaměřuje na odhalení prediktivních faktorů, jež by definovaly skupinu pacientů, která má z této terapie přínos.
Nádorové vakcíny
Zejména v adjuvantním režimu léčby melanomu se zatím v rámci klinického zkoušení delší dobu objevují nádorové
vakcíny jako specifická aktivní imunoterapie. Využívají skutečnosti, že melanom je velmi imunogenním nádorem. Vakcíny se specifickými nádorovými antigeny (tumor associated antigens) si dávají za cíl prolomit toleranci hostitele a stimulovat T-bu-něčnou odpověď [2]. Výhodou vakcín je poměrně nízká toxicita. Vakcíny lze použít, pokud jsou splněny následující podmínky: a) nádorové buňky exprimují specifické antigeny, které jsou rozpoznatelné specifickými receptory T-lymfocytů, b) funkční imunitní systém, c) celková velikost nádoru nepřesahuje funkční kapacitu imunitního systému.
Adoptivní buněčná terapie
Novou léčebnou strategií umožňující aktivaci a expanzi protinádorově reaktivních specifických lymfocytů ex vivo a jejich následné podání pacientovi je adoptivní buněčná terapie (adoptive cell transfer, ACT). Tento terapeutický přístup staví na současných znalostech z nádorové imunologie, patofyziologie a molekulární biologie. U adoptivní buněčné terapie lze pozorovat korelaci mezi účinností léčby a množstvím transferovaných specifických buněk CD8. Preklinické, ale i klinické experimenty ukázaly, že účinek terapie lze zvýšit lymfodeplečními režimy před podáním T-lymfocytů a současnou aplikací interleukinu-2. Objektivní léčebná odpověď u ACT melanomu se pohybuje mezi 50–70 % [3, 4]. Rosenberg a kol. demonstrovali na skupině 93 pacientů s metastazujícím mela-nomem až 20% kompletní remisi onemocnění u pacientů léčených ACT v kombinaci s předchozí deplecí lymfocytů [5].
Interleukin-2
První molekulou schválenou americkou Food and Drug Administration (FDA) pro imunoterapeutickou léčbu generalizovaného maligního melanomu byl v roce 1992 interleukin-2. Je zajímavé, že se nejednalo o schválení na základě klinické studie fáze III (kontrolované placebem či jiným standardem), ale šlo o celkovou léčebnou odpověď u 15 % a dlouhodobou trvalou kompletní odpověď u 5–8 % pacientů lé-čených vysokými dávkami interleukinu-2 [6, 7]. Vzhledem k závažným toxickým nežádoucím účinkům má tato léčba omezené použití, v ČR se doposud nepoužívala vůbec.
Průlomem na poli imunomodulační léčby byl v nedávné době objev ipilimumabu, protilátky blokující receptor CTLA-4. Ipilimumab prokázal zlepšení mediánu přežití u pacientů s melanomem a téměř zdvojnásobil přežívání pacientů po 1 roce.
Ipilimumab
Ipilimumab je plně humánní monoklonální protilátka IgG1, která se selektivně váže na antigen CTLA-4 (cytotoxic T-lym-phocyte-associated antigen 4) nacházející se na povrchu T-lymfocytů. CTLA-4 je klíčovým negativním regulátorem adaptivní imunitní odpovědi a funguje jako určitá brzda imunitní reakce. Jeho zablokování vede „k odbrždění“ imunitní protinádorové odpovědi, k delší a silnější aktivaci T-lymfocytů a v ideálním případě k napadení a destrukci nádorové tkáně.
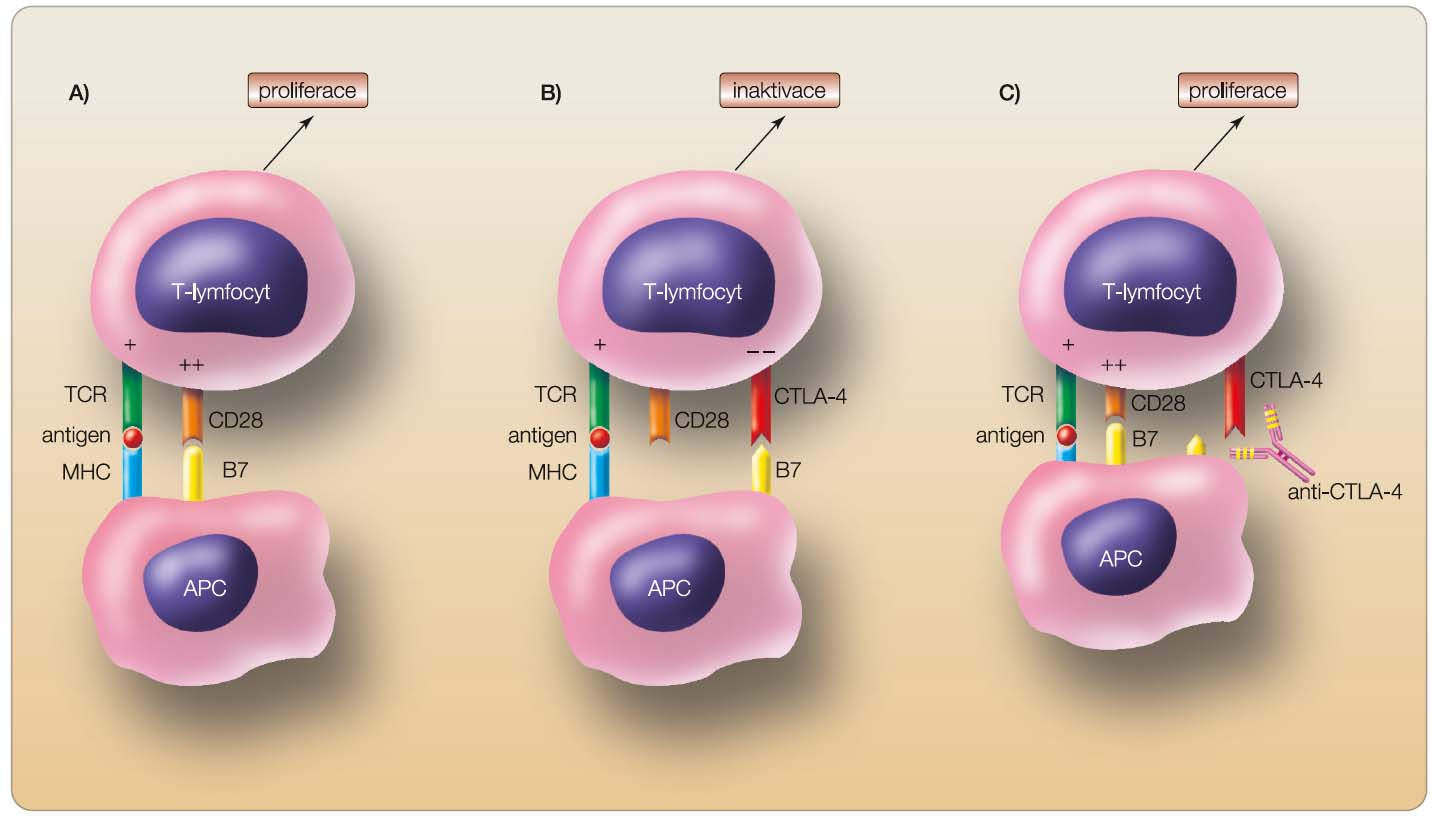 Myši s knockoutovaným CTLA-4 genem trpí fatálním lymfoproliferativním syndromem, což potvrzuje klíčovou roli CTLA-4 jako negativního regulátoru imunitní odpovědi [7–9]. Ipilimumab je plně humánní monoklonální protilátka typu IgG1, která se váže na molekulu CTLA-4 a blokuje jeho interakci s kostimulační molekulou B7 na povrchu antigen prezentujících buněk (obr. 1) [11, 12].
Myši s knockoutovaným CTLA-4 genem trpí fatálním lymfoproliferativním syndromem, což potvrzuje klíčovou roli CTLA-4 jako negativního regulátoru imunitní odpovědi [7–9]. Ipilimumab je plně humánní monoklonální protilátka typu IgG1, která se váže na molekulu CTLA-4 a blokuje jeho interakci s kostimulační molekulou B7 na povrchu antigen prezentujících buněk (obr. 1) [11, 12].
V preklinických studiích na myších modelech byla při blokádě CTLA-4 pozorována rozsáhlá regrese transplantabilních tumorů. Tyto pozitivní výsledky přenesly molekulu ipilimumabu do klinických studií. Po celém světě byl ipilimumab podáván ve studiích fáze II i III u více než 4000 pacientů s různými typy nádorů (kromě melanomu i u karcinomu prostaty, plic a ledvin). Převážná většina studií probíhá u metastazujícího maligního melanomu buď v monoterapii, nebo v kombinaci s dakarbazinem, interleukinem-2 [13], ale i v adjuvantním režimu.
Ipilimumab v klinických studiích
První klinické sledování na 14 pacientech provedl a publikoval Rosenberg a kol. v roce 2003 [14]. Tato malá skupina pa-cientů s generalizovaným melanomem byla každé 3 týdny léčena protilátkou anti-CTLA-4 v dávce 3 mg/kg a vakcínou gp100 s.c. U dvou pacientů byla zaznamenána kompletní regrese (CR) a u jednoho regrese částečná (PR).
Randomizovaná, multicentrická, mezinárodní, dvojitě zaslepená studie MDX010-20 fáze III prokázala prodloužení celkového přežívání pacientů s metastatickým melanomem.
V srpnu 2010 byly uveřejněny v New England Journal of Medicine výsledky této studie hodnotící účinnost a bezpečnost ipilimumabu podávaného ve druhé linii léčby [15]. Do této studie bylo zařazeno 676 pacientů s metastazujícím melanomem po selhání chemoterapie nebo imunoterapie interleukinem-2. Studie byla trojramenná: a) ipilimumab v dávce 3 mg/kg s vakcínou gp100, b) ipilimumab samotný c) vakcína gp100 samotná, s randomizačním poměrem 3 : 1 : 1. Medián přežití v rameni s ipilimumabem nebo v kombinaci s vakcínou byl 10,1, resp. 10,0 měsíců a v kontrolní skupině s vakcínou 6,4 měsíce. Po roce žilo v rameni s ipilimumabem v monoterapii
46 % nemocných versus 25 % v kontrolní skupině s vakcínou. Po dvou letech klinické-ho sledování se jednalo o 24 % oproti 14 % pacientů. Ve výsledcích nebyl významný rozdíl mezi účinností ipilimumabu podávaného v monoterapii a v kombinaci s vakcínou gp100, kde byly zjištěny výsledky překvapivě mírně horší. Tyto závěry vedly k pre-ferenci ipilimumabu v monoterapii. Pacientům, u nichž bylo v týdnu 12 zaznamenáno stabilní onemocnění, kompletní či částečná regrese a následně progrese onemocnění, byla nabídnuta reindukční léčba ipilimumabem (stejný režim jako při prvním podávání). Reindukci tak zahájilo 31 pacientů a léčebná odpověď byla zaznamenána u 21 z nich (67,7 %).
Na podkladě výsledků studie MDX010-20 byl ipilimumab dne 25. 3. 2011 schválen americkou FDA pro léčbu metastazující-ho melanomu ve 2. linii a následně i v 1. linii léčby a později i evropskou EMA pro 2. linii léčby.
Nová kritéria pro hodnocení imunoterapie irRC
Účinnost chemoterapie je dnes hodnocena na základě kritérií WHO nebo RECIST (Response Evaluation Criteria in Solid Tumors). Jakékoliv zvětšení sledovaných metastáz je považováno za progresi onemocnění. Léčebné odpovědi u ipilimumabu jsou vyvolány aktivací imunitního systému a nádorová tkáň pak může zareagovat na terapii různými způsoby. Na podkladě jiných typů léčebných odpovědí při imunoterapii byla vypracována nová doporučení pro jejich posuzování nazvaná immune related response criteria (irRC) [16]. Respektují fakt, že před regresí metastáz může dojít k jejich přechodnému zvětšení, tzv. pseudoprogresi, která je vysvětlována infil-trací nádorové tkáně T-lymfocyty. Vznik nových metastáz při zmenšení stávajících nemusí znamenat progresi onemocnění. Tento jev je vysvětlován tím, že tyto meta-stázy existovaly již před počátkem léčby, ale měly rozměry pod hranicí detekce. Rozpoznání T-lymfocyty vede k jejich infiltraci a zvětšení. Vzhledem k fenoménu pseudoprogrese a pozdějšímu nástupu léčebného účinku se první hodnocení provádí ve 12. týdnu léčby. Pokud je zaznamenána v tomto období progrese (a pacient je klinicky bez obtíží), měla by být tato progrese potvrzena v odstupu alespoň 4–6 týdnů.
Nežádoucí účinky ipilimumabu
Nežádoucí účinky ipilimumabu souvisí s mechanismem jeho účinku. Stimulace efektorových T-lymfocytů může vyvolávat imunitně mediované nežádoucí účinky, které se označují jako irAEs (immune-related Adverse Events). Některé práce poukazují na častější výskyt irAEs u pacientů dobře odpovídajících na léčbu ipilimumabem. Maker a kol. uveřejnili studii s 56 pacienty ve stadiu IV. Částečná a kompletní regrese byla pozorována u pacientů s imunitně zprostředkovanými nežádoucími účinky stupně 3–4, zatímco jen 5% léčebnou odpověď zaznamenali pacienti bez známek těchto nežádoucích účinků [17]. Typickými nežádoucími účinky jsou enteritidy provázené průjmy, kožní exantém s pruritem či vitiligo, endokrinopatie (thyreoidi-tida, hypofyzitida) či hepatotoxicita. Frekvence a intenzita nežádoucích účinků souvisí s dávkou ipilimumabu. Závažné nežádoucí účinky se ve studii MDX010-20 stupně 3 a 4 objevily u 12–15 % pacientů. Pro zvládnutí nežádoucích účinků byl vytvořen algoritmus pro jejich diagnostiku a léčbu. Ten zahrnuje především včasnou aplikaci vysokých dávek kortikosteroidů následovaných u endokrinopatií obvykle celoživotní příslušnou hormonální substitucí.
Shrnutí
Léčebné odpovědi na podávání ipilimumabu se pohybují okolo 15 %. Objevují se později než u chemoterapie nebo cílené léčby. Toto procento není vysoké, ale velmi slibná je doba trvání léčebných odpovědí. Jsou dokumentováni pacienti, kteří žijí i 4 roky od začátku terapie. U dalších přibližně 20 % pacientů představuje přínos z léčby dlouhodobá stabilizace choroby, k níž u těchto léčených dochází. Důležitá informace vyplynula z publikace Wolchoka a kol., která ukázala, že každý z těchto typů odpovědi je asociován s lepším přežíváním pacientů [18]. Spekuluje
se o tom, že dochází k prolomení tolerance vůči nádorovým antigenům a k navození dlouhodobé imunitně zprostředkované kontroly onemocnění.
Závěrem je nutné si položit několik otázek. Jaká je optimální dávka ipilimumabu? Schválena je dávka 3 mg/kg, ale použití 10 mg/kg je také stále reálné. Je vhodným terapeutickým schématem monoterapie ipilimumabem, nebo kombinovaná léčba? Zatímco kombinace ipilimumabu s chemoterapií se pomalu opouští, ke slovu přicházejí klinické studie, které kombinují ipilimumab s cílenou léčbou např. inhibitorem BRAF. Ten rychle navodí léčebnou odpověď a rozpad nádorových buněk uvolní antigeny s bezprostřední aktivací dendritických buněk. Vzniká ideální prostředí pro ipilimumab a dochází k navození imunologické odpovědi. Podobně se u nádorů prostaty testuje kombinace radioterapie zamířená na cílovou lézi, čímž může dojít k rozpadu tkáně a k uvolnění nádorových antigenů, s následnou aplikací ipilimumabu.
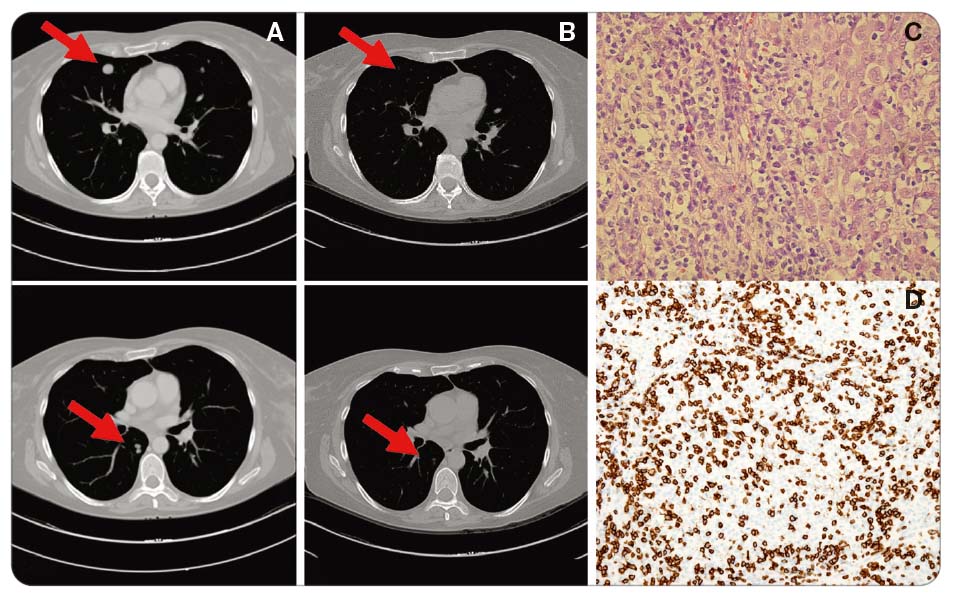 Existují prediktivní faktory definující skupinu pacientů, pro něž bude imunoterapie ipilimumabem přínosná? Na tuto otázku zatím nedokážeme jednoznačně odpovědět. Pozitivní trend ukázala korelace mezi výskytem autoimunních reakcí a četností léčebných odpovědí, ale zatím se nejednalo o statisticky signifikantní údaj. V hledáč-ku jsou nyní práce, které se zaměřují na typ a intenzitu infiltrace nádoru/metastázy tumor-infiltrujícími T-lymfocyty v souvislosti s typem léčebné odpovědi [19] (obr. 2).
Existují prediktivní faktory definující skupinu pacientů, pro něž bude imunoterapie ipilimumabem přínosná? Na tuto otázku zatím nedokážeme jednoznačně odpovědět. Pozitivní trend ukázala korelace mezi výskytem autoimunních reakcí a četností léčebných odpovědí, ale zatím se nejednalo o statisticky signifikantní údaj. V hledáč-ku jsou nyní práce, které se zaměřují na typ a intenzitu infiltrace nádoru/metastázy tumor-infiltrujícími T-lymfocyty v souvislosti s typem léčebné odpovědi [19] (obr. 2).
Závěr
Ipilimumab je v tuto chvíli v České republice dostupný pacientům s metastazujícím melanomem v rámci Specifického léčebného programu. Další molekula, která prokázala pozitivní vliv na celkové přežívání pacientů s melanomem, vemurafenib, je v ČR k dispozici v rámci klinické studie. Vemurafenib je selektivní inhibitor muta-ce BRAF V600E. Ve studii fáze III BRIM3 vemurafenib snížil riziko úmrtí ve srovná-ní s dakarbazinem o 63 %. Medián celkového přežití v rameni s vemurafenibem byl 13,2 měsíce vs. 9,6 měsíce u ramene s dakarbazinem [20, 21]. Prokázal tak statisticky signifikantní prodloužení celkového přežití u pacientů s melanomem s mutací genu BRAF.
U metastazujícího melanomu se v po-sledních desetiletích léčba téměř neměnila a léčebné výsledky nebyly uspokojivé. Nové léky schválené pro terapii pokročilého melanomu ale celou situaci mění a nabízejí nové možnosti léčby a zároveň novou naději pro nemocné s melanomem. Tento pozitivní vývoj však není bez rizika, protože s novými biologickými preparáty se objevují například nové imunitně podmíněné nežádoucí účinky nebo vznikají epiteliální nádory. Jakmile se podaří zmapovat další proliferační principy u melanomu, povede to k významnému posunu v léčbě tohoto onemocnění.
Seznam použité literatury
- [1] Mocellin S, Pasquali S, Rossi CR, Nitti D. Interferon alpha adjuvant therapy in patients with high-risk melanoma: a systematic review and meta-analysis. J Natl Cancer Inst 2010; 102: 493–501.
- [2] Mellman I, Coukos G, Dranoff G. Cancer immuno-therapy comes of age. Nature 2011; 480: 480–489.
- [3] Dudley ME, Yang JC, Sherry R, et al. Adoptive cell therapy for patients with metastatic melanoma: evaluation of intensive myeloablative chemoradiation preparative regimens. J Clin Oncol 2008; 26: 5233–5239.
- [4] Besser MJ, Shapira-Frommer R, Treves AJ, et al. Clinical responses in a phase II study using adoptive transfer of short-term cultured tumor infiltration lymphocytes in metastatic melanoma patients. Clin Cancer Res 2010; 16: 2646–2655.
- [5] Rosenberg SA, Yang JC, Sherry RM, et al. Durable complete response in heavily pretreated pa-tients with metastatic melanoma Using T cell transfer immunotherapy. Clin Cancer Res 2011; 17: 4550–4557.
- [6] Atkins MB, Lotze MT, Dutcher JP, et al. High- dose recombinant interleukin 2 therapy for pa-tients with metastatic melanoma: analysis of 270 patients treated between 1985 and 1993. J Clin Oncol 1999; 17: 2105–2116.
- [7] Smith FO, Downey SG, Klapper JA, et al. Treatment of metastatic melanoma using interleu-kin-2 alone or in conjunction with vaccines. Clin Cancer Res 2008; 14: 5610–5618.
- [8] Tivol EA, Borriello F, Schweitzer AN, et al. Loss of CTLA-4 leads to massive lymphoproliferation and fatal multiorgan tissue destruction, revealing a critical negative regulatory role of CTLA-4. Immunity 1995; 3: 541–547.
- [9] Waterhouse P, Penninger JM, Timms E, et al. Lymphoproliferative disorders with early lethality in mice deficient in CTLA-4. Science1995; 270: 985–988.
- [10] Chambers CA, Sullivan TJ, Allison JP. Lymphoproliferation in CTLA-4-deficient mice is media-ted by costimulation-dependent activation of CD4+T cells. Immunity 1997; 7: 885–895.
- [11] Keler T, Halk E, Vitale L, et al. Activity and safety of CTLA-4 blockade combined with vaccines in cynomolgus macaques. J Immunol 2003; 171: 6251–6259.
- [12] Morse MA. Technology evaluation: ipilimumab, Medarex/Bristol-Myers Squibb. Curr Opin Mol Ther 2005; 7: 588–597.
- [13] Prieto PA, Yang JC, Sherry RM, et al. CTLA-4 Blockade with Ipilimumab: Long-Term Follow-up of 177 Patients with Metastatic Melanoma. Clin Cancer Res 2012 Jan 23 [Epub ahead of print].
- [14] Phan GQ, Yang JC, Sherry RM, et al. Cancer regression and autoimmunity induced by cytotoxic T lymphocyte-associated antigen 4 blockade in patients with metastatic melanoma. Proc Natl Acad Sci U S A 2003;100: 8372–8377.
- [15] Hodi FS, O'Day SJ, McDermott DF, et al. Improved Survival with Ipilimumab in Patients with Meta-static Melanoma. NEJM 2010; 363: 711–723.
- [16] Klener P, Šťastný M. Posuzování léčebné odpovědi u zhoubných nádorů a potřeba úpravy kritérií pro hodnocení účinnosti imunoterapie. Remedia 2010; 20: 332–336.
- [17] Maker AV, Yang JC, Sherry RM, et al. Intrapatient dose escalation of anti-CTLA-4 antibody in pa-tients with metastatic melanoma. J Immunother 2006; 29: 455–463.
- [18] Wolchok JD, Hoos A, O'Day S, et al. Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. Clin Cancer Res 2009; 15: 7412–7420.
- [19] Erdag G, Schaefer JT, Smolkin ME, et al. Immunotype and Immunohistologic Characteristics of Tumor infiltrating Immune Cells are Associated with Clinical Outcome in Metastatic Melanoma 2012; DOI:10.1158/0008-5472.CAN-11-3218.
- [20] Souhrn údajů o přípravku Zelboraf (poslední revize 2/2012).
- [21] Chapman PB, Hauschild A, Robert C, et al. Improved Survival with Vemurafenib in Melanoma with BRAF V600E Mutation. N Engl J Med 2011; 364 (26): 2507–2516.