Moderní léčba migrény
Souhrn:
Podle nejnovější mezinárodní klasifikace bolestí hlavy ICHD‑3 (International Classification of Headache Disorders‑3) publikované letos v lednu se bolesti hlavy s malými obměnami nadále dělí do tří skupin: na primární bolesti hlavy, sekundární bolesti hlavy a bolestivé kraniální neuropatie a jiné bolesti obličeje a hlavy. Na rozdíl od sekundárních bolestí hlavy, které mají svou jasnou etiologickou příčinu (z velké škály například cévní nebo nádorovou), je podklad primární bolesti hlavy čistě patofyziologický a příznačný pro danou podskupinu. Následující text je věnován přehledu léčby nejznámější primární bolesti hlavy – migrény – v současnosti a blízké budoucnosti.
Key words: migraine, acute treatment, prophylaxis, pharmacotherapy,neuromodulation.
Summary:
According to the latest International Classification of Headache Disorders‑3 (ICHD‑3) published this January, headaches are with small variations still divided into 3 groups: primary headaches, secondary headaches and painful cranial neuropathies, other facial pains and other headaches. As secondary headaches have their clear etiological causes (largely for example vascular or tumorous), primary headaches have purely pathophysiological background which is characteristic for each subgroup. The following text is a review of the treatment of the most common primary headache – migraine – in the present and near future.
Migréna
Migréna je třetí nejčastější chorobou vůbec (z 310 chorob) a zároveň šestou nejvíce handicapující diagnózou celosvětově dle zprávy Světové zdravotnické organizace (WHO) z roku 2013 [1,2]. Prevalence migrény byla ve velkém souboru respondérů (n = 162 576) stanovena na 17,1 % u žen a na 5,6 % u mužů, nejčastěji mezi třicátníky až čtyřicátníky, a je velmi pravděpodobné, že její výskyt bude stoupat, zejména u žen. Chronická migréna (CM) se vyskytuje u 1−3 % pacientů [3].
Migrénu můžeme rozlišovat v několika osách: podle frekvence záchvatů ji klasifikujeme jako epizodickou (EM) s 1−14 záchvaty za měsíc a chronickou s více než 15 atakami bolesti. Chronická migréna mívá odlišné vlastnosti než EM, kromě vysoké frekvence jsou záchvaty méně intenzivní, modifikované často letitým podáváním triptanů a sklonem k nadužívání medikace. Podle typu rozeznáváme migrénu s aurou, která je méně častá (30 %), a bez aury, stejně jako specifické formy: s kmenovými příznaky – hemiplegickou nebo retinální. Podle komplikací: při trvání delším než 72 hodin hovoříme o migrenózním statusu nebo o kontinuální auře, vzniknout může ischemie v povodí a. cerebri posterior.
Podle uvedených faktorů se pak řídí profylaktická léčba. Zpravidla se její podávání zahajuje při frekvenci záchvatů s vyšší četností než čtyři za měsíc nebo při trvání bolesti jednotlivých atak delším než 48 hodin nebo u klinicky závažnějších forem, jako je migréna hemiplegická. Preventivní léčba pak musí být zvolena podle individuality pacienta (věk, pohlaví, interní a psychiatrické komorbidity). V akutní léčbě máme k dispozici v současnosti pouze tři skupiny léčiv, a to nesteroidní antirevmatika (NSA), neopioidní analgetika a triptany. Ačkoliv akutní medikaci užívá 98 % pacientů, pouze 12,4 % se léčí profylakticky, a to s nízkou perzistencí užívání léčby. Při zlepšení diagnostiky migrény (zatím stanovena správná diagnóza pouze zhruba u 56 % pacientů) a s potenciálními terapeutickými možnostmi lze očekávat významný nárůst nákladů na léčbu.
Akutní léčba migrény
Nesteroidní antirevmatika a neopioidní analgetika
Z patofyziologického hlediska je účinek NSA vysvětlován pravděpodobnou účastí prostaglandinů a zvýšenou agregabilitou trombocytů v patogenezi migrény. Kyselina acetylsalicylová (ASA) i indometacin blokují extravazaci plazmy v dura mater vyvolanou neuropeptidy [4]. Nimesulid silně penetruje do centrální nervové soustavy a tlumí tvorbu substance P. Léčiva ze skupiny NSA podáváme i v případě kontraindikace nebo intolerance triptanů [5]. Efekt některých NSA (ASA, ibuprofenu, naproxenu a diklofenaku) byl prokázán kontrolovanými studiemi, zatímco u dalších látek z této skupiny (indometacin, ketoprofen, nimesulid) byly provedeny pouze menší studie, ale klinická praxe ukazuje rovněž vysokou efektivitu při zvládání akutního záchvatu [6]. V roce 2014 byly prezentovány výsledky retrospektivní italské studie u 741 osob s migrénou. Nejčastěji předepisovanými NSA byly nimesulid, ketoprofen a ibuprofen a byl zjištěn signifikantně vyšší počet pacientů s kompletní úlevou od bolesti (72 %, 67 % a 59 %) ve srovnání s těmi, kteří měli úlevu jen částečnou nebo žádnou [7]. S výhodou se užívají rozpustné formy NSA (ASA, nimesulid), rychle se vstřebává dexketoprofen a při zvracení volíme čípky (indometacin, diklofenak). Kofein v kombinovaných přípravcích snižuje dávku NSA nutnou k úlevě od bolesti, ale bývá zdrojem návykové bolesti hlavy, obdobně jako kombinace NSA s barbituráty. Při menstruační migréně lze užít krátkodobou 10denní nebo při pravidelné menstruaci kratší perimenstruační profylaxi NSA, bezpečný účinek doložily studie s naproxenem a nimesulidem [8].
Z neopioidních analgetik bývá užíván paracetamol v dávce 1 000 mg a metamizol v tabletách nebo ve formě kapek. V těhotenství je lékem první volby paracetamol. Nesteroidní antirevmatika nepatří mezi přímé teratogeny, nejsou však doporučována a jsou kontraindikována ve třetím trimestru, neboť bylo popsáno předčasné uzavření fetálního ductus arteriosus. V případě nutnosti podání NSA je možné relativně bezpečně jednorázově nebo krátkodobě užít ibuprofen do 30. týdne těhotenství. Vyšší dávky ASA mohou způsobit neonatální krvácení.
Triptany
Jako specifická, a tedy základní léčba silnějších záchvatů migrény se za posledních 20 let ukotvily triptany, agonisté serotoninových receptorů 5 HT1B/1D, které hrají podstatnou roli v rozvoji záchvatu migrény. Ve studiích prokázaly jednoznačný efekt oproti placebu i v úlevě od bolesti do dvou hodin od podání oproti NSA [9]. Klasickým referenčním zástupcem je sumatriptan, který je dostupný ve všech potřebných lékových formách a některá jeho generika jsou plně hrazena pojišťovnou. U rezistentních pacientů je možností užití nákladnějšího eletriptanu. S cílem delšího trvání účinku u migrény s pomalým nástupem bolesti máme k dispozici spíše málo užívaný naratriptan. Frovatriptan s dlouhým biologickým poločasem užívaný i jako prevence menstruační migrény podložená daty tzv. evidence based medicine již není v ČR dostupný, obdobně jako zolmitriptan, který má i nazální formu, nebo rizatriptan (má i lékovou formu v ústech rozpustného lyofilizátu). Pro pacienty s prokázanou superiorní účinností uvedených přípravků je zatím možné zajistit individuální dovoz. Almotriptan s prezentovaným nižším výskytem nežádoucích účinků (chest pain) než u sumatriptanu nebyl v ČR registrován [10].
Přehled triptanů včetně některých
farmakokinetických parametrů a dostupnosti je uveden v tabulce 1. Fixní kombinace NSA a triptanu, tedy sumatriptanu
s naproxenem, je účinnější než efekt látek samotných
u středně těžké a těžké migrenózní bolesti [11].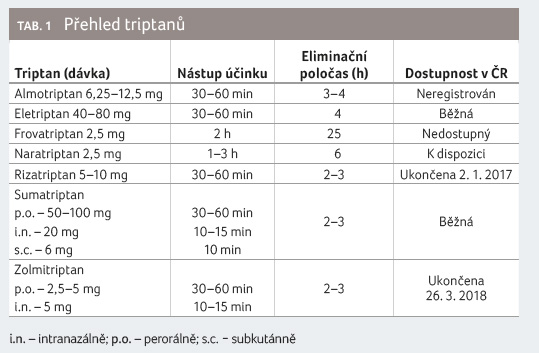
Běžnou otázkou v praxi je užívání triptanů v těhotenství. Již při prvních sledováních gravidit pacientek užívajících triptany nebylo pozorováno větší riziko vývojových vad, ačkoliv mírně byl zvýšen počet předčasných porodů [12]. Další akumulovaná data potvrdila dřívější výsledky pozorování, včetně absence nežádoucích účinků u kojenců [13]. Recentní německá studie opět zjišťuje, že triptany nejsou významným teratogenem. Doporučen je sumatriptan pro největší zkušenosti, nicméně vždy by měl být pečlivě zvážen poměr rizika vůči přínosu terapie [14].
Nežádoucí účinky triptanů jsou již dobře známé, obdobné pro všechny molekuly. Je jimi spavost, malátnost, nauzea nebo zvracení, parestezie končetin a obličeje, pocity horka. Typickým nežádoucím účinkem jsou tzv. bolesti na hrudi (chest symptoms/pain): tlak až bolest na prsou, která se může propagovat do ramen, paží a krku. Trvají obvykle 15−60 minut.
Triptany jsou kontraindikovány u infarktu myokardu v anamnéze (pozorovali jsme i těžší infarkt u relativně mladé pacientky), u ischemické choroby srdeční, u významných srdečních arytmií, cévní mozkové příhody nebo tranzitorní ischemické ataky v anamnéze, u onemocnění periferních cév, při nekontrolované hypertenzi, u těžkého poškození jater. Dále při současném podávání ergotaminu, inhibitorů monoaminooxidázy (MAO) a při léčbě lithiem. Existuje určité riziko serotoninového syndromu, nicméně v praxi je zanedbatelné [15]. Nadužívání triptanů se stává častým a při vedení terapie migrény ho musíme mít na paměti.
Námelové alkaloidy
Deriváty ergotaminu jsou dostupné již od roku 1918 v mnoha lékových formách. V akutní léčbě záchvatu migrény, status migrenosus nebo tzv. cluster headache byl do relativně nedávné doby k dispozici dobře účinný dihydroergotamin (DHE; podávaný v dávce 1 mg i.m. nebo s.c., 4 mg i.n.). V profylaxi migrény se používaly vzestupné a sestupné kúry DHE v kapkách perorálně. Po nástupu triptanů a vzhledem k četným potenciálním nežádoucím účinkům, jako jsou akutní nauzea, zvracení (DHE je i emetikum), křeče v břiše nebo chronické poruchy cirkulace způsobené vazokonstrikcí a retroperitoneální fibróza, bylo používání DHE v léčbě omezeno a v současné době není v ČR v žádné formě registrován. Možností podání jsou nyní magistraliter připravované čípky s 1−2 mg ergotaminu, často v kombinaci s barbiturátem, kofeinem či diazepamem, u kterých vzniká pochopitelné riziko nadužívání, odvykacích stavů a polékových bolestí hlavy.
Nové možnosti akutní léčby migrény
V současné době nadále probíhají studie s tzv. ditany. Prvním zástupcem této skupiny farmak je lasmiditan, selektivní agonista serotoninového receptoru 5 HT1F nacházející se ve fázi III klinického zkoušení. Výhodou selektivního ovlivnění 1F podjednotky receptoru je absence vazokonstriktivních nežádoucích účinků. Vyvíjena byla nejprve intravenózní (i.v.) forma a od roku 2010 i forma perorální, 50−200 mg (studie SPARTAN), dlouhodobá účinnost je sledována ve studiích SAMURAI a GLADIATOR. Byl prokázán signifikantní efekt v ústupu bolestí hlavy do dvou hodin po podání i u dalších sledovaných parametrů, jako je nauzea a světloplachost. Nezávažné nežádoucí účinky (vertigo, únava) nevedly k ukončení terapie [16].
Antagonisté CGRP (calcitonin gene related peptide) jsou předmětem klinického hodnocení preventivní léčby migrény. Malé molekuly s tímto mechanismem účinku a s rychlým nástupem účinku – gepanty – jsou hodnoceny i jako terapie akutní. K dispozici je relativně velká skupina derivátů. Nyní je věnována pozornost zejména perorálnímu podání ubrogepantu. Při preventivním podávání telcagepantu bylo zaznamenáno zvýšení aktivity jaterních transamináz [17].
Profylaktická léčba migrény
Jak již bylo uvedeno, k profylaktické
terapii migrény přistupujeme při frekvenci záchvatů vyšší než
jeden za týden, při jejich výrazné interferenci s denními
aktivitami přes akutní terapii, při neefektivitě akutní terapie,
při závažných nežádoucích účincích nebo při
kontraindikaci. Prevence je preferována u vzácnějších
podforem migrény hemiplegické, kmenové, s prolongovanou aurou
nebo při anamnéze migrenózního infarktu. Vždy musíme zvážit
přínos a potenciální rizika každodenního užívání léčby
[18]. V přehledu jsou uvedeny jednotlivé skupiny, léčiva
s doloženým účinkem i některá přírodní léčiva
(zjednodušeně v tab. 2).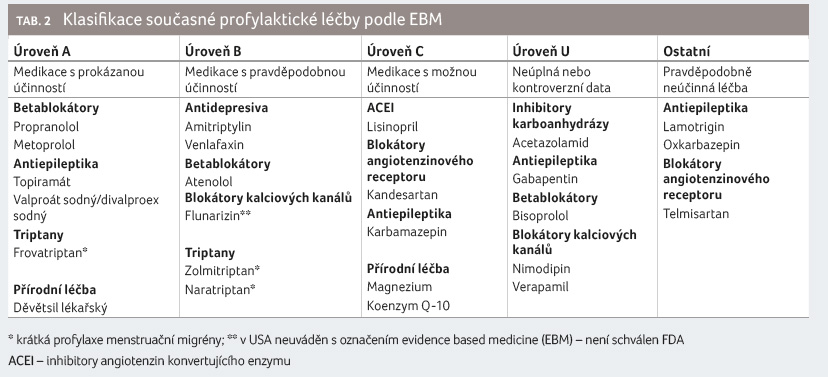
Betablokátory
Efekt léčby betablokátory (BB) na bolesti hlavy byl zjištěn náhodně při léčbě arteriální hypertenze. Nejvyšší účinnost pak prokázal propranolol oproti placebu i ve srovnání s léčbou amitriptylinem [19]. Propranolol je v ČR dobře dostupný ve formě magistraliter přípravků. Srovnatelný účinek má metoprolol [20]. Obdobný vliv byl prokázán u neretardované i retardované formy, která by mohla být preferována pro jednoduchost podání jedenkrát denně (SR/ZOK). U ostatních BB je evidence nižší. Timolol a nadolol jsou srovnatelné s propranololem, vysoce selektivní β1 antagonista bisoprolol je srovnatelný s metoprololem a atenolol byl ve studiích účinnější než placebo [21]. Nejčastějšími nežádoucími účinky BB jsou únava, hypotenze, bradykardie, deprese, živé sny nebo zvýšení tělesné hmotnosti, u mužů pak erektilní dysfunkce. Léčba BB je kontraindikována u astmatu.
Antiepileptika
Valproát sodný je širokospektré antiepileptikum (AE) s vícečetným mechanismem účinku, jako je inhibice sodíkových a vápníkových kanálů, zvýšení dostupnosti kyseliny gama aminomáselné (GABA) a snížení koncentrace glutamátu. Prostřednictvím GABAA receptorů podle pozorování blokuje neurogenní zánět v oblasti mening [22]. Ve dvojitě zaslepené studii z roku 1992 byl signifikantně účinnější než placebo [23], a dále byl srovnatelně účinný jako propranolol, amitriptylin nebo flunarizin. Existuje v parenterální formě pro akutní podání. U některých zřejmě predisponovaných pacientek dochází po zahájení léčby valproátem ke zvyšování hmotnosti, vzniku hyperandrogenismu a syndromu polycystických ovarií. Nepříjemným nežádoucím účinkem u části pacientů je alopecie, častý je tremor, ze vzácných trombocytopenie, pankreatitida nebo hyperamonemická encefalopatie. Podávání valproátu je spojeno s rizikem vzniku vrozených vývojových vad, které je vyšší než u jiných AE (6−11 %) [24]. Riziko může být sníženo při denní dávce nižší než 1 000 mg. Intrauterinní expozice valproátu může ovlivnit pozdější kognitivní funkce [25].
Topiramát má rovněž vícečetný mechanismus účinku s převahou antiglutamátové aktivity. Inhibuje šíření kortikální deprese. Jeho účinnost u EM byla prokázána ve dvou velkých randomizovaných, placebem kontrolovaných studiích u 468 pacientů, respektive 487 pacientů [26,27] a u CM ve třech studiích [28]. Mezi specifické nežádoucí účinky lze zařadit parestezie, redukci hmotnosti, vzácně po vysazení léčby reverzibilní akutní glaukom s myopií nebo nefrolitiázu, při kombinované léčbě se může vyskytnout porucha kognice nebo zhoršení řeči. Ve vyšší dávce (nad 200 mg/den) může snižovat účinnost hormonální kontracepce.
Existuje několik pozitivních klinických hodnocení s levetiracetamem. Potenciálně efektivním je zonisamid, lék podobného charakteru jako topiramát, který má ve studiích srovnatelnou účinnost, je lépe tolerovaný a je efektivní i u pacientů, kde léčba topiramátem selhala, a to i u CM [29,30]. Karbamazepin je potenciálně účinný, ale nevýhodou byl vyšší podíl nežádoucích účinků. Studie kontrolované placebem byly provedeny i u gabapentinu. Po zhodnocení byly výsledky negativní, obdobně jako u rozsáhlé randomizované studie v roce 2013 u jeho prekurzoru enacarbilu. Jednoznačný pozitivní terapeutický efekt u pacientů s migrénou nebyl prokázán u lamotriginu, oxkarbazepinu, pregabalinu a vigabatrinu, a tudíž tato léčiva nejsou v léčbě migrény indikována.
Vyjma valproátu a topiramátu nejsou ostatní AE pro terapii migrény v ČR registrována a jsou předepisována off label po pečlivém zhodnocení stavu pacienta, nicméně jejich potenciálního antimigrenózního efektu lze využít u pacientů trpících epilepsií a často koincidentní migrénou.
Antidepresiva
Tricyklické antidepresivum amitriptylin je zavedenou léčbou bolesti, užívá se u neuropatické bolesti a u migrény již od 70. let minulého století. K dispozici je několik starších malých studií a větší zaslepená studie srovnávající non inferioritu vůči topiramátu u 331 pacientů, bez významného rozdílu v účinnosti a s podobným procentem výskytu nežádoucích účinků [31]. V případě amitriptylinu se jedná o zvýšení hmotnosti, ospalost nebo sucho v ústech. Pozornost by měla být věnována kombinaci s jinými serotoninergními přípravky vzhledem k riziku serotoninového syndromu.
Druhým antidepresivem s účinkem v prevenci migrény je venlafaxin, selektivní inhibitor zpětného vychytávání serotoninu a noradrenalinu (SNRI). Existují dvě pozitivní studie účinnosti oproti placebu a ve srovnání s amitriptylinem [32].
Blokátory kalciových kanálů
Flunarizin je selektivní antagonista vápníkových kanálů s dlouhým biologickým poločasem přibližně 18 dní. K dispozici je řada pozitivních studií účinnosti v porovnání s placebem, propranololem u více než tisíce pacientů, valproátem, topiramátem, metoprololem a pizotifenem u EM i CM [33]. K nejčastějším nežádoucím účinkům patří zvýšení hmotnosti, ospalost a u starších pacientů při delším užívání extrapyramidové příznaky. Přes prokázaný efekt a určitou renesanci použití v západní Evropě přestal být flunarizin v ČR registrován. K dispozici máme již mnoho let cinarizin s nižší úrovní evidence účinku.
Ostatní farmaka
V systematickém přehledu bylo identifikováno několik studií prokazujících efekt kandesartanu v dávce 16 mg ve srovnání s placebem a propranololem [34]. Léčba byla velmi dobře tolerována.
Pizotifen býval v ČR k dispozici jako varianta terapie u pacientů s rezistentní migrénou. Bohužel jeho výroba byla zastavena před několika lety. Pizotifen byl licencován v 70. letech po sérii studií kontrolovaných placebem (responder rate byl až 50 %) a podáván v dávce 1,5−6 mg/den [35].
Doplňky stravy „evidence based“
Magnezium
Vzhledem k časté hypomagnezemii u pacientů s migrénou a s ohledem na roli nedostatku magnezia v patofyziologii migrény je magnezium velmi častou a oblíbenou přirozenou profylaxí migrény první volby i u pacientů s méně frekventní EM. V databázi z dlouhého období let 1990−2016 bylo nalezeno pět klinických dvojitě zaslepených randomizovaných, placebem kontrolovaných studií hodnotících efekt magnezia u dospělých. Do větší studie bylo zařazeno 81 pacientů se střední frekvencí záchvatů – 3,6/měsíc. Po čtyřtýdenní úvodní fázi sledování bylo podáváno 600 mg magnezia nebo placebo denně po dobu 12 týdnů. Frekvence záchvatů se snížila o 41,6 % oproti 15,8 % u pacientů dostávajících placebo. Častým nežádoucím účinkem (i jak pozorujeme v praxi) byl průjem, trpělo jím 18,6 % pacientů [36].
Děvětsil lékařský
Účinek extraktu z devětsilu lékařského (Petasites hybridus) byl od roku 2001 předmětem několika randomizovaných klinických studií. Větší studie kontrolovaná placebem zahrnula 245 dospělých s EM s užitím 50 mg a 75 mg výtažku versus placebo po dobu 16 týdnů a s redukcí záchvatů o 48 % při dávce 75 mg, 36 % v případě dávky 50 mg oproti 26 % při užívání placeba [37]. Podávání extraktu z devětsilu nemělo významné nežádoucí účinky včetně absence elevace hodnot jaterních enzymů. Ojediněle bylo pozorováno častější říhání.
Onabotulotoxin A
Zásadními studiemi účinnosti onabotulotoxinu A u CM jsou PREEMPT (Phase III REsearch Evaluating Migraine Prophylaxis Therapy) 1 a PREEMPT 2. Obě studie byly vedeny po dobu 24 týdnů s aplikací injekcí do 31 míst v oblasti čela, spánků, týlní oblasti a krku podle pevně stanoveného protokolu po 12 týdnech s následnou otevřenou fází. Ve studii PREEMPT 1 byl výsledek v primárních cílech negativní, ale signifikantní v cílech sekundárních v redukci počtu dní s migrénou. V PREEMPT 2 se tak primární cílové ukazatele změnily na redukci počtu dní s bolestí hlavy, kde bylo dosaženo významného snížení oproti placebu i oproti stavu před aplikací injekcí a redukce četností bolestí hlavy [38]. Následná analýza prokázala větší redukci počtu dní s migrénou u pacientů, kteří užívali tři a více preventivních medikací. V obou studiích tvořili pacienti s nadužíváním medikace (medication overuse headache) až dvě třetiny z celkového počtu, u kterých by tato léčba mohla být užitečná. Oproti tomu u pacientů s EM a tenzní bolestí hlavy nebyla terapie účinnější než placebo.
Výsledky dalších pěti studií u 350
pacientů byly srovnatelné s výsledky podávání topiramátu
a divalproexu sodného. Mezi nežádoucími účinky byly
zaznamenány ptóza, svalová slabost, bolesti a blok krční
páteře, parestezie a lokální kožní změny. Letošní
výsledky multicentrické otevřené studie COMPEL u 715
pacientů s celkem devíti(!) aplikacemi onabotulotoxinu po 12
týdnech (dohromady 108 týdnů) svědčí pro 30% a vyšší
redukci počtu dní s bolestí hlavy u 75 % pacientů
[39].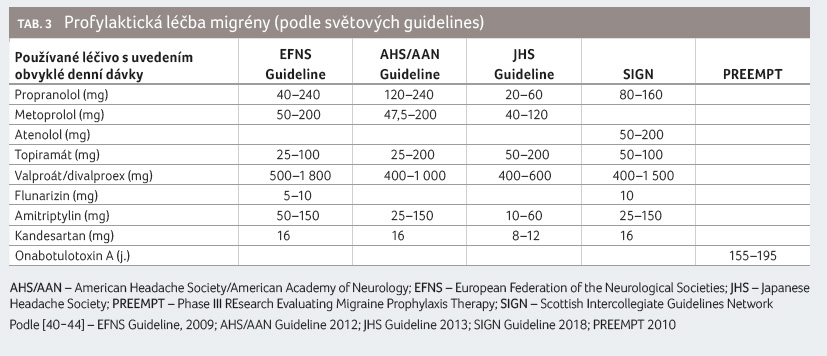
V současné době je aplikace onabotulotoxinu A indikována jako jediná registrovaná léčba u pacientů trpících CM (≥ 15 dní s bolestí hlavy) rezistentních na tři a více preventivních léků. Terapie je k dispozici v centrech pro diagnostiku a léčbu bolestí hlavy, v ČR však není onabotulotoxin A v této indikaci hrazen zdravotními pojišťovnami, a tak jedna aplikace vyjde řádově na několik tisíc Kč.
V tabulce 3 je upřesněno dávkování stávající profylaktické léčby migrény podle světových guidelines [40−44].
CGRP monoklonální protilátky
V současnosti probíhají studie fáze II a III u pacientů s EM a CM s protilátkami proti proteinovému fragmentu CGRP (calcitonin gene related peptide) nebo proti jeho receptoru. Humánní erenumab je antagonistou CGRP receptoru a humanizované monoklonální protilátky fremanezumab, galcanezumab a eptinezumab se váží přímo na CGRP (tab. 4).
Ve studii s erenumabem
u EM (STRIVE) bylo randomizováno celkem 955
pacientů: 317 pacientů užívalo dávku 70 mg, 319 pacientů
dávku 140 mg a 319 pacientů dostávalo placebo. Počet dní
s migrénou byl redukován o 3,2 ve skupině s dávkou
70 mg, o 3,7 u dávky 140 mg a jen o 1,8 při
podávání placeba (p < 0,001).
Redukce počtu dní s migrénou o 50 % a více bylo
dosaženo u 43,3 % pacientů [45]. Zlepšení hodnocení
v dotaznících bolestí hlavy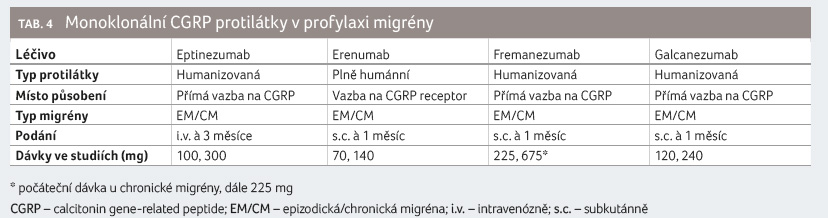 a kvality
života bylo klinicky významné u středně těžké a těžké
migrény a výraznější v rameni s dávkou 140 mg
než 70 mg erenumabu. V klinické studii u CM (n = 667)
bylo rozložení pacientů obdobné a bylo dosaženo redukce
počtu dní s migrénou (–6,6 dne při podávání 70 mg
a 140 mg oproti –4,2 dne ve skupině s placebem).
Nežádoucí účinky byly zjištěny u 45 % pacientů
v aktivních skupinách a nejčastěji to byly bolesti
v místě vpichu, respirační infekty a nauzea. Vedly
k ukončení léčby jen u čtyř pacientů, a to
v případě dvou z nich v placebové skupině a dvou
ve větvi s dávkou 140 mg erenumabu [46]. Erenumab
prokázal též konzistentní účinnost u pacientů s CM
po selhání 1−2 profylaktických terapií.
a kvality
života bylo klinicky významné u středně těžké a těžké
migrény a výraznější v rameni s dávkou 140 mg
než 70 mg erenumabu. V klinické studii u CM (n = 667)
bylo rozložení pacientů obdobné a bylo dosaženo redukce
počtu dní s migrénou (–6,6 dne při podávání 70 mg
a 140 mg oproti –4,2 dne ve skupině s placebem).
Nežádoucí účinky byly zjištěny u 45 % pacientů
v aktivních skupinách a nejčastěji to byly bolesti
v místě vpichu, respirační infekty a nauzea. Vedly
k ukončení léčby jen u čtyř pacientů, a to
v případě dvou z nich v placebové skupině a dvou
ve větvi s dávkou 140 mg erenumabu [46]. Erenumab
prokázal též konzistentní účinnost u pacientů s CM
po selhání 1−2 profylaktických terapií.
Fremanezumab byl hodnocen u 875 pacientů s EM rozdělených do tří skupin: s vyšší dávkou fremanezumabu 625 mg podanou jednorázově, s dávkou 225 mg podanou v intervalu 4 týdnů a do skupiny placebové. Při odečtu efektu placeba byl počet dní s migrénou redukován o 1,3, resp. 1,5 dne. Nejčastějšími nežádoucími účinky vedoucími k ukončení léčby byly erytém nebo otok v místě aplikace, průjem, úzkost a deprese [47]. U vysoce frekventní a chronické migrény bylo při různých dávkovacích schématech a parametrech dosaženo významného zlepšení ve dnech s migrénou, s akutní medikací a zvýšil se podíl respondérů.
Obdobných výsledků bylo dosaženo i v klinických studiích hodnotících podávání galcanezumabu u pacientů s EM (EVOLVE 1, EVOLVE 2) s redukcí počtu dní s bolestí hlavy o 2 dny, respektive 1,9 dne při dávce 120 mg a 240 mg podávaných subkutánně. Zaznamenaným nežádoucím účinkem byl pouze erytém v místě vpichu jako u předchozích protilátek [48].
Akupunktura
Když byla akupunktura porovnávána s metroprololem ve studii Strenga a kol., byla zjištěna redukce počtu dní trpících bolestí hlavy o 2,5 dne při akupunktuře a o 2,2 dne ve skupině pacientů užívajících metoprolol a podíl respondérů (snížení frekvence záchvatů o více než 50 %) byl 61 %, respektive 49 % [49]. Avšak systematická review klinických studií mezi roky 2005 a 2006 ukázala, že většina studií neprokázala signifikantní zlepšení (13/22 = 59 %), a bylo zjištěno, že shamová akupunktura byla stejně účinná jako akupunktura pravá.
Obstřik výstupů okcipitálního nervu
Blok okcipitálních nervů se užívá u více typů bolestí hlavy. Mechanismem účinku je ovlivnění trigeminocervikálního komplexu (cervikální část jádra V. nervu) via segment C2 a následný vliv na systém trigeminovaskulární. Kontrolované studie u migrény jsou nečetné. Ve studii s 97 pacienty s migrénou v porovnání s 87 pacienty s potraumatickou bolestí hlavy při užití kombinace lidokainu a metylprednisolonu došlo u 54 % pacientů s migrénou ke zlepšení trvajícímu šest měsíců [50].
Neurostimulační metody v léčbě migrény
Neuromodulace dosahuje v posledních letech velkého rozmachu a stává se alternativou farmakologické léčby s absencí biochemických nežádoucích účinků. Vedle terapie Parkinsonovy nemoci, epilepsie a farmakorezistentních periferních bolestivých stavů se neurostimulace stává možnou alternativou i v léčbě bolestí hlavy. Kromě migrény se využívá v léčbě cluster headache nebo bolestivých kraniálních neuropatií. Metody neurostimulace u migrény jsou relativně méně invazivní než například u cluster headache.
Jednopulzová transkraniální magnetická stimulace
Efekt jednopulzové transkraniální magnetické stimulace (sTMS) byl prokázán při akutní léčbě EM s aurou [51]. Teoreticky magnetické pole generované přístrojem proniká do mozkové kůry a inhibuje šířící se kortikální depresi. Rozsáhlejší studie (ESPOUSE) potvrdila účinek sTMS v profylaxi EM, kdy počet respondérů tvořil 46 % pacientů (p < 0,0001). Současně byl redukován počet dní se záchvaty (o 2,5 dne), s akutní medikací a snížilo se skóre v head impact testu (HIT-6) (p < 0,0001) [52]. Závažné nežádoucí účinky nebyly pozorovány. V Evropské unii je metoda certifikována pro akutní léčbu migrény s aurou, bez aury a k profylaxi EM.
Transkutánní stimulace supraorbitálního nervu (tSNS)
Intermitentní transkutánní stimulace obou prvních větví trigeminu byla testována v multicentrické randomizované dvojitě zaslepené (tzv. sham stimulace) studii PREMICE u EM v intervalech 20 minut denně po tři měsíce [53]. Počet respondérů činil 38,1 % s redukcí frekvence bolestí o dva dny. Nebyly zaznamenány vedlejší účinky.
Stimulace nervus vagus
V pozorování pacientů s farmakorezistentní epilepsií a migrénou bylo po implantaci systému stimulace n. vagus (VNS) zjišťováno zmírnění bolestí hlavy až u tří ze čtyř pacientů. Jelikož je implantace VNS relativně invazivní, byly vyvinuty transkutánní varianty stimulátoru – pro stimulaci nervus vagus v cervikální (nVNS) nebo aurikulární oblasti (tVNS). Určité zlepšení u pacientů s CM bylo prokázáno ve studii EVENT [54].
Stimulace okcipitálního nervu
Stimulace okcipitálního nervu (ONS) je používána od konce 90. let minulého století, nejdříve k léčbě neuralgie okcipitálních nervů a cervikogenních bolestí hlavy. Perkutánní ONS pro jiné diagnózy zmírnila i bolesti hlavy charakteru migrény a současné vyšetření mozku pozitronovou emisní tomografií ukázalo na ovlivnění mnoha podkorových a korových struktur. Princip působení je popsán výše u obstřiku okcipitálního nervu. Elektroda se implantuje subkutánně na výstupy okcipitálních nervů oboustranně. Efekt byl prokázán v několika randomizovaných zaslepených (sham) multicentrických studiích u více než 300 pacientů s CM se signifikantním poklesem počtu dní s migrénou (PRISM, ONSTIM, St. Jude) [55]. Implantace ONS může být akutně komplikována infekcí v průběhu elektrody, její migrací a při vyšších parametrech nastavení i kratší životností baterie (existuje ale dobíjitelný stimulátor). Tato metoda je v ČR dostupná [56], nicméně nyní je dávána přednost méně invazivním způsobům léčby, jako jsou CGRP protilátky nebo onabotulotoxin A.
Seznam použité literatury
- [1] Headache Classification Committee of the International Headache Society (IHS). The International Classification of Headache Disorders, 3rd edition. Cephalalgia 2018; 38: 1–211.
- [2] World Health Organization. World Health Statistics 2013 (A Wealth Of Information Of Global Public Health). WHO Document Production Services: Switzerland, Geneva: 1–168.
- [3] Diamond S, Bigal M, Silberstein SD, et al. A Patterns of Diagnosis and Acute and Preventive Treatment for Migraine in the United States: Results from the American Migraine Prevalence and Prevention Study. Headache 2007; 47: 355−363.
- [4] Rokyta R, Kršiak M, Kozák J. Bolest. Praha: Tigis, 2006, 684 s.
- [5] Buzzi MG, Sakas DE, Moskowitz MA. Indometacin and acetylsalicylic acid block neurogenic plasma protein extravasation in rat dura mater. Eur J Pharmacol 1989; 165: 251–258.
- [6] Niedermayerová I. Nimesulid v léčbě akutních bolestivých stavů v ordinaci praktického lékaře. Med praxi 2015; 12: 72–76.
- [7] Affaitati G, Fabrizio A, Lopopolo M, et al. Use of NSAIDs for migraine attacks: Results from retrospective analysis in Italian headache center. Presented in 15th World Congress on Pain, Buenos Aires, October 6–11, 2014.
- [8] Giacovazzo M, Gallo MF, Guidi V, et al. Nimesulide in the treatment menstrual migraine. Drugs 1993; 46(Suppl. 1): 140–141.
- [9] Cameron C. Triptans in the Acute Treatment of Migraine: A Systematic Review and Network Meta‑Analysis. Headache 2015; 55(Suppl 4): 221−235.
- [10] Keam SJ, Goa KL, Figgitt DP. Almotriptan: a review of its use in migraine. Drugs 2002; 62: 387−414.
- [11] Law S, Derry S, Moore RA. Sumatriptan plus naproxen for the treatment of acute migraine attacks in adults. Cochrane Database Syst Rev 2016 Apr 20; 4: CD008541.
- [12] Offie P, Soldin PO, Hahlin J, et al. Triptans in Pregnancy. Ther Drug Monit 2008; 30: 5–9.
- [13] Duong S, Bozzo P, Nordeng H, et al. Safety of triptans for migraine headaches during pregnancy and breastfeeding. Can Fam Physician 2010; 56: 537–539.
- [14] Spielmann KK, Kayser A, Evelin Beck E, et al. Pregnancy outcome after anti‑migraine triptan use: A prospective observational cohort study. Cephalalgia 2018; 38: 1081−1092.
- [15] Kotas R. Bolest hlavy v klinické praxi. Praha: Maxdorf, 2015: 312 s.
- [16] Kuca B, Wietecha L, Berg P, et al. Lasmiditan (200 and 100 mg) Compared to Placebo for Acute Treatment of Migraine. Headache 2017; 8: 1311−1312.
- [17] Ho TW, Connor KM, Zhang Y, et al. Randomized controlled trial of the CGRP receptor antagonist telcagepant for migraine prevention. Neurology 2014; 83: 958−966.
- [18] Silberstein SD. Practice parameter: evidence‑based guidelines for migraine headache (an evidence‑based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2000; 55: 754−762.
- [19] Ziegler DK, Hurwitz A, Hassanein R, et al. Migraine prophylaxis. A comparison of propranolol and amitriptyline. Arch Neurol 1987; 44: 486–489.
- [20] Steiner JT, Joseph R, Hedman C, et al. Metoprolol in the prophylaxis of migraine: parallel‑groups comparison with placebo and dose‑ranging follow‑up. Headache 1988; 28: 15–23.
- [21] Johannsson V, Nilsson LR, Widelius T, et al. Atenolol in migraine prophylaxis a double‑blind cross‑over multicentre study. Headache 1987; 27: 372–374.
- [22] Cutrer M, Moskowitz MA. The actions of valproate and neurosteroids in a model of trigeminal pain. Headache 1996; 36: 579–585.
- [23] Hering R, Kuritzky A. Sodium valproate in the prophylactic treatment of migraine: a double‑blind study versus placebo. Cephalalgia 1992; 12: 81–84.
- [24] Holmes, LB, Harvey, EA, Coull, BA et al. The teratogenity of anticonvulsant drugs, N Engl J Med 2001; 344: 1132−1138.
- [25] Meador K, Baker G, Browning N, et al. Cognitive function at 3 years of age after fetal exposure to antiepileptic drugs. N Engl J Med 2009; 360: 1597–1605.
- [26] Brandes JL, Saper JR, Diamond M, et al. Topiramate for migraine prevention: a randomized controlled trial. JAMA 2004; 291: 965–973.
- [27] Silberstein SD, Neto V, Schmitt J, et al. Topiramate in migraine prevention: results of a large controlled trial. Arch Neurol 2004; 61: 490–495.
- [28] Silberstein SD, Lipton RB, Dodick DW, et al. Efficacy and safety of topiramate for the treatment of chronic migraine: a randomized, double‑blind, placebo‑controlled trial. Headache 2007, 47: 170–180.
- [29] Bermejo PE, Dorado R. Zonisamide for migraine prophylaxis in patients refractory to topiramate. Clin Neuropharmacol 2009; 32: 103−106.
- [30] Pascual‑Gómez J, Gracia‑Naya M, Leira R, et al. Zonisamide in the preventive treatment of refractory migraine. Rev Neurol 2010; 50: 129−132.
- [31] Dodick DW, Freitag F, Banks J, et al. Topiramate versus amitriptyline in migraine prevention: a 26‑week, multicenter, randomized, double‑blind, double‑dummy, parallel‑group noninferiority trial in adult migraineurs. Clin Ther 2009; 31: 542–559.
- [32] Ozyalcin SN, Talu GK, Kiziltan E, et al. The efficacy and safety of venlafaxine in the prophylaxis of migraine. Headache 2005; 45: 144–152.
- [33] Luo N, Di W, Zhang A, et al. A randomized, one‑year clinical trial comparing the efficacy of topiramate, flunarizine, and a combination of flunarizine and topiramate in migraine prophylaxis. Pain Medicine 2012; 13: 80–86.
- [34] Stovner LJ, Linde M, Gravdahl GB, et al. A comparative study of candesartan versus propranolol for migraine prophylaxis: A randomised, triple‑blind, placebo controlled, double cross‑over study. Cephalalgia 2014; 34: 523−532.
- [35] Cleland PG, Barnes D, Elrington GM, et al. Studies to assess if pizotifen prophylaxis improves migraine beyond the benefit offered by acute sumatriptan therapy alone. Eur Neurol 1997; 38: 31−38.
- [36] Peikert A, Wilimzig C, Köhne‑Volland R. Prophylaxis of Migraine with Oral Magnesium: Results from a Prospective, Multi‑Center, Placebo‑Controlled and Double‑Blind Randomized Study. Cephalalgia 1996; 16: 257−263.
- [37] Lipton RB, Göbel H, Einhäupl KM, et al. Petasites hybridus root (butterbur) is an effective preventive treatment for migraine. Neurology 2004; 63: 2240−2244.
- [38] Diener HC, Dodick DW, Aurora SK, et al. Onabotulinumtoxin A for treatment of chronic migraine: results from the double‑blind, randomized, placebo‑controlled phase of the PREEMPT 2 trial. Cephalalgia 2010; 30: 804−814.
- [39] Blumenfeld AM, Stark RJ, Freeman MC, et al. Long term study of the efficacy and safety of Onabotulinumtoxin A for the prevention of chronic migraine: COMPEL study. J Headache Pain 2018; 19: 13.
- [40] Evers S, Afra J, Frese A, et al.; European Federation of Neurological Societies; EFNS guideline on the drug treatment of migraine‑revised report of an EFNS task force. Eur J Neurol 2009; 16: 968−981.
- [41] Silberstein SD, Holland S, Freitag F, et al; Quality Standards Subcommittee of the American Academy of Neurology and the American Headache Society. Evidence‑based guideline update: pharmacologic treatment for episodic migraine prevention in adults: report of the Quality Standards Subcommittee of the American Academy of Neurology and the American Headache Society. Neurology 2012; 78: 1337−1345.
- [42] Nobuo Araki N, Takeshima T, Eiichiro N, et al. Chronic Headache Clinical Practice Guideline Development Committee. Clinical Practice Guideline for Chronic Headache 2013. The Japanese Headache Society website.
- [43] Duncan C, Carod Artal FJ, Coulson A, et al.; Scottish Intercollegiate Guidelines Network. Publication 155. Pharmacological management of migraine. A national clinical guideline. Edinburg: SIGN; February 2018.
- [44] Dodick DW, Turkel CC, DeGryse RE, et al.; PREEMPT Chronic Migraine Study Group. Onabotulinumtoxin A for treatment of chronic migraine: pooled results from the double‑blind, randomized, placebo‑controlled phases of the PREEMPT clinical program. Headache 2010; 50: 921−936.
- [45] Goadsby PJ, Reuter U, Hallström Y, et al. A Controlled Trial of Erenumab for Episodic Migraine. N Engl J Med 2017; 377: 2123−2132.
- [46] Tepper S, Ashina M, Reuter U, et al. Safety and efficacy of erenumab for preventive treatment of chronic migraine: a randomised, double‑blind, placebo‑controlled phase 2 trial. Lancet Neurol 2017; 16: 425−434.
- [47] Dodick DW, Silberstein SD, Bigal ME, et al. Effect of Fremanezumab Compared With Placebo for Prevention of Episodic Migraine: A Randomized Clinical Trial. JAMA 2018; 319: 1999−2008.
- [48] Skljarevski V, Matharu M, Millen BA, et al. Efficacy and safety of galcanezumab for the prevention of episodic migraine: Results of the EVOLVE‑2 Phase 3 randomized controlled clinical trial. Cephalalgia 2018; 38: 1442−1454.
- [49] Streng A, Linde K, Hoppe A, et al. Effectiveness and tolerability of acupuncture compared with metoprolol in migraine prophylaxis. Headache 2006; 46: 1492–1502.
- [50] Gawel, MJ, Rothbart PJ. Occipital nerve block in the management of headache and cervical pain. Cephalalgia 1992; 12: 9–13.
- [51] Lipton RB, Dodick DW, Silberstein SD, et al. Single‑pulse transcranial magnetic stimulation for acute treatment of migraine with aura: a randomised, double‑blind, parallel‑group, sham‑controlled trial. Lancet Neurol 2010; 9: 373–380.
- [52] Starling AJ, Tepper SJ, Marmura MJ, et al. A multicenter, prospective, single arm, open label, observational study of sTMS for migraine prevention (ESPOUSE Study). Cephalalgia 2018; 38: 1038−1048.
- [53] Schoenen J, Vandersmissen B, Jeangette S, et al. Prevention of migraine by supraorbital transcutaneous neurostimulation using the Cefaly® device (PREMICE): a multi‑centre, randomized, sham‑controlled trial. J Headache Pain 2013; 14(Suppl 1): 184.
- [54] Silberstein SD, Calhoun AH, Lipton RB, et al. Chronic migraine headache prevention with noninvasive vagus nerve stimulation: The EVENT study. Neurology 2016; 87: 529−538.
- [55] Silberstein SD, Dodick D, Saper J, et al. The safety and efficacy of occipital nerve stimulation for the management of chronic migraine: results from a prospective, multicenter, double‑blind, controlled study. Cephalalgia 2012; 32: 1165−1179.
- [56] Nežádal T, Masopust V, Urgošík D, et al. Occipital nerve stimulation – first Czech experiences. Cephalalgia 2015; 35: 111−112.