Moderní léčba nehodgkinských lymfomů
Nehodgkinské lymfomy (NHL) představují pestrou skupinu nádorů lymfatické tkáně, v jejichž diagnostice, klasifikaci a léčbě bylo dosaženo velkého pokroku. Tento přehled uvádí nejčastější podtypy NHL a možnosti jejich standardní léčby. V tabulkách jsou uvedeny nové léky, které se v léčbě pacientů s NHL zkoušejí a jejichž indikace dosud není zcela definitivně určena.
Úvod
Nehodgkinské lymfomy (NHL) představují velmi pestrou skupinu nádorových lymfoproliferativních onemocnění, která vycházejí z lymfocytů B, T, NK buněk nebo z jejich prekurzorů. Výskyt NHL u dětí je velmi nízký, ale s přibývajícím věkem významně stoupá. V přepočtu na 100 000 obyvatel je v České republice výskyt NHL u mužů 13,4 a u žen 12,3. V etiopatogenezi se uplatňují: chromozomální translokace, např. t(14;18), t(11;14), t(8;14), infekce, např. Helicobacter pylori, chlamydiové infekce, dále virové infekce, jako např. EBV, HHV8, HIV, předchozí imunosupresivní léčba.NHL mohou kromě lymfatických uzlin postihovat prakticky kterýkoli orgán nebo tkáň a u pacientů se mohou vyskytovat tzv. B-příznaky: váhový úbytek větší než 10 % tělesné hmotnosti za posledních 6 měsíců, teploty vyšší než 38 °C a intenzivní noční pocení. Různé typy NHL se mezi sebou liší jednak rychlostí nádorového růstu (od pomalu rostoucích, tzv. indolentních lymfomů až po vysoce agresivní lymfomy, jako je Burkittův lymfom), dále se liší svou odpovědí na léčbu a celkovou prognózou. Různé biologické chování lymfomů si vyžaduje různý přístup k léčbě – u vysoce agresivních lymfomů je nutná agresivní léčba, naproti tomu u folikulárních NHL je u části pacientů možné s léčbou vyčkat.
Monoklonální protilátky
Zavedení monoklonální protilátky rituximabu do léčby v průběhu posledních dvou desetiletí, a to zejména v kombinaci s chemoterapií, významně prodloužilo dobu do progrese, prodloužilo celkové přežití pacientů a zlepšilo kvalitu jeji![Obr. 1 Zjednodušené schéma pravděpodobného mechanismu účinku rituximabu; upraveno podle [46] – Moreland, 2006. Rituximab snižuje počet cirkulujících B lymfocytů u pacientů s lymfomem pomocí několika předpokládaných odlišných mechanismů. CD20 je antigen, který se vyskytuje na buněčném povrchu středních vývojových fází B lymfocytů, ale nikoli na kmenových buňkách, časných buňkách a na plazmatických buňkách. • Rituximab se silně váže na Fc receptory makrofágů, monocytů nebo NK buněk. K zániku B lymfocytů tak dochází cestou cytotoxické reakce závislé na protilátkách (antibody-dependent cellular cytotoxicity, ADCC). • Po vazbě Fc domén rituximabu na antigen CD20 se spouští klasická cesta aktivace komplementu, která vede k tvorbě tzv. membránu atakujícího komplexu (MAC). MAC (označovaný také jako lytický pór) perforuje membránu B lymfocytu, což způsobí zánik B lymfocytu. Jde o komplement-dependentní cytotoxicitu (CDC). • Rituximab dává svou vazbou na povrchový antigen CD20 přímý signál k navození apoptózy – programované buněčné smrti.](https://www.remedia.cz/photo-a-29711---.jpg) ch života. Rituximab je chimérická myší/humánní monoklonální protilátka namířená proti povrchovému antigenu CD20, který se nachází na B lymfocytech včetně nádorových B buněk a navozuje apoptózu těchto buněk. Rituximab působí částečně i přes Fc receptory NK buněk a makrofágů a vede k zániku buněk prostřednictvím cytotoxicity závislé na protilátce (antibody-dependent cellular cytotoxicity, ADCC). Dalším možným mechanismem zániku nádorových B lymfocytů vlivem rituximabu je cytotoxicita závislá na komplementu (complement-dependent cytotoxicity, CDC), viz obr. 1. Nově se vedle intravenózní aplikace rituximabu používá i jeho subkutánní forma, která významně zkrátí dobu aplikace kombinované imunochemoterapie.
ch života. Rituximab je chimérická myší/humánní monoklonální protilátka namířená proti povrchovému antigenu CD20, který se nachází na B lymfocytech včetně nádorových B buněk a navozuje apoptózu těchto buněk. Rituximab působí částečně i přes Fc receptory NK buněk a makrofágů a vede k zániku buněk prostřednictvím cytotoxicity závislé na protilátce (antibody-dependent cellular cytotoxicity, ADCC). Dalším možným mechanismem zániku nádorových B lymfocytů vlivem rituximabu je cytotoxicita závislá na komplementu (complement-dependent cytotoxicity, CDC), viz obr. 1. Nově se vedle intravenózní aplikace rituximabu používá i jeho subkutánní forma, která významně zkrátí dobu aplikace kombinované imunochemoterapie.
Do druhé generace monoklonálních protilátek anti-CD20, které se zkoušejí v klinických studiích u NHL, patří: ocrelizumab, ofatumumab a veltuzumab. V klinických studiích se testuje účinnost dalších monoklonálních protilátek, které jsou zaměřeny na jiné povrchové antigeny, např. epratuzumab (anti-CD22), galiximab (anti-CD80), mogamulizumab (protilátka proti CCR4), alemtuzumab (anti-CD52) a blinatumomab (anti-CD3/anti-CD19).
Nově se v ČR zavádí do terapie brentuximab vedotin (BV), je to konjugát protilátky anti-CD30 a antimikrotubulárního agens monomethylauristatinu E, který je účinný v léčbě Hodgkinova lymfomu, dále u systémového anaplastického velkobuněčného T lymfomu a u dalších lymfoproliferací, které jsou CD30-pozitivní. 90Y-ibritumomab tiuxetan je kombinací myší protilátky anti-CD20, na kterou je navázán radioizotop 90Y.
Nové léky
I když se zvyšuje počet nových monoklonálních protilátek samotných nebo konjugovaných s radioizotopy, část lymfomů je vůči nim rezistentní. Proto se testují nové látky, které mají jiný mechanismus účinku. Používají se buď samostatně, nebo v kombinaci s rituximabem, případně s chemoterapií, patří sem:
- inhibitory proteazomu (bortezomib, salinosporamid A, carfilzomib),
- inhibitory histondeacetylázy (vorinostat, romidepsin, MGCD0103),
- imunomodulační látky (např. lenalido-
- mid),
- inhibitory mTOR (temsirolimus, everolimus, perifosin, GS1101),
- inhibitory Bcl-2 (oblimersen, navitoclax),
- inhibitory proteinkinázy C (např. enzastaurin),
- antiangiogenní látky (např. bevacizumab),
- inhibitory Brutonovy kinázy (např. ibrutinib),
- inhibitory Syk (např. fostamatinib),
- bendamustin (cytotoxická látka vyvinutá v roce 1963) – antimetabolit, který má současně alkylační vlastnosti.
Nežádoucí účinky
Z nežádoucích účinků monoklonálních protilátek se nejčastěji vyskytuje zejména při první aplikaci alergická reakce, dále v průběhu léčby hematologická toxicita a infekce. Po podání brentuximab vedotinu se u 31 % pacientů vyskytla závažná periferní neuropatie a bolesti břicha a v případě kombinace s chemoterapií i plicní toxicita. Po blinatumomabu se přechodně objevila toxicita centrálního nervového systému (encefalopatie, tremor, afázie). Ibrutinib inhibuje funkci trombocytů s projevy krvácení. Po léčbě inhibitory mTOR byla hlášena hematologická toxicita a pneumonitida. Inhibitory histondeacetylázy, Syk a Bcl-2 byly spojeny s hematologickou toxicitou.
Radioterapie
Pro léčbu některých podtypů NHL má své jasně určené místo radioterapie. Uplatní se u primárního lymfomu centrální nervové soustavy (CNS) nebo u NK/T lymfomu nazálního typu, naopak v léčbě dalších lymfomů, jako např. DLBCL, je radioterapie na ústupu. Obecně je snaha maximálně radioterapii omezit (dávky radioterapie a ozařovací pole) vzhledem k jejím dlouhodobým nežádoucím účinkům, zejména k riziku sekundárních nádorů.
Přehled použitých zkratek chemoterapeutických režimů s rituximabem
R-CHOP (rituximab, cyklofosfamid, doxorubicin, vinkristin, prednison)
R-ACVBP (rituximab, doxorubicin, cyklofosfamid, vindesin, bleomycin, prednison)
R-CHOEP (rituximab, cyklofosfamid, doxorubicin, vinkristin, etoposid, prednison)
R-DHAP (rituximab, dexamethason, cytarabin, cisplatina, prednison)
R-ESHAP (rituximab, etoposid, cytarabin, methylprednisolon, cisplatina)
R-ICE (rituximab, ifosfamid, cytarabin, etoposid)
R-FCM (rituximab, fludarabin, cyklofosfamid, mitoxantron)
R-CVAD (rituximab, cyklofosfamid, vinkristin, doxorubicin, dexamethason)
R-MA (methotrexát, cytarabin)
Difuzní velkobuněčný B-lymfom
Difuzní velkobuněčný B-lymfom (DLBCL) patří mezi agresivní lymfomy a tvoří v České republice 40 % všech NHL. Z biologického hlediska jde o heterogenní onemocnění, které se dále dělí na několik podtypů na základě morfologie, imunohistochemie, průtokové cytometrie a molekulární genetiky. K posouzení prognózy se používá mezinárodní prognostický index (International Prognostic Index, IPI) a IPI upravený podle věku (age adjusted, aaIPI). K rizikovým faktorům, které se hodnotí v rámci IPI, se řadí: věk, extranodální postižení, klinické stadium III nebo IV, zvýšená aktivita laktátdehydrogenázy (LDH) a výkonnostní stav. U pacientů v časném stadiu onemocnění I–II je 5leté přežití bez progrese (progression-free survival, PFS) 80–85 %. Pacienti v pokročilém klinickém stadiu III–IV dosahují 5letého PFS v 50 %. Standardem první linie léčby u pacientů s DLBCL bez „bulku“ (velké nádorové masy) a s nízkým IPI je 6 cyklů chemoterapie označované jako R-CHOP + 2 × R (2 cykly rituximabu v monoterapii) [1]. U pacientů s DLBCL a s „bulkem“ (definovaným nádorovou masou ≥ 7 cm) v kombinaci s nízkým IPI nebo s nízkým až intermediárním IPI je doporučena léčba 6 cykly R-CHOP + 2 × R s možnou následnou radioterapií na úvodní „bulky“ postižení nebo intenzifikovaná chemoterapie R-ACVBP [2]. U mladých pacientů s DLBCL a intermediárním až vysokým nebo vysokým IPI je stanovení standardu obtížné, protože režim R-CHOP není dostatečně účinný (3letý PFS < 50 %). Zkoušejí se intenzivnější režimy, např. R-CHOEP14, R-ACVBP, R-MegaCHOP + R-ESHAP. Nevýhodou intenzifikovaných režimů je jejich vyšší hematologická toxicita, která je spojena zejména s vyšším rizikem závažných infekcí.
U pacientů ve věku 60–80 let je doporučeno podání 8 cyklů R-CHOP nebo 6 cyklů R-CHOP + 2 × R. U relabujících pacientů ve věku do 65 let se používají tři cykly záchranné imunochemoterapie: R-DHAP nebo R-ESHAP
nebo R-ICE [3]. Po zác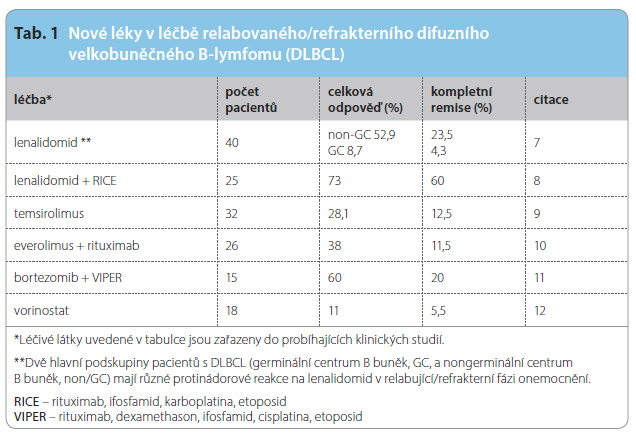 hranné imunochemoterapii následuje konsolidace vysokodávkovanou chemoterapií s autologní transplantací kmenových buněk (ASCT) [4]. V relapsu je možné použít i režimy na bázi gemcitabinu a oxaliplatiny [5, 6]. Alogenní transplantace kmenových buněk je vhodná ve vybraných případech, pokud selhala ASCT. U relabovaných nebo refrakterních pacientů, u nichž došlo k relapsu po ASCT nebo nejsou schopni ASCT absolvovat, probíhají klinické studie s novými léky, viz tab. 1. Nové léky se zkoušejí samostatně nebo v kombinaci s chemoterapií.
hranné imunochemoterapii následuje konsolidace vysokodávkovanou chemoterapií s autologní transplantací kmenových buněk (ASCT) [4]. V relapsu je možné použít i režimy na bázi gemcitabinu a oxaliplatiny [5, 6]. Alogenní transplantace kmenových buněk je vhodná ve vybraných případech, pokud selhala ASCT. U relabovaných nebo refrakterních pacientů, u nichž došlo k relapsu po ASCT nebo nejsou schopni ASCT absolvovat, probíhají klinické studie s novými léky, viz tab. 1. Nové léky se zkoušejí samostatně nebo v kombinaci s chemoterapií.
Folikulární lymfom
Folikulární lymfom tvoří v České republice 20 % všech NHL. Rizikové faktory a prognóza jsou určeny pomocí mezinárodního prognostického indexu pro folikulární lymfomy (Follicular Lymphoma International Prognostic Index, FLIPI), který zahrnuje věk, klinické stadium, počet postižených uzlinových oblastí, hladinu hemoglobinu a LDH. Pacienti v klinickém stadiu IA nebo IIA s nízkým rizikem jsou léčeni radioterapií „involved field“ nebo „involved site“ v dávce 24–35 Gy. Retrospektivní analýza z databáze SEER, ve které bylo vyhodnoceno 6568 pacientů s folikulárním lymfomem v klinickém stadiu I nebo II, prokázala zlepšení celkového přežití po 5, 10, 15 a 20 letech (81 %, 62 %, 45 % a 35 %) v rameni s časným ozářením oproti skupině bez ozáření (71 %, 48 %, 34 % a 23 %), p < 0,0001, a současně prokázala i zlepšení přežití v souvislosti se základním onemocněním, p < 0,0001 [13]. U pacientů v klinickém stadiu II s „bulkem“ nebo ve stadiích III–IV se symptomatickou nemocí (B-symptomy, velikost postižených uzlin větší než 3 cm, splenomegalie, orgánová komprese, výpotky, cytopenie, „bulky“ masa) je indikována léčba 6–8 cykly R-CHOP, která dosahuje celkové odpovědi 81 %, z toho ve 41 % dochází ke kompletním remisím [14]. Pacientům je dále podávána udržovací léčba rituximabem v intervalu jednou za 2 měsíce po dobu dvou let [15]. Z takto léčených zůstává 71,5 % pacientů v kompletní remisi po dvou letech od první linie léčby a v mediánu sledování 36 měsíců je PFS 74,9 %. Z výsledků studie fáze III vyplývá, že kombinace bendamustinu s rituximabem je v první linii méně toxická a dosahuje vyššího PFS ve srovnání s léčbou R-CHOP (medián PFS 69,5 měsíce vs. 31,2 měsíce, p < 0,0001), ale celkové přežití se mezi oběma skupinami neliší [16]. Podávání rituximabu sam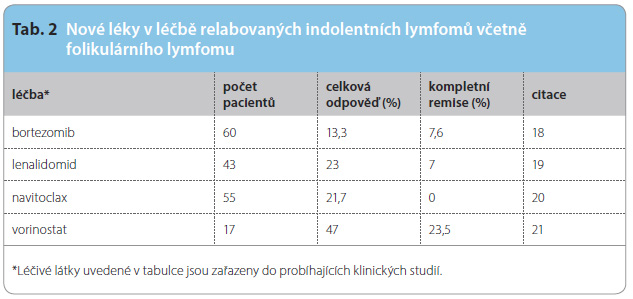 otného je vhodné u starších pacientů, kteří vzhledem k nežádoucím účinkům nejsou schopni zvládnout chemoterapii. V konsolidaci po první linii léčby u pacientů v kompletní nebo parciální remisi s pokročilým folikulárním lymfomem je možné kromě rituximabu použít radioimunoterapii s 90Y-ibritumomabem, který zlepšuje 8letý PFS o 19 % a prodlužuje dobu do další léčby o 5,1 roku [17]. Při prvním relapsu je možné podávat imunochemoterapii, která se používá v první linii, nebo alternativně kombinaci: bendamustin s bortezomibem a rituximabem, dále R-FCM nebo radioimunoterapii s 90Y-ibritumomabem. Vysokodávkovanou léčbu s ASCT je možné použít při druhém nebo dalším relapsu. Ve vybrané skupině mladších pacientů je při relapsu vhodnou alternativou i alogenní transplantace kmenových buněk. Použití některých nových léků u relabovaného/refrakterního folikulárního lymfomu je shrnuto v tab. 2.
otného je vhodné u starších pacientů, kteří vzhledem k nežádoucím účinkům nejsou schopni zvládnout chemoterapii. V konsolidaci po první linii léčby u pacientů v kompletní nebo parciální remisi s pokročilým folikulárním lymfomem je možné kromě rituximabu použít radioimunoterapii s 90Y-ibritumomabem, který zlepšuje 8letý PFS o 19 % a prodlužuje dobu do další léčby o 5,1 roku [17]. Při prvním relapsu je možné podávat imunochemoterapii, která se používá v první linii, nebo alternativně kombinaci: bendamustin s bortezomibem a rituximabem, dále R-FCM nebo radioimunoterapii s 90Y-ibritumomabem. Vysokodávkovanou léčbu s ASCT je možné použít při druhém nebo dalším relapsu. Ve vybrané skupině mladších pacientů je při relapsu vhodnou alternativou i alogenní transplantace kmenových buněk. Použití některých nových léků u relabovaného/refrakterního folikulárního lymfomu je shrnuto v tab. 2.
Lymfom marginální zóny
Do skupiny lymfomů marginální zóny (MZL) patří podle klasifikace WHO (Světová zdravotnická organizace) lymfomy označované jako extranodální MALT (mucosa associated lymphoma tissue), splenický MZL a nodální MZL. U pacientů s MALT v žaludku ve stadiu I–II, který je pozitivní na Helicobacter pylori, je nutná jeho eradikace pomocí kombinace inhibitoru protonové pumpy s klarithromycinem a amoxicilinem nebo metronidazolem po dobu 10 až 14 dnů. U pacientů s MALT v žaludku bez přítomnosti Helicobacter pylori je základem léčby podle doporučení ESMO (European Society of Medical Oncology) radioterapie včetně ozáření perigastrických uzlin a v případě klinického stadia II i s ozářením paraaortálních a parakaválních uzlin. U pacientů s nodálním MZL jsou principy první linie léčby a léčby relapsu shodné s folikulárním lymfomem, viz tab. 2. U pacientů se splenickým MZL je několik léčebných možností: splenektomie, podávání samotného rituximabu nebo kombinace rituximabu s chemoterapií [22]. Samotný rituximab je málo toxický a léčba dosahuje vysoké celkové odpovědi (> 80 %) a vysokého podílu kompletních remisí (> 40 %).
Lymfom z plášťové zóny
Lymfom z buněk plášťové zóny (mantle cell lymphoma, MCL) představuje 6 % všech NHL a je charakterizován chromozomální translokací t(11;14)(q13;q32), vedoucí k deregulaci exprese cyklinu D1. Z biologického hlediska jde o heterogenní onemocnění. Chemoterapie R-CHOP dosahuje vysokého počtu odpovědí, ale remise trvá pouze 1,5 roku. U pacientů do věku 65 let jsou doporučeny 3 cykly R-CHOP v alternaci s 3 cykly R-DHAP s následnou vysokodávkovanou chemoterapií a ASCT. Tato léčba dosahuje lepších výsledků oproti léčbě samotným R-CHOP bez vysokodávkovaného cytarabinu a bez ASCT: počet dosažených odpovědí je 95 %, medián přežití bez relapsu je 83 měsíců a 5leté celkové přežití 75 % [23]. Podobným režimem je Nordický protokol, který alternuje 3 cykly R-MaxiCHOP s 3 cykly rituximabu spolu s vysokými dávkami cytarabinu s následnou vysokodávkovanou chemoterapií a ASCT [24]. Režim R-HyperCVAD/R-MA (rituximab, cyklofosfamid, vinkristin, doxorubicin, dexamethason, alternující s m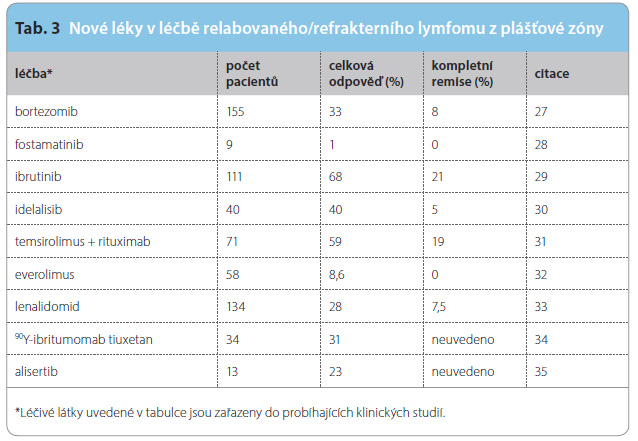 ethotrexátem a cytarabinem) dosahuje celkové odpovědi 97 % (87 % kompletních remisí) a po deseti letech sledování byla doba do selhání léčby 4,6 roku, mediánu přežití nebylo dosaženo [25]. Pacienti starší 60 let, kteří jsou léčeni R-CHOP s následnou udržovací léčbou rituximabem, dosahují 4letého celkového přežití v 87 % [26]. U pacientů s indolentními lymfomy a MCL kombinace BR (bendamustin a rituximab) oproti R-CHOP v první linii léčby signifikantně prodloužila PFS a byla méně toxická, proto je tato kombinace vhodná zejména u pacientů, kde nelze podat doxorubicin [16]. V léčbě relapsů MCL se zkoušejí další léky, jejichž použití u MCL je zatím experimentální, viz tab. 3. Alogenní transplantace je možnou alternativou u mladých pacientů s relabovaným MCL.
ethotrexátem a cytarabinem) dosahuje celkové odpovědi 97 % (87 % kompletních remisí) a po deseti letech sledování byla doba do selhání léčby 4,6 roku, mediánu přežití nebylo dosaženo [25]. Pacienti starší 60 let, kteří jsou léčeni R-CHOP s následnou udržovací léčbou rituximabem, dosahují 4letého celkového přežití v 87 % [26]. U pacientů s indolentními lymfomy a MCL kombinace BR (bendamustin a rituximab) oproti R-CHOP v první linii léčby signifikantně prodloužila PFS a byla méně toxická, proto je tato kombinace vhodná zejména u pacientů, kde nelze podat doxorubicin [16]. V léčbě relapsů MCL se zkoušejí další léky, jejichž použití u MCL je zatím experimentální, viz tab. 3. Alogenní transplantace je možnou alternativou u mladých pacientů s relabovaným MCL.
Nehodgkinské T buněčné lymfomy
Nehodgkinské T buněčné lymfomy (T-NHL) tvoří 10–15 % všech NHL. Jde o pestrou skupinu lymfomů, ve které se vyskytují nejčastěji periferní T lymfom (PTCL), systémový anaplastický velkobuněčný T lymfom (ALCL) s pozitivní nebo negativní kinázou anaplastického lymfomu (ALK) a angioimunoblastový T lymfom (AITL). K určení prognózy se používá prognostický index pro T lymfomy (PIT), který zohledňuje následující rizikové faktory: věk, výkonnostní stav, LDH a Ki-67. V první linii léčby je u všech podtypů T-NHL s výjimkou NK/T lymfomu nazálního typu a T lymfomu spojeného s enteropatií (EATL) doporučena léčba 6krát CHOP nebo CHOEP (s přidáním etoposidu). U pacientů s PIT ≥ 2, kteří dosáhnou kompletní nebo parciální remise po první linii léčby, je vhodné zvážit vysokodávkovanou chemoterapii s ASCT. Pacienti s NK/T lymfomem jsou léčeni L-asparaginázou a lokálním ozářením; 70 % pacientů s T-NHL relabuje nebo jsou refrakterní na první linii léčby. Prognóza pacientů s relapsem T-NHL je špatná: medián přežití bez progre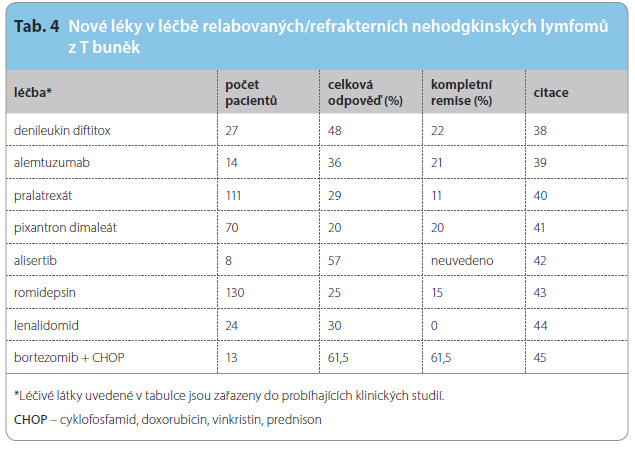 se (PFS) je 3,1 měsíce a medián celkového přežití (OS) 5,5 měsíce. U relabovaných/refrakterních PTCL je možné použít kombinovanou chemoterapii, např. DHAP nebo ICE, která dosahuje celkové odpovědi 62 % [35]. Gemcitabin v kombinaci s cisplatinou a s methylprednisolonem dosahuje celkové odpovědi u relabovaných T-NHL 69 %, z toho je 19 % kompletních remisí a OS 68,2 % [36]. Výše uvedené záchranné režimy umožňují asi 50 % pacientů následně absolvovat vysokodávkovanou léčbu s ASCT nebo alternativně alogenní transplantaci kmenových buněk. Brentuximab vedotin je indikován pro léčbu relabovaného nebo refrakterního ALCL, kde dosahuje celkové odpovědi 86 %, z toho 57 % kompletních remisí [37]. Alemtuzumab (monoklonální protilátka anti-CD52) vede k celkové odpovědi u 36 % pacientů s T-NHL. V kombinaci s chemoterapií je jeho účinnost pouze 30–50 %, navíc odpovědi na léčbu jsou krátkodobé. Jeho využití u nemocných s T-NHL omezuje i fakt, že pouze 30–40 % pacientů s PTCL exprimuje antigen CD52 na povrchu nádorových buněk. Ostatní léky, které se zkoušejí v relapsu T-NHL samotné nebo v kombinaci s další chemoterapií, jsou uvedeny v tab. 4.
se (PFS) je 3,1 měsíce a medián celkového přežití (OS) 5,5 měsíce. U relabovaných/refrakterních PTCL je možné použít kombinovanou chemoterapii, např. DHAP nebo ICE, která dosahuje celkové odpovědi 62 % [35]. Gemcitabin v kombinaci s cisplatinou a s methylprednisolonem dosahuje celkové odpovědi u relabovaných T-NHL 69 %, z toho je 19 % kompletních remisí a OS 68,2 % [36]. Výše uvedené záchranné režimy umožňují asi 50 % pacientů následně absolvovat vysokodávkovanou léčbu s ASCT nebo alternativně alogenní transplantaci kmenových buněk. Brentuximab vedotin je indikován pro léčbu relabovaného nebo refrakterního ALCL, kde dosahuje celkové odpovědi 86 %, z toho 57 % kompletních remisí [37]. Alemtuzumab (monoklonální protilátka anti-CD52) vede k celkové odpovědi u 36 % pacientů s T-NHL. V kombinaci s chemoterapií je jeho účinnost pouze 30–50 %, navíc odpovědi na léčbu jsou krátkodobé. Jeho využití u nemocných s T-NHL omezuje i fakt, že pouze 30–40 % pacientů s PTCL exprimuje antigen CD52 na povrchu nádorových buněk. Ostatní léky, které se zkoušejí v relapsu T-NHL samotné nebo v kombinaci s další chemoterapií, jsou uvedeny v tab. 4.
Závěr
V průběhu posledního desetiletí bylo díky zavedení moderních léčebných postupů a cílené terapie dosaženo v léčbě lymfomů velkého pokroku, který vede u části pacientů k vyléčení, nebo alespoň k významnému prodloužení jejich života. Další prohlubování znalostí o biologii lymfomů umožňuje vývoj a zavedení nových léků selektivně působících na nádorové buňky s cílem léčby, která bude přizpůsobena „na míru“ každému jednotlivému pacientovi.
Seznam použité literatury
- [1] Pfreundschuh M, Trümper L, Osterborg A, et al. CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group. Lancet Oncol 2006; 7: 379–391.
- [2] Récher C, Coiffier B, Haioun C, et al. Intensified chemotherapy with ACVBP plus rituximab versus standard CHOP plus rituximab for the treatment of diffuse large B-cell lymphoma (LNH03-2B): an open-label randomised phase 3 trial. Lancet 2011; 378: 1858–1867.
- [3] Gisselbrecht C, Glass B, Mounier N, et al. Salvage regimens with autologous transplantation for relapsed large B-cell lymphoma in the rituximab era. J Clin Oncol 2010; 28: 4184–4190.
- [4] Mounier N, Canals C, Gisselbrecht C, et al. High-dose therapy and autologous stem cell transplantation in first relapse for diffuse large B cell lymphoma in the rituximab era: an analysis based on data from the European Blood and Marrow Transplantation Registry. Biol Blood Marrow Transplant 2012; 18: 788–793.
- [5] Telio D, Fernandes K, Ma C, et al. Salvage chemotherapy and autologous stem cell transplant in primary refractory diffuse large B-cell lymphoma: outcomes and prognostic factors. Leuk Lymphoma 2012; 53: 836–841.
- [6] Mounier N, El Gnaoui T, Tilly H, et al. Rituximab plus gemcitabine and oxaliplatin in patients with refractory/relapsed diffuse large B-cell lymphoma who are not candidates for high-dose therapy. A phase II Lymphoma Study Association trial. Haematologica 2013; 98: 1726–1731.
- [7] Hernandez-Ilizaliturri FJ, Deeb G, Zinzani PL, et al. Higher response to lenalidomide in relapsed/refractory diffuse large B-cell lymphoma in nongerminal center B-cell-like than in germinal center B-cell-like phenotype. Cancer 2011; 117: 5058–5066.
- [8] Feldman T, Mato AR, Chow KF, et al. Addition of lenalidomide to rituximab, ifosfamide, carboplatin, etoposide (RICER) in first-relapse/primary refractory diffuse large B-cell lymphoma. Br J Haematol 2014 Mar 25. doi: 10.1111/bjh.12846. [Epub ahead of print].
- [9] Smith SM, van Besien K, Karrison T, et al. Temsirolimus has activity in non-mantle cell non-Hodgkin‘s lymphoma subtypes: The University of Chicago phase II consortium. J Clin Oncol 2010; 28: 4740–4746.
- [10] Barnes JA, Jacobsen E, Feng Y, et al. Everolimus in combination with rituximab induces complete responses in heavily pretreated diffuse large B-cell lymphoma. Haematologica 2013; 98: 615–619.
- [11] Elstrom RL, Andemariam B, Martin P, et al. Bortezomib in combination with rituximab, dexamethasone, ifosfamide, cisplatin and etoposide chemoimmunotherapy in patients with relapsed and primary refractory diffuse large B-cell lymphoma. Leuk Lymphoma 2012; 53: 1469–1473.
- [12] Crump M, Coiffier B, Jacobsen ED, et al. Phase II trial of oral vorinostat (suberoylanilide hydroxamic acid) in relapsed diffuse large-B-cell lymphoma. Ann Oncol 2008; 19: 964–969.
- [13] Pugh T, Ballonoff A, Newman F, et al. Improved survival in patients with early stage low-grade follicular lymphoma treated with radiation. A surveillance, epidemiology, and end results database analysis. Cancer 2010; 16: 3843–3851.
- [14] Hiddemann W, Kneba M, Dreyling M, et al. Frontline therapy with rituximab added to the combination of cyclophosphamide, doxorubicin, vincristine, and prednisone (CHOP) significantly improves the outcome for patients with advanced-stage follicular lymphoma compared with therapy with CHOP alone: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group. Blood 2005; 106: 3725–3732.
- [15] Salles G, Seymour JF, Offner F, et al. Rituximab maintenance for 2 years in patients with high tumour burden follicular lymphoma responding to rituximab plus chemotherapy (PRIMA): a phase 3, randomised controlled trial. Lancet 2011; 377: 42–51.
- [16] Rummel MJ, Niederle N, Maschmeyer G, et al. Benda-mustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: an open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet 2013; 381: 1203–1210.
- [17] Morschhauser F, Radford J, Van Hoof A, et al. 90Yttrium--ibritumomab tiuxetan consolidation of first remission in advanced-stage follicular non-Hodgkin lymphoma: updated results after a median follow-up of 7.3 years from the International, Randomized, Phase III First-Line Indolent trial. J Clin Oncol 2013; 31: 1977–1983.
- [18] Di Bella N, Taetle R, Kolibaba K, et al. Results of a phase 2 study of bortezomib in patients with relapsed or refractory indolent lymphoma. Blood 2010; 115: 475–480.
- [19] Witzig TE, Wiernik PH, Moore T, et al. Lenalidomide oral monotherapy produces durable responses in relapsed or refractory indolent non-Hodgkin’s Lymphoma. J Clin Oncol 2009; 27: 5404–5409.
- [20] Wilson WH, O’Connor OA, Czuczman MS, et al. Navitoclax, a targeted high-affinity inhibitor of BCL-2, in lymphoid malignancies: a phase 1 dose-escalation study of safety, pharmacokinetics, pharmacodynamics, and antitumour activity. Lancet Oncol 2010; 11: 1149–1159.
- [21] Kirschbaum M, Frankel P, Popplewell L, et al. Phase II study of vorinostat for treatment of relapsed or refractory indolent non-Hodgkin’s lymphoma and mantle cell lymphoma. J Clin Oncol 2011; 29: 1198–1203.
- [22] Tsimberidou AM, Catovsky D, Schlette E, et al. Outcomes in patients with splenic marginal zone lymphoma and marginal zone lymphoma treated with rituximab with or without chemotherapy or chemotherapy alone. Cancer 2006; 107: 125–135.
- [23] Delarue R, Haioun C, Ribrag V, et al. CHOP and DHAP plus rituximab followed by autologous stem cell transplantation in mantle cell lymphoma: a phase 2 study from the Groupe d’Etude des Lymphomes de l’Adulte. Blood 2013; 121: 48–53.
- [24] Geisler CH, Kolstad A, Laurell A, et al. Long-term progression-free survival of mantle cell lymphoma after intensive front-line immunochemotherapy with in vivo-purged stem cell rescue: a nonrandomized phase 2 multicenter study by the Nordic Lymphoma Group. Blood 2008; 112: 2687–2693.
- [25] Romaguera JE, Fayad LE, Feng L, et al. Ten-year follow-up after intense chemoimmunotherapy with Rituximab-HyperCVAD alternating with Rituximab-high dose methotrexate/cytarabine (R-MA) and without stem cell transplantation in patients with untreated aggressive mantle cell lymphoma. Br J Haematol 2010; 150: 200–208.
- [26] Kluin-Nelemans HC, Hoster E, Hermine O, et al. Treatment of older patients with mantle-cell lymphoma. N Engl J Med 2012; 367: 520–531.
- [27] Goy A, Bernstein SH, Kahl BS, et al. Bortezomib in patients with relapsed or refractory mantle cell lymphoma: updated time-to-event analyses of the multicenter phase 2 PINNACLE study. Ann Oncol 2009; 20: 520–525.
- [28] Friedberg JW, Sharman J, Sweetenham J, et al. Inhibition of Syk with fostamatinib disodium has significant clinical activity in non-Hodgkin lymphoma and chronic lymphocytic leukemia. Blood 2010; 115: 2578–2585.
- [29] Wang ML, Rule S, Martin P, Goy, et al. Targeting BTK with ibrutinib in relapsed or refractory mantle-cell lymphoma. N Engl J Med 2013; 369: 507–516.
- [30] Kahl BS, Spurgeon SE, Furman RR, et al. Results of a phase I study of idelalisib, a PI3Kδ inhibitor, in patients with relapsed or refractory mantle cell lymphoma (MCL). Blood 2014 Mar 10, doi: 10.1182/blood-2013-11-537555. [Epub ahead of print].
- [31] Ansell SM, Tang H, Kurtin PJ, et al. Temsirolimus and rituximab in patients with relapsed or refractory mantle cell lymphoma: a phase 2 study. Lancet Oncol 2011; 12: 361–368.
- [32] Wang M, Popplewell LL, Collins RH Jr, et al. Everolimus for patients with mantle cell lymphoma refractory to or intolerant of bortezomib: multicentre, single-arm, phase 2 study. Br J Haematol 2014 Mar 2. doi: 10.1111/bjh.12780. [Epub ahead of print].
- [33] Goy A, Sinha R, Williams ME, et al. Single-agent lenalidomide in patients with mantle-cell lymphoma who relapsed or progressed after or were refractory to bortezomib: phase II MCL-001 (EMERGE) study. J Clin Oncol 2013; 31: 3688–3695.
- [34] Wang M, Oki Y, Pro B, et al. Phase II study of yttrium-90-ibritumomab tiuxetan in patients with relapsed or refractory mantle cell lymphoma. J Clin Oncol 2009; 27: 5213–5218.
- [35] Friedberg JW, Mahadevan D, Cebula E, et al. Phase II study of alisertib, a selective Aurora A kinase inhibitor, in relapsed and refractory aggressive B- and T-cell non-Hodgkin lymphomas. J Clin Oncol 2014; 32: 44–50.
- [35] Puig N, Wang L, Seshadri T, et al. Treatment response and overall outcome of patients with relapsed and refractory peripheral T-cell lymphoma compared to diffuse large B-cell lymphoma. Leuk Lymphoma 2013; 54: 507–513.
- [36] Arkenau HT, Chong G, Cunningham D, et al. Gemcitabine, cisplatin and methylprednisolone for the treatment of patients with peripheral T-cell lymphoma: the Royal Marsden Hospital experience. Haematologica 2007; 92: 271–272.
- [37] Pro B, Advani R, Brice P, et al. Brentuximab vedotin (SGN-35) in patients with relapsed or refractory systemic anaplastic large-cell lymphoma: results of a phase II study. J Clin Oncol 2012; 30: 2190–2196.
- [38] Dang NH, Fayad L, McLaughlin P, et al. Phase II trial of the combination of denileukin diftitox and rituximab for relapsed/refractory B-cell non-Hodgkin lymphoma. Br J Haematol 2007; 138: 502–505.
- [39] Enblad G, Hagberg H, Erlanson M, et al. A pilot study of alemtuzumab (anti-CD52 monoclonal antibody) therapy for patients with relapsed or chemotherapy-refractory peripheral T-cell lymphomas. Blood 2004; 103: 2920–2924.
- [40] O’Connor OA, Pro B, Pinter-Brown L, et al. Pralatrexate in patients with relapsed or refractory peripheral T-cell lymphoma: results from the pivotal PROPEL study. J Clin Oncol 2011; 29: 1182–1189.
- [41] Pettengell R, Coiffier B, Narayanan G, et al. Pixantrone dimaleate versus other chemotherapeutic agents as a single-agent salvage treatment in patients with relapsed or refractory aggressive non-Hodgkin lymphoma: a phase 3, multicentre, open-label, randomised trial. Lancet Oncol 2012; 13: 696–706.
- [42] Friedberg JW, Mahadevan D, Cebula E, et al. Phase II study of alisertib, a selective Aurora A kinase inhibitor, in relapsed and refractory aggressive B- and T-cell non-Hodgkin lymphomas. J Clin Oncol 2014; 32: 44–50.
- [43] Coiffier B, Pro B, Prince HM, et al. Results from a pivotal, open-label, phase II study of romidepsin in relapsed or refractory peripheral T-cell lymphoma after prior systemic therapy. J Clin Oncol 2012; 30: 631–636.
- [44] Dueck G, Chua N, Prasad A, et al. Interim report of a phase 2 clinical trial of lenalidomide for T-cell non-Hodgkin lymphoma. Cancer 2010; 116: 4541–4548.
- [45] Lee J, Suh C, Kang HJ, et al. Phase I study of proteasome inhibitor bortezomib plus CHOP in patients with advanced, aggressive T-cell or NK/T-cell lymphoma. Ann Oncol 2008; 19: 2079–2083.
- [46] Moreland LW. B-cell targeted therapies: clinical trials updates, presentation, University of Alabama at Birmingham School of medicine. January 2006. Dostupné: http://www.medscape.org/viewarticle/523554