Nové inovativní léky v léčbě mnohočetného myelomu
Souhrn:
Mnohočetný myelom je druhým nejčastějším krevním nádorovým onemocněním. Od začátku tohoto tisíciletí se dostala do běžné klinické praxe nová účinná léčiva thalidomid, lenalidomid a bortezomib. V posledních pěti letech došlo v léčbě k významnému pokroku souvisejícímu s objevem dalších vysoce účinných léků, které zásadně zlepšují prognózu nemocných. Carfilzomib je nový, doposud nejúčinnější inhibitor proteasomu, ixazomib je prvním perorálním příprav-kem ze skupiny inhibitorů proteasomu. Novým léčivem ze skupiny imunomodulačních léků je pomalidomid. Objevily se i nové skupiny léčiv, které dosud nebyly v léčbě pacientů s myelomem využívány. Jde především o monoklonální protilátky, u kterých nebyly až na reakce související s infuzí zaznamenány zásadní nežádoucí účinky. Elotuzumab je indikován v kombinaci s lenalidomidem a dexamethasonem a účinnější daratumumab je zatím indikován v monoterapii. Druhou novou skupinou léčiv jsou inhibitory histondeacetyláz, jejich zástupcem je panobinostat, který je používán v kombinaci s bortezomibem a dexamethasonem. Při pokračování aktuálního trendu léčby s významným zlepšováním léčebných výsledků se dá předpokládat dosažení dlouhodobých remisí až u 30 % nemocných s mnohočetným myelomem a desetileté přežití u nejméně 50 % nemocných. Mnohočetný myelom dnes považu-jeme za vyléčitelný u přibližně 10–15 % nemocných a urychlené zavedení nejúčinnějších léků do první linie vyléčitelnost dále zlepší.
Key words: multiple myeloma – carflizomib – ixazomib – pomalidomide – elotuzumab – daratumumab – panobinostat.
Summary:
Multiple myeloma is the second most common malignant haematological disease. Several new drugs, including thalidomide, lenalidomide, and bortezomib have entered routine clinical practice since the beginning of new millennium. Another important step forward was achieved during the last five years with the discovery of other highly effective drugs which have significantly improved prognosis of the disease. Carfilzomib is the most effective proteasome inhibitor currently available. Ixazomib is the first oral agent from the proteasome inhibitors group. Pomalidomide is a new immunomodulatory drug. Brand new drug classes have also appeared on the market which have not been used in the myeloma treatment up to now. They are predominantly represented by monoclonal antibodies which do not show any substantial adverse effects, except for those related to the infusional application itself. Elotuzumab is indicated for treatment in combination with lenalidomide and dexamethasone and the most effective of these drugs, daratumumab, is currently administered as a monotherapy. Histone-deacetylase inhibitors are the second new drug class represented by panobinostat which is used in combination with bortezomib and dexamethasone. With continuation of the current treatment trends with significant increase in the therapy effectiveness we may expect the achievement of long-term remissions in as many as 30% of patients with 10-year survival rate of at least 50%. Multiple myeloma is currently considered to be a curable disease in 10–15% of patients and expedited introduction of the most potent drugs to the first line therapy could potentially increase this percentage even further..
Úvod
Mnohočetný myelom (MM) je v České republice diagnostikován každý rok u přibližně 450 pacientů. Patří tedy mezi vzácnější onemocnění, jde však o druhé nejčastější krevní nádorové onemocnění [1]. Myelom je vyléčitelným onemocněním asi u 10–15 % nemocných [2]. Stále častěji se v tomto směru v literatuře objevuje pojem „operative cure“, který představuje jedinou intenzivní léčbu, po níž nemocní v hluboké remisi žijí déle než deset let a na toto onemocnění nezemřou. Přes významný pokrok se u většiny nemocných objeví nová aktivita onemocnění.
Mezi již používaná moderní léčiva patří od nového tisíciletí thalidomid, lenalidomid a bortezomib [3]. Zjednodušeně lze říct, že každý nový účinný lék znamená jeden rok navíc v celkovém přežití. V současnosti prochází úhradovým řízením v České republice pět nových přípravků, které zásadně zlepší prognózu nemocných (tab. 1). V této chvíli jsme svědky dalšího 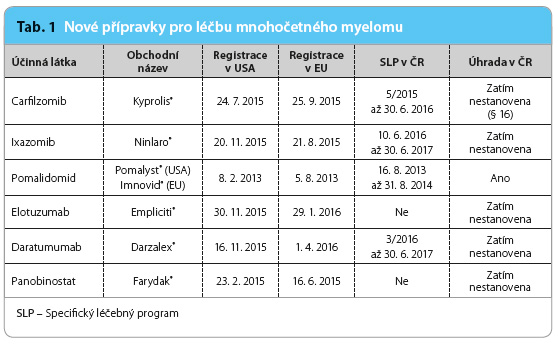 přelomového období v léčbě MM, jímž je podání vysoce účinných léčiv v trojkombinaci. Situace je nová i v tom, že v moderní strategii se kombinují poprvé v historii léčby MM dva drahé přípravky [4–6].
přelomového období v léčbě MM, jímž je podání vysoce účinných léčiv v trojkombinaci. Situace je nová i v tom, že v moderní strategii se kombinují poprvé v historii léčby MM dva drahé přípravky [4–6].
Cílem této práce je podat ucelený stručný přehled o nových přípravcích v léčbě MM zaváděných do klinické praxe.
Proteasomové inhibitory
Bortezomib
Bortezomib je prvním a stále široce používaným zástupcem inhibitorů proteasomu. Pro léčbu MM je bortezomib dostupný od roku 2005 [7] a v současnosti je již k dispozici řada generik. Léčivo je reverzibilním selektivním inhibitorem chymotrypsinové aktivity podjednotky 26S proteasomu. Bortezomib je indikován ve všech liniích léčby MM. V kombinaci s dexamethasonem nebo s dexamethasonem a thalidomidem se využívá v indukční léčbě pacientů s nově diagnostikovaným MM před vysokodávkovanou chemoterapií s transplantací krvetvorných kmenových buněk (TKB). V kombinaci s pegylovaným liposomálním doxorubicinem nebo s dexamethasonem je indikován k léčbě pacientů s mnohočetným myelomem relabujícím po léčbě anebo refrakterním na léčbu (RRMM), kteří již prodělali nejméně jednu předchozí léčbu.
V současnosti jsou k dispozici dva inhibitory proteasomu druhé generace – carfilzomib a ixazomib.
Carfilzomib
Carfilzomib (PR‑171) je inhibitor proteasomu druhé generace. Díky své odlišné chemické struktuře, biologickým vlastnostem, mechanismu účinku a ireverzibilitě inhibice proteasomu nabízí oproti bortezomibu řadu výhod v podobě zvýšené účinnosti, bezpečnosti léčby a překonání rezistence k bortezomibu [8].
Mechanismus inhibice proteasomu carfilzomibem spočívá v jeho selektivní a ireverzibilní vazbě na podjednotku β5 a podjednotku LMP7 imunoproteasomu. Jelikož je proteasom zapojen do obratu intracelulárních proteinů, patří mezi primární důsledky jeho inhibice hromadění nefunkčních proteinů a chyby v signálních drahách, které vyúsťují v narušení adheze myelomových buněk, potlačení angiogeneze, zastavení buněčného cyklu, omezení odpovědi na poškození DNA a v indukci apoptózy nádorových buněk. V sérii preklinických studií carfilzomib prokázal schopnost navodit apoptózu u bortezomib‑naivních i u bortezomibem předléčených myelomových buněk bez zvýšené toxicity. Carfilzomib je schopen překonat primární i sekundární rezistenci [9]. Ve srovnání s bortezomibem vykazuje carfilzomib v klinických studiích nižší výskyt nežádoucích účinků, zvláště periferní neuropatie [10]. Obdobně jako bortezomib je účinný i v monoterapii (celková léčebná odpověď 24 %), ačkoliv v kombinaci nejméně s dexamethasonem se jeho léčebná účinnost významně zvyšuje.
Vysoký léčebný potenciál carfilzomibu včetně účinku léčby u nemocných rezistentních k léčbě bortezomibem a zvýšení bezpečnosti léčby určuje nové místo carfilzomibu v terapii MM. Na základě klinické studie fáze II PX‑171‑003‑A1 byl carfilzomib registrován v roce 2015 ve Spojených státech amerických a v Evropě. Ve studii PX‑171‑003‑A1 bylo zařazeno 257 pacientů včetně velmi předléčených (průměrně pěti léčebnými liniemi) a pacientů, u kterých došlo k progresi onemocnění do 60 dnů od ukončení poslední terapie (83 %). Dávka carfilzomibu byla zvyšována během prvního cyklu z 20 mg/m² podávaných intravenózně (i.v.) až na 27 mg/m² i.v., podáno bylo maximálně 12 cyklů. Medián doby do dosažení odpovědi (alespoň parciální nebo větší odpovědi na léčbu [partial response, PR]) u 61/257 (23 %)
pacientů byl 1,9 měsíce. Celkové léčebné odpovědi (overall response rate, ORR) dosáhlo 24 % pacientů, doba trvání odpovědi (duration of response, DOR) byla 7,4 měsíce [11,12].
Další významná klinická studie ASPIRE prokázala zlepšení léčebné účinnosti carfilzomibu v kombinaci s lenalidomidem a dexamethasonem (standardně používaným léčebným režimem u RRMM) ve srovnání s lenalidomidem a s dexamethasonem samotným. Zařazeno bylo 792 nemocných s relabujícím MM, kteří absolvovali jednu až tři předchozí linie léčby. Režim s carfilzomibem ukázal lepší léčebnou účinnost nejen v dosažení většího procenta léčebných odpovědí (ORR 87,1 % vs. 66,7 %; p < 0,001), ale také významně větší procento kompletních léčebných odpovědí (complete response [CR]) – 31,8 % vs. 9,3 %; p < 0,001). Přežití bez progrese nemoci (progression free survival, PFS) bylo ve větvi s carfilzomibem prodlouženo o devět měsíců (26,3 měsíce vs. 17,6 mě-
síce; p = 0,0001) [4].
V klinické studii ENDEAVOR byla porovnávána účinnost dvou inhibitorů proteasomu – bortezomibu a carfilzomibu – v kombinaci s dexamethasonem. V souboru 929 ne-
mocných s relabujícím MM byla ve větvi s carfilzomibem prokázána mimořádná léčebná účinnost, dvojnásobně lepší ve smyslu prodloužení doby do progrese (PFS 18,7 měsíce vs. 9,4 měsíce; p < 0,001) [13].
Carfilzomib je indikován v léčbě nemocných s relabujícím MM, kteří absolvovali nejméně jednu předchozí linii léčby, podává se v kombinaci s lenalidomidem a dexamethasonem. Doposud není stanovena úhrada ze zdravotního pojištění. O úhradu léčby carfilzomibem je nutné žádat podle §16 zákona č. 48/97 Sb.
Carfilzomib se aplikuje v krátké intravenózní infuzi ve dnech 1, 2, 8, 9, 15 a 16 z 28denního cyklu v dávce 20 mg/m2 ve dnech 1 a 2 prvního cyklu a dále se pokračuje dávkou 27 mg/m2. Lenalidomid se podává v dávce 25 mg jedenkrát denně po dobu 21 dní, dexamethason jedenkrát týdně v dávce 40 mg. Léčba se zpravidla podává po dobu 18 měsíců nebo do progrese onemocnění.
Mezi nejčastější nežádoucí účinky patří hematologická toxicita, infekční komplikace, zejména infekce dýchacích cest, mírná gastrointestinální toxicita a hypertenze, na kterou je nutno při léčbě myslet, a krevní tlak kontrolovat. Závažná, i když méně častá, je kardiální toxicita – u nemocných bylo pozorováno srdeční selhání či fibrilace síní.
Ixazomib
Ixazomib (MLN9708) je analog kyseliny borité a první perorálně podávaný inhibitor proteasomu druhé generace. Díky své odlišné chemické struktuře, biologickým vlastnostem a mechanismu účinku nabízí ixazomib stejně jako carfilzomib oproti inhibitoru první generace (bortezomibu) řadu výhod v podobě zvýšené účinnosti, bezpečnosti a způsobu užívání [14].
Ixazomib, stejně jako bortezomib, je reverzibilní inhibitor proteasomu. Ixazomib prokázal vyšší účinek proti buňkám MM než bortezomib v sérii preklinických studií in vivo. Ve vodných roztocích či v plazmě rychle hydrolyzuje na MLN2238, jeho biologicky aktivní formu. Je tedy schopen rozsáhlejší distribuce ve stabilní formě a má vyšší farmakodynamický účinek v tkáních [15].
Ixazomib inhibuje především chymotrypsinovou proteolytickou (β5) podjednotku 20S proteasomu. Navíc je schopen ve vyšších koncentracích inhibovat kaspázovou (β1) a trypsinovou (β2) proteolytickou podjednotku a indukovat akumulaci ubikvitinovaných proteinů. K rozpadu 20S podjednotky proteasomu po léčbě MLN9708 dochází šestkrát rychleji než po léčbě bortezomibem.
Ve srovnání s bortezomibem vykazuje ixazomib v klinickém hodnocení nižší výskyt nežádoucích účinků, zvláště periferní neuropatie (14 % vs. 2 %). V kombinaci s lenalidomidem vykazuje synergistickou antimyelomovou aktivitu.
Registrační klinická studie fáze III C16010 Tourmaline‑MM1 srovnávala bezpečnost a účinnost léčby ixazomibem v kombinaci s lenalidomidem a dexamethasonem (I‑Rd) proti kontrolní skupině bez ixazomibu (režim Rd) v souboru 722 pacientů s RRMM, kteří absolvovali jednu až tři předchozí linie léčby. Časté nežádoucí účinky stupně 3/4 režimu I‑Rd zahrnovaly neutropenii (19 % vs. 16 %), anemii (9 % vs. 13 %) a trombocytopenii (13 % vs. 5 %). Nejčastěji zaznamenanou nehematologickou toxicitou byl průjem (42 % vs. 36 %), vyrážka (35 % vs. 21 %), zácpa (34 % vs. 25 %), periferní neuropatie (28 % vs. 21 %), nevolnost (26 % vs. 21 %) a zvracení (22 %
vs. 11 %). Výskyt renálního selhání (4 % vs. 6 %)
a srdečního selhání (4 % vs. 3 %) byl nízký. Ve skupině léčené I‑Rd bylo dosaženo lepší léčebné odpovědi (ORR 78 % vs. 72 %), potvrzeno bylo prodloužení přežití bez progrese nemoci (PFS 20,6 měsíce vs. 14,7 měsíce; poměr rizik [hazard ratio, HR] = 0,74; p = 0,01) a delší trvání léčebné odpovědi (DOR
20,5 měsíce vs. 15 měsíců), a to bez zásadního zvýšení výskytu nežádoucích účinků (včetně kardiotoxicity a neurotoxicity) [5].
V současné době je režim I‑Rd schválen ve Spojených státech amerických, v Evropě v roce 2016 neproběhlo schválení ve zrychlené proceduře a nyní probíhá standardní schvalovací proces. Od začátku roku 2016 je v ČR aktivní program, ve kterém může být nemocným, kteří zahajují léčbu lenalidomidem, současně podávána v rámci programu pro nemocné léčba ixazomibem zdarma.
Ixazomib je dostupný ve formě kapslí, podává se v dávce 4 mg jedenkrát týdně ve dnech 1, 8 a 15 z 28denního cyklu. Lenalidomid se podává v dávce 25 mg jedenkrát denně po dobu 21 dní, dexamethason jedenkrát týdně v dávce 40 mg. Léčba je indikována do progrese onemocnění.
Imunomodulační léčiva
Prvním zástupcem imunomodulačních léčiv (immunomodulatory drug, IMID), který prokázal svou účinnost u nemocných s MM, byl thalidomid [16]. Pro svůj toxický profil, zejména vysoké procento polyneuropatií, není vhodný k podávání v dlouhodobých režimech. V současné době je široce používán v kombinaci s bortezomibem a dexamethasonem v indukční léčbě pacientů s nově diagnostikovaným MM před vysokodávkovanou chemoterapií s TKB. Thalidomid je dále indikován ve všech léčebných liniích u pacientů s MM, a to i u starších nemocných, u nichž není TKB vhodná.
Lenalidomid je IMID druhé generace, který má na rozdíl od thalidomidu minimální neurotoxicitu. V důsledku své dominující a dobře zvládnutelné hematologické toxicity se vyznačuje toxickým profilem přijatelným pro dlouhodobé podávání [17,18]. Lenalidomid je v kombinaci s dexamethasonem indikován k léčbě pacientů s MM, kteří absolvovali alespoň jednu předchozí linii léčby. V roce 2015 byl lenalidomid v USA i v Evropě schválen k použití i v léčbě pacientů s doposud neléčeným MM, kteří nejsou vhodnými kandidáty pro transplantaci. V České republice však bohužel zatím není schválena úhrada ze zdravotního pojištění pro jeho použití v primoléčbě.
Nejnovějším léčivem ze skupiny IMID druhé generace je pomalidomid.
Pomalidomid
Pomalidomid byl vytvořen modifikací molekuly thalidomidu tak, aby byl zvýšen léčebný účinek a snížena toxicita. Jeho mechanismus účinku není zcela objasněn, ale zahrnuje antiangiogenní, imunomodulační a přímý toxický účinek na myelomové buňky a ovlivnění mikroprostředí kostní dřeně. Pomalidomid také ovlivňuje osteoklasty, snižuje jejich aktivitu a tak pozitivně ovlivňuje i kostní chorobu u MM. Podobně jako u ostatních IMID je jeho účinek umožněn vazbou na protein cereblon [19]. Pomalidomid je považován za nejúčinnější léčivo ze skupiny IMID. In vitro je přibližně stokrát účinnější než thalidomid a desetkrát účinnější než lenalidomid a je účinný i u onemocnění rezistentních k thalidomidu a k lenalidomidu [20].
V klinické studii fáze II (MM‑002) byl pomalidomid podáván samotný nebo v kombinaci s dexamethasonem u 221 nemocných s RRMM, kteří byli v předchozích liniích léčeni bortezomibem a lenalidomidem. Ve větvi s dexamethasonem bylo u značně předléčených nemocných dosaženo léčebné odpovědi (ORR) u 33 % pacientů, medián trvání léčebné odpovědi byl 8,3 měsíce. Medián PFS byl 4,2 měsíce a medián celkového přežití (overall survival, OS) 16,5 měsíce. V rameni s pomalidomidem samotným bylo nižší procento léčebných odpovědí – 18 % – a medián PFS a OS činil 2,7 měsíce a 13,6 měsíce [21]. Dexamethason tedy potencuje léčebnou účinnost pomalidomidu.
V další klíčové a registrační klinické studii fáze III (MM‑003) byl porovnáván režim pomalidomid a dexamethason s vysokodávkovaným dexamethasonem u 455 nemocných s RRMM. Jednalo se o velmi předléčenou skupinu nemocných, kteří byli refrakterní alespoň ke dvěma předchozím liniím léčby a byli rezistentní jak na bortezomib, tak i na lenalidomid. V rameni s pomalidomidem byl snížen počet progresí o 52 % (PFS 4,0 měsíce vs. 1,9 měsíce; HR 0,48; 95% interval spolehlivosti [confidence interval, CI]: 0,39–0,6; p ≤ 0,001) a bylo delší celkové přežití (OS 12,7 měsíce vs. 8,1 měsíce; HR 0,74; 95% CI:
0,56–0,97; p = 0,03) [22].
Na základě uvedených studií byla léčba pomalidomidem v kombinaci s dexamethasonem schválena od roku 2013 v USA a v Evropě u pacientů s RRMM, kteří absolvovali nejméně dvě předchozí linie léčby včetně léčby lenalidomidem a bortezomibem a u kterých došlo k progresi onemocnění do 60 dnů od ukončení poslední terapie. V ČR je umožněno indikovat režim s pomalidomidem u pacientů s RRMM nejdříve ve třetí léčebné linii a za předpokladu, že byl v předchozích liniích použit režim s bortezomibem, lenalidomidem, thalidomidem a s alkylačními látkami.
Jedná se o perorální přípravek, standardní dávkování je 4 mg jedenkrát denně po dobu 21 dní, pak následuje přestávka trvající 7 dní, délka cyklu je 28 dní. Dexamethason se podává v nízkých dávkách 40 mg jedenkrát týdně. Tento režim je indikován do progrese onemocnění. Pomalidomid má z imunomodulačních léčiv nejlepší profil toxicity, zvláště není potřeba redukovat jeho dávky u nemocných s renální insuficiencí. Mezi nejběžnější nežádoucí účinky léčby patří hematologická toxicita, která zpravidla nebývá limitující pro podávání přípravku, infekční komplikace a trombotické komplikace, pro které je nutno podávat antikoagulancia po celou dobu léčby.
Monoklonální protilátky
Monoklonální protilátky jsou skupinou léčiv, která je v hematoonkologii používána řadu let u B‑lymfoproliferací a v současné době se dostává do popředí i v léčbě pacientů s MM. Monoklonální protilátky svým zacílením proti antigenům na myelomových buňkách způsobují jejich likvidaci řadou mechanismů, mezi jinými jejich přímou apoptózou, cytotoxicitou zprostředkovanou komplementem, buněčnou fagocytózou závislou na protilátkách a buňkami zprostředkovanou cytotoxicitou závislou na protilátkách. Velmi důležité je, že díky mechanismu účinku odlišnému od ostatních léčiv používaných v léčbě MM nedochází ke kumulaci toxicity. Až na reakce související s infuzí, které se vyskytují téměř výhradně při prvním podání léku, nebyl pozorován jiný zásadní nežádoucí účinek této lékové skupiny. Za zmínku stojí, že v souvislosti s monoklonálními protilátkami zpravidla dochází k interferenci s laboratorními vyšetřeními využívajícími specifickou reakci antigen–protilátka, jako jsou hodnocení léčebné odpovědi u MM pomocí imunofixace, detekce minimální zbytkové nemoci pomocí průtokové cytometrie a nepřímý Coombsův test [23]. V roce 2015 byly v USA i v Evropě schváleny pro léčbu nemocných s MM dvě monoklonální protilátky – elotuzumab a daratumumab.
Elotuzumab
Elotuzumab je humanizovaná IgG1κ monoklonální protilátka proti molekule SLAMF7 (Signaling Lymphocytic Activation Molecule F7), známá také jako CS1. Tato molekula je exprimována zejména na myelomových buňkách a NK buňkách (natural killers, přirození zabíječi). Elotuzumab neprokázal u RRMM léčebnou účinnost v monoterapii, ale v kombinaci s lenalidomidem a dexamethasonem nebo s bortezomibem a s dexamethasonem synergicky zvyšuje účinnost těchto léčebných režimů [23].
V registrační klinické studii ELOQUENT‑2 byla porovnávána bezpečnost a účinnost léčby elotuzumabem v kombinaci s lenalidomidem a s dexamethasonem (E‑Rd) oproti skupině léčené režimem Rd u 646 nemocných s relabujícím MM po jedné až třech předchozích liniích léčby. Medián PFS byl ve větvi s elotuzumabem o 4,5 měsíce delší (19,4 měsíce vs. 14,9 měsíce; HR 0,70, 95% CI: 0,57–0,85; p < 0,001), stejně tak bylo dosaženo většího počtu léčebných odpovědí (ORR 79 % vs. 66 %; 95 % CI: 1,4–2,8; p < 0,001) [6]. Na základě výsledků této klinické studie byl elotuzumab registrován v roce 2015 v USA a v roce 2016 v Evropě v kombinaci s lenalidomidem a s dexamethasonem v léčbě nemocných s MM, u kterých došlo k progresi po alespoň jedné předchozí linii léčby.
Elotuzumab se aplikuje intravenózní infuzí po předchozí premedikaci (antihistaminika, paracetamol, blokátor H2‑receptorů) v dávce 10 mg/kg ve dnech 1, 8, 15 a 22 první dva 28denní cykly, od třetího cyklu se podává jedenkrát za dva týdny. Lenalidomid se podává v dávce 25 mg jedenkrát denně po dobu
21 dní, dexamethason jedenkrát týdně v dávce 40 mg. Léčba je indikována do progrese onemocnění.
Daratumumab
Daratumumab je lidská IgG1κ monoklonální protilátka proti antigenu CD38, což je transmembránový glykoprotein. Tato molekula funguje jako ektoenzym regulující cytoplazmatickou koncentraci kalcia. Plní rovněž funkci receptoru, který se účastní mezibuněčných interakcí a transmembránové signalizace. Za normálních okolností je antigen CD38 na povrchu myeloidních i lymfoidních buněk, stejně jako na buňkách jiných tkání (příčně pruhované svalstvo, neurony), exprimován v malé míře. Nadměrnou expresi znaku CD38 je možné pozorovat u většiny lymfoidních neoplazií, ve vysoké míře je však exprimován na maligních plazmocytech (CD38++) [24]. Tato skutečnost umožňuje, že se daratumumab váže na myelomové buňky poměrně selektivně a vykazuje tak u myelomu silný imunologický protinádorový účinek.
Efektorovými buňkami podílejícími se na procesu buňkami zprostředkované cytotoxicity jsou mimo jiné NK buňky a makrofágy, jejichž funkci zvyšují imunomodulační léky. Lze předpokládat, že přidání některého z IMID do kombinace s léčbou monoklonální protilátkou dále zvýší její účinnost [25].
Ve studii fáze I/II GEN501 byl daratumumab v monoterapii podáván 104 pacientům s RRMM, kteří podstoupili nejméně dvě předchozí linie léčby. Do první části studie (se zvyšující se dávkou daratumumabu 0,005–24 mg/kg) bylo zařazeno celkem 32 významně předléčených nemocných (s mediánem počtu předchozích linií 6), z nichž 75 % bylo dvojitě refrakterních – k bortezomibu a k lenalidomidu. Ve skupině pacientů, kteří byli léčeni daratumumabem v dávce ≥ 4 mg/kg, dosáhlo ORR 42 % nemocných. Nejčastějšími nežádoucími účinky byly reakce související s infuzí, které se vyskytly u 30 % pacientů během podání první dávky. Po zavedení adekvátní premedikace formou kortikosteroidů se nevyskytla žádná významná reakce související s infuzí [26]. Ve studii fáze II MMY2002 (SIRIUS) byl daratumumab podáván v dávce 8 mg/kg a 16 mg/kg v souboru 124 pacientů s RRMM. Celkové léčebné odpovědi dosáhlo 29 % ze 106 pa-
cientů léčených dávkou 16 mg/kg. Tři pacienti dosáhli sCR (stringent complete response, striktní kompletní odpověď – bez průkazu klonálních plazmocytů v kostní dřeni) a 10 pacientů VGPR (very good partial response, velmi dobrá částečná odpověď). Medián trvání léčebné odpovědi byl
7,4 měsíce, medián PFS 3,7 měsíce a medián OS 17,5 měsíce [27].
Studie fáze I/II GEN503 hodnotila léčbu daratumumabem v dávce 2–16 mg/kg (fáze I; n = 13) a v dávce 16 mg/kg (fáze II; n = 32) v kombinaci s lenalidomidem a s dexamethasonem u pacientů s RRMM. Ve skupině léčené dávkou 16 mg/kg byla ORR pozorována u 87 % nemocných, 7 % pacientů dosáhlo CR a 43 % VGPR. Mezi nejčastější nežádoucí účinky patřila neutropenie (84 %), kašel (47 %) a svalové křeče (44 %). Celkově byla léčba dobře tolerována a toxicita byla zvladatelná [28,29].
V klinických studiích fáze I a II (MMY2002, GEN501 a GEN503) prokázal daratumumab v monoterapii u vysoce předléčených nemocných vynikající účinek, léčebné odpovědi bylo dosaženo u 29–42 % nemocných. Při podávání v kombinaci s lenalidomidem a dexamethasonem byla ORR až 87 %.
Vysoký léčebný potenciál daratumumabu docílený díky jeho unikátním mechanismům účinku při minimální toxicitě léku určuje jeho nové místo a významný posun v léčbě myelomu. Na základě výsledků klinických hodnocení, ve kterých prokázal svoji vysokou účinnost v monoterapii u vysoce předléčených nemocných, byl daratumumab v listopadu 2015 v USA schválen Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) pro léčbu pacientů s MM, kteří absolvovali nejméně tři předchozí léčebné linie s využitím inhibitoru proteasomu a IMID nebo kteří jsou refrakterní k těmto oběma lékovým skupinám.
V současné době probíhají klinické studie fáze III, ve kterých se srovnává bezpečnost a vliv léčby daratumumabem (16 mg/kg) v kombinacích s dalšími přípravky. Ve studii MMY3003 [30] byla prokázána lepší léčebná účinnost daratumumabu v kombinaci s lenalidomidem a dexamethasonem ve srovnání s lenalidomidem a s dexamethasonem samotným (ORR 93 % vs. 76 %, p < 0,0001) a také byla prodloužena doba do progrese nemoci (PFS nedosaženo vs. 18,4 měsíce, HR 0,37; 95% CI; p < 0,0001). Ve studii MMY3004 [31] byl daratumumab s bortezomibem a dexamethasonem porovnáván s bortezomibem
a s dexamethasonem samotným. I v této studii byla prokázána v režimu s daratumumabem lepší léčebná účinnost (ORR 83 %
vs. 63 %, p < 0,0001) a prodloužení doby do progrese (PFS nedosaženo vs. 7,2 měsíce, HR 0,39;
95% CI; p < 0,0001). Výsledky studie MMY3007, ve které je daratumumab kombinován s bortezomibem, melfalanem a prednisonem, dosud nebyly publikovány [32].
Daratumumab se podává ve formě intravenózní infuze po předchozí premedikaci (antihistaminika, methylprednisolon, paracetamol) v dávce 16 mg/kg jedenkrát týdně v prvních dvou měsících, jedenkrát za dva týdny v dalších čtyřech měsících léčby a pak jedenkrát měsíčně do progrese onemocnění.
Inhibitory histondeacetyláz
Inhibitory histondeacetyláz jsou skupinou léčiv, která fungují na epigenetické úrovni ovlivněním terciární struktury DNA. Histondeacetylázy jsou klíčové pro procesy, jako je buněčné přežití, proliferace a diferenciace. Inhibice histondeacetyláz v nádorových buňkách indukuje zástavu buněčného cyklu, zástavu růstu, diferenciaci a apoptózu [33].
První inhibitor histondeacetyláz vorinostat byl v roce 2006 v USA schválen pro léčbu relabujícího kožního T‑lymfomu. Vorinostat byl prvním inhibitorem histondeacetyláz testovaným u MM. V klinických studiích však prokázal jen limitovaný přínos, proto není v léčbě pacientů s myelomem v klinické praxi využíván.
Panobinostat
Panobinostat je pan‑deacetylázový inhibitor s aktivitou proti histondeacetylázám třídy I, II a IV. Panobinostat prokázal v preklinických a časných fázích klinického hodnocení synergický účinek v kombinaci s bortezomibem, a to i u nemocných rezistentních k bortezomibu [34]. V klinické studii fáze III (PANORAMA 1) byla porovnávána kombinace panobinostat, bortezomib a dexamethason s léčbou bortezomibem a dexamethasonem u 768 nemocných s RRMM po jedné až třech liniích předchozí léčby. Ve skupině s panobinostatem bylo prokázáno prodloužení PFS o čtyři měsíce (12,0 měsíce vs. 8,1 měsíce; p < 0,0001) [35]. Subanalýza této studie prokázala podobný rozdíl u nemocných předléčených IMID a kombinací IMID s inhibitory proteasomu a u nemocných po dvou předchozích liniích léčby obsahujících IMID a inhibitory proteasomu. V poslední uvedené skupině byl rozdíl v PFS 7,8 měsíce (12,5 měsíce vs. 4,7 měsíce) [36]. Na základě výsledků klinické studie PANORAMA 1 byl panobinostat v kombinaci s bortezomibem a dexamethasonem schválen v roce 2015 v USA i v Evropě u nemocných s MM po alespoň dvou liniích předchozí léčby, v nichž byl užit inhibitor proteasomu a IMID a u kterých došlo k progresi při poslední linii léčby.
Panobinostat se podává perorálně v dávce 20 mg 3× týdně 21denního cyklu, bortezomib se podává v dávce 1,3 mg/m2 v den 1, 4, 8 a 11 cyklu a dexamethason se podává v dávce 20 mg v den aplikace bortezomibu a následující den. Léčba je indikována po dobu osmi cyklů, v případě pozitivního účinku léčby je možné ji prodloužit o dalších osm cyklů, v rámci kterých je již bortezomib podáván jedenkrát týdně. Z nežádoucích účinků se nejčastěji vyskytuje hematologická toxicita s dominující trombocytopenií, průjem a celková slabost.
Závěr
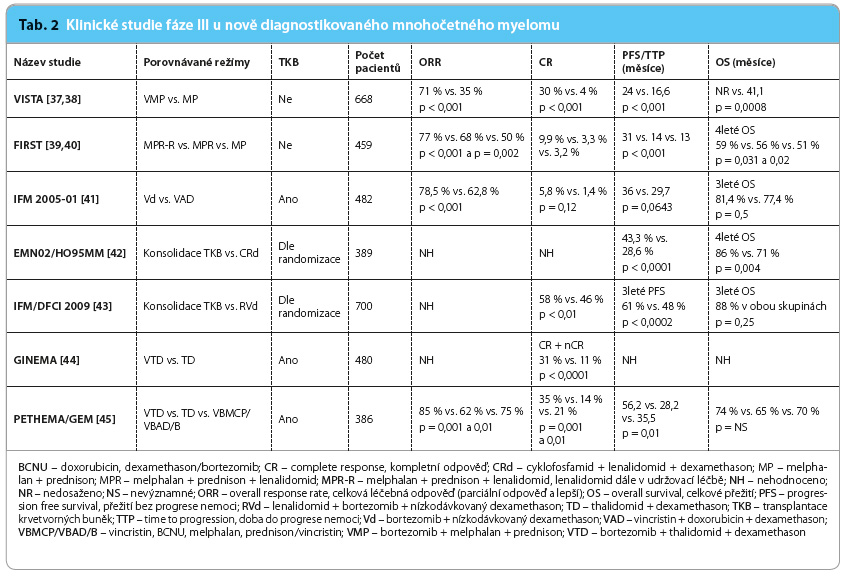 Z klinických studií fáze III probíhajících v posledních letech je zjevné, že nové přípravky v trojkombinaci jsou vysoce účinné ve srovnání s dvojkombinacemi (tab. 2, 3). Zdá se, že tomu tak je zvláště v případě myelomu se špatnou prognózou definovanou na základě chromosomálních abnormalit. V posledním roce jsou léčebné trojkombinace poprvé schvalovány regulačními autoritami. Tento trend ovšem vzhledem k ceně nových přípravků představuje velkou ekonomickou zátěž pro zdravotní systém. U nemocných s nově diagnostikovaným onemocněním se naopak intenzita režimů řeší málo, neboť teprve probíhají klinické studie, všechny akademické, s léčebným schématem intenzivní indukce, konsolidace a dlouhodobé udržovací léčby do progrese onemocnění. Cílem této intenzivní léčby trvající alespoň tři roky je zvýšit frakci nemocných s tzv.
Z klinických studií fáze III probíhajících v posledních letech je zjevné, že nové přípravky v trojkombinaci jsou vysoce účinné ve srovnání s dvojkombinacemi (tab. 2, 3). Zdá se, že tomu tak je zvláště v případě myelomu se špatnou prognózou definovanou na základě chromosomálních abnormalit. V posledním roce jsou léčebné trojkombinace poprvé schvalovány regulačními autoritami. Tento trend ovšem vzhledem k ceně nových přípravků představuje velkou ekonomickou zátěž pro zdravotní systém. U nemocných s nově diagnostikovaným onemocněním se naopak intenzita režimů řeší málo, neboť teprve probíhají klinické studie, všechny akademické, s léčebným schématem intenzivní indukce, konsolidace a dlouhodobé udržovací léčby do progrese onemocnění. Cílem této intenzivní léčby trvající alespoň tři roky je zvýšit frakci nemocných s tzv. 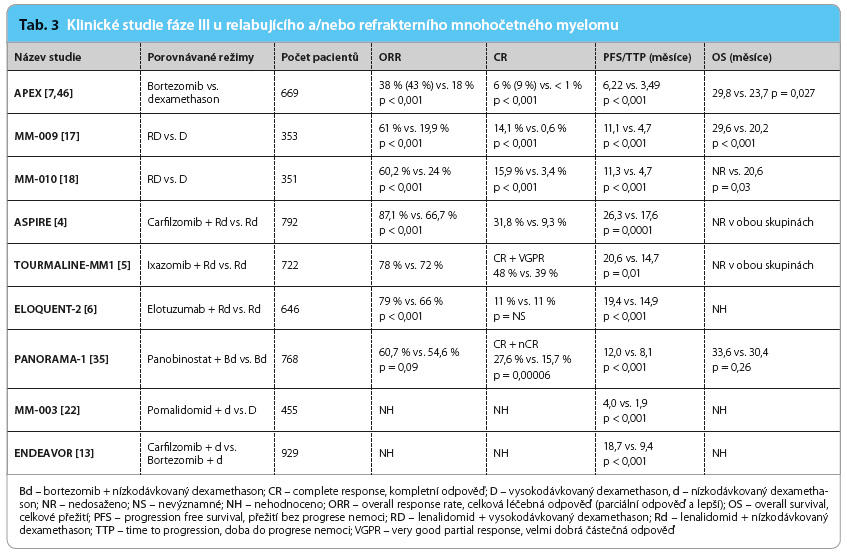 operative cure. V souvislosti se zlepšující se účinností léčebných režimů stoupá důležitost vyhodnocení hloubky léčebné odpovědi sledováním tzv. minimální zbytkové choroby (minimal residual disease, MRD), standardizace metod hodnocení MRD a jejich senzitivity. Při pokračování aktuálního trendu léčby s významným zlepšováním léčebných výsledků se dá předpokládat dosažení „operative cure“ až u 30 % nemocných s MM a desetileté přežití u 50 % nemocných.
operative cure. V souvislosti se zlepšující se účinností léčebných režimů stoupá důležitost vyhodnocení hloubky léčebné odpovědi sledováním tzv. minimální zbytkové choroby (minimal residual disease, MRD), standardizace metod hodnocení MRD a jejich senzitivity. Při pokračování aktuálního trendu léčby s významným zlepšováním léčebných výsledků se dá předpokládat dosažení „operative cure“ až u 30 % nemocných s MM a desetileté přežití u 50 % nemocných.
Seznam použité literatury
- [1] Adam Z, Hájek R, Mayer J, et al. Mnohočetný myelom a další monoklonální gamapatie. Brno, Lékařská fakulta Masarykovy univerzity, 1999.
- [2] Barlogie B, Mitchell A, van Rhee F, et al. Curing myeloma at last: defining criteria and providing the evidence. Blood 2014; 124: 3043–3051.
- [3] Kumar SK, Rajkumar VS, Dispenzieri A, et al. Improved survival in multiple myeloma and the impact of novel therapies. Blood 2008; 111: 2516–2520.
- [4] Stewart AK, Rajkumar V, Dimopoulos M, et al. Carfilzomib, lenalidomide, and dexamethasone for relapsed multiple myeloma. N Engl J Med 2015; 372: 142–152.
- [5] Moreau P, Masszi T, Grzasko N, et al. Oral Ixazomib, Lenalidomid, and Dexamethasone for Multiple Myeloma. N Engl J Med 2016; 374: 1621–1634.
- [6] Lonial S, Dimopoulos M, Palumbo A, et al. Elotuzumab therapy for relapsed or refractory multiple myeloma. N Engl J Med 2015; 373: 621–631.
- [7] Richardson PG, Sonnenveld P, Schuster MW, et al. Bortezomib or high dose dexamethasone for relapsed multiple myeloma. N Engl J Med 2005; 352: 2487–2498.
- [8] Demo SD, Kirk CJ, Aujay MA, et al. Antitumor activity of PR 171, a novel irreversible inhibitor of the proteasome. Cancer Res 2007; 67: 6383–6391.
- [9] Kuhn DJ, Chen Q, Voorhees PM, et al. Potent activity of carfilzomib, a novel, irreversible inhibitor of the ubiquitin proteasome pathway, against preclinical models of multiple myeloma. Blood 2007; 110: 3281–3290.
- [10] Jagannath SJ, Vij RV, Martin TM, et al. Carfilzomib is associated with a low rate of typically mild to moderate, non dose limiting treatment emergent peripheral neuropathy. European Hematological Association Annual Meeting, 2012, Amsterdam. p. Abstr: 0857.
- [11] diCapua Siegel DS, Martin T, Wang M, et al. Results of PX 171 003 A1, an open label, single arm, phase 2
- [12] Fostier K, De Becker A, Schots R. Carfilzomib: a novel treatment in relapsed and refractory multiple myeloma. Onco Targets Ther 2012; 5: 237–244.
- [13] Dimopoulos MA, Moreau P, Palumbo A, et al. Carfilzomib and dexamethasone versus bortezomib and dexamethasone for patients with relapsed or refractory multiple myeloma (ENDEAVOR): a randomised, phase 3, open label, multicentre study. Lancet Oncol 2016; 17: 27–38.
- [14] Chauhan D, Tian Z, Zhou B, et al. In vitro and in vivo selective antitumor activity of a novel orally bioavailable proteasome inhibitor MLN9708 against multiple myeloma cells. Clin Cancer Res 2011; 17: 5311–5321.
- [15] Garcia Gomez A, Quwaider D, Canavese M, et al. Preclinical activity of the oral proteasome inhibitor MLN9708 in myeloma bone disease. Clin Cancer Res 2014; 20: 1542–1554.
- [16] Singhal S, Mehta J, Desican R, et al. Antitumor activity of thalidomide in refractory multiple myeloma. N Engl J Med 1999; 341: 1565–1571.
- [17] Weber D, Chen C, Niesvitzky R, et al. Lenalidomide plus Dexamethasone for Relapsed Multiple Myeloma in North America. N Engl J Med 2007; 357: 2133–2142.
- [18] Dimopoulos M, Spencer A, Attal M, et al. Lenalidomide plus Dexamethasone for Relapsed od Refractory Multiple Myeloms. N Engl J Med 2007; 357: 2123–2132.
- [19] Zhu YX, Kortuem KM, Stewart AK. Molecular mechanism of action of immune modulatory drugs thalidomide, lenalidomide and pomalidomide in multiple myeloma. Leuk Lymphoma 2013; 54: 683–687.
- [20] McCurdy AR, Lacy MQ. Pomalidomide and its clinical potential for relapsed or refractory multiple myeloma: an update for the hematologist. Ther Adv Hematol 2013; 4: 211–216.
- [21] Richardson P, Siegel D, Vij R, et al. Pomalidomide alone or in combination with low dose dexamethasone in relapsed and refractory multiple myeloma: a randomized phase 2 study. Blood 2014; 123: 1826–1832.
- [22] San Miguel J, Weisel K, Moreau P, et al. Pomalidomide plus low dose dexamethasone versus high dose dexamethasone for patients with relapsed and refractory multiple myeloma (MM 003): a randomised, open label, phase 3 trial. Lancet Oncol 2013; 14: 1055–1066.
- [23] van de Donk N, Moreau P, Plesner T, et al. Clinical efficacy and management of monoclonal antibodies targeting CD38 and SLAMF7 in multiple myeloma. Blood 2016; 127: 681–695.
- [24] Deaglio S, Mehta K, Malavasi F. Human CD38: a (r)evolutionary story of enzymes and receptors. Leuk Res 2001; 25: 1–12.
- [25] van der Veer MS, de Weers M, van Kessel B, et al. The therapeutic human CD38 antibody daratumumab improves the anti myeloma effect of newly emerging multi drug therapies. Blood Cancer J 2011; 1: e41.
- [26] Lokhorst HM, Plesner T, Laubach JP, et al. Targeting CD38 with Daratumumab Monotherapy in Multiple Myeloma. N Engl J Med 2015; 373: 1207–1219.
- [27] Lonial S, Brendan MW, Usmani SZ, et al. Daratumumab monotherapy in patients with treatment refractory multiple myeloma (SIRIUS): an open label, randomised, phase 2 trial. Lancet 2016; 387: 1551–1560.
- [28] Plesner T, Arkenau H T, Lokhorst HM, et al. Safety and efficacy of daratumumab with lenalidomide and dexamethasone in relapsed or relapsed, refractory multiple myeloma. Blood 2014; 124: a.84.
- [29] Plesner T, Arkenau H T, Gimsing P, et al. Daratumumab in combination with lenalidomide and dexamethasone in patients with relapsed or relapsed and refractory multiple myeloma – updated results of a phase 1/2 Study (GEN503). ASH Ann Meet Abstr, Blood 2015; 126: a.507.
- [30] Dimopoulos M. An open label, randomised phase 3 study of daratumumab, lenalidomide, and dexamethasone (DRD) versus lenalidomide and dexamethasone (RD) in relapsed or refractory multiple myeloma (RRMM): POLLUX. EHA 2016: a.LB2238.
- [31] Palumbo A. Chanan-Khan A, Weisel K, et al. Phase 3 randomised controlled study of daratumumab, bortezomib and dexamethasone versus bortezomib and dexamethasone in patient with relapsed or refractory multiple myeloma: CASTOR. EHA 2016: Abstr. LB2236.
- [32] https://clinicaltrials.gov[33] Muthná D, Řezáčová M, Stoklasová A, Vávrová J. Histondeacetylázy a jejich inhibitory. Postgrad Med 2009; 11: 254–258.
- [34] Hideshima T, Richardson PG, Anderson KC. Mechanism of action of proteasome inhibitors and deacetylase inhibitors and the biological basis of synergy in multi-ple myeloma. Mol Cancer Ther 2011; 10: 2034–2042.
- [35] San Miguel JF, Hungria VT, Yoon SS, et al. Panobinostat plus bortezomib and dexamethasone versus placebo plus bortezomib and dexamethasone in patient with relapsed or relapsed and refractory multiple myeloma: a multicentre, randomised, double blind phase 3 trial. Lancet Oncol 2014; 15: 1195–1206.
- [36] Richardson PG, Hungria VT, Yoon SS, et al. Panobinostat plus bortezomib and dexamethasone in previously treated multiple myeloma: outcomes by prior treatment. Blood 2016; 127: 713–721.
- [37] San Miguel J, Schlag R, Khuageva N, et al. Bortezomib plus Melphalan and Prednisone for Initial Treatment of Multiple Myeloma. N Engl J Med 2008; 359: 906–917.
- [38] San Miguel J, Schlag R, Khuageva N, et al. Persistent overall survival benefit and no increased risk of second malignancies with bortezomib melphalan prednisone versus melphalan prednisone in patients with previously untreated multiple myeloma. J Clin Oncol 2013; 31: 448–455.
- [39] Palumbo A, Hajek R, Delforge M, et al. Continuous Lenalidomide Treatment for Newly Diagnosed Multiple Myeloma. N Engl J Med 2012; 366: 1759–1769.
- [40] Benboubker L, Dimopoulos MA, Dispenzieri A, et al. Lenalidomide and dexamethasone in transplant ineligible patients with myeloma. N Engl J Med 2014; 371: 906–917.
- [41] Harousseau JL, Attal M, Avet Loiseau H, et al. Bortezomib Plus Dexamethasone Is Superior to Vincristine Plus Doxorubicin Plus Dexamethasone As Induction Treatment Prior to Autologous Stem Cell Transplantation in Newly Diagnosed Multiple Myeloma: Results of the IFM 2005 01 Phase III Trial. J Clin Oncol 2010; 28: 4621–4629.
- [42] Gay F, Oliva S, Petrucci M, et al. Chemotherapy plus lenalidomide versus autologous transplantation, followed by lenalidomide plus prednisone versus lenalidomide maintenance, in patients with multiple myeloma: a randomised, multicentre, phase 3 trial. Lancet Oncol 2015; 16: 1617–1629.
- [43] Attal M, Lauwers Cances V, Hulin C, et al. Autologous Transplantation for Multiple Myeloma in the Era of New Drugs: A Phase III Study of the Intergroupe Francophone Du Mywlome (IFM/DFCI 2009 Trial) at ASH 2015, Blood 126: abstract 391.
- [44] Cavo M, Tacchetti P, Patriarca F, et al. Bortezomib with thalidomide plus dexamethasone compared with thalidomide plus dexamethasone as induction therapy before, and consolidation therapy after, double autologous stem cell transplantation in newly diagnosed multiple myeloma: a randomised phase 3 study. Lancet 2010; 376: 2075–2085.
- [45] Rosiñol L, Oriol A, Teruel A, et al. Superiority of bortezomib, thalidomide, and dexamethasone (VTD) as induction pretransplantation therapy in multiple myeloma: a randomized phase 3 PETHEMA/GEM study. Blood 2012; 120: 1589–1596.
- [46] Richardson PG, Sonnenveld P, Schuster MW, et al. Extended follow up of a phase 3 trial in relapsed multiple myeloma: final time to event results of the APEX trial. Blood 2007; 110: 3557–3560.