Nové možnosti léčby chronické idiopatické trombocytopenické purpury u dospělých
Patogeneze chronické trombocytopenické purpury je způsobena protilátkou indukovanou destrukcí trombocytů a snížením produkce trombocytů. Dosud byli nemocní léčeni imunosupresivní či imunomodulační terapií, ale dnes se nabízí nová možnost léčby, a to stimulací tvorby trombocytů. V článku se zabýváme současnými možnostmi léčby se zaměřením na léčbu trombopoetinovými agonisty eltrombopagem a romiplostimem.
Úvod
Imunitní trombocytopenická purpura (ITP) je způsobena protilátkami IgG namířenými proti různým povrchovým strukturám trombocytů. Díky tomu jsou předčasně destruovány orgány monocyto-makrofágového systému (nejčastěji ve slezině), což spolu s nedostatečnou trombocytopoézou vede k trombocytopenii a ke krvácivým projevům.
Incidence
Incidence ITP se udává 70–100 případů na milion obyvatel [1], někteří autoři uvádějí 5,8–6,6 případu na 100 000 osob [2]. Incidence u dětí představuje 4–5 případů na 100 000 obyvatel [3, 4]. V České republice se udává incidence 6 případů na 100 000 obyvatel [5].
Klasifikace
Dělení lze provést dle doby trvání (akutní, chronická forma), nebo na primární (bez průkazu jiného průvodního onemocnění) a sekundární. Nejčastějšími průvodními onemocněními jsou jiné imunitní choroby, nádorové nebo infekční. Podrobně se sekundární ITP zabývá recentní článek [6]. Za akutní ITP se stále považuje arbitrárně onemocnění, které spontánně či po terapii kompletně ustoupí do 6 měsíců a nepotřebuje žádnou další terapii. Hranice 6 měsíců je zejména u pediatrů považována za krátkou a je snaha ji prodloužit na 12 měsíců, protože až jedna čtvrtina dětských pacientů s ITP dosáhne normalizace počtu trombocytů teprve mezi 6.–12. měsícem. Za chronickou formu je považován průběh onemocnění, kdy po tomto intervalu klesá počet trombocytů pod normální hodnoty nebo je potřeba další terapie. Pokud i přes terapii klesá počet trombocytů pod hodnoty 30 x 109/l, jde o chronickou refrakterní ITP. Vzhledem k faktu, že ITP byly věnovány v našem písemnictví v tomto roce dva články [5, 7], zmíníme se velmi krátce o etiopatofyziologii, diagnostice a terapii této jednotky a dále se budeme podrobně zabývat novými možnostmi léčby chronické relabující ITP.
Patogeneze
Autoprotilátky vázající se na trombocyty (nejčastěji antigeny Gp IIb/IIIa, Gp Ib/IX a Gp Ia/IIa) [8] je označí pro monocyto-makrofágový systém jako cizorodé a ty jsou pak retikuloendoteliálním systémem (RES) odstraněny z oběhu. Tím je zkrácena i doba přežívání krevních destiček v cirkulaci. Zajímavý je vývoj poznatků o trombocytopoéze u ITP. Po mnoho let byla předpokládána zvýšená tvorba trombocytů v kostní dřeni (megakaryocytopoéza), dle studií prováděných v 80. letech 20. století byla zjištěna snížená produkce trombocytů v kostní dřeni, a to až u dvou třetin pacientů [9]. To je způsobeno velmi pravděpodobně přímým působením autoprotilátek na maturaci megakaryocytů a uvolňování trombocytů. Porucha může být také způsobena i autoprotilátkami aktivovanou apoptózou megakaryocytů. Složitost etiopatogeneze také vysvětluje rozdílnou tíži ITP a odpověď na léčbu.
Diagnostika
Diagnóza je stále stanovena vyloučením jiné příčiny trombocytopenie, per exclusionem. Je tudíž nezbytné vyloučit jiné příčiny – onemocnění, která vedou k trombocytopenii. Ke stanovení diagnózy by měla postačit anamnéza pacienta, fyzikální vyšetření, standardní biochemická vyšetření, vyšetření hemostázy a krevního obrazu s prohlédnutím nátěru periferní krve pod mikroskopem. Sternální punkci provádíme u všech jedinců starších 60 let, v případě podezření na jinou příčinu trombocytopenie, před splenektomií a u pacientů rezistentních k primární terapii [10]. Vyšetření antitrombocytárních protilátek není v rámci diagnostiky ITP doporučováno pro nedostatečnou senzitivitu a specificitu. Také stanovení hladiny trombopoetinu není rutinně prováděno, neboť přínos tohoto vyšetření je pouze informativní v rámci diferenciální diagnostiky poruchy tvorby trombocytů [10].
Léčba
Historicky terapie začala provedením splenektomie, kdy se odstranilo místo produkce autoprotilátek a hlavní místo destrukce trombocytů. Pak se začaly podávat kortikoidy s cílem snížit fagocytární aktivitu RES. Oba přístupy se dodnes používají jako základní (ale v obráceném pořadí) a byly doplněny o aplikaci intravenózních imunoglobulinů. V terapii chronické ITP se používá další imunosupresivní či imunomodulační terapie. První zásadní otázkou v terapii ITP je stanovení doby zahájení terapie (při jakém počtu trombocytů) a také vytčení cílů terapie (počet trombocytů) s individualizací, a to z následujících důvodů:
a) frekvence a tíže krvácivých projevů není u všech jedinců s ITP stejná i při stejném počtu trombocytů;
b) každá terapie je spojena s nežádoucími účinky, které je potřeba nemocnému vysvětlit a terapii individualizovat dle jeho přání a ostatních komorbidit.
Každého jedince je nutno před zahájením léčby řádně poučit o následujícím: neužívat léky, které ovlivňují funkce trombocytů (nejčastěji kyselina acetylsalicylová, nesteroidní antirevmatika), vyvarovat se poranění, plánované výkony je vhodné odložit na období po dosažení počtu trombocytů bezpečného pro příslušný výkon, nekonzumovat alkohol, poučit o vhodných analgetikách v případě bolesti, poučit ženy v produktivním věku o graviditě. Zahájení terapie je doporučováno při počtu trombocytů < 30 x 109/l. V případě krvácivých projevů zahajujeme terapii i při vyšších počtech trombocytů. Hospitalizujeme všechny jedince s krvácivými projevy a jedince s počtem trombocytů nižším než 20 x 109/l.
Terapie 1. linie
Kortikoidy
Iniciální dávka prednisonu (nebo jeho ekvivalentu) je 1–2 µg/kg/den po dobu obvykle jednoho měsíce, maximálně 6 týdnů. Rychlost odpovědi na prednison je individuální, někteří reagují vzestupem počtu trombocytů během 1.–2. týdne, někdy dochází k odpovědi až po 3. týdnu léčby. Pokud dojde k remisi, pak dávku kortikoidu postupně snižujeme. Někdy se používají iniciálně pulzy kortikoidů, s přechodem na dávku 1–2 µg/kg/den, nebo např. dexamethason podávaný v dávce 40 µg/den po 4 dny v měsíčních cyklech, a to 6krát za sebou. Nemáme jasný důkaz, že by terapie pulzními dávkami vedla k vyššímu procentu dosažení remise. Příznivou odpověď na tuto terapii lze očekávat u 60–70 % jedinců [11]. Pokud nedojde k odpovědi na terapii, pak je indikována 2. linie léčby (viz níže). Nejčastější chyby v klinické praxi spojené s kortikoterapií jsou následující: podávání nižší dávky kortikoidu, rychlé ukončení léčby po dosažení remise, netrpělivost při čekání na odpověď, podcenění rizika venózního tromboembolismu u jedinců s dalšími rizikovými faktory (obezita, imobilizace, užívání hormonální antikoncepce aj.). Pokud nemocný krvácí nebo hrozí vysoké riziko krvácení, je možno v 1. linii použít vysoké dávky imunoglobulinů (IVIG).
IVIG
Mechanismem působení je blokáda RES působením antiidiotypových protilátek, ovlivnění hladiny cytokinů a modulace Fc receptorů. Ve srovnání s kortikoidy je účinnost rychlejší [12]. Doporučuje se dávkování 1 g/kg po 2 dny či 0,4 g/kg po dobu 5 dnů. Odpověď je rychlá, ale trvá maximálně 3 týdny.
Anti D protilátka
Mechanismus působení je pravděpodobně stejný jako u IVIG. Doporučována je dávka 75 µg/kg v jednom cyklu. Terapie může být komplikována hemolytickou reakcí s akutní renální insuficiencí, ale byla popsána i diseminovaná intravaskulární koagulace [13]. K odpovědi dochází u 79–90 % dospělých. Nicméně tato terapie se běžně v České republice neprovádí.
Terapie 2. linie
Splenektomie
Slezina je místem tvorby protilátek a hlavním místem rozpadu trombocytů. Přes nové možnosti terapie volíme splenektomii jako metodu volby druhé linie. Obecně lze říci, že ke splenektomii jsou indikováni jedinci, u kterých terapie kortikoidy nebyla úspěšná nebo byla kontraindikována či u kterých byla dávka udržovací terapie vysoká, a tudíž spojená s nežádoucími účinky.
Splenektomie je tedy prováděna u nemocných refrakterních na 1. linii terapie, u časně relabujících jedinců s těžkou nebo symptomatickou trombocytopenií. Nepanuje stále jednotný názor na načasování splenektomie. Někteří ji indikují ihned po 4–6týdenní terapii kortikoidy, kdy nedojde k vzestupu počtu trombocytů, nyní je však mnoha autory doporučován odklad výkonu u dospělých bez závažných krvácivých projevů až o 6–12 měsíců. Z dlouhodobého hlediska je splenektomií dosaženo nejvyššího počtu léčebných odpovědí, a to 60–70 %. Bohužel stále neexistuje jednoznačný předoperační indikátor úspěšnosti splenektomie [14]. Není jím ani předoperační měření přežívání trombocytů značených radioaktivním indiem. Vlastní výkon je dnes možno provést i laparoskopickou technikou. Výsledky a komplikace tohoto zákroku byly publikovány i v našem písemnictví [15, 16]. Po provedení splenektomie je vyšší riziko infekce enkapsulovanými mikroorganismy, zejména jde o Streptococcus pneumoniae. Vzhledem k tomu by měli být všichni splenektomovaní očkováni proti pneumokokům, meningokokům typu C a hemofilům typu B [17]. Některá pracoviště doporučují profylaktické podávání antibiotik po dobu 6 měsíců, někteří po dobu 3 let až celoživotně [18]. V případě relapsu ITP po splenektomii je vždy nutno před zahájením další terapie vyloučit přítomnost akcesorní sleziny.
Rituximab
Jedná se o monoklonální chimérickou protilátku proti receptoru CD20 navázanému na B lymfocytech. Rituximab způsobuje FcR mediovanou B buněčnou lýzu cestou aktivace komplementu či cestou buněčné imunity [19]. Snížení počtu B lymfocytů vede i ke snížení množství protilátek, dochází také k blokádě RES. Léčba rituximabem je většinou dobře tolerovaná, může dojít přechodně k hypotenzi, poruše srdečního rytmu, vzácně i k anafylaxi. Kompletní remise je navozena asi v 50 % případů, z toho dlouhodobá je u 33 % nemocných [20–22].
Chronická refrakterní ITP
Pokud nejsou výše uvedené terapeutické přístupy úspěšné, pak můžeme hovořit o chronické refrakterní ITP. Zde jsou splněny tyto podmínky:
a) ztráta léčebné odpovědi;b) nulová odpověď na 1. a 2. linii léčby;c) nutnost terapie neakceptovatelně vysokými dávkami kortikoidů k udržení bezpečné hodnoty trombocytů (nejméně 20 x 109/l, spíše ≥ 30 x 109/l). U některých jedinců s krvácivými projevy je nutno dosáhnout i vyšší hodnoty trombocytů.
V klinické praxi se jedná přibližně o 10 % z celkového počtu jedinců s diagnózou ITP.
V této dosud nelehké situaci jsme vystaveni volbě mezi mnoha léčivy, která mají různý mechanismus účinku, různou úspěšnost, ale léčba je bohužel spojena s nežádoucími účinky, mnohdy závažnými. Není zde pevný algoritmus terapie, léčba se řídí doporučeními expertních skupin [10], protože donedávna chyběly prospektivní randomizované studie. Pacienti s chronickou refrakterní ITP mohou mít prospěch z podávání danazolu, imunosupresivních léků a nově zejména z léčby trombopoetinovými agonisty. Danazol je slabý androgen, 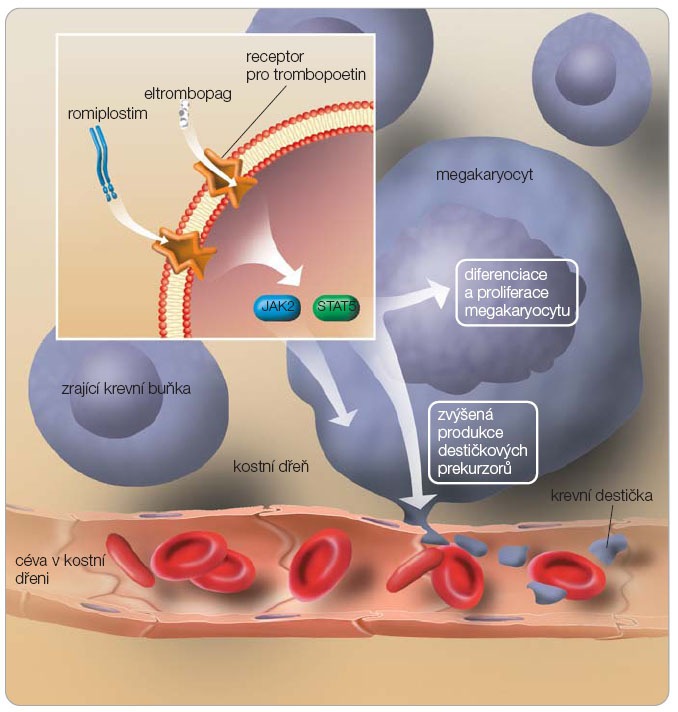 patofyziologický mechanismus spočívá pravděpodobně v ovlivnění Fc receptoru. Naše zkušenosti s tímto přípravkem nebyly dobré, podávání dávky léčiva, které vedlo k uspokojivému vzestupu počtu trombocytů, bylo téměř vždy spojeno s elevací hodnot jaterních testů či s jinými nežádoucími účinky (přírůstek hmotnosti, retence tekutin). Mezi imunosupresiva používaná v této situaci patří azathioprin, mykofenolát mofetil, cyklosporin A, cyklofosfamid, vinka alkaloidy. Zásadní změnu v přístupu k terapii představují agonisté trombopoetinu. Idea léčit ITP tímto mechanismem vyšla z poznatku, že ITP je provázena neadekvátní odpovědí megakaryopoézy na trombocytopenii a relativním nedostatkem endogenního trombopoetinu (TPO). Jedná se o glykoproteinový hormon, hematopoetický cytokin produkovaný zejména v játrech a ledvinách. Jeho podávání vede ke stimulaci tvorby a k diferenciaci megakaryocytů. TPO působí až na kmenovou buňku, a to destičkovým receptorem Mpl (CD 110), který je produktem protoonkogenu c-Mpl [23]. První generace těchto látek nebyla v terapii úspěšná vzhledem k tvorbě protilátek, které dále vedly k trombocytopenii a i k těžkému útlumu krvetvorby [24, 25]. Do další generace mnohem úspěšnějších agonistů receptorů pro TPO patří dvě molekuly: rekombinantní protein romiplostim (AMG 531) a nepeptidová molekula eltrombopag, viz obr. 1 [26, 27]. Těmto dvěma látkám věnujeme nejvíce pozornosti, protože jsou velkým příslibem pro budoucnost.
patofyziologický mechanismus spočívá pravděpodobně v ovlivnění Fc receptoru. Naše zkušenosti s tímto přípravkem nebyly dobré, podávání dávky léčiva, které vedlo k uspokojivému vzestupu počtu trombocytů, bylo téměř vždy spojeno s elevací hodnot jaterních testů či s jinými nežádoucími účinky (přírůstek hmotnosti, retence tekutin). Mezi imunosupresiva používaná v této situaci patří azathioprin, mykofenolát mofetil, cyklosporin A, cyklofosfamid, vinka alkaloidy. Zásadní změnu v přístupu k terapii představují agonisté trombopoetinu. Idea léčit ITP tímto mechanismem vyšla z poznatku, že ITP je provázena neadekvátní odpovědí megakaryopoézy na trombocytopenii a relativním nedostatkem endogenního trombopoetinu (TPO). Jedná se o glykoproteinový hormon, hematopoetický cytokin produkovaný zejména v játrech a ledvinách. Jeho podávání vede ke stimulaci tvorby a k diferenciaci megakaryocytů. TPO působí až na kmenovou buňku, a to destičkovým receptorem Mpl (CD 110), který je produktem protoonkogenu c-Mpl [23]. První generace těchto látek nebyla v terapii úspěšná vzhledem k tvorbě protilátek, které dále vedly k trombocytopenii a i k těžkému útlumu krvetvorby [24, 25]. Do další generace mnohem úspěšnějších agonistů receptorů pro TPO patří dvě molekuly: rekombinantní protein romiplostim (AMG 531) a nepeptidová molekula eltrombopag, viz obr. 1 [26, 27]. Těmto dvěma látkám věnujeme nejvíce pozornosti, protože jsou velkým příslibem pro budoucnost.
Romiplostim
Romiplostim je protein o molekulární hmotnosti 60 kDa, který se váže k receptoru Mpl, ale nemá žádnou strukturální podobnost s endogenním TPO. Velmi podrobně je této látce věnována publikace [7], proto zmíníme jen nejpodstatnější informace. Ve třech studiích byla na zdravých dobrovolnících vyzkoušena účinnost v různých dávkováních, a to 0,3, 1,0 a 10 µg/kg intravenózně. U všech účastníků, kterým byla aplikována dávka 1–10 µg/l, došlo po podání jedné dávky k vzestupu počtu trombocytů na ≥ 1,5násobek původního počtu. Nejvyšší vzestup byl pozorován mezi 12.–15. dnem po aplikaci. Účinnost a bezpečnost tohoto přípravku byla testována v několika klinických studiích.
První studie fáze I [28] s romiplostimem u jedinců s chronickou refrakterní ITP měly za cíl primárně ověřit bezpečnost, druhotně pak účinek. V první z nich byl romiplostim podáván subkutánně v dávkovém rozmezí 0,2–10 µg/kg dle hmotnosti pacienta. Cílový počet trombocytů byl 50–450 x 109/l. Pokud nedošlo k dosažení této hodnoty, byla aplikována 2. dávka. Doba sledování představovala 72 dnů. Celkem bylo do studie zahrnuto 24 pacientů (79 % po splenektomii). Cílového počtu trombocytů bylo dosaženo u 4 ze 12 pacientů, kteří byli léčeni dávkami 3, 6, a 10 µg/kg. K podobným výsledkům dospěla i další studie fáze I/II [29], kdy dávka romiplostimu byla eskalována v absolutních hodnotách v dávkových hladinách 30, 100, 300, resp. 500 µg. Celkem bylo zařazeno 16 pacientů, po čtyřech do každé dávkové skupiny. Pro druhou dávku byla uplatněna stejná strategie jako u předchozí studie. U pacientů, kteří obdrželi 2 dávky romiplostimu, byla zaznamenána odpověď v závislosti na dávkové hladině: jeden pacient ze čtyř s dávkou 30 µg, 2 pacienti ze čtyř s dávkou 100 µg a 4 pacienti ze sedmi s dávkou 300 µg.
Zkoušení romiplostimu s dávkou vázanou na hmotnost pokračovalo v dvojitě zaslepené, placebem kontrolované klinické studii fáze II [26]. Pacienti s chronickou ITP (67 % po splenektomii) byli randomizováni k terapii v dávkách 1, 3, 6 µg/kg nebo k podávání placeba. Léčba byla podávána po 6 týdnů (jedna dávka týdně po dobu 6 týdnů) a sledování trvalo také 6 týdnů. Primárním cílem bylo zjistit reakci na dávku vzestupem počtu trombocytů s cílovou hladinou 50–450 x 109/l. Celkem bylo zkoušeno 21 jedinců: 4 ve skupině s placebem, po 8 pacientech ve skupinách s dávkami 1 a 3 µg/kg a 1 pacient byl léčen ve skupině s dávkou 6 µg/kg. Medián dosažení nejvyšší hodnoty trombocytů byl 18, resp. 19 dní při dávkových hladinách 1 a 3 µg/kg, u placeba byla doba delší, a to 63 dní. Cílového počtu trombocytů bylo dosaženo u 7 z osmi pacientů léčených dávkou 1 µg/kg a u 5 z osmi s dávkou 3 µg/kg. Nejčastějším nežádoucím účinkem ve studiích fáze I byla mírná bolest hlavy, po ukončení terapie došlo k trombocytopenii. V roce 2008 byly publikovány výsledky dvou paralelně probíhajících randomizovaných, dvojitě zaslepených, placebem kontrolovaných studií fáze III [29]. Do studií byl zařazeno 125 pacientů s chronickou ITP (63 po splenektomii, 62 bez předchozí splenektomie). Vstupním kritériem byl počet trombocytů ≤ 30 x 109/l. Randomizace k placebu byla v poměru 2 : 1. Romiplostim byl aplikován 1krát týdně subkutánně po dobu 6 měsíců v iniciální dávce 1 µg/kg s úpravou dávky tak, aby bylo dosaženo rozmezí 50–200 x 109/l. Pacienti byli sledováni do konce 9. měsíce od zahájení terapie, nebo do poklesu počtu trombocytů < 50 x 109/l. Dalším kritériem hodnocení byl počet trombocytů > 50 x 109/l po dobu alespoň 6 týdnů v posledních 8 týdnech terapie bez současné další terapie ITP. Tohoto cíle dosáhlo ve skupině s romiplostimem 38 % pacientů a nikdo ve skupině placeba (p = 0,0013). Ve skupině pacientů bez splenektomie byla dlouhodobá odpověď vyšší: 61 % s romiplostimem vs. 5 % s placebem (p < 0,001). Celková odpověď byla ve skupině se splenektomií 79 % vs. 0 % a ve skupině bez splenektomie 88 % vs. 14 % (p < 0,001). Průměrná doba trvání odpovědi byla ve skupině se splenektomií 13,9 vs. 0,8 týdne, ve skupině bez splenektomie 15,2 vs. 0,2 týdne. Záchranná terapie byla potřebná u 26 % pacientů léčených romiplostimem vs. u 57 % z těch pacientů, kteří dostávali placebo (p = 0,0175); ve studii bez splenektomie to bylo 17 % vs. 62 % (p = 0,004).
Nejčastějším nežádoucím účinkem ve studiích III. fáze byla cefalea, ale výskyt se vůči placebu významně nelišil. Poté, co bylo podávání romiplostimu ukončeno, došlo znovu k trombocytopenii. U jednoho pacienta došlo ke zvýšení hladiny retikulinu v kostní dřeni, které plně odeznělo po ukončení léčby. Podobný reverzibilní nález byl již pozorován v dřívějších zkoušeních [30]. U dvou pacientů léčených romiplostimem byla popsána trombotická příhoda (a. poplitea a cerebrovaskulární ischemie), ale jednalo se o jedince v pokročilém věku s arteriosklerózou. Ani v jedné studii nebyly detekovány protilátky proti romiplostimu či endogennímu TPO. Výše uvedené studie mají pokračování v otevřené studii [31], do které mohli vstoupit všichni jedinci z výše uvedených randomizovaných studií, včetně pacientů, kterým bylo podáváno placebo. Těm byla podána zahajovací dávka romiplostimu 1 µg/kg s.c. s následnou titrací. Jedinci, kteří dostávali v předchozí studii romiplostim, pokračovali v dávkování, které jim byla podáváno na konci studie. Ze 137 zařazených pacientů jich 82 % (tj. 112 jedinců) odpovědělo vzestupem počtu trombocytů ≥ 50 x 109/l a nejméně na dvojnásobek vůči výchozí hodnotě.
Eltrombopag
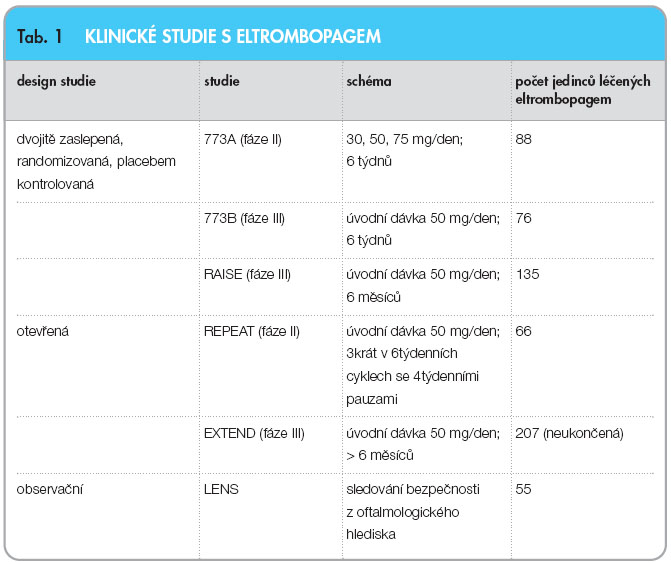 Další možností terapie chronické refrakterní ITP je eltrombopag. Jedná se o malou molekulu, agonistu TPO receptoru. Jeho podávání vede k vzestupu počtu trombocytů závislému na dávce léčiva. Je k dispozici v tabletách po 25 µg nebo 50 µg. Indikací k podání je terapie chronické ITP u jedinců s předchozí léčbou s cílem zvýšit počet trombocytů a snížit riziko krvácení. Dávkování, účinnost a bezpečnost přípravku byla testována v několika klinických studiích (tab. 1).
Další možností terapie chronické refrakterní ITP je eltrombopag. Jedná se o malou molekulu, agonistu TPO receptoru. Jeho podávání vede k vzestupu počtu trombocytů závislému na dávce léčiva. Je k dispozici v tabletách po 25 µg nebo 50 µg. Indikací k podání je terapie chronické ITP u jedinců s předchozí léčbou s cílem zvýšit počet trombocytů a snížit riziko krvácení. Dávkování, účinnost a bezpečnost přípravku byla testována v několika klinických studiích (tab. 1).
Podávání eltrombopagu se doporučuje dle následujícího schématu: začít dávkou 50 µg denně a dle potřeby ji po 2–3 týdnech zvýšit na 75 µg. Pokud trombocyty dosahují počtu 200–400 x 109/l, dávka se sníží o 25 µg. V případě vzestupu počtu trombocytů > 400 x 109/l se léčba přechodně přeruší.
Do studie TRA 100773A [32] bylo zařazeno 118 pacientů s chronickou refrakterní či relabující ITP s výchozím počtem trombocytů < 30 x 109/l. Po 6 týdnech podávání eltrombopagu v dávce 75 µg došlo k vzestupu trombocytů > 50 x 109/l u 81 % pacientů a u 70 % pacientů, kteří užívali dávku 50 µg. Při užívání 30 µg došlo k vzestupu počtu trombocytů nad tuto hodnotu pouze u 28 % léčených. Ve skupině, která dostávala placebo, byl zaznamenán vzestup v 11 % případů. Také došlo ke snížení frekvence krvácivých projevů ve srovnání s placebem. Do studie TRA 100773B [33] bylo zařazeno 114 pacientů také s chronickou refrakterní či relabující ITP s počtem trombocytů < 30 x 109/l. Ve skupině pacientů, kteří užívali 50 µg eltrombopagu po dobu 6 týdnů (s eventuálním zvýšením dávky na 75 µg), dosáhlo vzestupu počtu trombocytů na hodnotu > 50 x 109/l celkem 58,9 % jedinců, zatímco ve skupině s placebem to bylo pouze 16,2 % jedinců (p < 0,001). Došlo také ke statisticky významnému snížení výskytu krvácivých projevů ve skupině léčených v porovnání se skupinou placebovou. Do studie RAISE [34] (fáze III, dvojitě zaslepená studie kontrolovaná placebem) bylo zařazeno 197 jedinců. Byla zkoušena účinnost, bezpečnost a snášenlivost eltrombopagu po dobu 6 měsíců podávání u jedinců s chronickou idiopatickou trombocytopenickou purpurou, kteří byli již předléčeni. Cílem bylo vyhodnocení počtu jedinců s počtem trombocytů v rozmezí 50–≤ 400 x 109/l při 6měsíčním podávání. Tento počet byl 8krát vyšší v porovnání s placebem, OR 99%: 8,2 (3,59, 18,73); p < 0,001.
Ve studii REPEAT byl eltrombopag podáván ve 3 cyklech po dobu 6 týdnů se 4týdenními pauzami. Byli zařazeni jedinci s počtem trombocytů 20–50 x 109/l. Základním cílem bylo hodnocení počtu jedinců, kteří odpověděli vzestupem počtu trombocytů ≥ 50 x 109/l a nejméně na dvojnásobek vůči výchozí hodnotě v cyklu 1 a dále v cyklech 2 nebo 3. Tohoto cíle dosáhlo 52 jedinců (80 %) v cyklu 1 a 45 jedinců v cyklu 2 nebo 3. Poslední studií, která stále probíhá, je studie EXTEND [35], kam jsou zařazeni nemocní z předchozích studií, kteří užívali eltrombopag. Do studie, která má 4 stadia, bylo zařazeno 207 jedinců. V 1. fázi byli nemocní léčeni eltrombopagem, ve 2. fázi se ukončilo podávání přídatné medikace pro léčbu ITP, ve 3. fázi byla možná úprava dávky a ve 4. fázi byla podávána dávka udržovací. Více než 35 % jedinců mělo odpověď na terapii ≥ 10 týdnů. Z nežádoucích účinků terapie eltrombopagem převládaly bolesti hlavy, únava, bolesti v kloubech, nazofaryngitida, ale stejně četný výskyt těchto potíží byl zaznamenán i ve skupině s placebem. U některých pacientů došlo k vzestupu hodnot jaterních testů, ale tato elevace byla přechodná, mírná a bez klinické konsekvence. Nebyly pozorovány žádné nežádoucí účinky na kostní dřeň či větší výskyt katarakty. Léčba byla všeobecně dobře snášena.
Na základě výše uvedených dat lze dnes doporučit léčbu ITP agonisty trombopoetinu v následujících situacích:
-
selhání terapie 1. a 2. linie při přetrvávající těžké trombocytopenii, krvácivých projevech či tam, kde tyto krvácivé komplikace lze očekávat (věk, komorbidity aj.);
-
kdy je z nějakého důvodu kontraindikována splenektomie; ¨
-
při přípravě na elektivní zákrok u jedince v parciální remisi ITP.
Závěr
Chronická refrakterní či relabující idiopatická trombocytopenická purpura postihuje cca 10 % nemocných s ITP. Dosud představovala skupinu nemocných, pro něž bylo obtížné najít účinnou a bezpečnou léčbu. S novými poznatky o etiopatogenezi ITP a účinnosti výše uvedených dvou látek se nabízí kvalitativně jiná možnost pomoci těmto nemocným.
Seznam použité literatury
- [1] Cines DB, Blanchette VS. Immune thrombocytopenic purpura. N Engl J Med 2002; 346: 995–1008.
- [2] McMillan R. Therapy for adults with refractory chronic immune thrombocytopenic purpura. Ann Internal Med 1997; 126: 307–314.
- [3] Zeller B, Helgestad J, Hellenbosatd M, et al. Immune thrombocytopenic purpura in childhood in Norway: a prospective population – based registration. Pediatric Hematology and Oncology 2000; 174: 551–558.
- [4] Fogarty PF, Segal JB. The epidemiology of immune thrombocytopenic purpura. Curr Opin Hematol 2007; 14: 515–519.
- [5] Červinek L, Doubek M, Mayer J. Idiopatická trombocytopenická purpura – patogeneze, moderní léčba a analýza prevalence, diagnostiky a terapie v Jihomoravském kraji. Trans Hemat dnes 2009; 15: 23–30.
- [6] Cines DB, Bussel JB, Howard A, et al. The ITP syndrome: pathogenic and clinical diversity. Blood 2009; 113: 6511–6521.
- [7] Kozák T. Romiplostim (AMG 531) a léčba imunitní trombocytopenické purpury. Farmakoterapie 2009; 5: 249–256.
- [8] Cooper N, Bussel JB. The pathogenesis of immune thrombocytopenic purpura. Br J Haematol 2006; 133: 364–374.
- [9] Heyens AP, Loter MG, Badenhorst PN, et al. Kinetics and sites of destruction of 111 indium-oxine-labeled platelets in idiopathic thrombocytopenic purpura. A quantitative study. Am J Hematol 1982; 12: 167–177.
- [10] Provan D, Newland A, Bolton-Maggs P, et al. Guidelines for the investigation and management of idiopathic thrombocytopenic purpura in adults, children and in pregnancy. Br J Haematol 2003; 120: 575–596.
- [11] George JN, El-Harake MA. Chronic idiopathic thrombocytopenic purpura. N Engl J Med 1994; 331: 1207–1211.
- [12] Beck CE, Nathan PC, Parkin PC. Corticosteroids versus intravenous immune globulin for the treat-ment of acute immune thrombocytopenic purpura in children: a systematic review and meta-analysis of randomized controlled trials. J Pediatr 2005; 147: 521–527.
- [13] Scaradavou A, Woo B, Divine M, et al. Intravenous anti-D treatment of immune thrombocytopenic purpura: experience in 272 patients. Blood 1997; 89: 2689–2700.
- [14] Kajouri K, Vesely SK, Terrell DR, et al. Splenectomy for adult patients with idiopathic thrombocytopenic purpura: a systematic review to assess long-term platelet count responses, prediction of response, and surgical complications. Blood 2004; 104: 2623–2634.
- [15] Kvapil F, Doubek M, Brychtová Y, et al. Splenektomie v diagnostice a léčbě hematologických onemocnění – indikace, komplikace a výsledky z jednoho pracoviště. Trans Hematol dnes 2006; 12: 146–152.
- [16] Vokurka S, Koza V, Vozobulová V, et al. Výsledky a komplikace splenektomie u pacientů s těžkou trombocytopenií při ITP rezistetntní na úvodní konzervativní léčbu – zkušenosti centra. Trans Hematol dnes 2007; 13: 23–26.
- [17] BCSH Guidelines for the prevention and treatment of infection in patients with an absent or dysfunctional spleen. Working Party of the British Committee for Standards in Haematology, Clinical Haematology Task Force. BMJ 1996; 312: 430–434.
- [18] Ráčil Z. Prevence septických stavů u dospělých pacientů s funkčním hyposplenismem po splenektomii. Vnitř Lék 2001; 47: 781–789.
- [19] Garvey B. Rituximab in the treatment of autoimmune haematological disorders. Br J Haematol 2008; 141: 149–169.
- [20] Stasi R, Pagano A, Stipa E, et al. Rituximab chimeric anti-CD 20 monoclonal antibody treatment for adults with chronic idiopathic thrombocytopenic purpura. Blood 2001; 98: 952–957.
- [21] Cooper N, Stasi R, Cunningham-Rundles S, et al. The efficacy and safety of B-cell depletion with anti-CD20 monoclonal antibody in adults with chronic immune thrombocytopenic purpura. Br J Haematol 2004; 125: 232–239.
- [22] Braendstrup P, Bjerrum OW, Nielsen OJ, et al. Rituximab chimeric anti-CD20 monoclonal antibody treatment for adult refractory idiopathic thrombocytopenic purpura. Am J Hematol 2005; 78: 275–280.
- [23] de Sauvage FJ, Hass PE, Spenser SD, et al. Stimulation of megakaryocytopoiesis and thrombopoiesis by the c-Mpl ligand. Nature 1994; 369: 533–538.
- [24] Li J, Yang C, Xia Y, et al. Thrombocytopenia caused by the development of antibodies to thrombopoetin. Blood 2001; 98: 3241–3248.
- [25] Basser RL, O’Flaherty E, Green M, et al. Development of pancytopenia with neutralizing antibodies to thrombopoetin after multicycle chemotherapy supported by megakaryocyte growth and development factor. Blood 2002; 99: 2599–2602.
- [26] Bussel JB, Kuter DJ, George JN, et al. AMG 531, a thrombopoiesis-stimulating protein, for chronic ITP. N Engl J Med 2006; 355: 1672–1681.
- [27] Jenkins JM, Williams D, Deng Y, et al. Phase I clinical study of eltrombopag, an oral, non-peptide thrombopoetin receptor agonist. Blood 2007; 109: 4739–4741.
- [28] Newland A, Ceulier MT, Kappers-Klunne M, et al. An open-label, unit dose finding study of AMG 531, a novel thrombopoesis-stimulating peptibody, in patients with immune thrombocytopenic purpura. Br J Haematol 2006; 135: 547–553.
- [29] Kuter DJ, Bussel JB, Lyons RM, et al. Efficacy of romiplostim in patients with chronic immune thrombocytopenic purpura: a double-blind randomised controlled trial. Lancet 2008; 371: 395–403.
- [30] Douglas VK, Tallman MS, Cripe LD, et al. Thrombopoetin administered during induction chemotherapy to patients with acute myeloid leukemia induces transient morphologic changes that may resemble chronic myeloproliferative disorders. Am J Clin Pathol 2002; 117: 844–850.
- [31] Bussel JB, Kuter DJ, deWolf JTM, et al. Long-Term Dosing of AMG 531 in thrombocytopenic patients with immune thrombocytopenic purpura: 2-Year Update. ASH 2007; abstract 568.
- [32] Bussel JB, Cheng G, Saleh MN, et al. Eltrombopag for the Treatment of Chronic Idiopatic Thrombocytopenic Purpura. N Engl J Med 2007; 357: 2237–2247.
- [33] Bussel JB, Provan D, Shamsi T. Effect of eltrombopag on platelets counts and bleeding during treatment of chronic idiopathic thrombocytopenic purpura: a randomised, double blind, placebo-controlled trial. Lancet 2009; 373: 641–648.
- [34] Cheng G, Saleh MN, Bussel JB, et al. Oral el-trombopag for the long-term treatment of patients with chronic idiopathic thrombocytopenic purpura (RAISE). Blood 2008; 112: 153 (abstract 400).
- [35] Bussel JB, Cheng G, Kovaleva L, et al. Long-term safety and efficacy of oral eltrombopag for the treatment of subjects with idiopathic thrombocytopenic purpura: 5(ITP): preliminary data from the EXTEND study. Blood ASH Annu Meet Abstr 2007; 11066.