Nové přístupy v léčbě chronických neuropatických bolestí
Péče o nemocné s chronickou bolestí je často velmi složitým medicínským problémem. Velmi důležitým a přitom komplikovaným typem chronických bolestí jsou neuropatické bolesti, které vznikají na podkladě léze či onemocnění periferního nebo centrálního somatosenzitivního nervového systému. Typické senzorické změny jsou významné pro správnou diagnózu neuropatické bolesti a pro její odlišení od jiných typů bolesti. K potvrzení správné diagnózy slouží i dotazníkové metody. Léčba neuropatické bolesti je pro lékaře velkou výzvou, protože mnoho nemocných má stále nedostatečně účinnou léčbu této bolesti. Je nezbytné zvolit multidisciplinární přístup. Ze škály léčebných možností se nejčastěji využívají ty nejdůležitější – farmakologické metody. V článku jsem se zaměřil na léčbu opioidy, na novější invazivní, zejména neuromodulační (neurostimulační) analgetické přístupy a na nové přístupy v léčbě neuropatické bolesti, jež představují především lokálně aplikované léky. Ke zlepšení a k zefektivnění léčby neuropatické bolesti je nezbytné dále rozpoznávat specifika neuropatické bolesti a na podkladě těchto znalostí dále zlepšovat již používané algoritmy v této léčbě.
Úvod
Syndrom chronické nenádorové bolesti (CHNB) se vyznačuje stížností na bolest tělesnou nebo útrobní trvající déle než 3 měsíce. Za chronickou je třeba považovat bolest i při kratším trvání, pokud přesahuje dobu pro dané onemocnění či poruchu obvyklou. Chronická dlouhotrvající bolest nemá žádnou biologicky užitečnou funkci a je zdrojem tělesných, duševních i sociálních útrap. Cílem léčebných postupů u chronické bolesti nemusí být nutně úplné uzdravení jedince, ale úprava a eventuálně obnovení funkční zdatnosti v dosažitelné míře v oblasti fyzické, psychické i sociální [1]. Důležitým principem, který zvyšuje efektivitu léčby CHNB jak u bolestí nociceptivních, tak neuropatických, příp. také u bolestí smíšené etiologie, je použití postupů farmakologických i nefarmakologických.
Základní terapeutické postupy v léčbě CHNB
- Farmakoterapie
- Rehabilitační postupy
- Psychoterapeutické metody
- Sociální podpora
- Invazivní analgetické metody
- Postupy alternativní medicíny (např. akupunktura)
Základní cíle léčby CHNB
- Dosažení úlevy od bolesti
- Zvýšení funkční kapacity a zlepšení kvality života
Epidemiologie a definice neuropatické bolesti
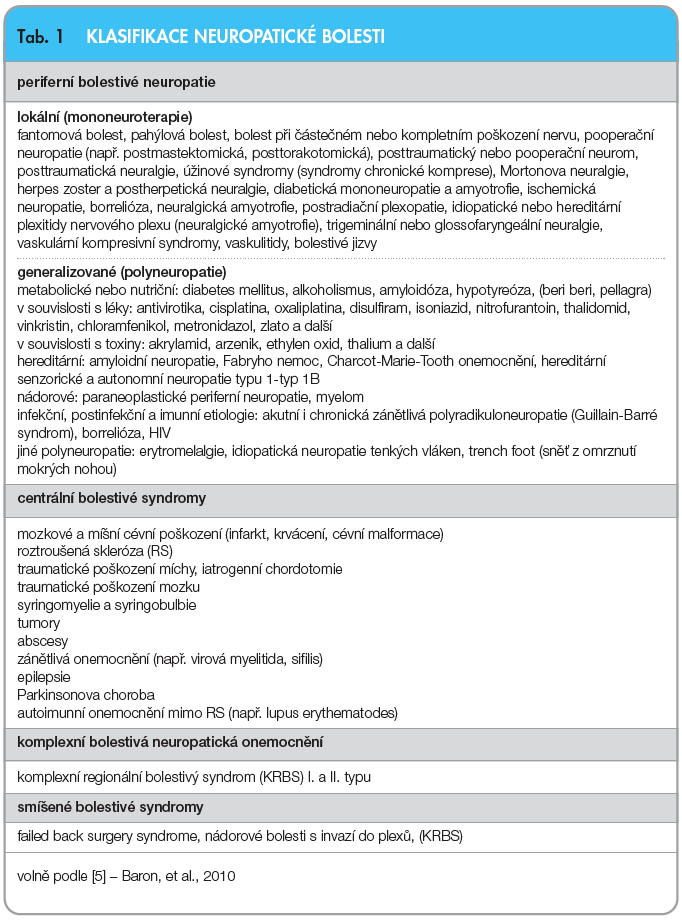 Přesná prevalence neuropatické bolesti (NB) není známa. Podle dvou evropských studií se prevalence výskytu NB pohybuje mezi 7–8 % [2]. Nejčastějšími příčinami NB jsou posttraumatická a chirurgická poškození nervu a postherpetická neuralgie (PHN). Po herniotomii vznikne chronická NB asi u 10 % pacientů, akutní herpes zoster vyvolá PHN asi v 8 % případů, po cévní mozkové příhodě vzniká NB též v 8 %, při roztroušené skleróze (RS) v 28 % a po postižení míchy – spinal cord injury (SCI) – vzniká NB až u 67 % pacientů. U nemocných s diabetem nastává bolestivá periferní neuropatie v 16 % [2]. Přehled a rozdělení NB jsou uvedeny v tab. 1.
Přesná prevalence neuropatické bolesti (NB) není známa. Podle dvou evropských studií se prevalence výskytu NB pohybuje mezi 7–8 % [2]. Nejčastějšími příčinami NB jsou posttraumatická a chirurgická poškození nervu a postherpetická neuralgie (PHN). Po herniotomii vznikne chronická NB asi u 10 % pacientů, akutní herpes zoster vyvolá PHN asi v 8 % případů, po cévní mozkové příhodě vzniká NB též v 8 %, při roztroušené skleróze (RS) v 28 % a po postižení míchy – spinal cord injury (SCI) – vzniká NB až u 67 % pacientů. U nemocných s diabetem nastává bolestivá periferní neuropatie v 16 % [2]. Přehled a rozdělení NB jsou uvedeny v tab. 1.
NB byla nedávno předefinována Speciální skupinou pro neuropatickou bolest (NeuPSIG) Světové společnosti pro studium bolesti (IASP) jako „bolest vznikající jako přímý důsledek poškození nebo onemocnění postihující somatosenzitivní systém“ [3]. Tato nová definice nahradila předcházející definici IASP: „Neuropatická bolest je bolest vyvolaná nebo způsobená primárním poškozením nebo dysfunkcí nervového systému.“
NB patří mezi obtížně léčitelné bolesti, které zejména v chronické fázi často výrazně zhoršují kvalitu života nemocných. Patofyziologie NB a základní přístupy k léčbě jsou velmi dobře popsány v mnoha recentních českých a světových publikacích [2–5], a tak bych se více zaměřil na screening nemocných s NB a zvláště pak na jejich léčbu, a to zejména opioidy, dále na intervenční, především neuromodulační (neurostimulační) terapeutické postupy a na nové, většinou lokální možnosti v léčbě NB.
Screening nemocných s neuropatickou bolestí
Stálou snahou vědců a zvláště lékařů je určit nemocné, kteří budou vhodní k léčbě NB na podkladě detailního rozboru symptomů a příznaků s použitím vhodných neurologických vyšetření a specifických dotazníků bolesti [6].
Vyšetření nemocných s podezřením na NB by mělo vést k rozpoznání NB, k určení vyvolávajícího onemocnění, k určení lokalizace nervové léze a ke zjištění funkčního a sociálního omezení na podkladě NB a souvisejících psychosociálních aspektů. Důležité je zvážení i případných komorbidit, jako jsou nespavost, strach, deprese, disabilita (neschopnost, omezení) a vlivu onemocnění v rodině, práci a sociálním životě nemocného [2]. Současné studie ukazují, že nervová léze vede k významným změnám v nervovém systému, které NB odlišují od jiných typů chronické bolesti. Detailní anamnéza a pečlivé klinické vyšetření je samozřejmě základem k určení NB. Léze v periferním i v centrálním somatosenzitivním nervovém systému vede k senzorickému deficitu dle místa a rozsahu postižení. K dispozici jsou validní diagnostické prostředky, které pomáhají k upřesnění diagnostiky NB: elektrofyziologické techniky, zejména elektroneuromyografie, somatosenzorické evokované potenciály, příp. laserem evokované potenciály, (funkční) magnetická rezonance, příp. pozitronová emisní tomografie, biopsie kůže či nervu, příp. mikroneurografie a vhodné laboratorní testy, které mohou pomoci k diagnostice typu a určení rozsahu nervového poškození [5, 7]. Velmi důležité je přesně analyzovat kvalitu somatosenzorických abnormalit. Senzorické testování je velmi důležitou částí klinického vyšetření a dá se provádět jednoduchými postupy k odlišení funkčního postižení různých senzitivních vláken. Pacient s NB má skoro vždy oblast abnormální citlivosti nebo hypersenzitivity v postižené oblasti. Tyto percepce jsou většinou jedinečné a jednoznačné a nemocný je předtím nikdy nepociťoval. Senzorické abnormality v postižené kožní oblasti jsou rozdílné u jednotlivých onemocnění, ale též se liší mezi jednotlivými nemocnými. Zatímco někteří nemocní při podobném postižení pociťují např. spontánní bolest, parestezie a elektrické rány, jiní pociťují v postižené oblasti pouze zvýšenou senzitivitu k teplu a dotyku [8].
K potvrzení NB jsou v současnosti používány standardizované vyšetřovací (screeningové) dotazníky, které se používají na podkladě pacientovy verbální výpovědi a popisu kvalit jeho bolesti [9]. K nejpoužívanějším patří the Leeds assessment of neuropathic symptoms and signs (LANSS), Neuropathic pain questionnaire (NPQ), Douleur neuropathique en 4 questions (DN4), painDETECT a ID-Pain. Většina otázek je zaměřena na typy a četnost bolesti, na doprovázející pocity bolesti (např. pálení), parestezie, mechanickou a termickou hypersenzitivitu a necitlivost. Hlavním přínosem těchto vyšetřovacích metod je identifikace potenciálních pacientů s NB, zejména lékaři nespecializovanými v této problematice. Základem je jejich jednoduché použití jak pro nemocné, tak pro lékaře, s výhodou okamžité informace (s možností použití telefonu či internetu). K většímu využití je nutné tyto dotazníky rozšířit, tedy i přeložit do co nejvíce jazyků. Klasifikace na podkladě senzorických změn získaných z dotazníků a kvantitativních senzorických testů může pomoci snížit patofyziologickou heterogenitu nemocných s chronickou bolestí a zlepšit výsledky léčby NB [6]. Ale ani tyto metody neodhalí všechny nemocné s NB, 10–20 % případů zůstává nezjištěno [8]. Nemocní s potvrzenou NB jsou dále vyšetřováni speciálními diagnostickými metodami, které vedou k určení nejvhodnější léčby. Ale je třeba říci, že i když screeningové metody mohou pomoci k dalšímu diagnostickému a následně léčebnému rozhodování, nikdy by neměly nahrazovat klinické rozhodnutí lékaře [5].
Léčba neuropatické bolesti
Ačkoliv poznání mechanismů, které vyvolávají NB, značně vzrostlo během posledních let, stále nedochází k odpovídajícímu zlepšení v léčbě této bolesti [10]. Zde je potřeba se zmínit i o specifické léčbě, či spíše prevenci určitých onemocnění, která mohou vyvolávat vznik NB. Je to např. úprava glykemie u diabetu, použití imunomodulace u RS, včasná a dostatečná léčba pásového oparu (antivirotika, analgetika, antidepresiva), vhodná (šetřící) operační technika u operačních výkonů a mnohé další [2].
Farmakoterapie
V současné době jsou do 1. linie léčby NB (mimo neuralgie trigeminu) zařazena dle NeuPSIG a dle Evropské neurologické společnosti (EFNS) tricyklická antidepresiva (TCA; 5–150 mg/den), gabapentin (1200–3600 mg/den) a pregabalin (150–600 mg/den), lidokainové náplasti (maximálně 3 náplasti/den) u PHN a selektivní blokátory zpětného vychytávání serotoninu a noradrenalinu (SSNRI; duloxetin 60–120 mg/den, venlafaxin 150–225 mg/ den) u diabetické polyneuropatie (DPN).
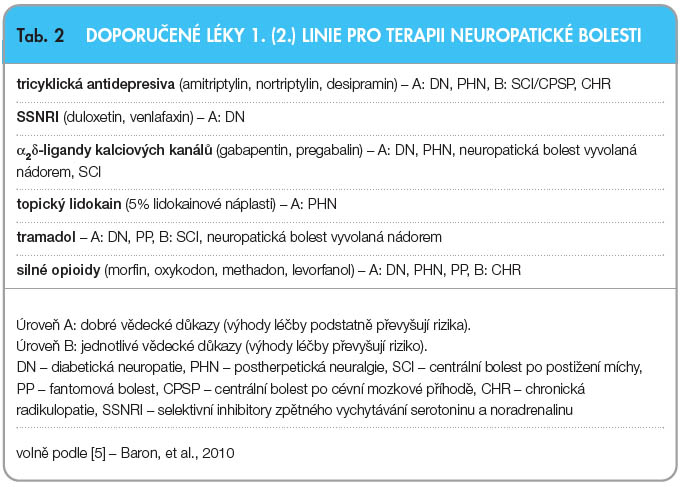 Do 2. linie léčby NB patří: tramadol (200–400 mg/den), kapsaicin krém u PHN a silné opioidy (2.–3. linie pro riziko psychické závislosti), dále sem lze zařadit 8% kapsaicinové náplasti (HIV neuropatie a PHN), kannabinoidy (RS a periferní NB v refrakterních bolestivých stavech) a kombinovanou terapii – gabapentin s opioidy nebo TCA, jestliže není dosaženo dostatečné úlevy při monoterapii. Opioidy jsou většinou zařazeny do 2. linie léčby, ale u nemocných s epizodami exacerbované bolesti se doporučuje jejich zařazení i do 1. linie léčby [11] (tab. 2, 3).
Do 2. linie léčby NB patří: tramadol (200–400 mg/den), kapsaicin krém u PHN a silné opioidy (2.–3. linie pro riziko psychické závislosti), dále sem lze zařadit 8% kapsaicinové náplasti (HIV neuropatie a PHN), kannabinoidy (RS a periferní NB v refrakterních bolestivých stavech) a kombinovanou terapii – gabapentin s opioidy nebo TCA, jestliže není dosaženo dostatečné úlevy při monoterapii. Opioidy jsou většinou zařazeny do 2. linie léčby, ale u nemocných s epizodami exacerbované bolesti se doporučuje jejich zařazení i do 1. linie léčby [11] (tab. 2, 3).
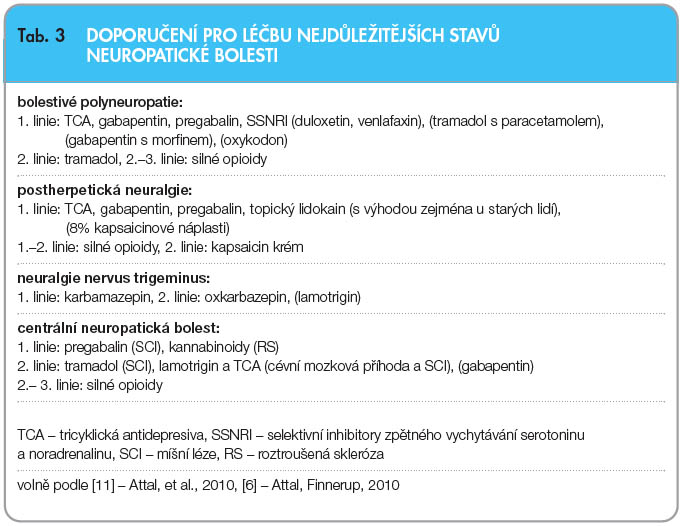 Léčba NB se odvíjí dle podílu jednotlivých složek na komplexním bolestivém stavu. Ke složitosti výběru správné lékové formy přispívá velká rozdílnost v mechanismech NB a velmi často se společně vyskytující psychologické, sociálně-ekonomické a emoční aspekty chronické NB. Základem pro určení nejvhodnější a nejefektivnější léčby je i zde pečlivá anamnéza a určení správné diagnózy. Před léčbou a i v jejím průběhu je velmi důležitá edukace (podání dostatečných informací) nemocného, příp. jeho rodiny, o NB, o reálných léčebných cílech a o možných vedlejších nežádoucích účincích léčby. To vše zvyšuje spolupráci a aktivní přístup nemocného k řešení jeho bolesti a dalších s tím souvisejících problémů [5]. Je nutné se zaměřit i na problémy se spaním, na rozsah funkčnosti a na kvalitu života, včetně ovlivnění sociálního a emočního stavu. I při léčbě chronické NB je nezbytný multidisciplinární přístup, a to jak při použití farmakologických, tak i nefarmakologických léčebných přístupů, jako jsou kognitivně-behaviorální přístupy, fyzikální a pracovní terapie a mnohé další, např. i alternativní postupy.
Léčba NB se odvíjí dle podílu jednotlivých složek na komplexním bolestivém stavu. Ke složitosti výběru správné lékové formy přispívá velká rozdílnost v mechanismech NB a velmi často se společně vyskytující psychologické, sociálně-ekonomické a emoční aspekty chronické NB. Základem pro určení nejvhodnější a nejefektivnější léčby je i zde pečlivá anamnéza a určení správné diagnózy. Před léčbou a i v jejím průběhu je velmi důležitá edukace (podání dostatečných informací) nemocného, příp. jeho rodiny, o NB, o reálných léčebných cílech a o možných vedlejších nežádoucích účincích léčby. To vše zvyšuje spolupráci a aktivní přístup nemocného k řešení jeho bolesti a dalších s tím souvisejících problémů [5]. Je nutné se zaměřit i na problémy se spaním, na rozsah funkčnosti a na kvalitu života, včetně ovlivnění sociálního a emočního stavu. I při léčbě chronické NB je nezbytný multidisciplinární přístup, a to jak při použití farmakologických, tak i nefarmakologických léčebných přístupů, jako jsou kognitivně-behaviorální přístupy, fyzikální a pracovní terapie a mnohé další, např. i alternativní postupy.
Základem léčby NB je stále farmakologický přístup. Jelikož není ještě zcela poznán mechanismus neuropatické bolesti, závisí všeobecně terapeutický přístup na postupných krocích, které nám ukáží, jaké léky či lékové kombinace zajišťují nejlepší léčebný efekt s minimálními vedlejšími účinky, což je zvláště důležité u starých lidí s komorbiditami a polypragmazií [3].
Antidepresiva a antikonvulziva vhodná pro 1. linii léčby NB byla dostatečně a stále platně popsána v článku, na který navazuji [4]. Proto jsem se zaměřil na další farmakologické léčebné možnosti NB, a to zejména na opioidy a topické léky. Jenom doplňuji Number Needed to Treat (NNT) léků vhodných pro 1. linii léčby NB, jež ve svém článku nezdůrazňuji: gabapentin má NNT 3,9–4,0, pregabalin 4,2, duloxetin 5,2, venlafaxin 4,6, TCA mají NNT 2,1–2,5 [12].
Opioidy
Opioidní analgetika jsou agonisté presynaptických a postsynaptických receptorů. Účinnost opioidů v léčbě periferní i centrální NB byla prokázána již v mnoha randomizovaných studiích [11, 13, 14].
Tramadol je slabý opioid, který je indikován ve 2. linii, případně ve 3. linii léčby NB. NNT pro tramadol se pohybuje v rozmezí 3,4–4,8 dle typu NB [12]. Tramadol a jeho aktivní metabolity se váží na centrální m-opioidní receptory a blokují přenos bolesti. Tramadol též blokuje zpětné vychytávání serotoninu a noradrenalinu. Účinnost tramadolu, zejména v kombinaci s paracetamolem, byla ověřena u DPN [6]. Tramadol byl pozitivně otestován u nemocných po míšní lézi [14]. Tramadol může vyvolávat závratě, suchost v ústech, nauzeu, zácpu, ospalost a může zhoršovat rozpoznávací funkce, zejména u starých lidí, u kterých je často nutné redukovat léčebnou dávku. Tramadol může způsobit serotoninový syndrom, zejména v kombinaci se serotoninergními látkami (zvláště selektivními inhibitory zpětného vychytávání serotoninu – SSRI), i když riziko vzniku tohoto syndromu se v praxi ukazuje jako velmi malé. Klinicky důležité je, že až 10 % kavkazské (bělošské) populace jsou tzv. pomalí metabolizátoři cytochromu P-450 2D6, u nichž má podání běžné dávky tramadolu nízkou analgetickou účinnost [12].
Používání silných opioidů pro léčbu chronické periferní NB se velmi zvýšilo v posledních letech [3, 6]. Mají analgetickou účinnost srovnatelnou s TCA, ale většinou se musí používat pro léčbu NB ve vyšší dávce než pro léčbu nociceptivní bolesti. Kvůli tomu a kvůli vedlejším účinkům (zejména nebezpečí psychické závislosti) jsou většinou opioidy zařazovány do 2. nebo až do 3. linie léčby nenádorové NB. Limitací v použití jsou typické vedlejší nežádoucí účinky, zejména zácpa, sedace, nauzea, závratě, zvracení, imunologické změny a hypogonadismus, hyperalgezie, fyzická a psychická závislost. Tak jako v léčbě nociceptivní nenádorové bolesti, má použití opioidů v léčbě nenádorové NB určitá pravidla, jejichž dodržování je nezbytné [15]. U bolestivé polyneuropatie jsou důkazy o snížení bolesti při použití oxykodonu. Oxykodon, morfin a methadon (v České republice není povolen pro léčbu bolesti) jsou účinné v léčbě PHN a mají podobný či mírně lepší účinek ve srovnání s TCA [11]. Podle mnoha studií se NNT opioidů pohybuje v rozmezí 2,5–2,7 v závislosti na typu NB a typu silného opioidu [12]. Některé silné opioidy, zvláště oxykodon, nacházejí své použití v léčbě průlomové bolesti u NB. U centrální i periferní NB byl úspěšně testován levorfanol [16], který však v České republice není k dispozici.
Kannabinoidy
Po objevení kannabinoidních receptorů i endogenních ligandů se stále intenzivně studuje použití kannabinoidů v léčbě chronické bolesti. Perorálně používané kannabinoidy (tetrahydrokannabiol, kannabidiol a nabolon) se ukázaly jako účinné jak u nociceptivních bolestí (revmatické artritidy a fibromyalgie), tak též u centrální a periferní NB [17]. Kannabinoidy jsou účinné v léčbě NB u RS a periferní NB spojené s allodynií [11, 18]. Inhalovaný výtažek z konopí (9,4% tetrahydrokannabiol) byl účinnější než placebo u HIV neuropatií a NB po postoperačních traumatech, a navíc vedl ke zlepšení spánku, nálady a kvality života [17]. Nejčastějšími vedlejšími účinky léčby kannabinoidy jsou závratě, sedace, únava, gastrointestinální potíže a suchost v ústech [18]. Kannabinoidy nejsou doporučovány u nemocných s duševními onemocněními pro nebezpečí zhoršení jejich psychického stavu. V České republice byl v dubnu tohoto roku zaregistrován ústní sprej obsahující kannabinoidy pro použití u nemocných s RS.
Topicky aplikované léky
Náplasti s 5% lidokainem jsou doporučovány v 1. linii léčby lokálních NB, zvláště PHN. Většinou se používají náplasti, výjimečně gelová forma. NNT 5% lidokainové náplasti je 4,4 [12]. Lidokain působí analgeticky nespecifickou blokádou sodíkových kanálů periferních aferentních vláken. Díky lokálnímu působení s minimální systémovou absorpcí má lidokain dobrý poměr přínos/riziko s minimálním výskytem vedlejších nežádoucích účinků (erytém, vyrážka), což je výhodné zejména u starších nemocných. Topicky aplikovaný lidokain je zvláště vhodný při použití u lokalizované NB, např. u PHN [19]. Dalšími léčebnými cíli jsou lokální neuropatie s allodynií, periferní nervová poranění a neuralgie trigeminu [10]. Mohou se aplikovat současně až 3 náplasti/24 hod. nalepené maximálně 12 hodin na postiženou kožní oblast. Poté by měl následovat 12hodinový interval bez použití náplasti. Před zahájením léčby není třeba titrace. Výhodou této moderní lékové formy je její velmi dobrá tolerance nemocnými [12]. V České republice jsou tyto náplasti registrovány již déle než jeden rok, lze je předepisovat, ale stále není schválena jejich úhrada.
Ač stále ještě není zařazen v 1. linii léčby chronické NB, jako velmi slibný lék v léčbě lokálních NB se ukazuje 8% kapsaicin v náplasťové lékové formě. Kapsaicin je agonista vaniloidního receptoru (TRPV1), aktivuje depolarizací tento receptor, což vede k jeho desenzitizaci a následné inhibici bolestivého podnětu [20]. Na rozdíl od doposud často používané aplikace kapsaicinu v nízké 0,05–0,075% koncentraci v krému nebo náplastech dochází u 8% koncentrace kapsaicinu k protrahovanému lokálnímu analgetickému efektu, který trvá tři i více měsíců. Výhodou jsou minimalizované systémové vedlejší účinky (pouze zvýšení krevního tlaku), lokální vedlejší účinky se mohou vyskytnout v místě nalepení (bolest, zarudnutí kůže, pálení, edém); 8% kapsaicinová náplast neovlivňuje jiné senzorické funkce. Náplast je aplikována na 30 minut (dolní končetiny) nebo 60 minut (tělo, horní končetiny). Je možné použít až 4 náplasti o velikosti jedné náplasti s plochou 280 cm2 po ošetření místa nalepení 4% lidokainovým gelem. Tyto 8% kapsaicinové náplasti jsou indikovány pro léčbu periferní NB, zvláště PHN, u dospělých nemocných bez onemocnění diabetem [10]. V současné době se velmi rozšiřuje jejich použití i v České republice, kde jsou registrovány a je schválena jejich úhrada.
Další léčiva používaná k léčbě NB
Novější možností v léčbě NB jsou podkožní injekční aplikace toxinu A botulinu (BTX-A). Při použití botulotoxinu v jeho základní indikaci (léčba svalové hyperaktivity) byl zjištěn analgetický efekt, který byl využit v léčbě periferní NB a DPN [6] Byl prokázán analgetický efekt u poškození periferního nervu a PHN, který přetrvával i více než 12 měsíců. Výhodou je vysoká bezpečnost této léčby, bez systémových vedlejších účinků. Připravuje se její náplasťová léková forma [21].
Jako nejnovější možnosti v léčbě NB se ukazují nitráty (isosorbid dinitrát nebo glycerol trinitrát ve spreji) u DPN a subkutánně aplikovaný sumatriptan u neuralgie trigeminu [10]. Zkoušeny jsou i antioxidanty na podkladě zjištění, že oxidativní stres má určitou roli v patogenezi NB. Při podávání kyseliny alfa-lipoové byl prokázán analgetický efekt u pacientů s DPN [22].
Jestliže monoterapie není úspěšná nebo je zatížena významnými vedlejšími účinky, je vhodné použít v léčbě chronické NB kombinovanou terapii s využitím dvou i více léků k dosažení dostatečného analgetického efektu. Zvláště vhodné jsou kombinace silných opioidů a antikonvulziv, např. morfinu s gabapentinem u nemocných s PHN a DPN a morfinu s pregabalinem u nemocných s PHN a radikulárními bolestmi u FBSS. Kombinace gabapentinu a oxykodonu byla u DPN účinnější než použití samotného gabapentinu. Dalšími vhodnými kombinacemi se ukázaly kombinace nortriptylinu a gabapentinu, pregabalinu a topického 5% lidokainu u DPN a PHN. Prokázalo se, že podávání těchto kombinací vede k vyššímu analgetickému efektu (aditivní nebo synergický efekt), a to při použití nižších dávek jednotlivých léků s nižšími nežádoucími vedlejšími účinky než při použití jednotlivých léků [5, 10].
Invazivní možnosti léčby bolesti
Invazivní přístupy se zvažují u nemocných, u kterých není dostatečná léčebná odpověď na standardní (neinvazivní) léčbu nebo je tato léčba zatížena nezvladatelnými vedlejšími účinky. Invazivní léčba je součástí komplexního léčebného plánu chronických NB. Rozborem studií z let 1968 až 2006 byly zhodnoceny některé invazivní metody v léčbě NB dle úrovně důkazů o jejich účinnosti [23]. Spinal cord stimulation (SCS) je účinný v léčbě failed back surgery syndromu (FBSS) a komplexního regionálního bolestivého syndromu (KRBS) typu 1 (úroveň doporučení B). Transkutánní elektrická neurostimulace (TENS) je analgeticky lepší než placebo (úroveň C), ale horší než elektroakupunktura (úroveň B). Repetitivní transkraniální magnetická stimulace (rTMS) má přechodnou analgetickou účinnost v léčbě centrální a periferní NB (úroveň B). TENS a rtMS reprezentují neinvazivní přístupy vhodné jako zkušební a doplňující terapie. Motorická stimulace mozkové kůry – motor cortex stimulation (MCS) – se ukázala analgeticky účinnou v léčbě centrální NB po iktu a v léčbě faciální bolesti (úroveň C). Ukázalo se, že mnohé tyto invazivní metody vedou k uspokojivým analgetickým výsledkům u nemocných s NB, kteří jsou rezistentní na lékovou či jinou léčbu. Je ale potřeba udělat mnoho dalších kvalitních studií, zejména pro použití SCS v dalších indikacích a všeobecně u MCS a DBS [23].
K dalším invazivním metodám používaným v léčbě NB patří nervové bloky, intraspinální blokády, např. epidurální, pro nemocné s PHN a radikulopatií, sympatické bloky, např. u nemocných s KRBS, a periradikulární terapie pro diagnostické upřesnění či léčbu radikulárních bolestí, např. u FBSS. Na vrcholu léčebného algoritmu se nacházejí neurochirurgické metody, které se používají v léčbě nenádorových NB jen výjimečně, protože jsou provázeny mnoha nežádoucími účinky (při výkonech na míše) a velmi často jen pouze přechodným analgetickým efektem (výkony na nervu). Jsou však i výjimky, jako např. výborné analgetické efekty mikrovaskulární dekomprese u dobře indikované neuralgie trigeminu (neurovaskulární konflikt), často jsou velmi dobré efekty u avulzí brachiálního plexu po použití neurochirurgických nebo radiofrekvenčních výkonů v oblasti dorsal root entry zone (DREZ). K neurochirurgickým metodám, které svým primárním léčebným účinkem sekundárně ovlivňují NB, patří neuromodulační metody – DBS a MCS. K analgetickým indikacím DBS (zadní hypotalamická stimulace) patří cluster headache a paroxysmální hemikranie, léčba však nemá vždy odpovídající efekt, problémem mohou být i její vedlejší účinky a komplikace. Podobných výsledků bylo dosaženo i při ovlivnění centrální NB po míšní lézi a po iktech. Určité analgetické efekty se ukazují u NB po poškození končetin a plexů, jako jsou například fantomová a pahýlová bolest. Ve studii Stadlera a kol. zaznamenalo až 64 % nemocných s různými typy centrální NB významnou úlevu od bolesti po použití MCS [24].
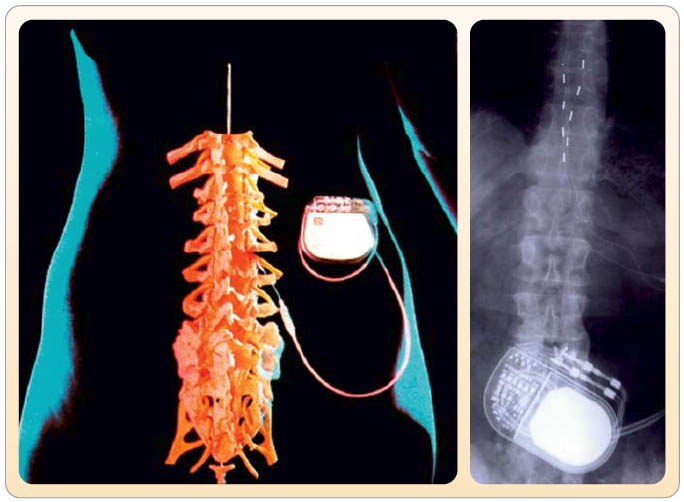 Některé minimálně invazivní terapie se ale spíše blíží rehabilitačním (fyzikálním) metodám, např. transkutánní elektrická neurostimulace (TENS) s velmi dobrým poměrem přínos/riziko u pacientů s NB s možností léčebného použití i v domácích podmínkách. Tato metoda se někdy využívá jako testovací metoda před použitím jedné z neuromodulačních metod – neurostimulace míchy (SCS) [23]. Za neuromodulaci se považuje nedestruktivní a reverzibilní analgetická léčba, která zahrnuje zejména použití implantovaných elektrických stimulačních systémů (obr. 1) a
Některé minimálně invazivní terapie se ale spíše blíží rehabilitačním (fyzikálním) metodám, např. transkutánní elektrická neurostimulace (TENS) s velmi dobrým poměrem přínos/riziko u pacientů s NB s možností léčebného použití i v domácích podmínkách. Tato metoda se někdy využívá jako testovací metoda před použitím jedné z neuromodulačních metod – neurostimulace míchy (SCS) [23]. Za neuromodulaci se považuje nedestruktivní a reverzibilní analgetická léčba, která zahrnuje zejména použití implantovaných elektrických stimulačních systémů (obr. 1) a 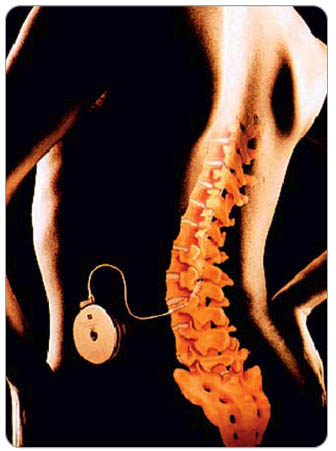 chemickou (lékovou) neuromodulaci (obr. 2), při níž se aplikují léky přímo do centrálního nervového systému [25]. Neurostimulace je v léčbě chronické NB vhodnější metodou než kontinuální intraspinální aplikace léků. Je zvláště účinná u nemocných s radikulární složkou bolesti u FBSS. Ale i druhá základní neuromodulační metoda – subarachnoidální (s.a.) aplikace léků, zejména opioidů – se ukazuje jako metoda volby v léčbě NB, zejména po zavedení nového léku v této indikaci – zikonotidu [23]; tento syntetický výtažek z mořského hlemýždě se již začal léčebně používat i v České republice.
chemickou (lékovou) neuromodulaci (obr. 2), při níž se aplikují léky přímo do centrálního nervového systému [25]. Neurostimulace je v léčbě chronické NB vhodnější metodou než kontinuální intraspinální aplikace léků. Je zvláště účinná u nemocných s radikulární složkou bolesti u FBSS. Ale i druhá základní neuromodulační metoda – subarachnoidální (s.a.) aplikace léků, zejména opioidů – se ukazuje jako metoda volby v léčbě NB, zejména po zavedení nového léku v této indikaci – zikonotidu [23]; tento syntetický výtažek z mořského hlemýždě se již začal léčebně používat i v České republice.
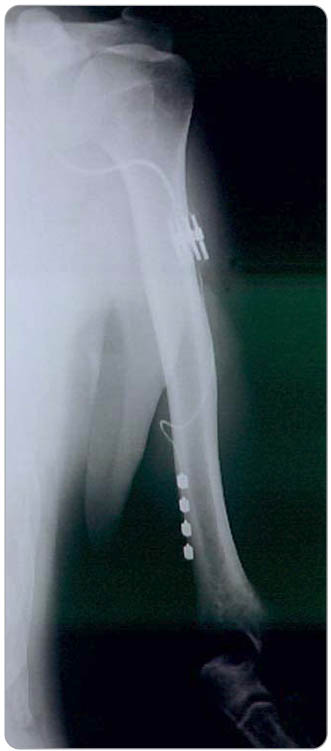 Významné místo v léčbě zejména lokální NB má méně používaný typ neurostimulační terapie – periferní nervová stimulace (PNS), viz obr. 3. PNS pomocí plně implantovaného elektronického zařízení byla opakovaně prokázána jako analgeticky efektivní v léčbě periferní NB [26–28]. Oproti SCS se PNS vzhledem k mnoha okolnostem (např. kvůli technickým a operačním složitostem a vyššímu výskytu komplikací i kvůli nevhodnému tvaru elektrod k implantaci k nervu) nestal všeobecně používanou neurostimulační metodou. Tato situace se v poslední době přece jen postupně mění. Burns a kol. použili PNS pro úspěšnou léčbu perzistující kraniální bolesti [27] a Slavin k úspěšné léčbě v mnoha typech NB [28]. Velmi dobré efekty PNS u pěti nemocných s periferní NB prokázal Kupers a kol. [26]. V Nemocnici na Homolce jsou s použitím PNS zaléčeni 2 nemocní s periferní NB (po poranění nervus medianus) s výborným analgetickým efektem trvajícím již šest a sedm let.
Významné místo v léčbě zejména lokální NB má méně používaný typ neurostimulační terapie – periferní nervová stimulace (PNS), viz obr. 3. PNS pomocí plně implantovaného elektronického zařízení byla opakovaně prokázána jako analgeticky efektivní v léčbě periferní NB [26–28]. Oproti SCS se PNS vzhledem k mnoha okolnostem (např. kvůli technickým a operačním složitostem a vyššímu výskytu komplikací i kvůli nevhodnému tvaru elektrod k implantaci k nervu) nestal všeobecně používanou neurostimulační metodou. Tato situace se v poslední době přece jen postupně mění. Burns a kol. použili PNS pro úspěšnou léčbu perzistující kraniální bolesti [27] a Slavin k úspěšné léčbě v mnoha typech NB [28]. Velmi dobré efekty PNS u pěti nemocných s periferní NB prokázal Kupers a kol. [26]. V Nemocnici na Homolce jsou s použitím PNS zaléčeni 2 nemocní s periferní NB (po poranění nervus medianus) s výborným analgetickým efektem trvajícím již šest a sedm let.
Závěr
Navzdory velkému zvýšení počtu kvalitně provedených studií v léčbě NB od roku 2005 nejsou stále dostatečné důkazy pro provedení významnějších změn v dosavadním léčebném algoritmu a pro možnosti zlepšení efektivnosti současné léčby neuropatických bolestí [10]. Přesné příčiny, proč pouze u některých nemocných vznikne po poranění nervové tkáně NB, jsou stále neznámé. Zdá se, že spíše rizikové faktory, jako jsou např. vyšší věk, pohlaví, intenzita bolesti před poraněním a po něm, emoční a kognitivní faktory a zvláště kombinace těchto faktorů, jsou důležitějšími pro vznik chronické NB než samotná nervová léze [9].Vliv mají pravděpodobně i genetické faktory. Pro zlepšení tohoto stále neuspokojivého stavu je nezbytné provádět další kvalitní randomizované klinické studie a zjišťovat skutečné příčiny vzniku a udržování chronické neuropatické bolesti. To by mělo vést k určení specifické léčby u jednotlivých nemocných s NB, a tím ke zlepšení léčebných výsledků u těchto stále velmi obtížně a nedostatečně ovlivnitelných a značně devastujících bolestí.
Seznam použité literatury
- [1] Neradilek F. Bolest jako syndrom. In: Rokyta R, Kršiak M, Kozák J, eds. Bolest: monografie algeziologie. Praha: Tigis 2006: 22–26.
- [2] Haanpää M, Treede RD. Diagnosis and classification of neuropathic pain. Pain, clinical updates September 2010, vol. XVIII, 7.
- [3] Dworkin EH, O’Connor AB, Backonja M. Pharmacologic management of neuropathic pain: an evidence-based recommendations. Pain 2007, 132: 237–251.
- [4] Ambler Z. Nové možnosti ovlivnění neuropatické bolesti. Remedia 2007,17: 576–580.
- [5] Baron R, Binder A, Wagner G. Neuropathic pain: diagnosis, pathophysiological mechanisms, and treatment. Lancet Neurol 2010; 9: 807–819.
- [6] Attal N, Finnerup NB. Pharmacological management of neuropathic pain. Pain, clinical updates November 2010, vol. XVIII, 9.
- [7] Haanpää ML, Backonja MM, Bennett MI, et al. Assessment of neuropathic pain in primary case. Am J Med 2009,122: 13–21.
- [8] Baron R. Mechanisms of disease: neuropathic pain – a clinical perspective. Nat Clin Pract Neurol 2006; 2: 95–106.
- [9] Haanpää M, Attal N, Backonja M, et al. NeuPSIG guidelines on neuropathic pain assessment. Pain 2011; 152: 14–27.
- [10] Finnerup NB, Sindrup SH, Jensen TS. The evidence for pharmacological treatment of neuropathic pain. Pain 2010; 150: 573–581.
- [11] Attal N, Cruccu G, Baron R, et al. EFNS guidelines on pharmacological treatment of neuropathic pain: 2010 revision. Eur J Neurol 2010; 17: 1113–1188.
- [12] Hovaguimian A, Gibbons CH. Diagnosis and treatment of pain in small-fiber neuropathy. Curr Pain Headache Rep. Published online: 01 February 2011, DOI 10.1007/s11916-011-0181-7.
- [13] O’Connor AB, Dworkin RH. Treatment of neuropathic pain: an overview of recent guidelines. Am J Med 2009; 122: 22–32.
- [14] Norrbrink C, Lundeberg T. Tramadol in neuropathic pain after spinal cord injury: randomized, double-blind, placebo controlled trial. Clin J Pain 2009, 25: 177–184.
- [15] Kolektiv autorů. Metodické pokyny pro farmakoterapii bolesti. Přepracované vydání. Bolest 2009; 12 (Suppl 2).
- [16] Rowbotham MC, Twilling L, Davies PS. Oral opioid therapy for chronic peripheral and central neuropathic pain. N Engl J Med 2003; 348: 1223–1232.
- [17] Ware MA, Wang T, Shapiro S. Smoked cannabis for chronic neuropathic pain: a randomized controllled trial. CMAJ 2010; 14: 694–701.
- [18] Rog DJ, Nurmikko TJ, Friede T, Young CA. Randomized, controllled trial of cannabis – based medicine in central pain in multiple sclerosis. Neurology 2005; 68: 812–819.
- [19] Baron R, Mayoral V, Leijon G, et al. Efficacy and safety of combination therapy with 5% lidocain medicated plaster and pregabalin in post-herpetic neuralgia and diabetic polyneuropathy. Curr Med Res Opin 2009; 25: 1677–1687.
- [20] Vlachová V, Vyklický L. Buněčné a molekulární mechanizmy nocicepce. In: Rokyta R, Kršiak M, Kozák J, eds. Bolest: monografie algeziologie. Praha: Tigis 2006: 42–57.
- [21] Ranoux D, Attal N, Morain F, et al. Botulinum toxin type A induces direct analgesic effects in chronic neuropathic pain. Ann Neurol 2008; 64: 274–283.
- [22] Zillioux L, Russell JW. Treatment of diabetic sensory polyneuropathy. Curr Treat Opt Neurol 2011; 13: 143–159.
- [23] Cruccu G, Aziz TZ, Garcia-Larrea L et al. EFNS guidelines on neurostimulation therapy for neuropathic pain. Eur J Neurol 2007; 14: 952–970.
- [24] Stadler JA, Ellens DJ, Rosenow JM. Deep brain stimulation and motor cortical stimulation for neuropathic pain. Curr Pain Headache Rep 2011; 15: 8–13.
- [25] Kozák J, Vrba I, Masopust V, et al. Neuromodulace v léčbě chronické bolesti. In: Rokyta R, Kršiak M, Kozák J, eds. Bolest: monografie algeziologie. Praha: Tigis 2006: 551–578.
- [26] Kupers R, Laere KV, Calenbergh FV, et al. Multimodal therapeutic assessment of peripheral nerve stimulation in neuropathic pain: five case reports with a 20-year folow-up. Eur J Pain 2011, 15: 161–169.
- [27] Burns B, Watkins L, Goadsby PJ. Treatment of intractable chronic cluster headache by occipital nerve stimulation in 14 patients. Neurology 2009; 72: 341–345.
- [28] Slavin KV. Peripheral nerve stimulation for neuropathic pain. Neurotherapeutics 2008; 5: 100–106.