Novinky v léčbě infekce HIV/AIDS
Souhrn:
Moderní antiretrovirová léčba a preventivní opatření se dnes považují za hlavní metody kontroly pandemie AIDS (acquired immune deficiency syndrome, syndrom získané imunodeficience). Od přípravků prvních generací se liší podstatně příznivějšími farmakokinetickými/farmakodynamickými vlastnostmi, vyšší rezistenční bariérou a obecně lepší tolerancí. Celodenní kombinovanou léčbu dnes v optimálním případě představuje jedna tableta podávaná jednou denně. Antiretrovirová léčba je pojištěncům v České republice hrazena v plném rozsahu. Za poslední dva roky zaregistrovala Evropská léková agentura pět antiretrovirotik, další nejméně čtyři jsou v pořadí. Racionální antiretrovirová léčba se neustále vyvíjí a zlepšuje v důsledku probíhajících klinických studií. Celosvětově existuje několik doporučených postupů léčby infekce HIV (human immunodeficiency virus, virus lidského imunodeficitu)/AIDS. Jejich inovace v České republice probíhá každé 2–3 roky, přičemž se přihlíží ke specifikům naší populace a zdravotnického systému. Základem jsou nukleos(t)idové inhibitory HIV reverzní transkriptázy spolu s inhibitory HIV integrázy nebo s potencovanými inhibitory HIV proteázy, alternativně pak nenukleosidové inhibitory HIV reverzní transkriptázy, inhibitory fúze a vstupu do CD4+ buňky. Infekce HIV u vysoce adherentních osob se díky kombinované antiretrovirové léčbě stala chronickým léčitelným, ale zatím nevyléčitelným onemocněním. Zásadně se změnila kvalita života, došlo ke snížení morbidity na oportunní infekce i k poklesu mortality. Predikovaná délka života vysoce adherentních HIV‑pozitivních osob se v současné době téměř neliší od běžné populace.
Key words: AIDS – acquired immune deficiency syndrome – HIV+ – HIV‑positive – HIV‑1 – human immunodeficiency virus type 1 – ART – combination antiretroviral
therapy – HIV reverse transcriptase inhibitors – HIV integrase inhibitors – HIV protease inhibitors – prevention.
Summary:
Current antiretroviral therapy and preventive measures are still the essential option to control the AIDS (acquired immune deficiency syndrome) pandemic. Compared with the first available drugs, current drugs have considerably more favourable pharmacokinetic/pharmacodynamic effects, a higher resistance barrier, and generally better tolerance. All‑day combination therapy today consists of only one tablet a day in optimal cases. Antiretroviral therapy is fully covered by insurance companies in the Czech Republic. During the last 2 years, there were 5 medications registered in the European Medicines Agency and at least 4 more are expected. Rational antiretroviral treatment (ART) is constantly evolving and improving as a result of continuing clinical trials. Worldwide, there are several guidelines for treatment of HIV (human immunodeficiency virus) infection/AIDS. Their innovation in the Czech Republic takes place every 2–3 years, taking into account the specificities of our population and health system. They are mainly based on nucleos(t)ide HIV reverse transcriptase inhibitors, along with HIV integrase inhibitors or boosted HIV protease inhibitors. Alternatively, non‑nucleoside HIV‑reverse transcriptase inhibitors, fusion inhibitors, and inhibitors of the entry into CD4+ cells are used. HIV infection in highly adherent people, thanks to combination antiretroviral therapy, has become a chronic, treatable but not yet curable disease. Fundamental improvement in the quality of life has been associated with reduction in morbidity caused by opportunistic infections, as well as mortality. The predicted life span of highly adherent HIV+ people at present barely differs from that of general population.
Úvod
Před 35 lety bylo poprvé popsáno onemocnění později označené jako syndrom získané imunodeficience (acquired immune deficiency syndrome, AIDS). Od té doby došlo k mnoha velkým objevům na poli virologie, imunologie, farmakologie atd., ale také k četným změnám v přístupu k nemocným. Objev původce (HIV, human immunodeficiency virus, virus lidského imunodeficitu) v roce 1983, zavedení diagnostických testů v roce 1985, první použití antiretrovirového léku (zidovudin) v roce 1987 a zahájení kombinované antiretrovirové léčby v roce 1996 (původně označované jako HAART, highly active antiretroviral therapy, později cART, dnes zjednodušeně ART) představují milníky, které zásadně ovlivnily průběh pandemie AIDS [1,2]. Ve světě existují dva typy HIV. Typ HIV 1 se vyskytuje celosvětově, je prokazován až u 95 % nakažených, zbylých 5 % nákaz vyvolává typ HIV 2, vyskytující se endemicky v zemích západní Afriky. V tomto článku se budeme zabývat výlučně HIV 1 (dále HIV).
Cílem úspěšné léčby je dosažení maximální suprese replikace HIV (v praxi to znamená dosažení nedetekovatelných koncentrací HIV RNA v krvi) v co nejkratší době po zahájení ART. Rychlý pokles virémie vede k mobilizaci rezerv v podobě vzestupu počtu CD4+ T lymfocytů produkujících různé cytokiny [3]. Následující zlepšení imunologických parametrů u pacientů správně dodržujících léčebný režim (vysoce adherentní nemocní) vede ke snížení morbidity (v důsledku oportunních infekcí, nádorů a imunologických dysregulací) a mortality [4,5]. Významně také klesá riziko šíření nákazy v populaci, neboť správně léčení nemocní s velmi nízkou virémií představují minimální riziko nákazy pro své okolí [1,6]. Snižuje se též potřeba hospitalizací, zlepšuje se kvalita života nemocných a tím i jejich schopnost pracovat a zajistit si přiměřené životní podmínky. Postupně se tak, díky komplexnímu přístupu, infekce HIV/AIDS stala chronickým léčitelným, avšak dosud nevyléčitelným onemocněním. Včasně indikovaná a dobře snášená ART se u vysoce adherentních nemocných významně odráží také v délce jejich života, která je dnes srovnatelná s délkou života běžné HIV negativní populace [7].
Přes veškeré úsilí se dosud HIV deponovaný v rezervoárových CD4+ T lymfocytech v podobě provirové DNA nedaří z napadených buněk odstranit. Avšak časně zahájená kontinuální léčba, byť pro nemocné představuje určitá omezení, přináší vynikající výsledky nejen pro pacienty samotné, ale i pro jejich okolí [5,8–10].
Stává se však i nadále, že někteří pacienti přicházejí k prvnímu vyšetření velmi pozdě – až ve stadiu hlubokého imunodeficitu (tzv. late presenters). V některých evropských zemích je takových nemocných více než 20 %, v České republice příslušná data nebyla dosud publikována. Léčba pacientů v pokročilé fázi onemocnění, často s manifestací několika současně probíhajících oportunních infekcí či s nádorem, bývá mnohem obtížnější, více nemocného zatěžuje a často vyžaduje dlouhé a finančně velmi náročné hospitalizace.
Epidemiologie
Přes veškeré snahy a současné možnosti léčby není epidemiologická situace celosvětově uspokojivá. V mnoha zemích Afriky, Asie, ale např. i ve východní Evropě je situace mnohdy kritická a odvíjí se od finančních možností dané země a od politické vůle chtít situaci řešit. Lze sice konstatovat, že se situace v některých zemích oproti předchozí dekádě zlepšila, ale zdaleka nemůžeme být spokojeni. Odhaduje se, že ve světě žije přibližně 37 milionů osob infikovaných HIV, ale např. v Africe je ART dostupná jen přibližně jedné třetině z celkového počtu infikovaných [11]. Ročně se nakazí další 2 miliony osob a přibližně 1,5 milionu osob v důsledku rozvinutého onemocnění (AIDS) umírá. Podle údajů Světové zdravotnické organizace (World Health Organization, WHO) zemřelo od počátku pandemie v důsledku AIDS více než 40 milionů nemocných.
Česká republika patří k zemím s relativně nízkým výskytem infekce HIV. Ke konci července 2016 registrovala Národní referenční laboratoř pro AIDS v Praze (NRL) celkem 3 219 HIV pozitivních (HIV+) osob (2 807 občanů ČR, včetně rezidentů, a 412 cizinců). Celkem 534 osob pokročilo do stadia AIDS (492 občanů ČR, včetně rezidentů, a 42 cizinců) a 247 osobs diagnózou AIDS již zemřelo. V ČR převládá přenos sexuální cestou (89,5 %), většinu infikovaných tvoří muži mající sex s muži či bisexuálové (64,7 %) [12].
Světová zdravotnická organizace vyhlásila v roce 2013 program 90–90–90 usilující o zlepšení kontroly nad onemocněním HIV/AIDS. Jeho cílem je, aby ke konci roku 2020 znalo 90 % infikovaných svůj HIV status, z nich 90 % bylo adekvátně léčeno a aby 90 % léčených mělo nedetekovatelná množství HIV RNA v krvi [13].
Patogeneze
Vyléčení infekce HIV (eradikace provirové DNA z buněk rezervoárových orgánů) je dosud nemožné. Záhy po nákaze hostitele dochází k rychlé replikaci HIV v cílových buňkách, které na svém povrchu vystavují receptor CD4 a CCR5 nebo CXCR4 (např. makrofágy, dendritické buňky nebo různé typy CD4+ T lymfocytů). Nově vytvořené viriony se poté uvolňují do periferní krve a napadají další CD4+ buňky, dokonce i ty, které jsou přítomny za určitými bariérami [14]. V těchto tzv. rezervoárových orgánech (CNS, lymfatická tkáň, prostata, gonády aj.) mohou latentně infikované CD4+ T lymfocyty, mající dlouhý poločas života, dlouhodobě přežívat a uchovávat tak genom HIV v hostiteli [15,16]. Díky účinné ART jsou plazmatické koncentrace HIV RNA zpravidla nedetekovatelné. V rezervoárech však trvale probíhá mírná replikace, a pokud se ART přeruší, nově vzniklé HIV se mohou uvolňovat zpět do krevního oběhu [17,18]. Dosud panuje kolem patofyziologie a funkce rezervoárů při různých léčebných intervencích mnoho nejasností, což brání přípravě úspěšných léčebných strategií umožňujících skutečné vyléčení, nebo alespoň trvalou supresi replikace HIV [15].
V současné době je proto naším cílem alespoň maximální dlouhodobá suprese virémie (dosažení nedetekovatelné koncentrace HIV RNA v periferní krvi) navozená správně indikovanou a pacientem užívanou ART. Za tohoto předpokladu dochází postupně k restauraci počtu CD4+ T lymfocytů. Zvyšují se počty naivních T lymfocytů CD45RA+, odstraňují se některé paměťové T lymfocyty CD45R0+, jež obsahují provirovou DNA kódující HIV, a tím se postupně obnovuje úroveň imunokompetence. Schopnost restituce imunity je silně ovlivněna nejnižší dosaženou hodnotou absolutního počtu CD4+ T lymfocytů (tzv. nadir) [19]. Zvýšení imunokompetence je většinou spojeno se snížením nemocnosti a úmrtnosti na oportunní infekce a vede ke zlepšení kvality života. Všeobecně očekávaným cílem do budoucna je vyléčení, tedy eradikace HIV ze všech rezervoárů hostitelského organismu.
Léčba
Je možno aktivovat latentní HIV v infikovaných CD4+ buňkách v rezervoárech?
Teprve v posledních letech se daří latentní HIV v buňkách rezervoárů stimulovat pomocí různých látek, jako jsou např. antiepileptika, IL 2 a inhibitory histon deacetylázy (např. panobinostat) [20]. Jedna strategie umožňující atakovat HIV zakódovaný v genomu hostitelských T lymfocytů, označovaná jako „kick and kill“, byla představena na kongresu o AIDS v australském Melbourne v roce 2014. Využívá chemoterapeutikum romidepsin schopné aktivovat hibernující HIV, což umožní jejich zničení [21]. Replikující se HIV jsou pak snadno zranitelné působením standardní ART. Tyto postupy se jeví jako vykročení správným směrem, ale představují teprve začátek dlouhé cesty s mnoha překážkami, jež bude nutno překonat. Na konci může být definitivní vyléčení infekce HIV.
Kdy se zahajuje léčba a jak hodnotíme její úspěšnost?
Současné postupy pro léčbu infekce HIV/AIDS doporučují její zahájení v co nejkratší době po zjištění HIV pozitivity bez ohledu na počty CD4+ T lymfocytů v periferní krvi [22–26]. Za úspěšnou považujeme ART tehdy, pokud za šest měsíců po jejím zahájení je počet HIV RNA < 20 kopií/ml.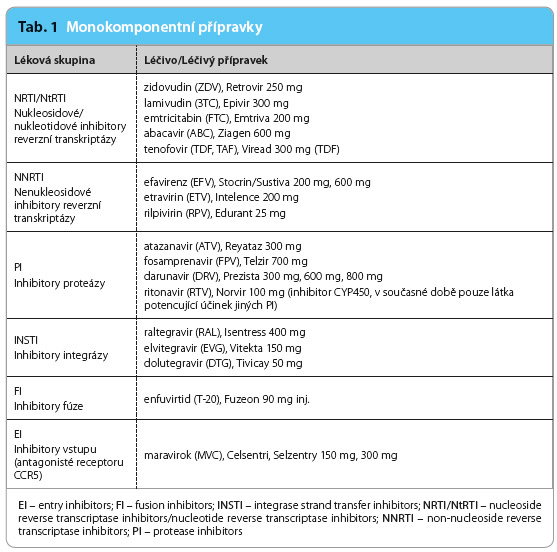
Antiretrovirotika používaná v současné době
Moderní, šetrnější léčebné režimy znamenají významný obrat v kvalitě života HIV+ osob [27]. Nové generace ART mají významně snížené krátkodobé nežádoucí účinky [28,29]. Léky jsou zpravidla dobře snášeny a mají vylepšené farmakokinetické vlastnosti. Přesto jsou nutné pravidelné klinické a laboratorní kontroly, které jsou schopny u pacientů včas odhalit nežádoucí účinky, nebo dokonce toxické projevy. Úprava léčby bývá v takových případech nutná. Zahájení ART je sice spojeno s novými povinnostmi a znamená určitá omezení až do konce života, ale úspěšná léčba vynahradí počáteční nesnáze. Přípravky jsou dodávány jako monokomponentní tablety (tab. 1) nebo jako fixní kombinace několika léčiv (tab. 2).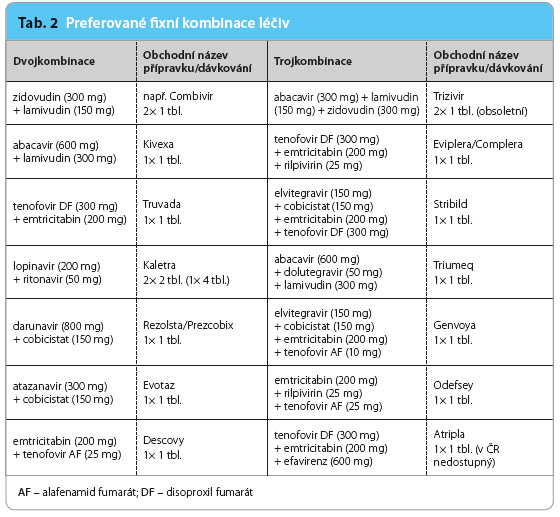
Simplifikace režimů
Zjednodušení léčby napomáhá vyšší adherenci nemocných léčených ART a tím dosažení dlouhodobě příznivých výsledků léčby (maximální suprese replikace HIV je rovněž prevencí vývoje rezistence). Vychází především z jednoduchého dávkování (optimálně jedna denní dávka), z malého počtu tablet (ideálně fixní kombinace nejméně dvou, lépe všech tří až čtyř komponent v jedné tabletě), z dobré snášenlivosti nových přípravků a z vysoké účinnosti léků i na rezistentní mutanty HIV. Zde se uplatňuje zejména vysoký inhibiční kvocient (inhibitory quotient [IQ] = cmin/IC50, tj. poměr nejnižší koncentrace léčiva těsně před podáním další dávky ku koncentraci léčiva, která stačí k tomu, aby znemožnila množení 50 % kmenů HIV) a vysoký biologický práh, kdy pro vznik rezistence je potřeba více mutací v genu pro příslušný enzym (např. u lopinaviru je to nejméně 7 mutací v genu pro HIV proteázu). Samozřejmostí u moderních přípravků je minimalizace nežádoucích účinků jak klinických (porucha renálních funkcí, kostního metabolismu, kardiovaskulární riziko atd.), tak laboratorních (změny hodnot hemoglobinu, jaterních aminotransferáz, laktátu, glukózy, lipidového spektra a řady dalších). Výhledově budou nová antiretrovirotika zasahovat i nové cíle replikačního cyklu a budou mít takové farmakokinetické vlastnosti, které umožní prodloužit dávkování na interval např. 1× za 1–3 měsíce.
Léčiva upřednostňovaná při moderní ART
Inhibitory integrázy
Látky blokující HIV integrázu (integrase strand transfer inhibitors, INSTI) se vyznačují rychlým nástupem účinku, velmi malým množstvím nežádoucích účinků a dobrou tolerancí nemocnými. Jsou tudíž velmi oblíbené a v kombinaci s nukleos(t)idy jsou v současné době považovány za léky první volby [25] (tab. 1, 2).
Elvitegravir (EVG) byl schválen Evropskou lékovou agenturou (European Medicines Agency, EMA) v květnu 2013 pro kombinovanou léčbu HIV+ osob. Distribuuje se v podobě fixní kombinace EVG 150 mg + cobicistat (cobi) 150 mg (inhibitor CYP3A4 a 3A5, který nemá antiretrovirový účinek, ale zlepšuje farmakokinetiku INSTI a PI) + emtricitabin (FTC) 200 mg + tenofovir disoproxil fumarát (TDF) 300 mg. Podává se jedna tableta jednou denně s jídlem. Je indikován u osob doposud neléčených nebo již dříve léčených, bez prokázané rezistence HIV na jednotlivé komponenty přípravku. Za nejdůležitější mutace v genu pro HIV integrázu spojené s rezistencí na EVG jsou považovány: Q148K/R/H, N155H, E92Q a E138K.
Vlivem cobicistatu dochází k inhibici tubulárních transportérů pro kreatinin, a tím k mírnému zvýšení jeho sérových koncentrací, aniž by to znamenalo počínající renální insuficienci. Z tohoto důvodu se požaduje iniciální clearance kreatininu ≥ 70 ml/min a v počátečních fázích léčby častější sledování renálních funkcí.
Dolutegravir (DTG) byl schválen EMA v lednu 2014 ke kombinované léčbě HIV+ osob starších než 12 let (> 40 kg tělesné hmotnosti) doposud neléčených, ale i dříve léčených. Ve čtyřech předregistračních studiích byla u tohoto přípravku prokázána vysoká bezpečnost, účinnost, příznivá farmakokinetika a vysoký genetický práh (hůře vzniká rezistence) [30]. Za mutaci spojenou s rezistencí vůči DTG je považována Q148K/R/H, pokud se vyskytne současně s dalšími dvěma či více obecnými INSTI mutacemi. Dolutegravir se podává např. v kombinaci s TDF + FTC v dávce 50 mg jednou denně (při zjištěné rezistenci na integrázový inhibitor I. generace 2× 50 mg) s jídlem. K dispozici je také kombinovaný přípravek obsahující abacavir (ABC) 600 mg + lamivudin (3TC) 300 mg + DTG 50 mg, který lze podávat jen u HLA B*5701 negativních osob. Osoby s alelou HLA B*5701 mají zvýšené riziko hypersenzitivní reakce na ABC. Z nežádoucích účinků se uvádí nespavost, cefalea, vzácně alergické reakce a u osob s virovou hepatitidou typu B a/nebo C abnormální aktivita jaterních aminotransferáz (je vyžadováno častější laboratorní monitorování).
Inhibitory reverzní transkriptázy
Tenofovir alafenamid fumarát (TAF) je nový nukleotidový inhibitor reverzní transkriptázy. Je prekursorem a v účinnou substanci, nestabilní tenofovir, se mění až působením enzymů v cílových CD4+ buňkách. Vykazuje vyšší antivirovou aktivitu a lepší distribuci v lymfoidních tkáních než TDF. Studie fáze III srovnávající TDF (245 mg) a TAF (10 mg) ve 48. týdnu prokázala non inferioritu TAF v dávce 10 mg a také nižší incidenci nežádoucích účinků (poruchy renálních funkcí). Je obsažen v kombinovaném přípravku, který je od 1. září 2016 dostupný i v ČR (ELV + cobi + FTC + TAF). Podává se 1× denně s jídlem osobám HIV+, u nichž nebyly prokázány rezistentní mutace (shodné jako u TDF), bez ohledu na případnou předchozí ART. V příštím roce se na trhu objeví kombinace TAF + FTC a TAF + FTC + RPV (rilpivirin).
Rilpivirin (RPV) je nenukleosidový inhibitor reverzní transkriptázy druhé generace. Od 1. června 2014 je v ČR dostupný pro dosud neléčené HIV+ osoby s HIV RNA < 105 kopií/ml, u nichž nebyly prokázány rezistentní mutace. Rilpivirin, tak jako ostatní nenukleosidové inhibitory reverzní transkriptázy (NNRTI), je účinný pouze na HIV 1, avšak působí i na mnoho kmenů HIV 1, které jsou rezistentní na NNRTI první generace. Přesto je známo celkem 17 mutací spojených s rezistencí (Y181I, Y181V, L100I, K101P, Y181C, M230L, V106I, E138A, V179F, G190S, V90I, A98G, K101E, K101H, V179D, V179T, G190A). Podává se v dávce 25 mg jednou denně s jídlem. Kombinuje se např. s ABC + 3TC. Od 1. října 2014 je k dispozici také kombinovaný přípravek RPV 25 mg spolu s TDF 245 mg a FTC 200 mg v jedné tabletě, který se podává HIV+ osobám s HIV RNA < 105 kopií/ml, bez ohledu na předchozí ART, pokud nemají prokázány rezistentní mutace.
Inhibitory proteázy
Darunavir potencovaný cobicistatem (DRV/cobi) je kombinovaný přípravek schválený EMA v listopadu 2014, který je od dubna 2016 k dispozici i v ČR. V jedné tabletě obsahuje 800 mg DRV a 150 mg cobi. Vyznačuje se vyšším prahem pro vznik rezistence. K mutacím v genu pro HIV proteázu zodpovídajícím za vznik rezistence patří: V11I, V32I, L33F, I47V, I50V, I54L nebo M, T74P, L76V, I84V a L89V. Podmínkou vzniku rezistence je přítomnost nejméně tří mutací. Zlepšené farmakokinetické vlastnosti kombinace DRV/cobi umožňují u dospělých osob s hodnotami clearance kreatininu ≥ 70 ml/min dávkování jedna tableta jednou denně s jídlem. Kombinace se dvěma nukleos(t)idovými inhibitory je dobře snášena. Přípravek dobře proniká do CNS, je dobře tolerován, lze jej používat i u gravidních žen. Z nežádoucích účinků se uvádí průjem, nauzea, bolesti hlavy, bolesti břicha a exantém. U některých osob se může v průběhu léčby objevit porucha lipidového spektra, glukózové tolerance nebo hepatopatie. Molekula DRV obsahuje sulfonovou skupinu, proto při alergii na sulfonamidy je namístě opatrnost. V průběhu léčby jsou nutné pravidelné kontroly renálních funkcí, jaterních testů, krevních lipidů a glykemie. Byly popsány interakce přípravku s některými léčivy metabolizovanými stejným enzymem (CYP3A), proto je podávání řady léků kontraindikováno. U slabších inhibitorů nebo substrátů CYP3A jsou nutné pravidelné klinické a laboratorní kontroly.
Plány do budoucna
Intenzivní vývoj antiretrovirotik pokračuje a lze očekávat, že se do léčebného repertoáru zařadí další přípravky. V nejbližší době přibydou kombinace TAF + FTC + DRV + cobi a DTG + RPV. Usilovně se pracuje na prodlužování dávkovacích intervalů. Naděje vzbuzuje zejména kombinace nanopartikulární cabotegravir + RPV, která umožňuje dávkování jednou za 1–3 měsíce.
Přestože usilovný výzkum vakcíny proti HIV stále pokračuje, dosud se nepodařilo vyvinout účinnou preventivní ani terapeutickou vakcínu schopnou postihnout více subtypů HIV. Dosavadní vakcíny zatím selhávají, neboť je velmi obtížné najít konstantní vysoce imunogenní epitopy společné pro více subtypů HIV. Je to dáno genetickou nestabilitou retrovirů, neboť při přepisu HIV RNA vznikají chyby, které mají za následek vznik antigenně odlišných tzv. quazispecies. Rovněž v důsledku primárně poškozené funkce regulačních CD4+ T lymfocytů je velmi omezená produkce specifických regulačních cytokinů jak pro T lymfocyty, tak pro B lymfocyty. Určitým ekvivalentem vakcín mohou být tzv. terapeutické interferující partikule (TIPs), které fungují na principu poliovakcíny. Jsou infekční, ale nepatogenní, neboť obsahují jen jednu třetinu genetické informace HIV. V hostitelských CD4+ buňkách mohou TIPs interferovat s replikací HIV a tím oslabovat jeho virulenci; TIPs se mohou spontánně šířit od očkovaného na další osoby a tím přispívat ke zvyšování kolektivní imunity [31].
Vývoj léčby
V posledních 20 letech byla koncepce antiretrovirové léčby mnohokrát přepracovávána. Ještě před dvěma lety se u asymptomatických pacientů bez komorbidit a koinfekcí ART zahajovala při poklesu počtu CD4+ T lymfocytů pod 350/mm3. Dříve provedené studie prokázaly, že zahájení při počtu 350 CD4+ T lymfocytů/mm3 má lepší výsledky, než když se čeká na pokles počtu pod 200 CD4+ T lymfocytů/mm3 nebo na propuknutí oportunních infekcí. Teprve autoři studie HPTN 052 (Léčba jako prevence) doporučují léčit všechny HIV+ osoby. Tato studie, poprvé publikovaná v roce 2011, znamenala zásadní změnu v indikaci ART. Prokázala, že pokud bude HIV+ jedinec žijící s osobou
HIV negativní (tzv. HIV diskordantní pár) účinně léčen pomocí ART, je minimální předpoklad, že svého HIV negativního partnera nakazí (riziko nákazy se snížilo o 96 %) [6,32].
Studie START (Strategic Timing of ART), jejíž výsledky vycházejí z velkého souboru 4 600 pacientů a byly zveřejněny v květnu 2015, mohla přinést odpověď na základní otázku – za jakých podmínek a kdy se má ART zahajovat. Již během prvního roku mělo téměř 98 % pacientů léčených ART nedetekovatelné koncentrace HIV RNA v krvi. Závěr studie vyzněl jednoznačně pro zahajování léčby co nejdříve po nákaze HIV, bez ohledu na stav imunity. Zahájení ART ve fázi akutní infekce tak otevírá nové možnosti pro rychlé a dlouhodobé dosažení bezpříznakové fáze. Včas zahájená léčba je rovněž prevencí přenosu HIV. Současné léky, které jsou vysoce účinné a zároveň bezpečné, umožňují zahájit léčbu již v den stanovení diagnózy po vyšetření iniciálních hodnot CD4+ T lymfocytů a HIV RNA v krvi [22,23,33].
Postexpoziční profylaxe
Antiretrovirová terapie se dá využít nejen jako vlastní léčba, ale také profylakticky. Pokud dojde např. u zdravotnického pracovníka k poranění lékařským nástrojem kontaminovaným HIV+ krví, případně pokud se HIV+ krev dostane do rány nebo na oční spojivku, indikuje se na dobu 30 dnů postexpoziční profylaxe (PEP). Podobně lze postupovat např. při znásilnění, kdy násilník není zjištěn; PEP je nutno zahájit nejdéle do 72 hodin a používají se při ní stejná schémata jako při vlastní léčbě. Podobně v rámci profylaxe vertikálního přenosu, i v případě, že budoucí matka je léčena ART již v průběhu gravidity, novorozenec dostává ART ve formě sirupu s cílem minimalizovat riziko jeho nákazy. V posledních letech se v zahraničí upouští od vedení porodu císařským řezem v případě, že je gravidní žena účinně léčena ART a její virové nálože nepřevyšují 50 kopií HIV RNA/ml krve.
Preexpoziční profylaxe – jedna z možností prevence?
Použití některých antiretrovirotik a jejich kombinací se logicky nabízí i jako možná prevence šíření infekce HIV v komunitě. Problém však spočívá v praktické realizaci této myšlenky. Při masovém zavedení s sebou dlouhodobá preexpoziční profylaxe (PrEP) přinese mnoho nežádoucích účinků, zejména riziko selekce rezistentních kmenů HIV, možná i toxických projevů způsobených ART u predisponovaných osob. Komu bude PrEP poskytnuta a jak se bude stanovovat míra reálného rizika, jímž příslušní jedinci ohrožují své partnery? Před zahájením PrEP musí být zřejmé, že osoba již není HIV+. Osoby užívající PrEP budou muset být pravidelně laboratorně i klinicky kontrolovány. Dosud nejsou k dispozici jednoznačně určená aplikační schémata, není ani vyřešena úhrada v případě masového zavedení. Kdo bude PrEP indikovat? Antiretrovirová terapie je primárně určena jako léčebný režim, nikoliv jako prevence a může být předepsána pouze specialistou se zkušenostmi s léčbou HIV/AIDS. Koncem srpna 2016 byl pro země Evropské unie schválen zatím jediný přípravek (kombinace TDF + FTC, Truvada®), který ve studiích vykázal dostatečné preventivní účinky.
Studují se však i další možnosti. Na konferenci o retrovirech a oportunních infekcích, která se konala počátkem roku 2016 v Bostonu, byl představen přípravek s obsahem nanopartikulárního dlouhodobě působícího cabotegraviru, který je podáván jako PrEP intramuskulárně mužům majícím sex s muži.
Doporučené postupy – pokus o standardizaci ART
V současné době existuje několik všeobecně akceptovaných doporučených postupů sloužících jako podklad pro správnou indikaci ART, ale také pro vyjednávání s různými institucemi (např. se Státním ústavem pro kontrolu léčiv nebo se zdravotními pojišťovnami). K nejznámějším patří tyto: doporučený postup Evropské klinické společnosti pro AIDS (European AIDS Clinical Society, EACS), jehož 8. verze byla publikována v červnu 2016, doporučený postup Britské společnosti pro HIV (British HIV Association, BHIVA), doporučený postup Mezinárodní antivirové společnosti (International Antiviral Society USA, IAS USA) a doporučený postup Ministerstva zdravotnictví USA (Department of Health and Human Services, DHHS). Tato doporučení spolu s výsledky probíhajících studií slouží k přípravě národních doporučení. V České republice vznikl první doporučený postup v roce 2007 [34]. Čtvrtá verze doporučeného postupu pro léčbu HIV/AIDS v ČR byla schválena výborem Společnosti infekčního lékařství ČLS JEP v lednu 2016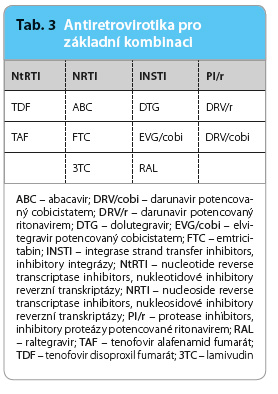 .
.
Základní kombinaci ART lze vyjádřit vzorcem: [1 NRTI + 1 NtRTI] nebo 2 NRTI + INSTI nebo PI/r (tab. 3).
Vysoká účinnost, nízký výskyt nežádoucích účinků, vynikající bezpečnostní profil a dobrá tolerance inhibitorů HIV integrázy předurčuje tyto přípravky za léky první volby; RAL a DTG navíc nemají žádné významnější interakce s CYP 3A. Proteázový inhibitor DRV (potencovaný RTV nebo cobi) má vysokou genetickou bariéru pro vznik rezistence, je tudíž velmi vhodný tam, kde vázne adherence [35].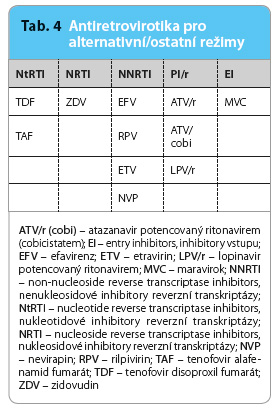
Alternativní/ostatní režimy ART lze vyjádřit vzorcem: [1 NRTI + 1 NtRTI] nebo 2 NRTI + NNRTI nebo PI/r nebo EI (tab. 4).
Alternativní/ostatní režimy nepatří kvůli některým svým nevýhodám či kvůli nedostatku zkušeností s jejich použitím mezi ART první volby. Za určitých speciálních podmínek však mohou být u daného pacienta režimem preferovaným a optimálním [35].
Závěr
Antiretrovirová terapie představuje v současné době jedinou medicínsky akceptovatelnou možnost léčby infekce HIV/AIDS. Specializace v oblasti léčby HIV v posledních letech pokročila natolik, že léky předepisují zkušení specialisté z AIDS (HIV) center. Léčba optimalizovanou kombinací antiretrovirotik se v současné době u daného pacienta zahajuje co nejdříve po potvrzení HIV-pozitivity, po řádném proškolení pacienta a po navození co nejvyššího stupně adherence. Většina lékových kombinací je v ČR dostupná a pojištěncům je plně hrazena z veřejného zdravotního pojištění. I nadále přibývají nová léčiva, která se do léčebného repertoáru zařazují na základě výsledků uskutečněných klinických studií. Vývoj léčiv směřuje k šetrnějším přípravkům s minimem nežádoucích účinků, s vysokou genetickou bariérou (oddalující selekci rezistentních mutant HIV), s vylepšenými farmakokinetickými vlastnostmi umožňujícími dávkování léků jednou denně (výhledově i v delších intervalech, např. jednou za několik měsíců) a s možností sdružovat jednotlivé léčivé substance do jedné tablety. Tím je usnadněno další zvyšování adherence nemocných k léčbě, ale i kontrola léčby. Predikovaná délka života správně léčených vysoce adherentních pacientů je v současné době srovnatelná s délkou života běžné HIV negativní populace.
Souhrn zkratek uvedených léčiv
ABC – abacavir; ATV – atazanavir; cobi – cobicistat; DRV – darunavir; DTG – dolutegravir; EFV – efavirenz; ETV – etravirin; EVG – elvitegravir; EVG/cobi – elvitegravir „boostovaný“, tj. potencovaný cobicistatem; FTC – emtricitabin; LPV/r – lopinavir potencovaný ritonavirem; MVC – maravirok; NVP – nevirapin; RAL – raltegravir; RPV – rilpivirin; RTV – ritonavir; TAF – tenofovir alafenamid fumarát; TDF – tenofovir disoproxil fumarát; T 20 – enfuvirtid; ZDV – zidovudin; 3TC – lamivudin
Souhrn zkratek lékových skupin
EI – inhibitor vstupu; INSTI – inhibitory HIV integrázy; NNRTI – nenukleosidový inhibitor reverzní transkriptázy; NRTI – nukleosidový inhibitor reverzní transkriptázy; NtRTI – nukleotidový inhibitor reverzní transkriptázy; PI – inhibitor proteázy; PI/r – inhibitor proteázy potencovaný ritonavirem
Podpořeno projektem institucionálního výzkumu MZČR–FNPI, 00669806.
Seznam použité literatury
- [1] Maartens G, Celum C, Lewin SR. HIV infection: epidemiology, pathogenesis, treatment, and prevention. Lancet 2014; 384: 258–271.
- [2] Staňková M. Novinky v antiretrovirové terapii HIV/AIDS infekce. Interní Med 2008; 10: 498–501.
- [3] Norris PJ, Zhang J, Worlock A, et al. Systemic Cytokine Levels Do Not Predict CD4+ T‑Cell Recovery After Suppressive Combination Antiretroviral Therapy in Chronic Human Immunodeficiency Virus Infection. Open Forum Infect Dis 2016; 3: doi: 10.1093/ofid/ofw025.
- [4] Low A, Gavriilidis G, Larke N, et al. Incidence of Opportunistic Infections and the Impact of Antiretroviral Therapy Among HIV‑Infected Adults in Low‑ and Middle‑Income Countries: A Systematic Review and Meta‑analysis. Clin Infect Dis 2016; 62: 1595–1603.
- [5] Price JC, Seaberg EC, Phair JP, et al. Highly Active Antiretroviral Therapy Mitigates Liver Disease in HIV Infection. J Acquir Immune Defic Syndr 2016; 72: 319–323.
- [6] Cohen MS, Chen YQ, McCauley M, et al. Prevention of HIV‑1 Infection with Early Antiretroviral Therapy. N Engl J Med 2011; 365: 493–505.
- [7] May MT, Gompels M, Delpech V, et al. Impact on life expectancy of HIV‑1 positive individuals of CD4+ cell count and viral load response to antiretroviral therapy. AIDS 2014; 28: 1193–1202.
- [8] Johnston Ch, Harrington R, Jain R, et al. Safety and Efficacy of Combination Antiretroviral Therapy in Human Immunodeficiency Virus‑Infected Adults Undergoing Autologous or Allogeneic Hematopoietic Cell Transplantation for Hematologic Malignancies. Biol Blood Marrow Transplant 2016; 22: 149–156.
- [9] Del Romero J, Baza MB, Río I, et al. Natural conception in HIV‑serodiscordant couples with the infected partner in suppressive antiretroviral therapy: A prospective cohort study. Medicine 2016; 95: e4398.
- [10] Rodger AJ, Cambiano V, Bruun T, et al. Sexual Activity Without Condoms and Risk of HIV Transmission in Serodifferent Couples When the HIV‑Positive Partner Is Using Suppressive Antiretroviral Therapy. JAMA 2016; 316: 171–181.
- [11] UNAIDS. Access to antiretroviral therapy in Africa status report on progress towards the 2015 targets. Dostupné na: http://www.unaids.org/sites/default/files/media_asset/20131219_AccessARTAfricaStatusReportProgresstowards2015Targets_en_0.pdf.
- [12] NRL AIDS. Výskyt a šíření HIV/AIDS v ČR. Červenec 2016. Dostupné na: http://www.szu.cz/uploads/documents/CeM/HIV_AIDS/rocni_zpravy/2016/HIV_AIDS_07_2016.pdf.
- [13] UNAIDS. Global gains made towards the 90–90–90 targets. 18 July 2016. Dostupné na: http://www.unaids.org/en/resources/presscentre/featurestories/2016/july/20160717_90‑90‑90.
- [14] Fontdevila MC, Cozzi‑Lepri A, Phillips A, et al. Plasma HIV‑1 tropism and risk of short‑term clinical progression to AIDS or death. J Int AIDS Soc 2014; 17 (Suppl 3): 19685.
- [15] Chun TW, Moir S, Fauci AS. HIV reservoirs as obstacles and opportunities for an HIV cure. Nature Immunology 2015; 16: 584–589.
- [16] Luzuriaga K. Early Combination Antiretroviral Therapy Limits HIV‑1 Persistence in Children. Annu Rev Med 2016; 67: 201–213.
- [17] Martinez‑Picado J, Deeks SG. Persistent HIV‑1 replication during antiretroviral therapy. Curr Opin HIV AIDS 2016; 11: 417–423.
- [18] De Cock KM, Gilks ChF, Lo Y‑R, Guerma T. Can antiretroviral therapy eliminate HIV transmission? Lancet 2009; 373: 7–9.
- [19] Bishop JD, DeShields S, Cunningham T, Troy SB. CD4 Count Recovery After Antiretroviral Therapy Initiation in Patients Infected with the Human Immunodeficiency Virus. Amer J Med Sci 2016 http://dx.doi.org/10.1016/j.amjms.2016.05.032.
- [20] Rasmussen TA, Tolstrup M, Brinkmann CR, et al. Panobinostat, a histone deacetylase inhibitor, for latent‑virus reactivation in HIV‑infected patients on suppressive antiretroviral therapy: a phase 1/2, single group, clinical trial. Lancet HIV 2014; 1: e13–21.
- [21] Søgaard OS, Graversen ME, Leth S, et al. The Depsipeptide Romidepsin Reverses HIV‑1 Latency In Vivo. PLoS Pathog 2015; 11: e1005142.
- [22] Lundgren JD, Babiker AG, Gordin F, et al. Initiation of Antiretroviral Therapy in Early Asymptomatic HIV Infection. N Engl J Med 2015; 373: 795–807.
- [23] Lundgren J, Babiker A, Gordin F, et al. Why START? Reflections that led to the conduct of this large long‑term strategic HIV trial. HIV Med 2015; 16 (Suppl 1): 1–9.
- [24] Ahmed N, Angus B, Boffito M, et al. BHIVA guidelines for the treatment of HIV‑1‑positive adults with ART 2015 (2016 interim update) 2016: 1–152. Dostupné na http://www.bhiva.org/HIV‑1‑treatment‑guidelines.aspx.
- [25] Günthard HF, Saag MS, Benson CA, et al. Antiretroviral Drugs for Treatment and Prevention of HIV Infection in Adults2016. Recommendations of the International Antiviral Society‑USA Panel. JAMA 2016; 316: 191–210.
- [26] Granich RM, Gilks ChF, Dye Ch, et al. Universal voluntary HIV testing with immediate antiretroviral therapy as a strategy for elimination of HIV transmission: a mathematical model. Lancet 2009; 373: 48–57.
- [27] Jin Y, Liu Z, Wang X, et al. A systematic review of cohort studies of the quality of life in HIV/AIDS patients after antiretroviral therapy. Int J STD AIDS 2014; 25: 771–777.
- [28] Mocroft A, Kirk O, Reiss P, et al. Estimated glomerular filtration rate, chronic kidney disease and antiretroviral drug use in HIV‑positive patients. AIDS 2010; 24: 1667–1678.
- [29] Nduka CU, Uthman OA, Kimani PK, Stranges S. Body Fat Changes in People Living with HIV on Antiretroviral Therapy. AIDS Rev 2016; 18: [Epub ahead of print].
- [30] Walmsley SL, Antela A, Clumeck N, et al. Dolutegravir plus Abacavir‑Lamivudine for the Treatment of HIV‑1 Infection. N Engl J Med 2013; 369: 1807–1818.
- [31] Rouzine IM, Weinberger LS. Design Requirements for Interfering Particles To Maintain Coadaptive Stability with HIV‑1. J Virol 2013; 87:2081–2093.
- [32] Cohen MS, Chen YQ, McCauley M, et al. Antiretroviral Therapy for the Prevention of HIV‑1 Transmission. N Engl J Med 2016; 375: 830–839.
- [33] Rosen S. Maskew M, Fox MP, et al. Initiating Antiretroviral Therapy for HIV at a Patient’s First Clinic Visit: The RapIT Randomized Controlled Trial. PLOS Medicine 2016. http://dx.doi.org/10.1371/journal.
- [34] Sedláček D, Staňková M, Machala L, et al. Komplexní postup antiretrovirové léčby osob infikovaných virem lidské imunodeficience (HIV) v České republice. Klin Mikrobiol Infekc Lek 2007; 13: 28–34.
- [35] Snopková S, Rozsypal H, Aster V, et al. Doporučený postup péče o dospělé infikované HIV a postexpoziční profylaxe infekce HIV. Klin Mikrobiol Infekc Lek 2016; 22: 20–38.