Novinky ze sympozia v San Antoniu věnovaného karcinomu prsu
Článek shrnuje novinky teoretického výzkumu i praktické výsledky klinických studií, které byly prezentovány na 31. San Antonio Breast Cancer Symposium v prosinci 2008.
Sympozium věnované problematice karcinomu prsu, které se koná vždy před Vánoci v San Antoniu, má od počátku vysokou odbornou úroveň a novinky teoretického výzkumu i praktické výsledky klinických studií přinášejí velkou naději pro všechny nemocné s touto diagnózou.
Nová cílená léčba karcinomu prsu
Nic není významnějšího pro vývoj cílené terapie než znalost terče vhodného pro zacílení léčby. Příkladem toho je i prezentace nových molekul směrovaných k HER2 antigenu, které byly na 31. San Antonio Breast Cancer Symposium (SABCS) 2008 představeny.
Konjugát trastuzumabu s DM1
V teoretické úrovni se již dlouho diskutuje o možné „chytré bombě“ v onkologické léčbě, tedy o spojení ničivého cytostatika a směrující protilátky, aby byl eliminován nepříznivý efekt chemoterapie na okolní zdravou tkáň. Tuto představu částečně splňuje trastuzumab-DM1 konjugát (TDM1). DM1 je cytostatikum ze skupiny antibiotik izolovaných z Maytenus errata, které působí toxicky na mikrotubuly. V TDM1 je navázano na molekulu trastuzumabu. Výsledky studií fáze I dokládají přes pozorovanou hepatotoxicitu, únavu a trombocytopenii velmi povzbuzující účinky TDM1 u pacientek s HER2 pozitivním metastatickým karcinomem prsu. To potvrzují i první závěry studie fáze II [1] u pacientek s generalizovaným HER2 pozitivním karcinomem prsu, u nichž selhala předchozí léčba chemoterapií a trastuzumabem. Pacientky byly léčeny TDM1 v dávce 3,6 mg/kg podávané 1krát za 3 týdny. Ve skupině 107 nemocných s mediánem 76 týdnů předchozí léčby trastuzumabem bylo 68 % pacientek léčeno v předchozím režimu antracykliny a 55 % lapatinibem.
Nežádoucí účinky TDM1 představovaly především trombocytopenii klinicky se projevující epistaxí (25 %) a konjunktivitidu (25 %). Nežádoucí účinky stupně 3/4 byly vzácné, všechny nemocné měly ECHO měřenou ejekční frakci vyšší než 50 % a žádná neměla známky srdečního selhání. Celková odpověď potvrzená zobrazovacími metodami byla zaznamenána ve 27 %, v 39 % odpověděli pacienti předléčení lapatinibem. Tyto velice slibné výsledky budou dále potvrzovány ve studiích nejen u těžce předléčených nemocných, ale také u pacientů s čerstvě generalizovaným onemocněním.
Neratinib
Neratinib je multikinázový inhibitor antigenů EGFR (receptor pro epidermální růstový faktor), HER2 a HER4. Na rozdíl od lapatinibu blokuje kinázy ireverzibilně. Je také dostupný v tabletách a farmakokinetické studie ukazují, že je možné podávat jej 1krát za den. Výsledky mezinárodní multicentrické studie u žen s HER2 pozitivním karcinomem prsu byly prezentovány formou posteru [2]. Lék byl podáván jednak pacientkám s generalizovaným karcinomem prsu po předchozí chemoterapii pro generalizované onemocnění (průměrně 2 linie), které nebyly zatím trastuzumabem léčeny, jednak skupině nemocných, které již trastuzumab dostávaly. Lék byl podáván perorálně v dávce 240 mg/den. Hlavním nežádoucím účinkem byl průjem (85 %), který bylo možno zvládnout loperamidem nebo mírnou redukcí dávky (cca o 15 %). Na léčbu odpovědělo 26 % nemocných předléčených trastuzumabem a 55 % trastuzumab-naivních pacientek. Primárním cílem byl PFS (progression-free survival, doba přežití bez progrese onemocnění), který činil 16 týdnů u 60 %, respektive u 77 % pacientek ve vztahu k předchozí léčbě trastuzumabem. Medián doby do progrese byl 40 týdnů u pacientek trastuzumabem nepředléčených a 23 týdnů u trastuzumabem již předléčených. Tyto slibné výsledky daly podnět k uspořádání několika probíhajících studií fáze II, které testují neratinib v kombinaci s různými cytostatiky, a studií fáze III, jež porovnávají neratinib proti kombinaci lapatinibu s kapecitabinem.
Známá léčiva v nových indikacích
Neoadjuvantní užití zoledronátu napomáhá zmenšení nádoru
Výsledky studie AZURE (Neo-Adjuvant Zoledronic Acid to Reduce Recurrence) u 3360 pacientek ve stadiu II a III karcinomu prsu, které byly léčeny buď standardní neoadjuvantní a adjuvantní chemoterapií, nebo dostávaly tuto léčbu společně s kyselinou zoledronovou, budou teprve zhodnoceny. Předběžná data ohledně neoadjuvantního podání však zazněla již v San Antoniu. Dr. Coleman prezentoval výsledky skupiny 205 nemocných, které se podrobily chirurgickému zákroku po neoadjuvantní léčbě. Ty ukazují, že přidání zoledronátu způsobuje výraznější zmenšení primárního nádoru (20,5 mm vs. 30,0 mm) oproti podání samotné chemoterapie (p = 0,002). Při přidání zoledronátu k léčbě byla kompletní patologická remise diagnostikována u 10,8 % pacientů, při léčbě samotnou chemoterapií v 5,8 % (p = 0,02) [3].
Lapatinib a hormonální rezistence
Významným problémem v oblasti hormonální léčby je vznik rezistence k této terapii a možnosti jejího překonání. Laboratorní studie prokázaly souvislost mezi aktivací hormonálních receptorů a jiných růstových faktorů včetně EGFR a HER2.
Výsledky studií s modely růstu karcinomu prsu nasvědčují tomu, že inhibice všech těchto cest v kombinaci zajistí lepší dlouhodobou kontrolu nádoru než samotná inhibice jednotlivých receptorů. To měla potvrdit i studie EGF30008, ve které byl kombinován letrozol s lapatinibem u 1286 pacientek s ER+ (pozitivní exprese estrogenového receptoru) metastatickým karcinomem prsu HER2 pozitivních i HER2 negativních [4]. Ve skupině HER2 pozitivních nemocných zlepšovalo přidání lapatinibu k letrozolu PFS. Odpověď se zvýšila z 15 % na 28 %, PFS se prodloužil ze 3 na 8 měsíců. Tyto výsledky byly konzistentní se závěry studie TANDEM, v níž měly nemocné s HER2 pozitivitou také prospěch z léčby kombinací anastrozol + trastuzumab. Ve skupině HER2 negativních nemocných nemělo přidání lapatinibu význam ve srovnání s léčbou samotným letrozolem. Když však byla HER2 negativní populace stratifikována dle endokrinní citlivosti, byl u hormonálně rezistentních (relaps ≤ 6 měsíců po ukončení léčby tamoxifenem) zjištěn medián PFS 3,1 měsíce s léčbou letrozolem a zvýšil se na 8,3 měsíce při podávání kombinace letrozolu s lapatinibem. V rameni s kombinovanou léčbou došlo k 22% (ale nesignifikantnímu) snížení rizika. U pacientů, kteří byli hormonálně citliví (relaps ≥ 6 měsíců od ukončení podávání tamoxifenu nebo bez předchozího podávání tamoxifenu), byl medián PFS přibližně 15 měsíců v každé větvi, a to bez ohledu na léčbu lapatinibem. V rezistentní populaci bylo dosaženo přínosu z léčby u 32 % pacientek léčených samotným letrozolem ve srovnání s 44 % pacientek užívajících kombinaci. V citlivé populaci mělo asi 63 % nemocných z každého ramene klinický přínos z léčby. Dá se předpokládat, že rezistence k hormonální léčbě může souviset s expresí HER2 a anti-HER2 terapie ji může oddálit. Tuto hypotézu testuje probíhající studie CALGB 40302, která srovnává léčbu pacientek s generalizovaným hormonálně dependentním karcinomem prsu, u nichž selhala léčba inhibitory aromatázy. Pacientky v této studii jsou randomizovány k monoterapii fulvestrantem nebo k terapii, v níž je kombinován fulvestrant s lapatinibem.
Novinky v léčbě HER2 pozitivních nádorů prsu
Jaké je riziko malého HER2 pozitivního nádoru?
Většina adjuvantních studií s trastuzumabem je zacílena na HER2 pozitivní nádory prsu ≥ 1 cm, eventuálně s pozitivními regionálními uzlinami. Užití trastuzumabu v terapii menších HER2 pozitivních nádorů s negativními regionálními uzlinami není zatím podpořeno dostatkem výsledků klinických studií. Na tuto populaci se zaměřila studie M.D. Anderson Cancer Center, která zařazovala pacientky s HER2 pozitivním zhoubným nádorem prsu ≤ 1 cm [5]. Sledovaná skupina pacientek dostávala nebo nedostávala chemoterapii s trastuzumabem, není proto zřejmé, co by nemocným zajistilo do budoucna lepší přínos, jasné ale je, že prognóza nemocných závisí jednoznačně na stavu HER2. U pacientek s HER2 negativním nádorem stadia T1a,bN0M0 bylo období 10 let bez recidivy zaznamenáno v 88 %, pokud byl nádor ER+, a v 80 %, pokud byl triple negativní. Pokud byl ale nádor HER2 pozitivní, bylo období bez recidivy zjištěno jen u 62 % nemocných. Toto pozorování zakládá představu o tom, že i pro nemocné s velmi malými HER2 pozitivními nádory by mohla být adjuvantní chemoterapie s trastuzumabem přínosem. To je v souladu s doporučením NCCN (National Comprehensive Cancer Network), které uvádí i nádory velikosti 6–10 mm s HER2 pozitivitou jako vhodné k adjuvanci s trastuzumabem. V Dana-Farber Cancer Institute probíhá nyní klinická studie testující efektivitu kombinace trastuzumabu s paklitaxelem v adjuvanci pro nemocné s HER2 pozitivním karcinomem prsu stadia I.
Neoadjuvantní podání trastuzumabu se stalo standardem v léčbě lokálně pokročilého HER2 pozitivního karcinom prsu
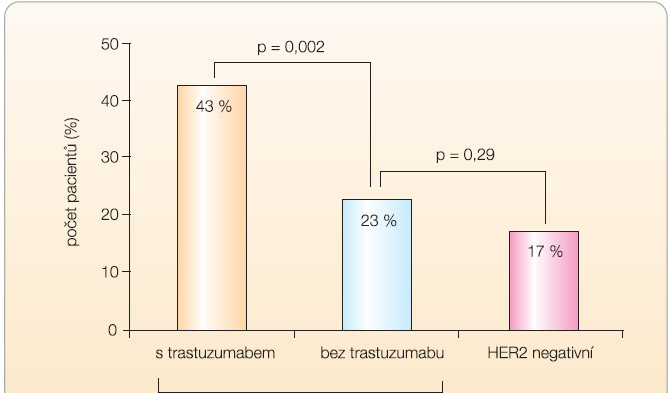 Doposud bylo podávání trastuzumabu nestandardní neoadjuvantní metodou a trastuzumab byl podáván standardně v adjuvanci, přestože již byly známy přesvědčivé důkazy o jeho účinnosti v této indikaci [6]. Ve studii fáze III NOAH (Neo-Adjuvant Herceptin) italských autorů bylo zařazeno 228 pacientek s lokálně pokročilým karcinomem prsu včetně inflamatorního nádoru. K neodajuvantní chemoterapii antracykliny a taxany byl přidán trastuzumab; 3letá doba bez známek nemoci byla v kombinovaném rameni zaznamenána u 70 % pacientek, ve srovnání s 53 % pacientek v rameni s chemoterapií samotnou, to znamená, že relativní riziko rekurence bylo po přidání trastuzumabu téměř poloviční (hazard ratio 0,56; p = 0,006). Po přidání trastuzumabu k léčbě dosáhlo patologické kompletní remise téměř 2krát více nemocných než s chemoterapií samotnou (39 % vs. 20 %; p = 0,002), viz graf 1. Celková odpověď byla také vyšší v kombinovaném rameni (89 % vs. 77 %; p = 0,02). Zlepšení celkového přežití v rameni s trastuzumabem nebylo zatím signifikantní. Z přidání trastuzumabu měly prospěch všechny skupiny pacientek, nemocné s inflamatorním karcinomem, s hormonálně dependentním karcinomem, s negativními hormonálními receptory i ty, které nedosáhly patologické kompletní remise. Terapie byla dobře tolerovaná s únosnou kardiotoxicitou [7].
Doposud bylo podávání trastuzumabu nestandardní neoadjuvantní metodou a trastuzumab byl podáván standardně v adjuvanci, přestože již byly známy přesvědčivé důkazy o jeho účinnosti v této indikaci [6]. Ve studii fáze III NOAH (Neo-Adjuvant Herceptin) italských autorů bylo zařazeno 228 pacientek s lokálně pokročilým karcinomem prsu včetně inflamatorního nádoru. K neodajuvantní chemoterapii antracykliny a taxany byl přidán trastuzumab; 3letá doba bez známek nemoci byla v kombinovaném rameni zaznamenána u 70 % pacientek, ve srovnání s 53 % pacientek v rameni s chemoterapií samotnou, to znamená, že relativní riziko rekurence bylo po přidání trastuzumabu téměř poloviční (hazard ratio 0,56; p = 0,006). Po přidání trastuzumabu k léčbě dosáhlo patologické kompletní remise téměř 2krát více nemocných než s chemoterapií samotnou (39 % vs. 20 %; p = 0,002), viz graf 1. Celková odpověď byla také vyšší v kombinovaném rameni (89 % vs. 77 %; p = 0,02). Zlepšení celkového přežití v rameni s trastuzumabem nebylo zatím signifikantní. Z přidání trastuzumabu měly prospěch všechny skupiny pacientek, nemocné s inflamatorním karcinomem, s hormonálně dependentním karcinomem, s negativními hormonálními receptory i ty, které nedosáhly patologické kompletní remise. Terapie byla dobře tolerovaná s únosnou kardiotoxicitou [7].
Novinky v adjuvantní hormonální léčbě karcinomu prsu
Možnost využít předností hormonální terapie jako cílené protinádorové léčby rozšiřuje terapeutické spektrum pro všechny pacientky s hormonálně dependentním nádorem; znamená pro ně naději dosáhnout dlouhodobé kontroly nemoci s minimem nežádoucích účinků a s dobrou snášenlivostí terapie. Významný pokles mortality u karcinomu prsu v posledních 10–15 letech je nepochybně částečně způsoben masovým rozšířením adjuvantní hormonální léčby u ER+ karcinomu prsu.
Metaanalýza studií s inhibitory aromatázy v adjuvantní léčbě
Analyzovány byly největší klinické studie porovnávající efekt tamoxifenu a inhibitorů aromatázy v adjuvanci, tedy ATAC (9000 pacientů), BIG 1-98 (8000 pacientů) a IES (5000 pacientů) [8].
Na SABCS 2008 byly prezentovány dvě analýzy. Jednak rozbor „upfront“ studií, které srovnávaly 5leté podávání inhibitorů aromatázy a tamoxifenu v adjuvanci po operaci pro hormonálně dependentní karcinom prsu (ATAC, BIG 1-98). Druhá analýza srovnávala „switch“studie, kde bylo hodnoceno adjuvantní podávání tamoxifenu po dobu 5 let vs. podávání tamoxifenu 2–3 roky, jež bylo následováno podáváním inhibitoru aromatázy do celkové doby 5 let trvání terapie (IES, ARNO 95, ABCSG 8). Závěry nebyly nijak překvapivé, korespondovaly totiž se známými fakty z jednotlivých studií, a sice že vstupní léčba inhibitorem aromatázy zlepšuje období bez nemoci, ale nemá vliv na celkové přežití; srovnání s taktikou „switch“ ukázalo, že tzv. switch léčebný přístup zlepšuje jak období bez nemoci, tak i celkové přežití. Dochází k redukci vzdálených metastáz, regionálních rekurencí i nádorů v kontralaterálním prsu. Při začlenění inhibitorů aromatázy do léčby karcinomu prsu se pohybuje riziko komplikací (HR) mezi 0,75 a 0,85, znamená to tedy 3–4% rozdíl v absolutním riziku komplikací karcinomu prsu v době mediánu sledování nemocných. Analýza neprokázala významné rozdíly v závislosti na stupni diferenciace nádoru, stavu uzlin nebo v závislosti na expresi progesteronového receptoru (PR). K potvrzení závěrů metaanalýzy přispěly i další dvě studie. První z nich byla studie ABCSG 8 s pacientkami s hormonálně dependentními nádory nízkého rizika G1–G2, které nebyly léčeny chemoterapií. Nemocné byly randomizovány k léčbě tamoxifenem po dobu 5 let nebo k 2leté léčbě tamoxifenem s následným inhibitorem aromatázy [9]. Na SABCS 2008 bylo prezentováno hodnocení po 100 měsících sledování. „Switch“ terapie zlepšovala období bez nemoci, ale při delší době sledování zlepšovala i celkové přežití (HR = 0,77; p = 0,025). Druhá studie – TEAM – randomizovala pacienty do ramene s adjuvantním tamoxifenem nebo s exemestanem, dále měla také rameno se změnou léčby („switch“), kde byl tamoxifen vystřídán léčbou exemestanem; bohužel data z této části studie nebyla k dispozici, bylo možno srovnávat jen obě „upfront“ ramena v mediánu 2,75 roku [10]. Zařazeno bylo 9775 nemocných, riziko metastazování dosáhlo 5 % při léčbě tamoxifenem a 4,1 % při léčbě exemestanem, riziko lokální rekurence bylo v obou ramenech stejné – 0,9 %. Riziko redukce všech komplikací bylo pro rameno s exemestanem 11 %, tento údaj ale nebyl statisticky významný.
Letrozol a tamoxifen u pacientek s časným karcinomem prsu v adjuvanci
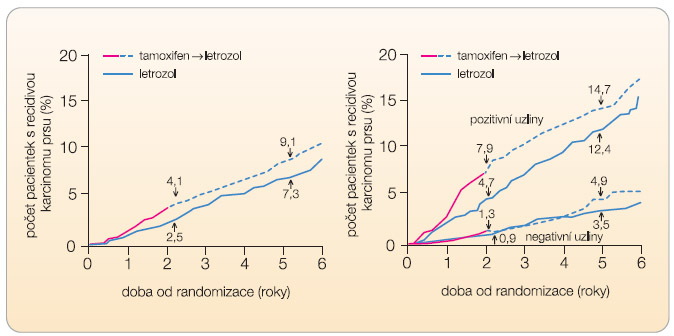 Výsledky nové analýzy studie Breast International Group (BIG) 1-98 [11] ukázaly, že ženy užívající adjuvantně po operaci hormonálně dependentního nádoru prsu letrozol po dobu 5 let mají proti ženám užívajícím tamoxifen o 13 % nižší riziko smrti (p = 0,08). Ve studii bylo randomizováno celkem 8010 postmenopauzálních žen s hormonálně dependentním karcinomem prsu do čtyř ramen: 5leté užívání tamoxifenu, 5leté užívání letrozolu, 2leté užívání tamoxifenu s následným 3letým obdobím užívání letrozolu a konečně 2leté užívání letrozolu s následnou 3letou léčbou tamoxifenem. Výsledky z roku 2005 ukázaly, že ženy užívající letrozol mají signifikantně nižší počet lokálních recidiv i vzdálených metastáz, proto byla studie odslepena a všem ženám užívajícím tamoxifen byla nabídnuta změna na léčbu letrozolem, jíž využilo 25 % nemocných. 13% redukce rizika smrti se tedy týká i těch žen, které původně užívaly tamoxifen; pokud se tyto nemocné neposuzují, představuje redukce rizika dokonce 19 %. Sekvenční léčba se výrazně přibližuje účinku samotného letrozolu. Pětileté přežití v rameni s letrozolem bylo 87,9 %, v
Výsledky nové analýzy studie Breast International Group (BIG) 1-98 [11] ukázaly, že ženy užívající adjuvantně po operaci hormonálně dependentního nádoru prsu letrozol po dobu 5 let mají proti ženám užívajícím tamoxifen o 13 % nižší riziko smrti (p = 0,08). Ve studii bylo randomizováno celkem 8010 postmenopauzálních žen s hormonálně dependentním karcinomem prsu do čtyř ramen: 5leté užívání tamoxifenu, 5leté užívání letrozolu, 2leté užívání tamoxifenu s následným 3letým obdobím užívání letrozolu a konečně 2leté užívání letrozolu s následnou 3letou léčbou tamoxifenem. Výsledky z roku 2005 ukázaly, že ženy užívající letrozol mají signifikantně nižší počet lokálních recidiv i vzdálených metastáz, proto byla studie odslepena a všem ženám užívajícím tamoxifen byla nabídnuta změna na léčbu letrozolem, jíž využilo 25 % nemocných. 13% redukce rizika smrti se tedy týká i těch žen, které původně užívaly tamoxifen; pokud se tyto nemocné neposuzují, představuje redukce rizika dokonce 19 %. Sekvenční léčba se výrazně přibližuje účinku samotného letrozolu. Pětileté přežití v rameni s letrozolem bylo 87,9 %, v ![Graf 3 Studie BIG 1-98, recidiva nádoru v sekvenčním rameni letrozolģtamoxifen proti samotnému letrozolu a) u všech pacientek, b) rozdělení pacientek dle stavu uzlin – 42 % pacientek mělo uzliny pozitivní, 58 % pacientek mělo uzliny negativní; podle [11] – Mouridsen, et al., 2009.](https://www.remedia.cz/photo-a-27320---.jpg) rameni se sekvencí tamoxifen »» ģletrozol 86,2 % a v rameni se sekvencí letrozol»»ģtamoxifen 87,6 %. Subanalýzy ukázaly, že zahájení sekvenční léčby letrozolem je přínosné pro rizikové pacientky s pozitivními uzlinami, v nerizikové populaci není statisticky významný rozdíl mezi letrozolem samotným a oběma sekvenčními režimy (graf 2 a 3). Zahájení léčby inhibitorem aromatázy bezprostředně po operaci je, jak je patrné z výsledků studie, rozhodující, pokračování v sekvenční léčbě tamoxifenem nesnižuje podstatně účinnost terapie, diverguje její nežádoucí účinky a výrazně léčbu zlevňuje.
rameni se sekvencí tamoxifen »» ģletrozol 86,2 % a v rameni se sekvencí letrozol»»ģtamoxifen 87,6 %. Subanalýzy ukázaly, že zahájení sekvenční léčby letrozolem je přínosné pro rizikové pacientky s pozitivními uzlinami, v nerizikové populaci není statisticky významný rozdíl mezi letrozolem samotným a oběma sekvenčními režimy (graf 2 a 3). Zahájení léčby inhibitorem aromatázy bezprostředně po operaci je, jak je patrné z výsledků studie, rozhodující, pokračování v sekvenční léčbě tamoxifenem nesnižuje podstatně účinnost terapie, diverguje její nežádoucí účinky a výrazně léčbu zlevňuje.
Tamoxifen v prevenci karcinomu prsu
Studie International Breast Intervention Study I (IBIS-I) randomizovala 7000 žen do ramene s tamoxifenem nebo s placebem po dobu 60 měsíců. Z jejích výsledků vyplývá, že redukce denzity prsní žlázy o alespoň 10 % v průběhu 12–18 měsíců od započetí léčby tamoxifenem může pomoci vytipovat ty rizikové pacientky, které by mohly mít prospěch z dlouhodobé chemoprevence tamoxifenem. Denzita prsní žlázy je po věku nejvýznamnějším rizikovým faktorem karcinomu prsu. Asi 10 % žen má hyperdenzní mléčnou žlázu, což je spojeno až se 4krát vyšším rizikem vzniku nádoru [12].
Molekulárněbiologická charakteristika nádorů léčených hormonální terapií
Subanalýzu molekulárněbiologické charakteristiky nádoru jako prediktivního faktoru pro hormonální léčbu pomocí vyšetření Oncotype DX™ podstoupilo 1231 pacientek s ER+ nádorem, které nebyly léčeny chemoterapií a byly zařazeny do studie ATAC [13]. V obou ramenech byly výsledky testu schopny dokumentovat senzitivitu nebo rezistenci nádoru na tamoxifen, ale i na anastrozol. Významné riziko recidivy představuje postižení uzlin, to se dramaticky zvyšuje od postižení 4 a více regionálních uzlin. Prognostické skóre potom ukazuje, že pacientky s příznivým genetickým profilem nádoru mají dobrou prognózu, ať jsou léčeny tamoxifenem nebo inhibitorem aromatázy. Přestože zařazení inhibitoru aromatázy do adjuvantní léčby přináší nevelkou procentuální výhodu pro dobu bez nemoci pacientek, je asi přeci jen rozumné nemocné stratifikovat, a ty, které mají nepříznivý molekulárněbiologický profil, pozitivní uzliny, nedostatečně pozitivní hormonální receptory, zvýšenou expresi HER2 neu a vysoké Ki 67, léčit adjuvantně inhibitorem aromatázy.
Kmenové buňky karcinomu prsu
Na základě řady studií je zřejmé, že zhoubný nádor je heterogenní směsí nádorových buněk různé funkce a významu, z nichž se zdají být nejvýznamnější právě kmenové buňky, které jsou nejspíše zodpovědné za obnovu nádoru (obr. 1). Proto se je pokoušíme identifikovat pomocí povrchových markerů. Klinicky významný je fakt, že tyto buňky jsou, bohužel, nejméně citlivé k chemoterapii a radioterapii. To potvrzuje i studie s neoadjuvantní chemoterapií, která ukazuje, že proporcionální zastoupení buněk s povrchovými markery kmenových buněk stoupá při zmenšování nádoru po léčbě. Ženy se zvýšenou expresí HER2 v nádoru měly větší množství kmenových buněk v 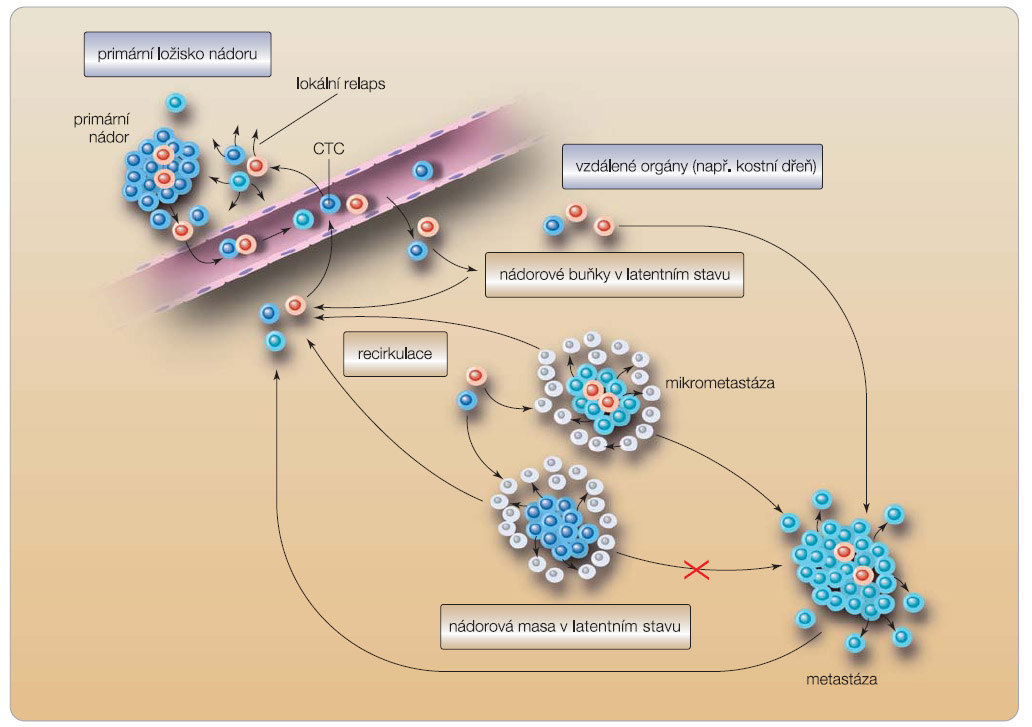 nádoru než ty, které zvýšenou expresi HER2 v nádoru neměly. Na druhé straně, přidání lapatinibu k neoadjuvantní chemoterapii v jiné studii vede k redukci počtu kmenových buněk v nádoru. Z toho vyplývá, že HER2 hraje významnou roli jako regulátor kmenových buněk karcinomu prsu a inhibitory HER2, jako je trastuzumab a lapatinib, jsou schopné selektivně zasahovat kmenové nádorové buňky. V rámci SABCS byly prezentovány výsledku výzkumu dr. Maxe Wichy z Michiganské univerzity v Ann Arbor, který ukázal, že kmenové buňky nádoru mohou být ovlivňovány a regulovány mikroprostředím. Ukázal, že mezenchymové buňky, které pocházejí z kostní dřeně a kolonizují nádor, jsou schopné regulovat nádorové kmenové buňky. Signální cesta komunikace mezi mezenchymální a kmenovou buňkou by mohla do budoucna být novým léčebným cílem v terapii karcinomu prsu [14]. Při léčbě karcinomu prsu produkují zanikající nádorové buňky interleukin 8 (IL-8). To je obvyklá odpověď na poškození, ale IL-8 je schopný stimulovat kmenové buňky karcinomu prsu přes CXCR1 chemokinový receptor. U myší byla vyzkoušena možnost blokády CXCR1 pomocí malé molekuly inhibitoru, což umožňuje zaměřit a zredukovat populaci kmenových buněk. Taková léčba by mohla výrazně snížit procento rekurencí karcinomu prsu. Výzkumně se testují protilátky proti IL-8 a také repertaxin (studie fáze I), což je malá molekula inhibitoru CXCR1, která byla vyvinuta jako protizánětlivý preparát snižující poškození srdeční tkáně po infarktu myokardu. Další významnou cestou, která by mohla ovlivňovat kmenové buňky, je Notch signální cesta. Notch inhibitory, jako jsou například inhibitory gamma sekretázy, se zkoušejí i v kombinaci s chemoterapií, jejíž účinek by mohly výrazně potencovat. Signální cesta Hedgehog může také regulovat kmenové buňky nádoru, ligandy pro Hedgehog mohou působit na buňky ve stromatu nádoru a interakce mezi stromatem a kmenovými buňkami může regulovat jejich růst. Malé molekuly Hedgehog inhibitorů procházejí také fází I a II testování. V Aktasově studii [15] byl prokázán význam dvou buněčných markerů aldehyddehydrogenázy (ALDH)-1 a epiteliálního-mezenchymálního přechodu (EMT), které mohou exprimovat kmenové buňky; ty jsou potom relativně rezistentní k chemoterapii a mohou být detekovány v cirkulaci. ALDH je častěji exprimován na kmenových buňkách bazálního typu nádoru i nádoru triple negativního. Předpokládá se, že bazální typy nádorů pocházejí z primitivních prsních kmenových buněk. Luminální nádory exprimují ALDH v daleko nižším procentu. Z toho se dá usoudit, že různé molekulární subkategorie karcinomů prsu mohou vznikat z různých buněčných linií a exprimovat různé markery. Pro identifikaci kmenových buněk, která je velmi obtížná, se nejčastěji využívá kombinace ALDH a CD44+ a CD24. Výzkum kmenových buněk karcinomu prsu je teprve v počátcích, ale již nyní se rýsují nadějné praktické výstupy, pravděpodobně v budoucnu uplatnitelné v léčbě karcinomu prsu.
nádoru než ty, které zvýšenou expresi HER2 v nádoru neměly. Na druhé straně, přidání lapatinibu k neoadjuvantní chemoterapii v jiné studii vede k redukci počtu kmenových buněk v nádoru. Z toho vyplývá, že HER2 hraje významnou roli jako regulátor kmenových buněk karcinomu prsu a inhibitory HER2, jako je trastuzumab a lapatinib, jsou schopné selektivně zasahovat kmenové nádorové buňky. V rámci SABCS byly prezentovány výsledku výzkumu dr. Maxe Wichy z Michiganské univerzity v Ann Arbor, který ukázal, že kmenové buňky nádoru mohou být ovlivňovány a regulovány mikroprostředím. Ukázal, že mezenchymové buňky, které pocházejí z kostní dřeně a kolonizují nádor, jsou schopné regulovat nádorové kmenové buňky. Signální cesta komunikace mezi mezenchymální a kmenovou buňkou by mohla do budoucna být novým léčebným cílem v terapii karcinomu prsu [14]. Při léčbě karcinomu prsu produkují zanikající nádorové buňky interleukin 8 (IL-8). To je obvyklá odpověď na poškození, ale IL-8 je schopný stimulovat kmenové buňky karcinomu prsu přes CXCR1 chemokinový receptor. U myší byla vyzkoušena možnost blokády CXCR1 pomocí malé molekuly inhibitoru, což umožňuje zaměřit a zredukovat populaci kmenových buněk. Taková léčba by mohla výrazně snížit procento rekurencí karcinomu prsu. Výzkumně se testují protilátky proti IL-8 a také repertaxin (studie fáze I), což je malá molekula inhibitoru CXCR1, která byla vyvinuta jako protizánětlivý preparát snižující poškození srdeční tkáně po infarktu myokardu. Další významnou cestou, která by mohla ovlivňovat kmenové buňky, je Notch signální cesta. Notch inhibitory, jako jsou například inhibitory gamma sekretázy, se zkoušejí i v kombinaci s chemoterapií, jejíž účinek by mohly výrazně potencovat. Signální cesta Hedgehog může také regulovat kmenové buňky nádoru, ligandy pro Hedgehog mohou působit na buňky ve stromatu nádoru a interakce mezi stromatem a kmenovými buňkami může regulovat jejich růst. Malé molekuly Hedgehog inhibitorů procházejí také fází I a II testování. V Aktasově studii [15] byl prokázán význam dvou buněčných markerů aldehyddehydrogenázy (ALDH)-1 a epiteliálního-mezenchymálního přechodu (EMT), které mohou exprimovat kmenové buňky; ty jsou potom relativně rezistentní k chemoterapii a mohou být detekovány v cirkulaci. ALDH je častěji exprimován na kmenových buňkách bazálního typu nádoru i nádoru triple negativního. Předpokládá se, že bazální typy nádorů pocházejí z primitivních prsních kmenových buněk. Luminální nádory exprimují ALDH v daleko nižším procentu. Z toho se dá usoudit, že různé molekulární subkategorie karcinomů prsu mohou vznikat z různých buněčných linií a exprimovat různé markery. Pro identifikaci kmenových buněk, která je velmi obtížná, se nejčastěji využívá kombinace ALDH a CD44+ a CD24. Výzkum kmenových buněk karcinomu prsu je teprve v počátcích, ale již nyní se rýsují nadějné praktické výstupy, pravděpodobně v budoucnu uplatnitelné v léčbě karcinomu prsu.
Závěr
Program sympozia v San Antoniu v prosinci 2008 je příkladem úzkého provázání základního výzkumu v oblasti kancerogeneze a molekulární biologie i aplikovaného klinického výzkumu s konkrétními doporučeními pro léčbu a diagnostiku karcinomu prsu. Sympozium si zachovává tradičně vysokou úroveň a znamená velkou naději pro naše pacienty, protože výměna recentních informací na tomto fóru může přispět k akceleraci výzkumu a vývoje nových léčebných metod.
Seznam použité literatury
- [1] Vukelja S, Rugo H, Vogel C, et al. A phase II study of trastuzumab-DM1, a first-in-class HER2 antibody-drug conjugate, in patients with HER2+ metastatic breast cancer. Cancer Res 2009; 69 (suppl. 2): 71s. Abstract 33.
- [2] Burstein HJ, Sun Y, Tan AR, et al. Neratinib (HKI-272), an irreversible pan erbB receptor tyrosine kinase inhibitor: phase 2 results in patients with advanced HER2+ breast cancer. Cancer Res 2009; 69 (suppl. 2): 73s. Abstract 37.
- [3] Winter MC, Thorpe HC, Burkinshaw R, et al. The addition of zoledronic acid to neoadjuvant chemotherapy may influence pathological response – exploratory evidence for direct anti-tumor activity in breast cancer. SABCS 2008. Abstract 5101.
- [4] Johnston S, Pegram M, Press M, et al. Lapatinib combined with letrozole vs letrozole alone for front line postmenopausal hormone receptor positive (HR+) metastatic breast cancer (MBC): first results from the EGF30008 trial. Cancer Res 2009; 69 (suppl. 2): 74s. Abstract 46.
- [5] Rakkhit R, Broglio K, Peintinger F, et al. Significant increased recurrence rates among breast cancer patients with HER2-positive, T1a,bN0M0 tumors. Cancer Res 2009; 69 (suppl. 2): 96s. Abstract 701.
- [6] Buzdar AU, Ibrahim NK, Francis D, et al. Significantly higher pathologic complete remission rate after neoadjuvant therapy with trastuzumab, paclitaxel, and epirubicin chemotherapy: results of a randomized trial in human epidermal growth factor receptor 2-positive operable breast cancer. J Clin Oncol 2005; 23: 3676–3985.
- [7] Gianni L, Eiermann W, Semiglazov V, et al. Neoadjuvant trastuzumab in patients with HER2-positive locally advanced breast cancer: primary efficacy analysis of the NOAH trial. SABCS 2008. Abstract 31.
- [8] Ingle JN, Dowsett M, Cuzick J, Davies C. Aromatase inhibitors versus tamoxifen as adjuvant therapy for postmenopausal women with estrogen receptor positive breast cancer: meta-analysis of randomized trials of monotherapy and switching strategies. Cancer Res 2009; 69 (suppl. 2): 66s. Abstract 12.
- [9] Jakesz R, Gnant M, Griel R, et al. Tamoxifen and anastrozole as a sequencing strategy in postmenopausal women with hormone-responsive early breast cancer: updated data from the Austrian breast and colorectal cancer study group trial 8. Cancer Res 2009; 69 (suppl. 2): 67s. Abstract 14.
- [10] Jones SE, Seynaeve C, Hasenburg A, et al. Results of the first planned analysis of the TEAM (tamoxifen exemestane adjuvant multinational) prospective randomized phase III trial in hormone sensitive postmenopausal early breast cancer. Cancer Res 2009; 69 (suppl. 2): 67s. Abstract 15.
- [11] Mouridsen HT, Giobbie-Hurder A, Mauriac L, et al. BIG 1-98: A randomized double-blind phase III study evaluating letrozole and tamoxifen given in sequence as adjuvant endocrine therapy for postmenopausal women with receptor-positive breast cancer. Cancer Res 2009; 69 (suppl. 2): 66s. Abstract 13.
- [12] Cuzick J, Warwick J, Pinney L, et al. Change in breast density as a biomarker of breast cancer risk reduction; results from IBIS-1., SABCS 2008. Abstract 61.
- [13] Dowsett M, Cuzick J, Wales C, et al. Risk of distant recurrence using Oncotype DX in postmenopausal primary breast cancer patients treated with anastrozole or tamoxifen: a TransATAC study. Cancer Res 2009; 69 (suppl. 2): 75s. Abstract 53.
- [14] Wicha M. Molecular targets in breast cancer stem cells. Program and abstracts of the 31st Annual San Antonio Breast Cancer Symposium (SABCS); December 10-14, 2008; San Antonio, Texas. Basic Science Panel Discussion.
- [15] Aktas B, Tewes M, Hauch S, et al. Stem cell and epithelial-mesenchymal transition markers on circulating tumor cells in patients with metastatic breast cancer. Cancer Res 2009; 69 (suppl. 2): 84s. Abstract 107.