Nukleární receptory: xenosenzory zprostředkující odpověď organismu na xenobiotika a příčina některých lékových interakcí
Pregnanový X receptor (PXR) a konstitutivní androstanový receptor (CAR) Nukleární receptory PXR a CAR regulují na základě interakce s xenobiotiky expresi enzymů I. a II. fáze biotransformace a některých detoxifikačních lékových transportérů. Ve většině případů se jedná o indukci exprese (up-regulaci) cílových genů, které se přímo podílejí na biotransformaci nebo exkreci xenobiotik. Tímto mechanismem mohou nukleární receptory výrazně modifikovat expozici organismu xenobiotiku, proto jsou často označovány jako xenosenzory. Je-li xenobiotikem léčivo – může být aktivace receptorů PXR nebo CAR příčinou farmakokinetických lékových interakcí, při kterých léčivo zvyšuje aktivitu biotransformačních enzymů nebo transportérů podílejících se na eliminaci jiného spolupodaného léčiva, a mění tak jeho farmakokinetické a případně i farmakodynamické vlastnosti. Je-li xenobiotikem toxická látka, pak nukleárními receptory zprostředkované urychlení eliminace představuje jeden ze základních homeostatických obranných mechanismů. Cílem tohoto přehledového článku je přiblížit nukleární receptory PXR a CAR jako důležité faktory farmakokinetických lékových interakcí.
Úvod
Indukční účinky léčiv i hormonální účinek endogenních steroidů jsou založeny na ovlivnění exprese cílových genů prostřednictvím aktivace tzv. nukleárních receptorů. Tento proces umožňuje transkripční regulaci konkrétních genů podle aktuálních potřeb organismu. V tomto ohledu jsou významné mimo jiné změny v expresi genů biotransformačních enzymů a transportních proteinů, které představují základní eliminační mechanismus bránící kumulaci některých endogenních látek nebo xenobiotik. Nejnovější literární údaje ukazují, že klíčovou roli v transkripční regulaci těchto detoxikačních procesů mají dva nukleární receptory – pregnanový X receptor a konstitutivní androstanový receptor.
Pregnanový X receptor (Pregnane X receptor, PXR, NR1I2, syn. steroid X receptor, SXR) a konstitutivní androstanový receptor (Constitutive androstane receptor, CAR, NR1I3) náleží do „ligandem aktivované" rodiny transkripčních faktorů a jsou označovány jako tzv. nukleární receptory. Společně s PXR a CAR do této rodiny náleží také receptor pro vitamin D (VDR), glukokortikoidní receptor (GRa), estrogenní receptor (ER) a řada dalších [1]. Receptory PXR a CAR se také někdy označují jako sirotčí (orphan) nukleární receptory, protože na rozdíl od dalších zástupců nukleárních receptorů nebyl dosud identifikován fyziologický ligand, který by primárně působil prostřednictvím PXR nebo CAR [1–4]. Rozvoj molekulárněbiologických metod umožnil identifikaci exogenních ligandů (viz dále), které v naprosté většině vedou k aktivaci transkripce a indukci biotransformačních enzymů a transportérů s následným urychlením eliminace xenobiotik. Proto jsou PXR a CAR někdy označovány jako xenosenzory. Zajímavým faktem svědčícím o tom, že PXR a CAR jsou primárně defenzivním mechanismem organismu regulujícím spíše dispozici xenobiotik, a nikoli účinek specifického endogenního ligandu nebo hormonu, je, že geneticky manipulované myši postrádající geny pro Pxr a Car jsou normálně životaschopné bez abnormalit [5].
Struktura nukleárních receptorů
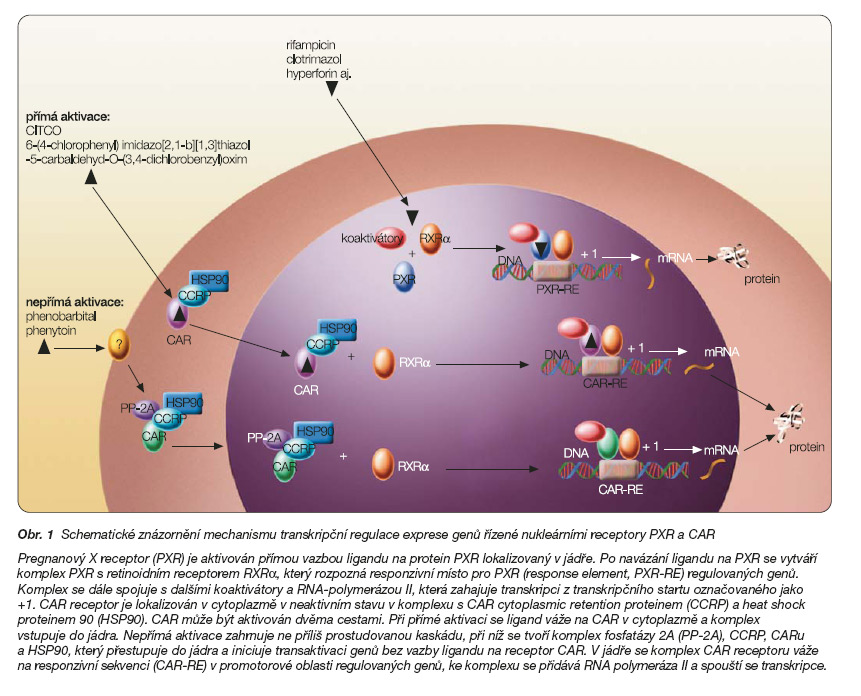
Protein nukleárního receptoru je složen ze čtyř částí: z modulátorové domény interagující s modulačními proteiny (koaktivátory), domény rozpoznávající specifické sekvence promotorové DNA (DBD – DNA binding domain), spojovací struktury a domény vázající ligand (LBD – ligand binding domain). DBD svojí specifitou k promotorové sekvenci konkrétních genů určuje škálu genů, které jsou regulovány. LBD tvoří jakousi kapsu, ve které ligandy nekovalentně interagují s aminokyselinovými skupinami LBD domény na základě jejich chemické sterické struktury [1, 4]. Mechanismus aktivace nukleárních receptorů PXR a CAR viz obr. 1. Tento proces je velmi komplikovaný, spoluúčastní se ho dále represorové proteiny, řada koaktivátorů i proteiny s enzymovou aktivitou ovlivňující chromatinovou strukturu DNA [1–4].
Pregnanový X receptor (PXR)
Přestože je PXR lokalizován především v jádře, byla popsána také cytoplazmatická lokalizace a translokace receptoru PXR z cytoplazmy do jádra během aktivace. V těle je PXR ve velké míře přítomen především v játrech, méně v tenkém a tlustém střevě, v žaludku a v ledvinách. Tato lokalizace významně koreluje s expresí cytochromu CYP3A4 i P-glykoproteinového transportéru (viz dále) [2, 4, 5]. Aktivace PXR probíhá přímou vazbou ligandu v jádře. PXR tvoří dimer s retinoidním receptorem RXRa a společně rozpoznávají specifické sekvence promotorové DNA regulovaných genů označované jako responzivní sekvence PXR-RE (PXR response element). V případě nejdůležitějšího biotransformačního cytochromu P-450 CYP3A4 byla identifikována dvě vazebná místa označovaná jako proximální a distální, která pro maximální indukční účinek spolupracují [7]. PXR-RE různých genů jsou charakteristické velkou sekvenční homologií, i když se v jednotlivých nukleotidech odlišují [2, 3].
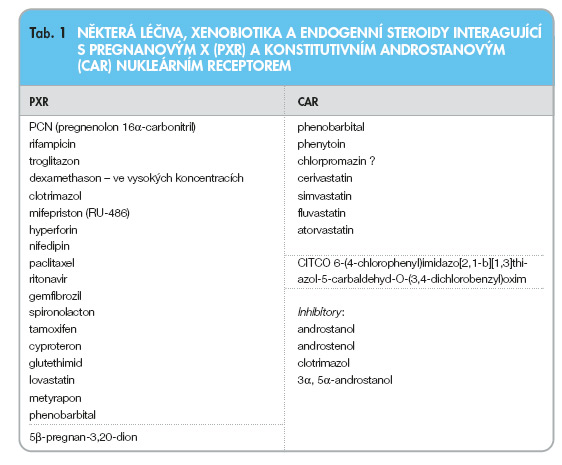
K ligandům PXR náleží farmaka z řady terapeutických skupin, některé toxiny i endogenní steroidy (tab. 1). Ligandy PXR mají velice různorodou chemickou strukturu a fyzikálně-chemické vlastnosti molekul (tab. 1). Tím se PXR odlišuje od ostatních nukleárních receptorů, např. estrogenního (ER), receptoru pro vitamin D (VDR) nebo receptoru pro hormony štítné žlázy (TR). Díky této široké specifitě ligandů i množství regulovaných biotransformačních enzymů a lékových transportérů je PXR receptor považován za jeden z nejdůležitějších faktorů ovlivňujících prostřednictvím eliminačních procesů farmakokinetiku mnoha léčiv [3]. Řada léčiv (např. phenobarbital) navíc aktivuje současně receptory PXR i CAR, což svědčí o určitém překryvu specifity ligandů/aktivátorů obou sirotčích receptorů [4]. Typickým jevem je i tzv. autoindukce, tzn. léčivo indukuje prostřednictvím PXR nebo CAR biotransformační enzymy nebo transportéry, pro které je samo substrátem, a tím urychlí svou vlastní eliminaci (např. carbamazepin). Funkce biotransformačních enzymů, lékových transportérů a xenosenzorů nukleárních receptorů tak společně tvoří plastický a důmyslný detoxikační systém lidského těla.
PXR společně s CAR regulují celou řadu genů pro enzymy I. a II. fáze biotransformace a transportérů (tab. 2). K nejdůležitějším patří hlavní izoforma cytochromu P-450 zapojená do metabolismu léčiv, CYP3A4, který se podílí na biotransformaci více než 50 % léčiv používaných v humánní medicíně. Nicméně v lidských játrech byla sledována až 90násobně rozdílná exprese této izoformy. Podobně byly zjištěny až 30násobné rozdíly v clearance modelových substrátů CYP3A4, což výrazným způsobem modifikuje expozici a celkovou farmakokinetiku léčiv [7].
Interindividuální variabilita metabolismu léčiv je všeobecně spojována s fenoménem genetického polymorfismu daného přítomností bodových mutací DNA (tzv. SNP, Single Nucleotide Polymorphism), které modifikují finální aktivitu enzymů. U CYP3A4 je však tato asociace nejasná a ukazuje se, že SNP v kódující nebo regulační oblasti genu CYP3A4 nejsou hlavní příčinou této variability [3]. Polymorfismus PXR, který přímo reguluje expresi CYP3A4, se proto nabízí jako nejpravděpodobnější vysvětlení těchto fenoménů. V promotorové i kódující oblasti genu PXR bylo identifikováno kolem 40 SNP, a to včetně sekvencí, které kódují ligand vázající doménu PXR [8]. Byly publikovány studie, které prokázaly souvislost mezi některými SNP a expresí CYP3A4 v játrech. Rovněž byly publikovány studie, ve kterých byla popsána silná korelace mezi expresí PXR a CYP3A4 [9]. Přesto se předpokládá, že exprese a genotyp PXR nejsou jedinými výhradními faktory interindividuální variability funkce CYP3A4 v populaci [3].
Konstitutivní androstanový receptor (CAR)
Konstitutivní androstanový receptor (Constitutive Androstane Receptor, CAR, NR1I3) je blízký příbuzný receptoru PXR. Na rozdíl od PXR je CAR intracelulárně přítomen v cytoplazmě, odkud se dostává do jádra tzv. translokací [1, 6]. Kromě genů pro enzymy I. a II. fáze biotransformace a transportérů léčiv (tab. 2) řídí CAR i transkripci důležitých genů podílejících se na metabolismu endogenních látek, jako jsou bilirubin, žlučové kyseliny, hormony štítné žlázy, steroidní hormony a mastné kyseliny [6].
Aktivace CAR probíhá dvěma způsoby: přímou aktivací nukleárního receptoru ligandem, tj. vazbou ligandu na nukleární receptor lokalizovaný v cytoplazmě, a následnou translokací komplexu nukleárního receptoru, ligandu a koaktivujících proteinů (HSP90 aj.) do jádra. Tímto způsobem aktivují transkripci modelové látky CITCO (6-(4-chlorophenyl) imidazo[2,1-b][1,3]thiazole-5-carbaldehyd-O-(3,4-dichlo-robenzyl)oxim) nebo v případě myšího Car receptoru karcinogen TCPOBOP (1,4-bis [2-(3,5-dichloropyridyloxy)]benzen). Phenobarbital a phenytoin, nejznámější induktory kooperující s receptorem CAR, aktivují transkripci regulovaných genů prostřednictvím tohoto nukleárního receptoru nepřímo bez vazby na nukleární receptor (obr. 1) [6]. Po translokaci komplexu CAR a koaktivátorů do jádra se komplex proteinů CAR a RXRa váže na CAR-RE responzivní sekvence v promotorové oblasti regulovaných genů. Transkripční aktivace pak probíhá podobně jako v případě receptoru PXR.
Kromě aktivace receptoru CAR xenobiotiky mohou tuto transaktivační kaskádu spustit i další mechanismy při některých fyziologických nebo patologických stavech. Například vysoké intracelulární koncentrace cAMP při hladovění indukují prostřednictvím CAR expresi genů, které se podílejí na odpovědi při nutričním stresu. Podobně je CAR nepřímo aktivován (obr. 1) bilirubinem při hyperbilirubinémii a spouští adaptační mechanismy, které aktivují biotransformační enzymy a transportéry zapojené do metabolismu bilirubinu a jeho konjugátů (např. GSTA1/A2, UGT1A1, MRP2 aj.) [6]. CAR a PXR společně chrání játra před toxickým působením kyseliny lithocholové (LCA) prostřednictvím indukce enzymů účastnících se metabolismu LCA. CAR například aktivuje SULT2A9 podílející se na sulfátové konjugaci LCA, myší cytochrom Cyp3A11 a Cyp7a1 a transportéry Mrp3 a Oatp2 [5, 6].
PXR a CAR jako prostředník závažných klinických lékových interakcí
Nukleární receptory PXR a CAR společně představují jeden z hlavních regulačních mechanismů určujících finální aktivitu základních enzymů a transportních proteinů zapojených do eliminace léčiv (tab. 2). V oblasti metabolismu to jsou především izoformy (enzymy) cytochromu P-450, CYP3A4, CYP2C9 a CYP2C19, které tvoří až 80 % obsahu P-450 v játrech a střevě a zprostředkují většinu reakcí I. fáze biotransformace léčiv [2–4]. Další izoforma cytochromu P-450, CYP2B6, je charakteristická svojí indukovatelností především prostřednictvím receptoru CAR [3, 6]. Z transportních proteinů se pozornost soustřeďuje na P-glykoprotein (P-gp, MDR1) a Multidrug resistance-associated protein 2 (MRP2), které transportují desítky farmakoterapeuticky důležitých léčiv, jejich metabolitů a konjugátů [11]. Ovlivnění PXR a CAR při současné aplikaci několika léčiv je proto významným mechanismem farmakokinetických lékových interakcí. To dokládá i skutečnost, že většina dosud klinicky popsaných lékových interakcí, při kterých dochází k indukci CYP3A4, je zprostředkována PXR nukleárním receptorem [2]. S ohledem na spektrum ligandů PXR a CAR a jejich používání v klinické praxi je vhodné zdůraznit příklady nejčastějších případů. Dobře dokumentované jsou především interakce antiepileptik phenobarbitalu, carbamazepinu a phenytoinu a antituberkulotika rifampicinu, které prostřednictvím PXR a CAR indukují izoformy cytochromu P-450 (např. CYP3A4, 2C9, 2C19, 2B6), což následně vede k urychlení eliminace jejich substrátů, poklesu plazmatických koncentrací a vážným klinickým interakcím [12]. Obzvláště závažné jsou klinické interakce phenobarbitalu, carbamazepinu a antituberkulotika rifampicinu s antikoagulanciem warfarinem. Indukce biotransformace warfarinu v těchto případech může vést až k fatálnímu snížení antikoagulační aktivity warfarinu [13].
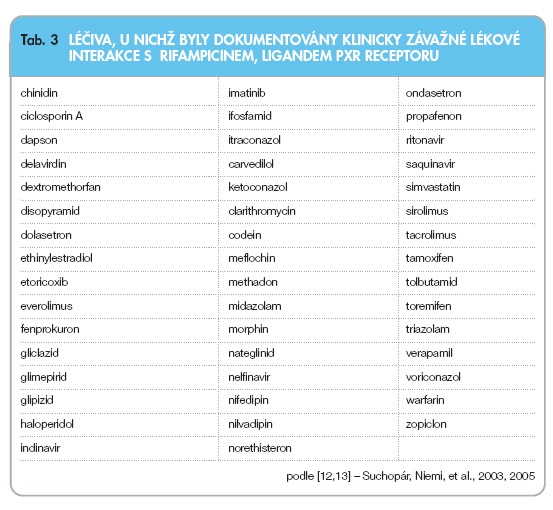
Rifampicin je jedním z nejsilnějších dosud známých ligandů PXR a induktorů biotransformačních enzymů CYP3A4, CYP2B6, CYP2C9 a transportérů P-glykoproteinu v játrech i ve střevě. Plný projev indukce biotransformačních enzymů a transportérů se během terapie rifampicinem projeví přibližně po 7 dnech. Podobně k regresi změn dochází po ukončení podávání přibližně za stejnou dobu. Klinicky významné interakce rifampicinu s léčivy prostřednictvím vazby na PXR a následné indukce enzymů a transportérů uvádí tab. 3 [13–15].
Známé jsou také klinicky významné interakce přírodního sedativa hyperforinu obsaženého v extraktu třezalky tečkované (Hypericum perforatum) s některými kontraceptivy, warfarinem, imunosupresivem ciclosporinem A, HIV proteázovým inhibitorem indinavirem a digoxinem [2]. Hyperforin má vysokou afinitu k receptoru PXR a v nízkých koncentracích významně indukuje jaterní i střevní CYP3A4 a CYP2C9, které primárně biotransformují výše zmíněná farmaka.
Závěr
Nukleární receptory řídí expresi enzymů I. a II. fáze biotransformace a detoxikačních lékových transportérů jako odpověď organismu na přítomnost xenobiotika. Po ukončení eliminace xenobiotika z organismu ustává aktivace nukleárních receptorů a následně i up-regulace cílových genů. Tento jednoduchý model je však mnohem komplikovanější a vstupují do něj další faktory. Exprese nukleárních receptorů PXR a CAR je sama regulována některými nukleárními receptory a transkripčními faktory. Příkladem jsou syntetické a endogenní glukokortikoidy, které indukují expresi PXR i CAR prostřednictvím glukokortikoidního receptoru GRa. Zvýšení exprese transportéru OATP2 prostřednictvím PXR může navíc urychlit vstup potenciálních induktorů do jádra. Naopak indukce efluxních lékových transportérů P-glykoproteinu a MRP2 prostřednictvím PXR může zamezit vstupu induktorů do buněk a snížit aktivaci nukleárních receptorů. Celý systém detoxikace a biotransformace xenobiotik tak nabývá na komplexnosti a porozumění tomuto systému a nalezení klinických implikací je úkolem moderní experimentální a klinické farmakologie.
Seznam použité literatury
- [1] Giguere V. Orphan nuclear receptors: from gene to function. Endocr Rev 1999; 20 (5): 689–725.
- [2] Kliewer S, Goodwin B, Willson TM. The nuclear Pregnance X receptor: a key regulator of xenobiotic metabolism. Endocrine Rev 2002; 23 (5): 687–702.
- [3] Wang H, LeCluyse EL. Role of orphan nuclear receptors in the regulation of drug-metabolising enzymes. Clin Pharmacokinet 2003; 42 (15): 1331–1357.
- [4] Willson TM, Kliewer SA. PXR, CAR and drug metabolism. Nature Rev 2002; 1: 259–266.
- [5] Zhang J, Huang W, Qatanani M, Evans RM, Moore DD. The constitutive androstane receptor and pregnane X receptor function coordinately to prevent bile acid-induced hepatotoxicity. J Biol Chem 2004; 279 (47): 49517–49522.
- [6] Goodwin B, Moore JT. CAR: detailing new models. Trends Pharmacol Sci 2004; 25(8): 437–441.
- [7] Schuetz EG. Lessons from the CYP3A4 Promoter. Mol Pharmacol 2004; 65 (2): 279–281.
- [8] Zhang J, Kuehl P, et al. The human pregnane X receptor: genomic structure and identification and functional characterization of natural allelic variants. Pharmacogenetics 2001; 11 (7): 555–572.
- [9] Pascussi JM, Drocourt L, Gerbal-Chaloin S, Fabre JM, Maurel P, Vilarem MJ. Dual effect of dexamethasone on CYP3A4 gene expression in human hepatocytes. Sequential role of glucocorticoid receptor and pregnane X receptor. Eur J Biochem 2001; 268: 6346–6357.
- [10] Mizuno N, Niwa T, Yotsumoto Y, Sugiyama Y. Impact of drug transporter studies on drug discovery and development. Pharmacol Rev 2003; 55 (3): 425–461.
- [11] Patsalos PN, Perucca E. Clinically important drug interactions in epilepsy: interactions between antiepileptic drugs and other drugs. Lancet Neurol 2003; 2 (8): 473–481.
- [12] Suchopár J, et al. Kompendium lékových interakcí – INFOPHARM 2005. InfoPharm Praha 2005.
- [13] Niemi M, Backman JT, Fromm MF, Neuvonen PJ, Kivisto KT. Pharmacokinetic interactions with rifampicin: clinical relevance. Clin Pharmacokinet 2003; 42 (9): 819–850.