Od imunosuprese k imunomodulaci v léčbě psoriázy
Přednášky profesora Jana Krejska jsou vždy velmi vítaným zpestřením každého odborného setkání. Nejinak tomu bylo i na symposiu spo-lečnosti Janssen-Cilag, které se konalo v rámci 22. národního dermatologického kongresu a neslo podtitul Od imunosuprese k imunomodulaci v léčbě psoriázy. Na tomto symposiu prof. RNDr. Jan Krejsek, CSc., (Ústav klinické imunologie a alergologie, FN a LF UK, Hradec Králové) prezentoval téma: Imunosuprese ve farmakoterapii, význam klíčových regulačních mechanismů.
Kožní mikrobiota se podílí na celkové imunitní reaktivitě každého člověka. Kůže je schopna se zapojit do mechanismů zánětu, a to jak obranného, tak poškozujícího. Zdravá kůže se všemi svými fyziologickými regulacemi nás ochraňuje. K tomu jí napomáhá fyziologická kožní mikrobiota. Za patofyziologických okolností je kůže poškozována faktory z vnějšího i z vnitřního prostředí, které vedou k vytvoření tzv. damage associated molecular patterns (DAMP, molekulární vzory asociované s poškozením), což je struktura, která signalizuje přítomnost patologického procesu v lidském těle, narušení homeostázy a nutnost reakce na tento stav.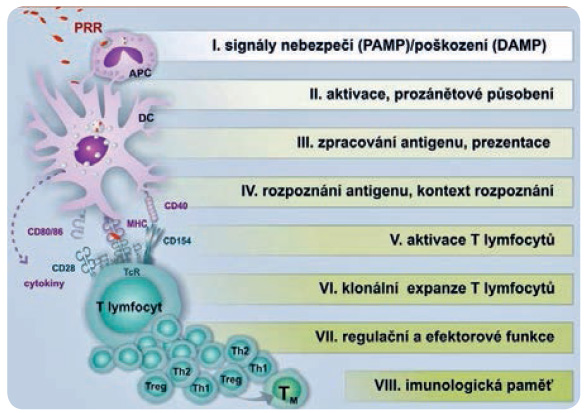
Patologická mikrobiota vytváří také své vlastní vzory – pathogen associated molecular patterns (PAMP, molekulární vzory asociované s patogenem). Jde o celou mozaiku faktorů patogenity, které poškozují buněčné struktury kůže. Přítomnost DAMP a PAMP spouští zánětlivou reakci (obr. 1).
Skupina antimikrobiálních peptidů je produkována kožními strukturami pod vlivem PAMP. Tyto antimikrobiální peptidy mají velmi zvláštní funkci – vytvářejí podmínky, aby mohly být zničeny patogenní mikroorganismy. Působí tedy jako jakási živočišná antibiotika a zároveň slouží jako signál patologického děje směrem k vlastnímu imunitnímu systému. K nejvýznamnějším antibakteriálním pept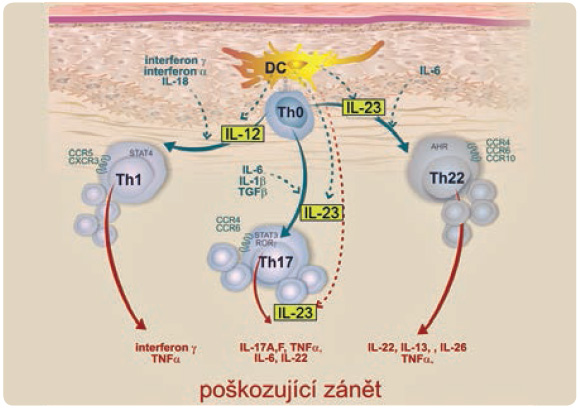 idům patří defensiny β (v epitelu), defensiny α (v neutrofilech), ribonukleáza 7, psoriasin S100A7. Můžeme je označit jako alarminy, na jejichž podnět dochází k aktivaci imunitního systému. Hlavní roli v počátečních fázích obranného i poškozujícího zánětu hrají netypické buňky, které jsou rozesety ve všech tkáních, tedy i v kůži. Jde o velmi heterogenní a rozsáhlou skupinu buněk. Patří k nim i myeloidní dendritické buňky CD11c+, které mají určité membránové receptory a které pomocí svých senzorových molekul detekují přítomnost alarminů, což aktivuje signalisom produkující transkripční faktory a kinázy. Při poruše v buňce vzniká složitým mechanismem tzv. inflamasom, z něhož se uvolňuje kaspáza‑1. V důsledku obou těchto dějů pak dochází ke zvýšení produkce TNFα (tumor necrosis factor α, tumor nekrotizující faktor alfa), iNOS (inducibilní syntáza oxidu dusnatého), IL (interleukin)‑20, IL‑23, IL‑1β, což jsou prozánětlivé cytokiny, které zprostředkovávají poškozující zánět.
idům patří defensiny β (v epitelu), defensiny α (v neutrofilech), ribonukleáza 7, psoriasin S100A7. Můžeme je označit jako alarminy, na jejichž podnět dochází k aktivaci imunitního systému. Hlavní roli v počátečních fázích obranného i poškozujícího zánětu hrají netypické buňky, které jsou rozesety ve všech tkáních, tedy i v kůži. Jde o velmi heterogenní a rozsáhlou skupinu buněk. Patří k nim i myeloidní dendritické buňky CD11c+, které mají určité membránové receptory a které pomocí svých senzorových molekul detekují přítomnost alarminů, což aktivuje signalisom produkující transkripční faktory a kinázy. Při poruše v buňce vzniká složitým mechanismem tzv. inflamasom, z něhož se uvolňuje kaspáza‑1. V důsledku obou těchto dějů pak dochází ke zvýšení produkce TNFα (tumor necrosis factor α, tumor nekrotizující faktor alfa), iNOS (inducibilní syntáza oxidu dusnatého), IL (interleukin)‑20, IL‑23, IL‑1β, což jsou prozánětlivé cytokiny, které zprostředkovávají poškozující zánět.
Z keratinocytů se uvolňuje celá skupina alarminů, například LL‑37 (lidský katelicidin 37), IL‑1α, IL‑33, defensiny, HMGB‑1 (high‑mobility group box 1, amfoterin), rodina S‑100s vápník vázajících proteinů a další látky, které stimulují vyzrávání dendritických buněk. Ty pak putují z místa vyzrávání do lymfatických uzlin, kde předkládají zpracované peptidy, které vznikly ze signálů DAMP a PAMP, Th0 lymfocytům (T helper cell, pomocný T-lymfocyt), které rozpoznají antigen, a dochází ke klonální expanzi a k dalšímu vyzrávání dalších populací T lymfocytů do imunoregulačních subsetů. Jde o velmi důmyslný komplexní regulační postup, v jehož každém kroku se rozhodne, zda dojde k reakci, či nikoli (obr. 2).
Podle současného konceptu vzniku chronického zánětu u psoriázy jsou součástí patologického mechanismu určité změny dendritických buněk. Na popud DAMP a PAMP předkládají dendritické buňky antigenní fragmenty navázané na molekuly HLA v populaci Th0 lymfocytů. V prostředí membránových interakcí a mnoha cytokinů se Th0 vydává různými směry vývoje. Pod vlivy IFN (interferon) γ, IFNα a především IL‑12, ale i IL‑18 (například z NK buněk nebo z makrofágů) d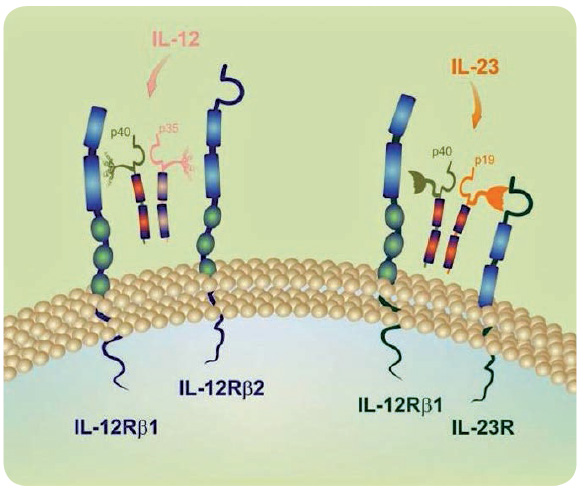 ochází k vzniku populace Th1, která migruje a dále produkuje IFNγ, IFNα; IL‑23 za pomoci IL‑6 podporuje vývoj Th22, a tím pádem produkci IL‑22, IL‑13, IL‑26 a TNFα.
ochází k vzniku populace Th1, která migruje a dále produkuje IFNγ, IFNα; IL‑23 za pomoci IL‑6 podporuje vývoj Th22, a tím pádem produkci IL‑22, IL‑13, IL‑26 a TNFα.
V posledních letech se ukazuje, že na rozvoji mnoha autoimunitních onemocnění, jako jsou roztroušená skleróza, idiopatické střevní záněty, ale i psoriáza a další choroby, se ve velké míře podílejí Th17, za jejichž vyzrávání mohou IL‑6, IL‑1β, TGFβ (transforming growth factor β, transformující růstový faktor beta) za spolupůsobení dendritického IL‑23. Th17 produk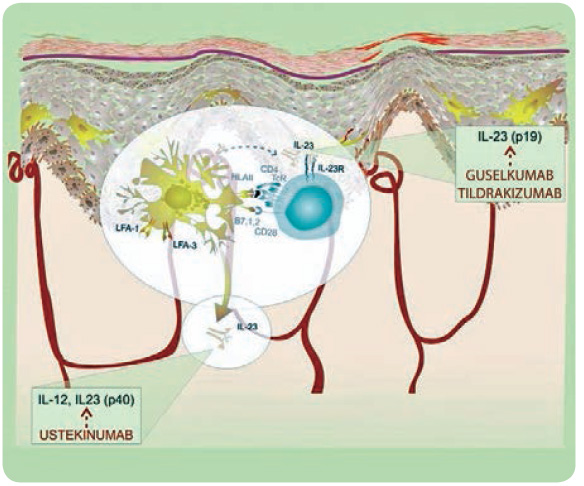 ují IL‑17A a F, TNFα, IL‑6 a IL‑22. Pro plnou funkci Th17 je zapotřebí přítomnost IL‑23, aby byly produkovány výše uvedené prozánětlivé cytokiny.
ují IL‑17A a F, TNFα, IL‑6 a IL‑22. Pro plnou funkci Th17 je zapotřebí přítomnost IL‑23, aby byly produkovány výše uvedené prozánětlivé cytokiny.
Ve všech fázích a složkách poškozujícího zánětu figuruje TNFα, ale jeho přítomnost v koncových fázích je klíčová. Tento fakt je znám již dlouho a na principu blokády TNFα byly založeny první přípravky biologické léčby chronických autoimunitn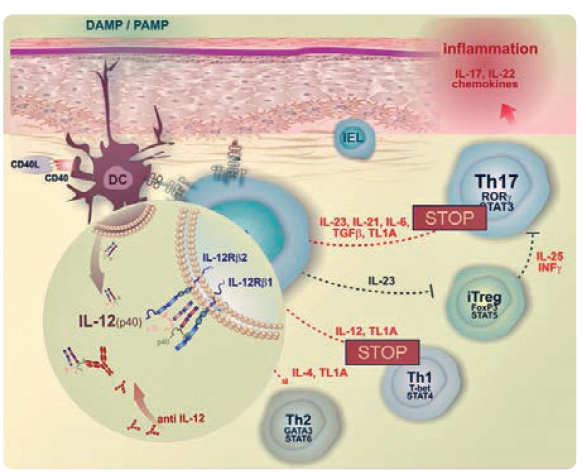 ích zánětů. Fúzní receptor TNFα a monoklonální protilátky proti TNFα ovlivňují děj v keratinocytech i v dendritických buňkách, a především blokují TNFα.
ích zánětů. Fúzní receptor TNFα a monoklonální protilátky proti TNFα ovlivňují děj v keratinocytech i v dendritických buňkách, a především blokují TNFα.
Zaměřme se na osu vývoje Th lymfocytů, do níž jsou zapojeny interleukiny 12 a především 23. Tyto dva interleukiny a jejich receptory sdílejí jednu podjednotku, ve druhé se liší. Na sdílenou podjednotku IL‑12 a IL‑23 cílí monoklonální protilátka ustekinumab (IL‑23 lze ovlivnit i tildrakizumabem) (obr. 3, 4).
Závěrem profesor Krejsek shrnul, že pod vlivem DAMP a PAMP ovlivňují dendritické buňky diferenciaci Th0. Důležitá je membránová interakce, ale IL‑23 může spustit proliferaci subsetu Th17 a Th1, které se podle současného konceptu podílejí na rozvoji psoriázy. Zároveň může IL‑23 blokovat rozvoj inducibilních regulačních T lymfocytů, které poškozující zánět omezují. Na druhou stranu Th17 potřebujeme, protože je součástí antimikrobiální ochrany organismu. Proto je nutné podpořit imunomodulační děje, které regulují imunitní pochody, a omezit celkovou imunosupresi, jež může vést k těžkým infekcím. Ubereme‑li na intenzitě IL‑23, omezíme diferenciaci směrem k Th17 a současně podpoříme vznik inducibilních Treg (obr. 5).
Obrázky v článku byly převzaty z prezentace přednášejícího.