Opioidní analgetika v léčbě chronické bolesti
Silné opioidy jsou v současné době nedílnou součástí základní strategie léčby středně silné až velmi silné bolesti. Jejich výhodou je absence orgánové toxicity, nevýhodou výskyt nežádoucích účinků spojených především se zahajováním léčby nebo se změnou dávky. Méně významným rizikem je vznik závislosti. Palčivou otázku užívání opioidů a řízení motorového vozidla vyřešila koncem letošního roku Společnost pro studium a léčbu bolesti vydáním doporučení. K jednoduchému screeningu se doporučuje reakční test CompACT-SR Hogrefe TestSystem.
Opioidy patří k nejstarším lékům používaným v léčbě bolesti. Nejstarší písemné památky svědčící o výrobě těchto léků pocházejí z Mezopotámie z období 8000 až 5000 roků před naším letopočtem. Tímto prvním lékem byla maková šťáva, kterou dále rozšířili nomádští obchodníci ze Sýrie. Znalosti účinku opia měli i Řekové, kteří rozlišovali mezi vytlačovanou šťávou z makovic zvanou meconium a mléčnou šťávou zvanou opos (odtud název opium). Osobní lékař císaře Nerona vymyslel lék theriak, jehož základní složkou bylo právě opium. Lék se používal na širokou škálu obtíží – od léčby nespavosti přes menstruační obtíže až k léčbě silné bolesti. Názory na používání opia se již v této době různily. Někteří, jako např. Hippokrates, je vychvalovali, jiní již začali upozorňovat na některé nebezpečné vlastnosti.
Do Evropy se opium dostává v období renesance. Na rozvoji jeho použití se významně podílel švýcarský lékař pracující v oblasti farmakologie Paracelsus, který vynalezl opiovou tinkturu. V 18. a 19. století je opium dodáváno lékárníkům a lékařům jako lék proti bolesti a sedativum. Od 16. století je však opium stále častěji zneužíváno jako droga.
K významnému objevu dochází v roce 1805, kdy německý lékárník Sertürner izoloval z opia bílý prášek, který nazval po bohu spánku Morfeovi – morfin. Zajisté netušil, že objevil lék, který se na jedné straně bude používat několik set roků k léčbě kruté bolesti a na druhé straně odstartuje „morfinovou mánii“. Ta se rozšířila především ve vyšších anglických kruzích, kdy si společenská smetánka dokonce nechávala vyrábět šperky se skrytými schránkami pro morfinový prášek tak, aby měli neustále svoji drogu po ruce. Snahy o léčbu stále vzrůstajícího počtu závislých na morfinu vedly k objevení diacetylmorfinu, později nazvaného heroin. Dnes již víme, jak mylná byla původní představa o vytvoření silného léku pomáhajícího závislým na morfinu. Firma Bayer dokonce v letech 1898 až 1925 vyráběla a distribuovala heroin jako lék na uklidnění.
První zařazení opioidů do strategie léčby bolesti přichází v roce 1986, kdy byl poprvé publikován třístupňový žebříček léčby bolesti WHO, viz obr. 1 [1]. Pro svoji jednoduchost a schematičnost byl posléze přejat i pro léčbu bolesti neonkologické. Dle žebříčku začíná léčba bolesti podáváním neopioidních analgetik (metamizol, paracetamol, nesteroidní antiflogistika), při nedostatečném efektu se přidává slabý opioid (kodein, tramadol), který je ve III. stupni terapie vystřídán opioidem silným (morfin, fentanyl, buprenorfin, hydromorfon a další). Toto pravidlo však není zcela striktní, v něk![Obr. 1 Žebříček léčby bolesti WHO; podle [1] – World Health Organisation, 1996.](https://www.remedia.cz/photo-a-29117---.jpg) terých případech lze přeskočit II. stupeň terapie a k neopioidnímu analgetiku přidat rovnou malou dávku opioidu silného (systém „výtah“). Jedná se především o onkologické pacienty, kde předpokládáme rychlejší navyšování dávky analgetik [2].
terých případech lze přeskočit II. stupeň terapie a k neopioidnímu analgetiku přidat rovnou malou dávku opioidu silného (systém „výtah“). Jedná se především o onkologické pacienty, kde předpokládáme rychlejší navyšování dávky analgetik [2].
Opioidy
Podle síly analgetického účinku se opioidy dělí na: slabé opioidy (dihydrokodein, kodein, tramadol) a na silné opioidy (morfin, piritramid, buprenorfin, fentanyl, oxykodon, hydromorfon a další). Slabé opioidy vykazují na rozdíl od silných tzv. stropový efekt, tedy maximální účinnou dávku. Tyto léky je možno předepisovat na běžný recept (bez modrého pruhu).
Slabé opioidy
Kodein je slabý μ-agonista. V organismu je biotransformován na morfin. Často je používán v kombinaci s paracetamolem. Jednotlivá dávka kodeinu bývá 60 mg, maximální doporučovaná denní dávka je 240 mg.
Dihydrokodein je semisyntetický analog kodeinu. K dispozici je retardovaný dihydrokodein, který lze podávat v dávkách 60–120 mg po dvanácti, případně i po osmi hodinách. Maximální racionální dávka je 240 mg denně.
Tramadol vykazuje duální efekt – jednak působí jako slabý μ-agonista, jednak ovlivňuje zpětné vychytávání serotoninu v CNS. Na trhu je přítomen v řadě aplikačních forem. Od injekční přes čípkovou až po tablety s bifázickým efektem a účinností 24 hodin. Maximální denní dávka tramadolu je 400 mg, obvyklá jednotlivá dávka tramadolu s rychlým nástupem je 50–100 mg (1–2 cps, 20–40 kapek).
Kombinace slabých opioidů s neopioidními analgetiky vzájemně zvyšuje jejich účinek s následnou možností snížit dávky. S tím souvisí omezení vedlejších účinků závislých na dávce. Toho využívají některé na trhu dostupné kombinované léky (kodein + paracetamol, tramadol + paracetamol).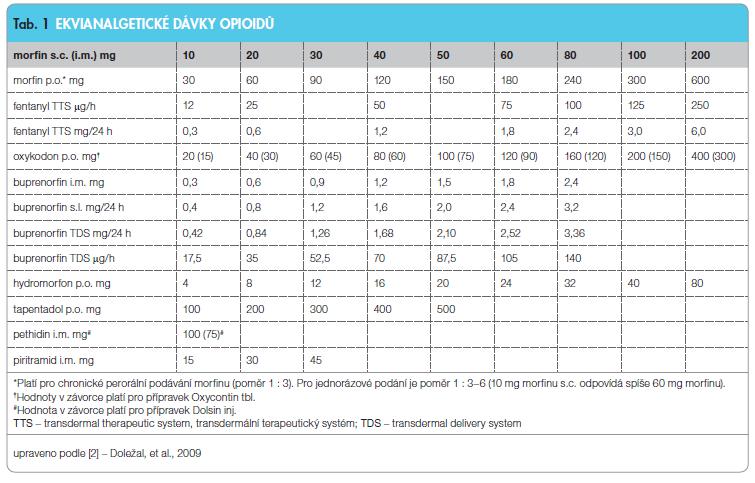
Silné opioidy
Silné opioidy jsou zpravidla agonisty na μ-receptorech. Jsou určeny pro silné a neztišitelné bolesti, které nelze dostatečně zmírnit neopioidními analgetiky nebo slabými opioidy. Maximální denní dávky silných opioidů nejsou určeny a nejsou limitovány farmakologickým stropovým efektem. V klinické praxi však pozorujeme, že další navyšování dávek opioidů podávaných ve velmi vysokých dávkách není doprovázeno adekvátním zvýšením analgetického účinku. Postup určují pravidla pro léčbu opioidy u chronické nenádorové bolesti [2]. V České republice jsou v současné době k dispozici dále uvedené opioidy.
Morfin je klasickým standardem v léčbě silné bolesti. Injekční forma je vhodná pro léčbu silné akutní bolesti. Perorální formy s postupným uvolňováním (SR – sustained release) působící 12 hodin nebo až 24 hodin jsou určeny pro tlumení chronické bolesti. Pro léčbu průlomové bolesti je vhodný morfin s bezprostředním uvolňováním (immediate release – IR forma).
Fentanyl v transdermálním terapeutickém systému (TTS) je rovněž vhodný pro léčbu silné chronické bolesti. Transdermální aplikace prostřednictvím postupného uvolňování z matrix náplasti zajišťuje stabilní plazmatickou hladinu po dobu 3 dnů. Ve srovnání s jinými opioidy byl u fentanylu v této lékové formě zaznamenán nižší výskyt obstipace. Ekvianalgeticky je fentanyl 100krát silnější než morfin. Od roku 2011 jsou k dispozici také transmukózní (sublinguální, bukální, nazální) lékové formy fentanylu s rychle nastupujícím účinkem určené pro léčbu průlomové nádorové bolesti.
Hydromorfon je efektivní μ-agonista, lze jej uplatnit obecně v rámci rotace opioidů. K dispozici je jak v retardované dvanáctihodinové formě, tak i ve formě s účinkem trvajícím 24 hodin. Ekvianalgeticky je hydromorfon 5–7krát silnější než morfin. Výhodou je jeho nízká vazba na plazmatické bílkoviny a biotransformace, která probíhá jinou cestou než přes cytochrom P450. Hydromorfon je díky svým vlastnostem vhodný pro pacienty s četnější komedikací, kde snižuje riziko vzájemné kompetice o vazbu na plazmatické bílkoviny nebo o metabolickou cestu.
Oxykodon je další silný opioid určený pro léčbu silné chronické a v některých případech i akutní bolesti. Pravděpodobně díky agonismu na receptorech μ i κ je vhodným opioidem pro léčbu neuropatické bolesti. Velmi dobrý analgetický účinek je bohužel často doprovázen zácpou. V současné době je v ČR již registrován lék obsahující oxykodon a naloxon, který již obstipaci neindukuje. Ekvianalgeticky je oxykodon 2krát silnější než morfin.
Buprenorfin je z farmakologického hlediska parciální agonista na μ-receptorech a antagonista na κ-receptorech. Přesto je řazen do skupiny silných opioidů, neboť vyšší dávky jsou ekvianalgetické jiným silným opioidům. Trvání účinku je 6–8 hodin (injekční a sublinguální forma). Délka účinku transdermální formy (systém TDS) je 3,5 dne, což je interval doporučovaný pro výměnu – nalepení – další náplasti. Tento opioid lze užít i v rámci rotace silných opioidů. V těchto dnech se dostává do lékáren transdermální buprenorfin od nového výrobce, jeho náplasti mají poloviční velikost a matrixový systém uvolňování
Tapentadol je novou účinnou látkou ve skupině silných opioidů. Obdobně jako tramadol vykazuje duální efekt účinku, chová se jako agonista na μ-opioidních receptorech, zároveň inhibuje zpětné vychytávání noradrenalinu v centrálním nervovém systému. Pravděpodobně tento princip působení odpovídá za jeho velmi dobrou účinnost u neuropatické bolesti. Tapentadol vyniká nízkým výskytem nežádoucích účinků. V současné době je tapentadol v České republice dostupný v retardované formě v silách od 50 mg do 250 mg. V zahraničí je distribuován i v IR (rychle účinné) formě.
Zahájení opioidní léčby
Opioidní analgetika jsou indikována u pacientů trpících silnou až velmi silnou onkologickou nebo neonkologickou bolestí nereagující na jinou analgetickou léčbu. Z nemaligních příčin bolesti se opioidy nejčastěji používají u chronických bolestí zad a kloubů, méně častěji u neuropatické bolesti (zde je vhodné volit některý ze silných opioidů s prokázanou afinitou k neuropatické bolesti – oxykodon, tapentadol). Jednoznačně nevhodnou bolestí pro léčbu silným opioidem je bolest psychogenní.
Opioidní léčbu u chronické bolesti titrujeme od nejnižších dávek, např. rychle se uvolňující morfin (IR tbl. či morfin připravovaný magistraliter) 5 mg po 6–12 hod., morfin SR 10 mg po 12 hod., fentanyl TTS 25 μg/h, buprenorfin TDS 35 μg/h tak, abychom zachytili nežádoucí účinky léčby (nauzea, zvracení, sedace, deprese kognitivních funkcí, útlum dechu z předávkování) a mohli jim předejít podáním pomocných léků (metoklopramid apod). Jsou-li přítomny anamnestické známky intolerance opioidů (nevolnost, zvracení), je vhodné antiemetické zajištění od počátku léčby, např. metoklopramid 3 × 1 tbl. či thiethylperazin 2 × 1 tbl. nebo čípek. Hledání účinné dávky opioidu může trvat i několik týdnů. I při přechodu z relativně vysokých dávek slabých opioidů (dihydrokodein, tramadol) začínáme léčbu zásadně podáním nejnižší možné dávky silného opioidu. Neuvážlivé zahájení léčby neadekvátně vysokou dávkou je pro pacienta nebezpečné a může diskreditovat cílový analgetický efekt opioidu. Všechny silné opioidy jsou vhodné pro léčbu nociceptivní bolesti, prokázaný analgetický efekt v případě neuropatické bolesti mají oxykodon a tapentadol. Koanalgetiky v případě neuropatické bolesti jsou antikonvulziva a antidepresiva.
Udržování opioidní léčby
Neexistuje maximální dávka opioidu. Optimální denní dávka je taková, při které je dosaženo uspokojivé analgezie při minimu vedlejších účinků opioidů (terapeutická odezva na opioidy – opioid responsiveness). I zdánlivě malý pokles v intenzitě bolesti může být pro pacienta s chronickou bolestí přínosný a může vést ke zvýšení denních aktivit, funkčních schopností a kvality života. Ztrácí-li léčba na účinnosti nebo se dominantními stávají vedlejší účinky, je doporučována tzv. rotace opioidů, kdy jeden opioid je nahrazen jiným. V této situaci je vhodné dávku nového opioidu zpočátku redukovat o 30 % až 50 % bez ohledu na tabulku ekvianalgetických dávek [3].
Záchranná analgetická léčba
Záchranná analgetická medikace by měla být paušálně předepisována všem onkologickým pacientům s chronickou bolestí a často je velmi vhodná i u pacientů neonkologických. Pacienti jsou vedle dlouhodobě působících opioidů vybaveni i lékem pro příležitostné užití při krátkodobém zhoršení bolestí. Tímto lékem může být rychle působící silný nebo slabý opioid (tramadol gtt, morfin IR), případně i neopioidní analgetika (nesteroidní antiflogistika, paracetamol). Je-li indikován jako „záchranné“ analgetikum silný opioid, velikost jednotlivé dávky by měla odpovídat 10–15 % celkové denní dávky základního opioidu. V současné době jsou ze skupiny silných opioidů dostupné především IR morfin (Sevredol, magistraliter připravovaný morfinový sirup), nově pro pacienty s onkologickou bolestí i transmukózní fentanyly (intranazální, transbukální, sublinguální). Nastavení optimální jednotlivé dávky se provádí titračním způsobem. Podává se nejnižší dostupná dávka, při nedostatečném efektu se tato dávka zdvojí, při další atace se již používá tato silnější dávka. Racionální je použití maximálně 4krát denně, při častější frekvenci záchvatů průlomové bolesti je vhodnější navýšení základní dávky retardovaného opioidu. Bohužel preskripční omezení IR fentanylů limituje jejich použití pouze pro algeziology.
Závislost při léčbě opioidy
Nejčastější obavou při užívání silné opioidní medikace je obava ze vzniku závislosti. Zde si je třeba uvědomit, že existuje několik druhů závislosti: fyzická, psychická, terapeutická závislost a pseudozávislost.
Fyzická závislost vzniká při pravidelném užívání opioidů. Její intenzita je velmi individuální, vždy je však zapotřebí s ní počítat. Projevuje se syndromem z odnětí neboli abstinenčním syndromem při náhlém vysazení nebo přílišné redukci dávky opioidu. Při dodržování léčebného režimu však fyzická závislost netvoří významnější problém, pouze při vysazování opioidu je třeba dbát na postupné snižování jeho dávky (obdobně jako při zahájení opioidní léčby). Tímto způsobem lze ukončit opioidní léčbu bez větších komplikací.
Pseudozávislost je abnormální chování jedince v důsledku trvání bolesti při nedostatečné dávce opioidů. Mylně bývá považováno za psychickou závislost. Po navýšení dávky opioidu, jehož podávání pak vede k výraznější úlevě od bolesti, dochází k úpravě chování pacienta.
Terapeutická závislost se vyskytuje u pacientů, kteří v minulosti trpěli silnou bolestí, a proto úzkostlivě lpějí na nynější účinné léčebné strategii. V tomto případě pomůže pohovor s pacientem, který vede k emočnímu zklidnění a nabytí důvěry v lékaře.
Výskyt psychické závislosti při dodržování léčebných doporučení a pravidelném sledování lékařem je spíše ojedinělý. Psychická závislost na léku je charakterizována silnou touhou získat lék (bažení – craving), obtížemi s kontrolou jeho užívání, upřednostňováním užívání látky před jinými aktivitami. Pro rozvoj závislosti nestačí „pouze“ užívat danou drogu, podílí se na ní součinnost čtyř faktorů [4]:
- farmakologické vlastnosti návykové látky,
- jedinec (genetické, psychosomatické faktory),
- faktory prostředí (nápodoba, norma rodiny),
- faktory podnětové (bolest, stres).
Publikovaná data se v jednotlivých pracích natolik různí, že jejich výpovědní hodnota je minimální. V případě onkologické bolesti je udávána prevalence výskytu závislosti na opioidní medikaci 0–7,7 %, v případě neonkologické bolesti od 0 % do 50 % v závislosti na subpopulaci a zvolených kritériích [5].
Při pravidelném sledování bývají pacienti se sklonem k psychické závislosti většinou brzy odhaleni.
Řízení motorových vozidel
Další zajímavou otázkou spojenou s chronickým užíváním opioidní medikace je schopnost řídit motorové vozidlo.
Uvedené problematiky se týkají tyto zákony a vyhlášky:
Zákon č. 361/2000 Sb., o provozu na pozemních komunikacích a o změnách některých zákonů (zákon o silničním provozu), ve znění pozdějších předpisů, § 89a:
Lékař, který zjistí, že žadatel o řidičské oprávnění nebo držitel řidičského oprávnění je zdravotně způsobilý k řízení motorových vozidel s podmínkou nebo není zdravotně způsobilý k řízení motorových vozidel, je povinen o této skutečnosti neprodleně informovat obecní úřad obce s rozšířenou působností příslušný podle obvyklého bydliště nebo místa studia žadatele o řidičské oprávnění nebo držitele řidičského oprávnění.
Vyhláška MZ ČR č. 277/2004 Sb., o stanovení zdravotní způsobilosti k řízení motorových vozidel v platném znění, příloha 3:
1. Zdravotní způsobilost k řízení motorových vozidel je vyloučena u žadatele nebo řidiče, který
... pravidelně užívá psychoaktivní látky nebo léčiva, jejichž účinek nebo jejich kombinace může snížit schopnost bezpečně řídit motorové vozidlo, a to v takovém množství, které má negativní vliv na jejich řízení.
Na základě této vyhlášky není nutno paušálně zakazovat řídit motorové vozidlo pacientům, kteří užívají psychoaktivní léčiva, jestliže neprokážeme jejich sníženou či znemožněnou schopnost řídit motorové vozidlo.
Aby nebylo nutné všem pacientům s chronicky užívanou opioidní medikací paušálně odebírat řidičské průkazy, vypracovala Společnost pro studium a léčbu bolesti po konzultaci s dopravními psychology a právníky doporučení k provedení krátkého screeningového testu. Po poučení pacient podstoupí jeden ze dvou testů na reakční čas (reakční test CompACT-SR Hogrefe TestSystem). Toto testování je prováděno na počítači, délka trvání nepřesahuje 10 minut. Testy jsou k dispozici na www.testcentrum.cz. Testováni by měli být pouze pacienti léčení stabilními dávkami opioidů, pacienti v době nastavování medikace by měli být poučeni o dočasném zákazu řízení. Pacienti s výsledkem testu v normě nemusí být ohlašováni jako nezpůsobilí pro řízení motorového vozidla, u pacientů s výsledkem mimo povolené rozhraní se doporučuje následné speciální dopravněpsychologické vyšetření (prováděné certifikovaným psychologem) [6].
Závěr
Opioidy jsou v léčbě silné a velmi silné bolesti nenahraditelnými analgetiky. Jejich hlavní výhodou je především velmi dobrý analgetický účinek a absence orgánové toxicity. Tyto vlastnosti umožňují dlouhodobé podávání bez rizika poškození organismu. Nevýhodou je přítomnost nežádoucích účinků spojených především se zahájením léčby nebo se změnou dávky opioidu. Většina nežádoucích účinků v průběhu léčby mizí, trvale zůstává pouze zácpa.
Seznam použité literatury
- [1] World Health Organisation. Cancer Pain Relief: guide to opioid availability, 2nd ed. WHO press; 1996.
- [2] Doležal T, Hakl M, Kozák J, et al. Metodické pokyny pro farmakoterapii bolesti. Bolest 2009; 2: 3–36.
- [3] Kozák J. Nové názory na dlouhodobou léčbu opioidy. Neurol prax 2008; 9: 42–46.
- [4] Neudertová H. Závislost na opioidech. In: Hakl M, et al. Léčba bolesti. Praha: Mladá fronta, 2011: 66–71.
- [5] Højsted J, Sjøgren P. Addiction to opioids in chronic pain patients: a literature review. Eur J Pain 2007; 11: 490–518.
- [6] Hřib R, Neudertová H, Hakl L, et al. Doporučený postup při podezření na změnu schopnosti řídit motorové vozidlo vlivem medikace. Bolest 2012; 4: 174–176.