Osteoporóza: léčebně-preventivní opatření
Osteoporóza a osteoporotické zlomeniny jsou zásadním problémem zdravotní péče. Vzhledem k charakteru onemocnění je nefarmakologická léčba předpokladem úspěšnosti všech ostatních terapeutických snah. Léčebná režimová opatření se kryjí s opatřeními preventivními nebo jsou jim podobná, protože mají stejný cíl – snížit riziko zlomeniny. Svoji nezastupitelnou roli v oblasti prevence osteoporózy hraje dostatečná a vhodná pohybová aktivita, vyvážená strava s dostatkem vápníku i vitaminu D a nekouření. Součástí komplexního modelu péče o nemocné s osteoporózou by měla být i prevence pádů či mírnění jejich vlivu na kost (protektory kyčle). Prevence pádů zahrnuje zejména úpravu prostředí, zlepšení koordinace pohybu a svalové činnosti a v neposlední řadě celkové zhodnocení, popř. úpravu medikace. Důležitá je rovněž léčba přidružených chorob, které mohou vést k úbytku kostní hmoty, a snaha o odstranění všech ovlivnitelných rizikových faktorů.
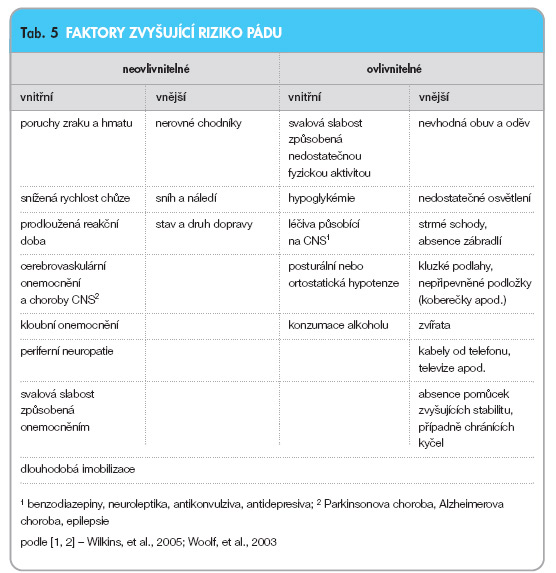
Rizikové faktory pro vznik osteoporózy a osteoporotické fraktury
Osteoporóza je chronické metabolické onemocnění charakterizované sníženým množstvím a kvalitou kostní hmoty a v důsledku toho zvýšeným rizikem zlomenin. Všechny faktory, které přispívají k těmto jevům, jsou proto rizikovými faktory osteoporózy. Rozlišujeme osteoporózu primární (postmenopauzální, involuční) a sekundární – způsobenou jiným onemocněním (endokrinopatie, mnohočetný myelom, chronická gastrointestinální onemocnění, nádorové metastázy do kostí, onemocnění pojiva, neurologická a psychiatrická onemocnění a další), stavem (dlouhodobá imobilizace, stav po transplantaci orgánů) či podáváním některých léčiv (kortikoidy). Nejvýznamnější a nejčastější rizikové faktory osteoporózy jsou uvedeny v tab. 1, která je dělí na ovlivnitelné a neovlivnitelné. Všechny ovlivnitelné faktory je možné minimalizovat nebo úplně odstranit a výrazně tak snížit riziko rozvoje osteoporózy.
Mezi faktory zvyšující riziko osteoporotické zlomeniny patří, kromě výše uvedených, ještě osteoporotická fraktura v osobní anamnéze a všechny faktory zvyšující riziko pádu (podrobněji uvedeny v části věnující se problematice pádů v tab. 5).
Snazší odhad rizika vzniku osteoporotické zlomeniny umožňují znaky ohlašující její zvýšené riziko (viz tab. 2). Pokud se některý z těchto znaků objeví u postmenopauzální pacientky, musíme u ní počítat se zvýšeným rizikem osteoporotické fraktury.
Prevence a základní léčba osteoporózy
Primární prevence
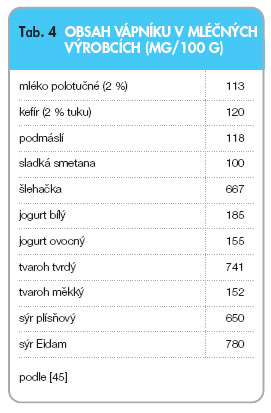
Prevence začíná už v dětství – během růstu kosti, který probíhá do uzavření epifizálních štěrbin ke konci puberty a až do třetí dekády života pokračuje jako zpevňování a mohutnění kosti. Dětství je důležité i z dalšího hlediska – v tomto období dochází k získávání návyků, které ovlivňují budoucí životní styl. V těchto obdobích je cílem prevence dosáhnout maximálního množství kvalitní kostní hmoty, a to zejména přiměřenou fyzickou aktivitou, dostatečným přísunem vápníku (tab. 3), vitaminů, bílkovin a vyloučením kouření. Po celý zbytek života se získanou kostní hmotu pokoušíme udržet.
Sekundární prevence
Sekundárně-preventivní i léčebná režimová opatření jsou si velmi podobná, protože mají stejný cíl – předcházet osteoporotické fraktuře. Hlavním nástrojem je udržení (popř. zvýšení) množství kostní hmoty, jejíž zrychlený úbytek nastává u žen po menopauze, a prevence pádů. Zásadním opatřením je úprava životního stylu, která je v případě potřeby doplněna farmakoterapií. Jedná se o farmakoterapii antiresorpčními nebo osteoanabolickými léčivy, vedenou odborným lékařem, která není předmětem tohoto sdělení.
V případě prevence a léčby sekundární osteoporózy je třeba odstranit příčinu úbytku (zhoršení kvality) kostní hmoty. Hlavní snahou je tedy léčba vyvolávajícího onemocnění, popř. úprava (dávkování) vyvolávající farmakoterapie.
Vliv výživy
Otázka výživy je v prevenci a léčbě osteoporózy klíčová. V současné době je nejvíce pozornosti věnováno vlivu vápníku a vitaminu D na stav skeletu a riziko fraktur. Vápník a vitamin D představují v odpovídajících dávkách medikaci 1. linie v prevenci a léčbě osteoporózy. Tato léčba se ukázala jako farmakologicky aktivní (zejména u pacientů s deficiencí vápníku a vitaminu D), bezpečná a účinná (i tzv. nákladově efektivní) v prevenci osteoporotických zlomenin [5]. Problematika prevence osteoporózy prostřednictvím dietních zvyklostí je však komplexní a zahrnuje přísun mnoha živin i jiných složek potravy a jejich vzájemné interakce včetně ovlivnění genetickými faktory [6].
Nedávno publikovaná studie [7] hodnotící účinnost suplementace vápníkem a vitaminem D zahrnula 36 282 postmenopauzálních žen ve věkovém rozmezí 50–79 let již zapsaných ve studii WHI (hodnotící rizika a prospěšnost podávání hormonální substituční terapie). Účastnice byly randomizovány k podávání kombinace vápníku (1000 mg denně) a vitaminu D3 (400 IU denně) nebo placeba. Výskyt fraktur byl hodnocen v průměru za 7 let od začátku sledování. Kostní denzita v oblasti krčku se u aktivně léčených žen zvýšila mírně (o 1,06 %), ale signifikantně (p < 0,01) ve srovnání s ženami, které užívaly placebo. Výskyt fraktur krčku (hazard ratio HR = 0,88; 95% CI: 0,72–1,08), klinických fraktur páteře (HR = 0,90; CI: 0,74–1,10) ani všech fraktur (HR = 0,96; CI: 0,91–1,02) však nebyl vlivem suplementace signifikantně snížen. Analýza zohledňující non-adherenci ke studované medikaci poukázala na signifikantní snížení výskytu fraktur krčku (HR = 0,71; CI: 0,52–0,97). Účinnost se významně neodlišovala v závislosti na počátečních sérových koncentracích vitaminu D. V léčené podskupině byl zvýšen výskyt ledvinových kamenů (HR = 1,17; CI: 1,02–1,34). Autoři uzavírají, že u zdravých postmenopauzálních žen vedla suplementace vápníkem a vitaminem D k malému zvýšení kostní denzity v oblasti krčku femuru, ale nesnížila signifikantně výskyt fraktur v této lokalizaci [7].
Vápník
Množství a kvalitu kostní hmoty ovlivňuje přes hormonální systém hladina vápníku v krvi, která je udržována na stálých hodnotách. Řízena je hormonálně (kalcitriolem a parathormonem) a vitaminem D.
Vápník se z lumen střeva do nitra enterocytů dostává po koncentračním gradientu iontovými kanály nebo přenašeče. Z enterocytů je dále transportován proteiny vázajícími vápník, které jsou regulovány aktivní formou vitaminu D – kalcitriolem. Tento regulovaný transport je saturabilní. Existuje také transport pasivní, na vitaminu D nezávislý. Jedná se o prostou nebo facilitovanou difuzi mezi enterocyty.
Aby se vápník mohl účastnit difuze nebo se dostat do nitra enterocytu, musí být v rozpustné ionizované formě vápenatého iontu Ca2+ nebo vázaný v malých organických molekulách schopných procházet střevní stěnou. Prostředí ve střevě a přítomnost potravy ovlivňuje rozpustnost vápníku ve střevním obsahu, a tím i jeho vstřebávání. Vznik málo rozpustných sloučenin vápníku (např. fosfátů, oxalátů a fytátů) snižuje vstřebání vápníku, naopak dobře rozpustné sloučeniny tvoří s vápníkem např. mléčné proteiny a aminokyseliny.
Potřeba příjmu vápníku se během života mění, záleží na věku a na aktuální životní situaci. Je zvýšená v pubertě během růstu, v těhotenství a při kojení (v těchto obdobích je vstřebávání vápníku rovněž zvýšeno). Potřeba přísunu vápníku dále roste po menopauze/andropauze v důsledku snížené produkce pohlavních hormonů, kdy se ale jeho vstřebávání s věkem snižuje. Doporučený denní příjem vápníku je uveden v tab. 3. Vstřebávání vápníku v trávicím traktu u dospělých osob dosahuje přibližně 30 % a závisí na typu potraviny (léčiva, potravního doplňku) [8]. Absorpce je zvýšena v přítomnosti laktózy, citrátů, při optimálním příjmu bílkovin a fosforu. Vstřebávání naopak snižují kortikoidy, nedostatek vitaminu D či estrogenů a vysoký příjem tuků. Rovněž zvýšená konzumace kolových nápojů, které obsahují kyselinu fosforečnou, jež váže vápník do méně využitelné formy, zhoršuje situaci v příjmu vápníku [9].
Vhodným zdrojem vápníku jsou tedy mléčné výrobky (tab. 4), především kysané (např. jogurt nebo kefír), protože kyselé prostředí napomáhá jeho lepšímu vstřebávání. (Kysané mléčné výrobky jsou rovněž lépe stravitelné než sladké mléko, obsahují totiž stravitelnější bílkoviny a méně laktózy.) Koncentrace vápníku v mléce nezávisí na obsahu tuku (na rozdíl od vitaminů rozpustných v tucích, jejichž obsah se při odtučňování mléka snižuje).
Mateřské mléko obsahuje méně vápníku než mléko kravské. Studie zahrnující 57 kojících matek poukázala na nižší obsah vápníku v mateřském mléce při jeho nižším příjmu potravou, přestože sérové koncentrace snížené zásobení neovlivnilo [10].
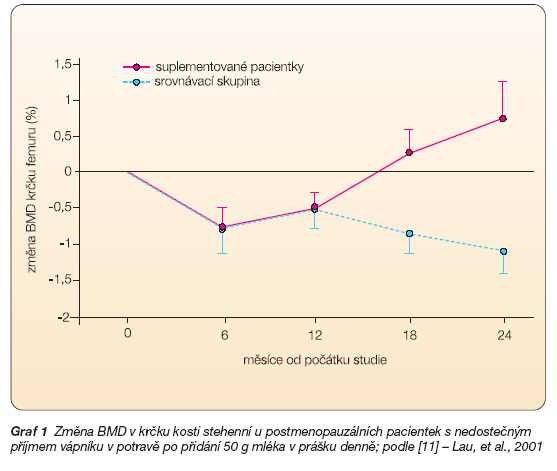
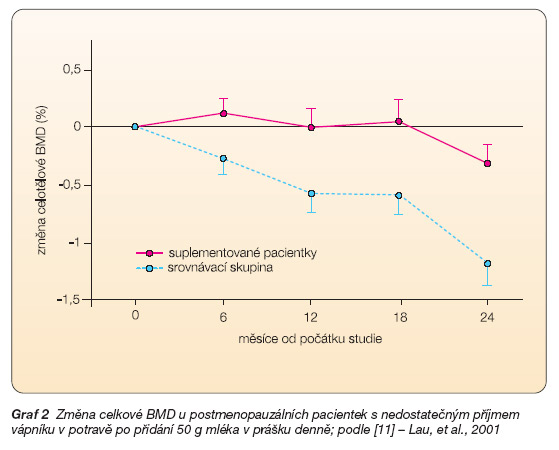
U postmenopauzálních žen s nízkým příjmem vápníku v potravě zpomalilo zařazení 50 g mléka v prášku (obsah vápníku okolo 800 mg) do diety snižování tělesné výšky a ztrátu kostní hmoty a zvýšilo hladinu kalcitriolu (aktivní formy vitaminu D) v krvi. Názorně ukazuje vliv této suplementace graf 1a graf 2 [11]. U krys po odejmutí vaječníků tlumí mléčné proteiny osteoresorpci [12].
Důležitost a efektivitu dostatečného příjmu vápníku u dívek od dětství do rané dospělosti prokázala studie Matkovice a kol. [13]. Příjem vápníku v potravě dosahoval hodnot kolem 830 mg denně, ke kterým bylo u jedné skupiny přidáno dalších 670 mg/den. Po 4 letech měly dívky se suplementací vápníku vyšší BMD ve všech měřených oblastech. Po dalších třech letech rozdíl nárůstu BMD proti srovnávací skupině již nebyl významný. Tato studie ukázala, že během růstu je spotřeba vápníku vyšší, po uzavření epifizálních štěrbin již dívkám postačoval vápník přijímaný v potravě, a proto se efekt suplementace ztrácel. Potřeba vápníku také záležela na tělesné stavbě dívek, u vyšších dívek bylo podávání vápníku efektivnější [13].
Přibližně od 25.–30. roku života do menopauzy/andropauzy není potřeba vápníku zvýšená a obvykle ji stačí pokrýt strava. Výjimkou jsou těhotné a kojící ženy, u kterých je potřeba vyšší, a které by proto jeho dostatečnému příjmu měly věnovat zvýšenou pozornost, aby u nich nedocházelo ke ztrátám kostní hmoty.
S rostoucím věkem u většiny lidí klesá příjem vápníku ve stravě, což zvyšuje riziko vzniku osteoporózy [14]. Naopak dostatečné množství vápníku významně snižuje riziko obratlových fraktur, u mimoobratlových fraktur nejsou výsledky studií jednotné [8, 14]. Dostatečný příjem vápníku má význam i v posledních dekádách života, jeho pozitivní efekt se prokázal i u stoletých pacientů [15].
Pozitivní vliv vápníku na kost snižuje kouření. Studie Siroly a kol. [16] ukázala, že negativní korelace mezi příjmem vápníku potravou a rychlostí úbytku BMD zjištěná u postmenopauzálních žen, které nikdy nekouřily, mizí u kuřaček (současných i bývalých) a pozitivní efekt vápníku na BMD se tak ztrácí.
Vitamin D
Vitamin D se ve své aktivní formě – kalcitriolu – podílí na udržování hladiny vápníku v krvi a ovlivňuje jeho vstřebání z potravy, je proto nezbytné přijímat ho v dostatečném množství stejně jako vápník. Denní příjem vitaminu D z potravy se jen velmi špatně odhaduje, je proto výhodnější hodnotit plazmatickou koncentraci 25-hydroxy-vitaminu D (hlavního cirkulující metabolitu).
Kalcitriol vzniká z prekurzorů přijímaných potravou v několika krocích. V potravě přijímáme vitamin D2 (ergokalciferol) a vitamin D3 (cholekalciferol). Vitamin D2 se v kůži vlivem ultrafialového záření přemění na vitamin D3. Ten se následně postupně mění na účinnou formu vitaminu D – v prvním kroku v játrech (na 25-OH vitamin D) a v druhém kroku v ledvinách (na 1,25-hydroxy-vitamin D = kalcitriol).
Zdraví lidé potřebují ve vyšším věku přibližně takovou denní dávku vitaminu D, kterou pokryje jedna až dvě sklenice mléka spolu s jednou dávkou multivitaminového přípravku. U nepohyblivých pacientů nebo pacientů s nedostatkem pobytu na slunci se toto množství zvyšuje. Vzhledem k dlouhému poločasu vitaminu D nemusí být jeho podávání časté a pacienty zatěžuje jen velmi málo [8].
Prevalence nedostatku vitaminu D (měřeno jako 25-hydroxy-vitamin D) u postmenopauzálních žen se pohybuje od 39,1 % do téměř 100 % u žen ve věku kolem 100 let [15, 17]. Nedostatek tohoto vitaminu je rizikovým faktorem pro vznik osteoporózy a způsobuje sekundární hyperparatyreoidismus (což se opět projeví ve zvýšených ztrátách kostní hmoty) [1].
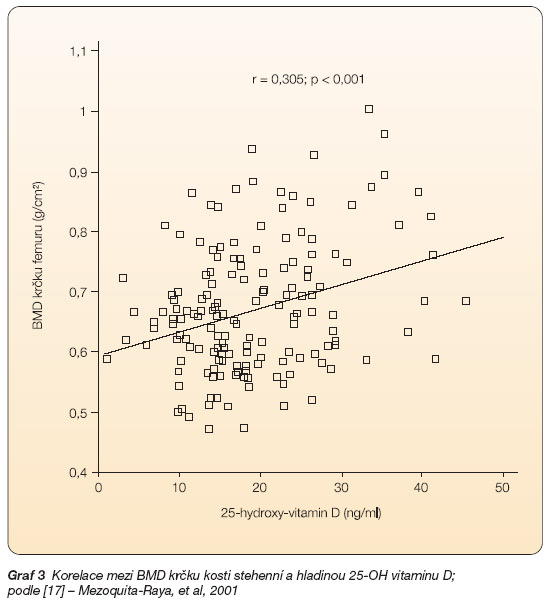
Při normální hladině vitaminu D v krvi pravděpodobně nemá jeho samostatné podávání vliv na BMD nebo riziko fraktury [18, 19]. Velká část postmenopauzálních pacientek však trpí jeho deficitem, proto podání vitaminu D u postmenopauzálních žen zvyšuje BMD, snižuje riziko vzniku obratlové fraktury a jeví tendenci snižovat i riziko mimoobratlových fraktur [20]. Statisticky významný vztah mezi hladinou vitaminu D v krvi a množstvím kostní hmoty znázorňuje graf 3.
Ve dvouleté multicentrické randomizované studii zahrnující 583 starších žen (průměrný věk 85 let) bylo podávání vápníku (1200 mg denně) a vitaminu D3 (800 IU denně) spojeno se snížením rizika zlomeniny kyčle [21]. Suplementace vápníku a vitaminu D oproti podávání samotného vápníku u starších žen navíc snižuje riziko pádů zlepšením muskuloskeletálních funkcí [22].
Proteiny
Nízký příjem proteinů ve stravě je statisticky významně spojen se ztrátami kostní hmoty v lumbální páteři i femuru. Proto by jejich příjem neměl klesnout pod 16 % denního příjmu energie [23].
Tělesná hmotnost a opakované hubnutí
Vyšší tělesná hmotnost (vyjádřená jako body mass index, BMI) významně souvisí s větším množstvím kostní hmoty. Jedním z vysvětlení je, že kosti jsou více namáhány a této zvýšené námaze se přizpůsobí právě zvýšením množství kostní hmoty, podobně jako např. při cvičení. Při snižování hmotnosti dochází zejména u starších osob k úbytku kostní hmoty, který je částečně způsoben sníženým příjmem vápníku a/nebo jeho sníženou absorpcí. Uplatňují se zde rovněž hormonální mechanismy (snížení hladiny estrogenu apod.) [24].
U žen ve věku 20–25 let byl zkoumán vliv tělesné hmotnosti na BMD s ohledem na to, zda se jednalo o vyšší tělesnou hmotnost způsobenou větším množstvím tuku v organismu. Jak tělesná hmotnost bez tuku, tak hmotnost tělesného tuku pozitivně korelovala s BMD, u tělesné hmotnosti bez tuku byla tato korelace silnější. Další studie zahrnující pacientky v jiných věkových skupinách však tento rozdíl v míře závislosti neprokázaly. Vliv celkové hmotnosti na BMD byl ale v těchto studiích prokázán [25].
Vzhledem k pozitivní korelaci BMI a BMD se u žen s nadváhou a obezitou očekávalo nižší riziko osteoporózy. Studie Bacona a kol. [26] se zajímala o ženy ve věku 30–45 let, které se opakovaně pokoušely snížit svou hmotnost omezením příjmu potravy. Ty ženy, které vykazují cyklické výkyvy hmotnosti, mají statisticky významně nižší BMD než ženy bez váhového kolísání. Incidence osteopenie nebo osteoporózy je u skupiny s kolísající hmotností 31 %, což vyvrací teorii, že všechny ženy s nadváhou a obezitou jsou do určité míry právě svou hmotností před osteoporózou chráněny [26]. Naopak snížené množství kostní hmoty se u žen s vyšší tělesnou hmotností a výkyvy v této hmotnosti způsobenými omezováním potravy vyskytuje již před menopauzou.
Pády
Pády ve stáří jsou rizikovým faktorem pro vznik osteoporotické fraktury a výrazně přispívají k morbiditě a mortalitě. Jejich následky – především osteoporotické fraktury – zatěžují jedince, jeho rodinu a poskytovatele zdravotní péče a jsou častým důvodem hospitalizace pacienta.
Riziko pádu je podle Nizozemské studie [27] u lidí nad 65 let bydlících doma 25–40 % upadnuvších pacientů za rok, u lidí v ústavní péči je to až 70 %. Toto riziko roste s věkem a je vyšší u žen. Nejméně 5 % lidí starších 65 let v některé z forem domácí nebo ústavní zdravotní a sociální péče utrpí zlomeninu v důsledku pádu. Z hlediska závažnosti jsou nejvýznamnější zlomeniny krčku kosti stehenní, kdy v roce následujícím po zlomenině umírá 20–30 % pacientů. Stejné procento pacientů má po této zlomenině omezené schopnosti se o sebe postarat a jsou odkázáni na pomoc dalšího člověka [27].
Rizikové faktory pádů
Pád je multifaktoriální problém, který ovlivňuje stav pacienta, okolní prostředí a situace, ve které se pacient právě nachází. Nejčastější faktory ovlivňující riziko pádu uvádí tab. 5.
V prevenci pádu je důležité přizpůsobit domácí prostředí pacienta a učinit ho pro něj bezpečnějším. Zakrýt kabely od elektrotechniky a odstranit nepřipevněné podložky, po kterých se snadno uklouzne, je otázka chvíle, strmé schody, absence zábradlí nebo nevhodná podlahová krytina si vyžádají větší investice času i finančních prostředků. Další faktory je možné ovlivnit změnou životního stylu (svalová slabost a problémy s udržováním rovnováhy, které je možné zlepšit cvičením, a proto budou podrobněji probrány u efektu cvičení v prevenci osteoporózy) a racionální farmakoterapií.
Rizikové faktory pádů – farmakoterapie
S rostoucím věkem se mění metabolismus člověka, podíl tuků a vody v organismu a tyto změny ovlivňují farmakokinetiku i farmakodynamiku léčiv. S těmito změnami je nutné počítat a vybrat vhodné léčivo v přiměřeném dávkovacím režimu. Bohužel ne vždy jsou všechny tyto změny vzaty v úvahu a jedním z možných následků je pád pacienta.
Vliv jednotlivých léčiv na riziko pádu je obtížné hodnotit. Snazší je zaměřit se na rizika, která se projevují u celé skupiny léčiv. K rizikovým léčivům z hlediska možnosti přispět k pádu patří léčiva ovlivňující psychické a motorické schopnosti člověka. Jde především o ovlivnění pozornosti, prodloužení reakční doby, extrapyramidové příznaky, ospalost, sedaci a posturální nebo ortostatickou hypotenzi.
Vyšší riziko pádu následujícího po předchozím pádu v časovém období jednoho roku se prokázalo u pacientů užívajících benzodiazepiny, neuroleptika, antikonvulziva a antidepresiva (tricyklická antidepresiva, selektivní inhibitory zpětného vychytávání serotoninu) [27]. Také množství užívaných léčiv pozitivně koreluje s rizikem pádu [27]. Jako vhodná prevence pádů v důsledku nevhodné farmakoterapie se nabízí její kompletní pravidelné hodnocení se snahou vyhnout se rizikovým skupinám léčiv a snížit celkový počet užívaných léčiv.
Protektory kyčle
Další možností, jak omezit riziko osteoporotické zlomeniny, je kromě předcházení pádu také mírnění jeho vlivu na kost. Za tímto účelem byly vyvinuty protektory kyčle.
Existují dva základní typy protektorů kyčle pracující na různých principech. Oba typy se vkládají do kapes speciálního elastického prádla a překrývají nejrizikovější místo pro osteoporotickou zlomeninu – krček kosti stehenní. První typ představuje měkký polštářek, který absorbuje náraz, druhým typem je tvrdý štítek vypodložený měkčí částí, který sílu nárazu rozkládá na větší plochu, a tak zmenšuje její následky. Jednotlivé typy protektorů se vzhledově a materiálově poněkud liší. Aby mohl protektor fungovat, musí být při pádu přítomen, což znamená, že pacient by ho měl používat neustále.
Vlivem protektoru kyčle na snižování rizika zlomenin se zabývalo více studií a většina potvrdila jeho efektivitu. Pokud se vliv protektoru neprokázal, bylo to obvykle z důvodu nízké compliance k neustálému používání protektoru. Tito pacienti nebyli při pádu chráněni a efektivita protektoru hodnocená jako snížení počtu fraktur ve skupině vybavené protektorem se následkem toho snížila.
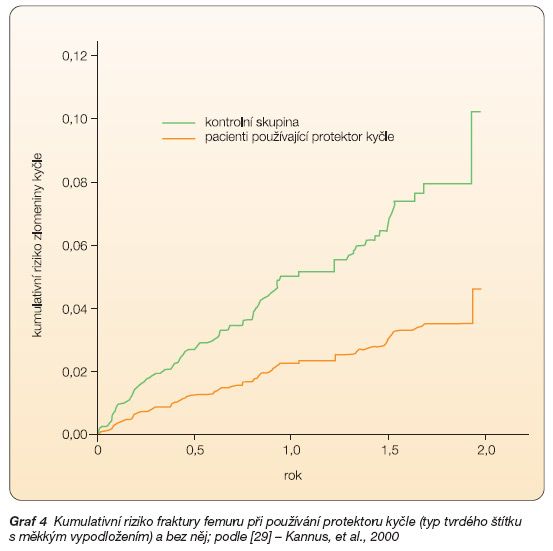
Snížení počtu fraktur femuru při používání protektoru kyčle prokázala např. studie u pacientů v domovech poskytujících péči v Nizozemí provedená Lauritzenem a kol. [28]. Další studie [29] prokázala snížení rizika fraktury kyčle u pacientů v ambulantní péči. Riziko zlomeniny se u pacientů se zvýšeným rizikem této zlomeniny snížilo o 60 %. Pokud pacienti nosili protektor kyčle neustále, snížení rizika dosahovalo až 80 %. Počet pacientů nutný k zabránění jedné fraktuře (number needed to treat) byl v případě ročního hodnocení 41 pacientů, v případě pětiletého hodnocení 8 pacientů. Vliv používání protektoru na riziko fraktury femuru viz graf 4. Kromě efektu na snížení počtu fraktur femuru byla prokázána i ekonomická efektivita používání protektorů kyčle [30].
Studie Van Shoora a kol. sice neprokázala efektivitu protektoru na snížení rizika fraktur, ale uvádí jako pravděpodobnou příčinu svého výsledku nízkou compliance pacientů k neustálému používání protektoru, protože většina fraktur byla zaznamenána právě v době, kdy pacienti protektor nepoužívali [31].
Pohybová aktivita
Pohyb má v prevenci i léčbě osteoporózy své nezastupitelné místo ve všech věkových kategoriích. Pravidelná, vhodná a přiměřená tělesná aktivita je pro organismus zátěží, která stimuluje tvorbu kostní hmoty a chrání ji před nadměrnými ztrátami. Současně posiluje kosterní svalstvo, zlepšuje udržování rovnováhy v pohybu i v klidu, čímž snižuje riziko pádů, významné především ve vyšším věku [32]. Nedostatečná pohybová aktivita se ukázala jako nejsilnější rizikový faktor zlomeniny proximálního femuru v australské studii, která analyzovala data od téměř 70 tisíc postmenopauzálních žen [33]. Chůze, aerobní cvičení a taichi jsou nejvhodnějšími typy pohybu pro stimulaci kostní novotvorby a posílení patřičných svalových skupin [34].
Chůze
Vzhledem k osteoporóze patří chůze k nejvhodnějším pohybovým aktivitám. Bylo prokázáno zvýšení BMD v páteři i v oblasti kyčle.
Cvičení
Jako nejefektivnější se ukázaly aktivity, při kterých jsou svaly nuceny překonávat určitý odpor, ať už působený vlivem gravitace nebo činkami. Takové cvičení zlepší koordinaci a sílu svalů, což snižuje riziko pádů přibližně o 25 % [32, 35].
Prokazatelný efekt má podle studie Chana a kol. [32] kromě sestav cviků vytvořených na míru konkrétnímu pacientovi také např. step aerobik, pěší turistika nebo taichi. U starších pacientů, kteří provozovali taichi, bylo prokázáno snížení rizika pádu až o 47,5 % a pacienti také pociťovali významně menší strach z pádu.
Efektivita cvičení se zátěží představovanou malými činkami a cvičební gumou se projevila zlepšením dynamické rovnováhy ve studii Cartera a kol. [36].
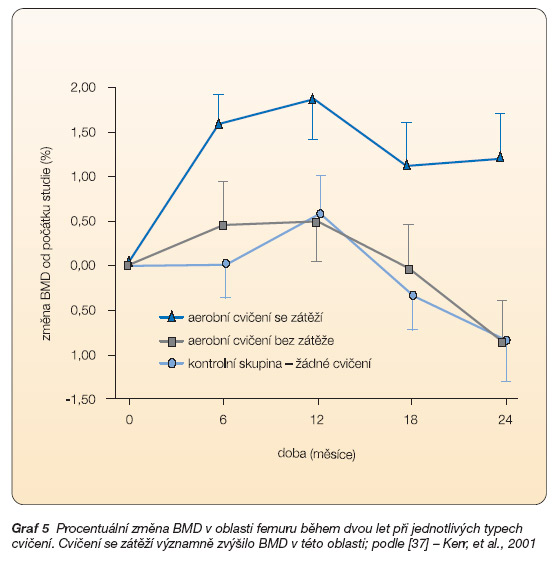
Vlivem cvičení na BMD se zabýval Kerr a kol. [37], který hodnotil nárůst BMD během dvou let u žen po menopauze. Zaměřil se na vliv různých cvičebních strategií. Strategie zahrnující cvičení s odporem významně zvýšila BMD v oblasti lumbální páteře a femuru, což je velmi důležité vzhledem k riziku osteoporotických zlomenin vyskytujících se často právě v těchto místech. Cvičení bez zátěže nemělo na BMD významný vliv. Změnu BMD v oblasti femuru během dvou let při jednotlivých cvičebních režimech znázorňuje graf 5.
Významným problémem u cvičebních režimů je nízká compliance pacientů, která má nepříznivý dopad na efektivitu cvičení. Většina osteoporotických pacientek vykazuje nízkou fyzickou aktivitu a právě u pacientek s nízkou fyzickou aktivitou byla zaznamenána nejnižší compliance k pravidelnému cvičení [38].
Mayoux-Benhamou a kol. [38] sledoval compliance ke cvičení u postmenopauzálních žen. Žena byla považována za compliantní, pokud odcvičila alespoň 50 % předepsaných cviků ve třech ze čtyř lekcí za týden. Na počátku sledování podstoupily ženy vzdělávací kurzy na téma osteoporóza a vhodný životní styl jako prevence a léčba osteoporózy. Všechny ženy se pod vedením terapeuta naučily správně provádět předepsané cviky a dostaly brožuru s podrobným návodem ke cvičení. Během kontrol po prvním a šestém měsíci pod vedením terapeuta upravily chybné provádění cviků, pokud se objevilo. Na konci studie (po 18 měsících) byla compliance pouhých 17,8 %. Jako nejčastější důvod pro vynechání cvičení uváděly ženy nedostatek motivace. Sportu (v jakékoli formě) se věnovalo 35,6 % žen. Z uvedených údajů vyplynulo, že fyzická aktivita postmenopauzálních žen zůstala i po edukaci naprosto nedostatečná kvůli nízké motivaci. Je proto nutné najít způsob, jak pacientky motivovat, a zvýšit tak jejich fyzickou aktivitu.
Toxické vlivy
Kouření
Kouření má škodlivý vliv na kostní metabolismus a je spojeno se snížením BMD u žen po menopauze. Metaanalýza 50 studií [39] zahrnující více než 500 000 osob ukázala, že kuřáci mají výrazně zvýšené riziko zlomenin. Zvýšení rizika se týká zlomenin páteře a kyčle, ale ne zlomenin předloktí. Zdá se, že toxický vliv cigaret na kost je reverzibilní, po ukončení kouření se zvýšené riziko zlomenin vrací k normálu. Bylo rovněž zjištěno, že negativní vliv kouření na riziko zlomenin kyčle je výraznější u populací žijících ve vyšších zeměpisných šířkách (severní Evropa), než je tomu blíže u rovníku (jižní Evropa, USA, Mexiko). Pravděpodobným vysvětlením může být snížení hladin vitaminu D v krvi u kuřáků, kdy nedostatečná expozice slunečnímu záření může tento nedostatek ještě prohloubit [39]. Některé studie poukázaly na možný dávkově závislý vztah mezi rizikem zlomenin a dobou trvání kuřáctví.
Alkohol
Nadměrný příjem alkoholu je spojen se zvýšeným rizikem osteoporotických zlomenin i samotných zlomenin kyčle. Tato závislost však není lineární; zvýšení rizika se projeví, až když konzumace přesáhne určité množství [40]. Zdá se dokonce, že přiměřená i častější konzumace alkoholu má oproti abstinenci jistý protektivní vliv na kost [41, 42]. Ve studii zahrnující více než 14 000 starších žen a mužů [42] bylo zjištěno snížené riziko zlomeniny obratle u žen starších 64 let, které přiznaly konzumaci alkoholických nápojů častěji než 5krát týdně, oproti těm, které konzumovaly alkohol méně často než jednou týdně. Celkové množství alkoholu v nápojích ale nebylo ve studii hodnoceno.
Kofein
Škodlivý vliv kofeinu na kost a hospodaření organismu s vápníkem nebyl prokázán [43, 44].
Závěr
Osteoporóza je zásadním problémem zdravotní péče, který vyžaduje rychlé a efektivní řešení. Je třeba zvýšit povědomí o osteoporotické problematice mezi zdravotníky na všech úrovních, což by mělo vést k většímu množství včas zachycených pacientek s vysokým rizikem zlomeniny, které budou následně adekvátně léčeny. U laické veřejnosti je třeba vytrvale zdůrazňovat nezbytnost prevence a motivovat všechny věkové skupiny k aktivitě v této oblasti.
Graf 1 Změna BMD v krčku kosti stehenní u postmenopauzálních pacientek s nedostečným příjmem vápníku v potravě po přidání 50 g mléka v prášku denně; podle [11] – Lau, et al., 2001
Graf 2 Změna celkové BMD u postmenopauzálních pacientek s nedostatečným příjmem vápníku v potravě po přidání 50 g mléka v prášku denně; podle [11] – Lau, et al., 2001
Graf 3 Korelace mezi BMD krčku kosti stehenní a hladinou 25-OH vitaminu D; podle [17] – Mezoquita-Raya, et al, 2001
Graf 4 Kumulativní riziko fraktury femuru při používání protektoru kyčle (typ tvrdého štítku s měkkým vypodložením) a bez něj; podle [29] – Kannus, et al., 2000
Graf 5 Procentuální změna BMD v oblasti femuru během dvou let při jednotlivých typech cvičení. Cvičení se zátěží významně zvýšilo BMD v této oblasti; podle [37] – Kerr, et al., 2001
Seznam použité literatury
- [1] Wilkins H, Birge S. Prevention of osteoporotic fractures in the elderly. The American Journal of Medicine 2005; 118; 1190–1195.
- [2] Woolf D, Ĺkesson K. Preventing fractures in elderly people. BMJ 2003; 327; 89–95.
- [3] Albrand G, Munoz F, Sornay-Rendu E, et al. Independent predictors of all osteoporosis-related fractures in healthy postmenopausal women: The OFELY Study. Bone 2003; 32: 78–85.
- [4] Nevitt M, Cummings S, Stone K, et al. Risk Factors for a First-Incident Radiographic Vertebral Fracture in Women ≥ 65 Years of Age: The Study of Osteoporotic Fractures. J Bone Miner Res 2005; 20: 131–140.
- [5] Boonen S, Rizzoli R, Meunier PJ, et al. The need for clinical guidance in the use of calcium and vitamin D in the management of osteoporosis: a consensus report. Osteoporos Int 2004; 15: 511–9.
- [6] Tucker KL. Dietary intake and bone status with aging. Curr Pharm Des 2003; 9: 2687–2704.
- [7] Jackson RD, LaCroix AZ, Gass M. Calcium plus vitamin D supplementation and the risk of fractures. N Engl J Med 2006; 354: 669–683 (Abstr.).
- [8] Rodriguez-Martinez MA, Garcia-Cohen EC. Role of Ca2+ and vitamin D in the prevention and treatment of osteoporosis. Pharm Ther 2002; 93: 37–49.
- [9] Lukášová J, Smrčková A. Obsah vápníku v mléce a jeho význam. Veterinářství 2003; 53: 192–193.
- [10] Ortega RM, Martinez RM, Quintas ME, et al. Calcium levels in maternal milk: relationships with calcium intake during the third trimester of pregnancy. Br J Nutr 1998; 79: 501–7.
- [11] Lau E, Woo J, Lam V, et al. Milk Supplementation of the Diet of Postmenopausal Chinese Women on a Low Calcium Intake Retards Bone Loss. J Bone Miner Res 2001; 16: 1704–1709.
- [12] Toba Y, Takada Y, Yamamura J, et al. Milk Basic Protein: A Novel Protective Function of Milk Against Osteoporosis. Bone 2000; 27: 403–408.
- [13] Matkovic V, Goel P, Badenhop-Stevens N, et al. Calcium supplementation and bone mineral density in females from childhood to young adulthood: a randomized controlled trial. Am J Clin Nutr 2005; 81: 175–178.
- [14] Nguyen T, Center J, Eisman J. Osteoporosis in Elderly Men and Women: Effects of Dietary Calcium, Physical Activity, and Body Mass Index. J Bone Miner Res 2000; 15: 322–331.
- [15] Passeri G, Pini G, Troiano L, et al. Low Vitamin D Status, High Bone Turnover, and Bone Fractures in Centenarians. J Clin Endocrinol Metab 2003; 88: 5109–5115.
- [16] Sirola J, Kröger H, Honkanen R, et al. Smoking May Impair the Bone Protective Effects of Nutritional Calcium: A Population-Based Approach. J Bone Miner Res 2003; 18: 1036–1042.
- [17] Mezoquita-Raya P, Muňoz-Torres M, Luna J, et al. Relation Between Vitamin D Insufficiency, Bone Density, and Bone Metabolism in Healthy Postmenopausal Women. J Bone Miner Res 2001; 16: 1408–1415.
- [18] Hunter D, Major P, Arden N, et al. A Randomized Controlled Trial of Vitamin D Supplementation on Preventing Postmenopausal Bone Loss and Modifying Bone Metabolism Using Identical Twin Pairs. J Bone Miner Res 2000; 15: 2276–2283.
- [19] Meyer H, Smedshaug G, Kvaavik E, et al. Can Vitamin D Supplementation Reduce the Risk of Fracture in the Elderly? A Randomized Controlled Trial. J Bone Miner Res 2002; 17: 709–715.
- [20] Papadimitropoulos E, Wells G, Shea B, et al. VIII: Meta-Analysis of the Efficacy of Vitamin D Treatment in Preventing Osteoporosis in Postmenopausal Women Endocrine Reviews 2002; 23: 560–569.
- [21] Chapuy MC, Pamphile R, Paris E, et al. Combined calcium and vitamin D3 supplementation in elderly women: confirmation of reversal of secondary hyperparathyroidism and hip fracture risk: the Decalyos II study. Osteoporos Int 2002; 13: 257–264.
- [22] Bischoff HA, Stahelin HB, Dick W, et al. Effects of vitamin D and calcium supplementation on falls: a randomized controlled trial. J Bone Miner Res 2003; 18: 343–351.
- [23] Hannan M, Tucker K, Dawson-Hughes, et al. Effect of Dietary Protein on Bone Loss in Elderly Men and Women: The Framingham Osteoporosis Study. J Bone Miner Res 2000; 15: 2504–2512.
- [24] Shapses SA, Riedt CS. Bone, body weight, and weight reduction: what are the concerns? J Nutr 2006; 136: 1453–6.
- [25] Wang M, Bachrach L, Van Loan M, et al. The relative contributions of lean tissue mass and fat mass to bone density in young women. Bone 2005; 37: 474–481.
- [26] Bacon L, Stern JS, Keim NL, et al. Low bone mass in premenopausal chronic dieting obese women. Eur J Clin Nutr 2004; 58: 966–971.
- [27] Daal L, Van Lieshout J. Falls and medications in the elderly. The Netherlands Journal of Medicine 2005; 63: 91–96.
- [28] Lauritzen JB, Petersen MM, Lund B. Effect of external hip protectors on hip fractures. Lancet 1993; 341: 11–13 (Abstr.).
- [29] Kannus P, Parkkari J, Niemi S, et al. Prevention of Hip Fracture in Elderly People with Use of a Hip Protector. N Engl J Med 2000; 343: 1506–1513.
- [30] Fleurence R, Iglesias C, Torgerson D. Economic evaluations of interventions for the prevention and treatment of osteoporosis: a structured review of the literature. Osteoporos Int 2006; 17: 29–40.
- [31] Van Schoor N, Smit J, Twisk J, et al. Prevention of Hip Fractures by External Hip Protectors A Randomized Controlled Trial. JAMA 2003; 289: 1957–1962.
- [32] Chan K, Anderson M, Lau E. Exercise interventions: defusing the world´s osteoporosis time bomb. Bulletin of the World Health Organization 2003; 81: 827–830.
- [33] Eisman J, Clapham S, Kehoe L. Osteoporosis prevalence and levels of treatment in primary care: the Australian Bone Care Study. J Bone Miner Res 2004; 19: 1969–1975.
- [34] Kai MC, Anderson M, Lau EM. Exercise interventions: defusing the world´s osteoporosis time bomb. Bull World Health Organ 2003; 81: 827–830.
- [35] American Medical Association. Osteoporosis Prevention, Diagnosis, and Therapy. NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis, and Therapy. JAMA 2001; 285: 785–795.
- [36] Carter N, Khan K, McKay H, et al. Community-based exercise program reduces risk factors for falls in 65- to 75-year-old women with osteoporosis: randomized controlled trial. CMAJ 2002; 167: 997–1004.
- [37] Kerr D, Ackland T, Maslen B, et al. Resistance Training over 2 Years Increase Bone Mass In Calcium-Replete Postmenopausal Women. J Bone Miner Res 2001; 16: 175–181.
- [38] Mayoux-Benhamou MA, Roux C, Perraud A, et al. Predictors of compliance with a home-based exercise program added to ususal medical care in preventing postmenopausal osteoporosis: an 18-month prospective study. Osteoporosis Int 2005; 16: 325–331.
- [39] Vestergaard P, Mosekilde L. Fracture risk associated with smoking: a meta-analysis. J Intern Med 2003; 254: 572–583.
- [40] Kanis JA, Johansson H, Johnell O, et al. Alcohol intake as a risk factor for fracture. Osteoporos Int 2005; 16: 737–742.
- [41] Siris ES, Miller PD, Barrett-Connor E, et al. Identification and fracture outcomes of undiagnosed low bone mineral density in postmenopausal women. Results from the National Osteoporosis Risk Assessment. JAMA 2001; 286: 2815–2822.
- [42] Naves Diaz M, O´Neill TW, Silman AJ. The influence of alcohol consumption on the risk of vertebral deformity. European Vertebral Osteoporosis Study Group. Osteoporos Int 1997; 7: 65–71.
- [43] Grainge MJ, Coupland CA, Cliffe SJ, et al. Cigarette smoking, alcohol and caffeine consumption, and bone mineral density in postmenopausal women. The Nottingham EPIC Study Group. Osteoporos Int 1998; 8: 355–63.
- [44] Heaney RP. Effects of coffeine on bone and the calcium economy. Food Chem Toxicol 2002; 40: 1263–1270.
- [45] www.zdravcentra.cz, 1. 6. 2006.