Perorální antikoagulancia, jejich lékové interakce a dávkování u pacientů s fibrilací síní
Souhrn:
V České republice jsou vedle klasického perorálního antikoagulancia warfarinu relativně nově registrována perorální antikoagulancia dabigatran, apixaban a rivaroxaban. Tato léčiva mají schválenu indikaci prevence cévní mozkové příhody a systémové embolie u pacientů s nevalvulární fibrilací síní a mnoho dalších užití. Vzhledem k tomu, že tito pacienti obvykle trpí řadou přidružených onemocnění, lze očekávat, že nová perorální antikoagulancia budou v této indikaci podávána současně s dalšími léčivy. Vezmeme li v úvahu, že proléčivo dabigatranu je substrátem P glykoproteinu (P gp) a že apixaban a rivaroxaban jsou substráty transportéru P gp i oxidázy CYP3A4, lze současně předpokládat, že při podávání těchto léčiv spolu s dalšími léčivy bude platit řada omezení. Lékové interakce všech antitrombotik mají velký význam, terapeutické okno je u této skupiny léčiv neobvykle úzké a jakákoliv odchylka nad či pod optimální hladinu může zvýšit riziko trombotických či krvácivých komplikací. Klinický význam má i skutečnost, že na eliminaci se v různé míře podílejí též ledviny, terapeutický účinek ovlivňuje tělesná hmotnost, věk či potrava. Jednotlivé faktory se pak výsledně sčítají. K lékovým interakcím dabigatranu může v podstatě dojít pouze ve fázi jeho vstřebávání. Podkladem interakce je inhibice P gp, která může významně zvýšit či snížit dostupnost antikoagulancia. Inhibice je sice poměrně krátkodobá (trvá po dobu dostatečné koncentrace inhibitoru ve střevě), nicméně v důsledku silné afinity dabigatranu k intestinální eliminační pumpě se může expozice zvýšit až několikanásobně. K lékovým interakcím apixabanu nebo rivaroxabanu může dojít nejen při vstřebávání těchto léčiv, ale i při jejich transportu, distribuci a eliminaci z organismu, přičemž mechanismem interakcí je vedle blokády eliminační pumpy P gp také souběžná blokáda oxidázy CYP3A4. Inhibice P gp a CYP3A4 (např. na úrovni hepatocytu) může i po podání jednorázové dávky inhibitoru trvat významně déle, minimálně však po dobu jeho dostatečné koncentrace v plazmě.
Key words: warfarin, dabigatran etexilate, apixaban, rivaroxaban, CYP3A4, P glycoprotein, drug interactions, diet, adverse effects.
Summary:
In the Czech Republic, oral anticoagulants dabigatran, apixaban, and rivaroxaban were registered quite recently as alternatives to the classical oral anti-coagulant warfarin. These drugs are indicated for prevention of stroke and systemic embolization in patients with non valvular atrial fibrillation and for many other purposes. Patients using new oral anticoagulants (NOACs) usually suffer from many comorbidities; it can thus be anticipated that NOACs will be taken together with other drugs. Since the prodrug of dabigatran is a substrate of P glycoprotein (P gp) and apixaban and rivaroxaban are substrates of the transporter of both P glycoprotein and CYP3A4 oxidase, many restrictions may be expected in treatment with NOACs. Drug interactions of all antithrombotic medications are very important given the fact that therapeutic window is very narrow in this group and that any drug levels outside the optimal range may increase the risk of thrombotic or bleeding complications. Another important clinical aspect is related to the variable, yet always present role of kidney in NOAC elimination, to the influence of weight, age, and diet on their effectiveness. Individual factors tend to exert a cumulative effect. Drug drug interactions of dabigatran can occur virtually only during its absorption. These interactions are based on the inhibition of P gp, which may signi-ficantly increase or decrease the availability of this NOAC. The inhibition is quite short term (its prerequisite being an adequate intestinal concentration of the inhibitor) but, given the strong affinity of dabigatran towards the intestinal elimination pump, exposition can increase even many fold. Drug drug in-teractions of apixaban or rivaroxaban can develop not only during absorption but also during their transport, distribution or elimination from the organism, the mechanism being not only the blockage of elimination pump P gp but also the parallel blockage of CYP3A4 oxidase. The inhibition of P gp and CYP3A4 (e.g. at the level of hepatocyte) can last much longer even after a single dose of the inhibitor – at least until its plasmatic concentration fall below the effecti-ve level.
Úvod
Antikoagulancia inhibují velmi důležitý reparační mechanismus, jakým je hemostáza. Nedostatečný útlum může vést k trombotickým komplikacím, naopak přílišná blokáda ke krvácení. Z těchto důvodů je třeba udržovat koncentraci léčiva v terapeutickém oknu. Lékové interakce ovlivňující farmakodynamický efekt (např. protidestičkové léky) potencují vlastní antitrombotický účinek. Naopak interakce na úrovni farmakokinetické mění expozici léčivu – zvyšují či snižují dostupnost, ovlivňují aktivaci či inaktivaci léčiva, zasahují do eliminace. U warfarinu hraje změna expozice vlivem interakcí zásadní roli, zde však máme možnost úpravy dávky podle aktuální hodnoty INR (international normalized ratio). U nových antikoagulancií typu inhibitorů trombinu (gatranů) či inhibitorů faktoru Xa (xabanů) mají sice lékové interakce menší dopad, nicméně stanovení výsledné antikoagulační aktivity a úprava dávky je obtížnější. Z těchto důvodů je důležité klinicky významné lékové interakce respektovat. Článek podává přehled o mechanismu a významu lékových interakcí nových antikoagulancií označovaných jako non vitamin K (non vitamin K oral anticoagulants, NOAC).
V ČR je ze skupiny perorálních antikoagulancií v současné době registrován warfarin a nová antikoagulancia apixaban, dabigatran a rivaroxaban. Dabigatran působí jako přímý inhibitor trombinu (f. II), apixaban a rivaroxaban jako inhibitory aktivovaného faktoru X (f. Xa) a warfarin, zejména jeho (S) enantiomer, neboť je přibližně 4–5krát účinnější ve srovnání s (R) enantiomerem, inhibuje vitamin K epoxid reduktázu a chinon reduktázu, což vede ke snížení syntézy koagulačních faktorů II, VII, IX a X i inhibitorů koagulace – protei-nu C a proteinu S. V klinické praxi se dále užívá v profylaxi tromboembolické nemoci (TEN) edoxaban (registrace v Japonsku od roku 2011), indikace prevence tromboembolického iktu u fibrilace síní je teprve ve schvalovacím řízení. V různých fázích klinického hodnocení se nachází též řada dalších zástupců inhibitorů f. Xa, jako je betrixaban, eribaxaban, otamixaban a další dosud označené pouze kódy (TAK 442 nebo LY517717).
Účinnost a bezpečnost
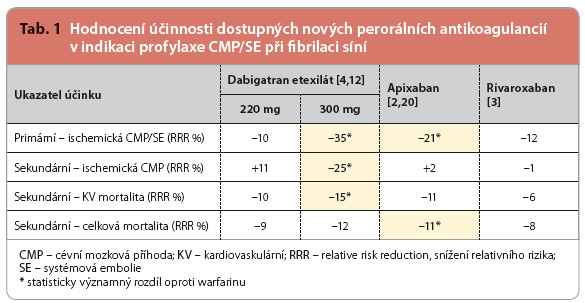
Účinek dabigatranu, apixabanu a rivaroxabanu v prevenci cévní mozkové příhody a systémové embolie (dále CMP/SE) u pacientů s nevalvulární fibrilací síní byl prokázán robustními kontrolovanými studiemi porovnávajícími účinek s warfarinem v dávce titrované dle hodnoty INR. Výsledky hodnocení účinnosti a bezpečnosti shrnuje tab. 1 a 2. Společné byly i primární ukazatele účinnosti (výskyt CMP/SE), respektive bezpečnosti (výskyt velkého krvácení). 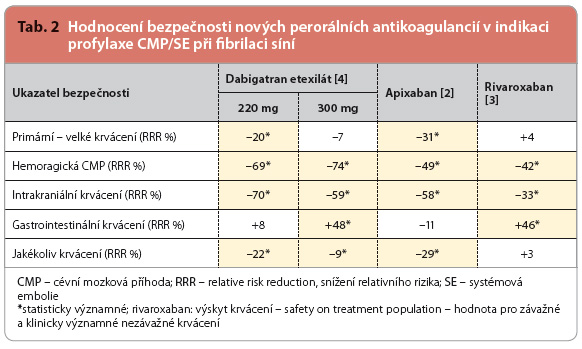 Velké krvácení bylo definováno snížením koncentrace hemoglobinu nejméně o 20 g/l nebo nutností podání transfuze nejméně 2 jednotek krve či symptomatickým krvácením do kritické oblasti.
Velké krvácení bylo definováno snížením koncentrace hemoglobinu nejméně o 20 g/l nebo nutností podání transfuze nejméně 2 jednotek krve či symptomatickým krvácením do kritické oblasti.
Dabigatran
Jako první byla prověřována účinnost a bezpečnost dabigatranu. Do studie RE LY [1] bylo zařazeno celkem 18 113 pacientů, kteří byli sledováni po dobu průměrně dvou let, podávána byla dávka 110 mg 2krát denně nebo 150 mg 2krát denně. Účinnost dabigatranu v prevenci CMP/SE (primární ukazatel) v denních dávkách 300 mg denně byla statisticky významně vyšší ve srovnání s warfarinem. Účinnost dabigatranu v denních dávkách 220 mg denně nebyla odlišná od účinnosti warfarinu. Primární ukazatel bezpečnosti (velké krvácení) byl významně nižší při užití dávky menší, nicméně intrakraniální krvácení a život ohrožující krvácení poklesla významně i při dávce vyšší.
Rivaroxaban
Účinnost a bezpečnost rivaroxabanu byla prověřována ve studii ROCKET AF [3]. Zařazeno bylo celkem 14 264 pacientů, přičemž průměrná délka sledování činila 1,9 roku, dávka byla stanovena, na rozdíl od předchozích studií, na 20 mg v jedné denní dávce (s redukcí na polovinu u renálního selhání). Na rozdíl od obou dalších studií u nemocných s fibrilací síní byl účinek hodnocen primárně u nemocných skutečně léčených, tedy nikoli podle randomizace. To vedlo k určitému zvýhodnění. Naproti tomu nemocní v této studii byli více rizikoví, což vedlo k nižší kvalitě antikoagulace warfarinem, studie se tak více přiblížila klinické praxi. Při hodnocení primár-ních ukazatelů byla účinnost i bezpečnost rivaroxabanu srovnatelná s warfarinem.
Apixaban
Druhým xabanem, který byl hodnocen v rámci prevence tromboembolie u fibrilace síní, byl apixaban. Do studie ARISTOTLE [2] bylo zařazeno celkem 18 201 pacientů, přičemž průměrná délka sledování činila 1,8 roku, základní dávka 5 mg 2krát denně byla při přítom-nosti renálního selhání redukována na polovinu. Apixaban byl ve srovnání s warfarinem statisticky významně účinnější (pokles výskytu CMP/SE) a současně bezpečnější (pokles výskytu velkých hemoragických příhod).
Ve srovnání s warfarinem byla všechna nová perorální antikoagulancia nejméně stejně účinná nebo účinnější (dabigatran při podává-ní dávek 300 mg denně a apixaban). Všechna tři nová antikoagulancia statisticky i klinicky významně snížila riziko vzniku hemoragické CMP. Dabigatran v dávkách 300 mg jako jediný snížil riziko vzniku ischemických CMP (tj. parametr, pro který je antikoagulační léčba u pacientů s fibrilací síní indikována), u ostatních byla redukce rizika dána zejména poklesem výskytu hemoragických mozkových pří-hod. Významnou skutečností přitom bylo, že riziko krvácení v souvislosti s podáváním nových perorálních antikoagulancií bylo obecně nižší než při podávání warfarinu.
Metaanalýza klinického hodnocení
Velmi zajímavá je metaanalýza všech studií fáze III klinického hodnocení s novými perorálními antikoagulancii v indikaci profylaxe CMP/SE u nemocných s nechlopenní fibrilací síní [4]. Do analýzy byly zařazeny megastudie RE LY (s dabigatranem), ROCKET AF (s rivaroxabanem), ARISTOTLE (s apixabanem) a ENGAGE AF–TIMI 48 (s edoxabanem). Více než 40 tisíc nemocných bylo léčeno novými antikoagulancii, účinnost a bezpečnost byla porovnána s kohortou 30 tisíc nemocných léčených warfarinem, viz tab. 1–3.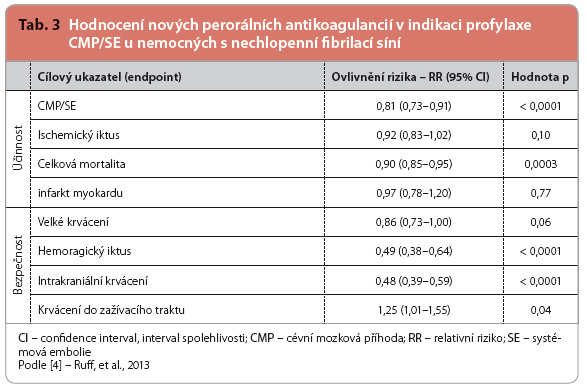
Primární ukazatel účinnosti – výskyt CMP/SE – poklesl významně téměř o pětinu. Hlavní podíl na příznivém výsledku však byl dán snížením výskytu mozkových příhod hemoragických (pokles o polovinu), naopak vlastní snížení výskytu ischemických iktů, s výjimkou skupiny s vyšší dávkou dabigatranu, bylo nevýznamné. Význam poklesu výskytu systémové embolizace nebyl celkově analyzován, nicméně v jednotlivých studiích byl zanedbatelný, rozdíly se pohybovaly v desetinách procenta. Dalším přínosem bylo snížení celkové úmrtnosti, pokles, v průměru o desetinu, byl statisticky významný.
Při sledování bezpečnosti léčby dominuje snížení výskytu mozkového a intrakraniálního krvácení, oba ukazatele poklesly při užití nových antikoagulancií na polovinu. Primární ukazatel, tj. frekvence výskytu velkých krvácivých příhod, se snížil pouze o 14 %, výsle-dek byl na hranici významnosti. Hemoragické příhody v oblasti trávicího traktu naopak při léčbě novými antikoagulancii byly významně, tj. o čtvrtinu častější.
Podíváme li se blíže na výsledky, viz tab. 3, pak na příznivém výsledku primárního ukazatele účinnosti (výskyt všech typů iktu a systémové embolizace) se paradoxně nejvíce uplatnilo snížení výskytu mozkového krvácení, tedy jeden z bezpečnostních ukazatelů. Stejně tak se na poklesu celkové mortality zásadním způsobem podílel i nižší výskyt krvácení nitrolebního, tedy opět ukazatel bezpeč-nosti. Shrneme li, pak se dá konstatovat, že rozhodujícím přínosem nových perorálních antikoagulancií (jako skupiny) ve srovnání s warfarinem je především jejich větší bezpečnost. Ta vyplývá ze zásadního rozdílu ve srovnání s warfarinem – z menší interindividuální i intraindividuální variability antikoagulačního efektu.
Předložená metaanalýza dokládá, že největší zisk daný poklesem výskytu velkých krvácivých příhod byl pozorován v populaci s nižší úrovní kvality vedení léčby warfarinem [4–6]. Konkrétně v centrech s dobrou kontrolou INR definovanou vysokým počtem dnů strávených v terapeutickém rozmezí (více než 66 %) byl rozdíl ve prospěch nových antikoagulancií jen 7 % (relativní riziko – RR – 0,93; interval spolehlivosti, confidence interval – 95% CI: 0,76–1,13). Naopak v centrech, kde byla úroveň léčby warfarinem kontrolována hůře, tj. při nižším počtu dnů v terapeutickém rozmezí než 66 %, dosáhl rozdíl 31 % (RR 0,69; 95% CI: 0,59–0,81). Není tak pravděpo-dobné, že by se na větší míře bezpečnosti nových antikoagulancií uplatnil jiný mechanismus účinku – tedy inhibice více koagulačních faktorů u warfarinu proti inhibici trombinu u gatranů či inhibici f. Xa u xabanů.
Účinek jednotlivých nových perorálních antikoagulancií se v uvedených studiích mírně lišil z hlediska ovlivnění výskytu tromboem-bolických příhod i výskytu krvácení. Nicméně tyto rozdíly lze vysvětlit různou dávkou antikoagulancií, přesněji řečeno různou intenzitou inhibice srážlivosti antikoagulanciem v průběhu dávkovacího intervalu. To vyplývá z jiných dávkovacích schémat (podávání ve dvou denních dávkách u apixabanu a dabigatranu či v jedné denní dávce u rivaroxabanu či edoxabanu). Do rozdílu se dále promítá i různá úroveň kvality vedení antikoagulační léčby warfarinem. Význam má i odlišnost cílových populací, tedy různé riziko embolizace i krvácení. V neposlední řadě se uplatní i různé predefinované hodnocení výsledku (dle randomizace či dle setrvání v léčbě), eventuálně typ zaslepení studie (otevřené podávání léčiva u dabigatranu a zaslepené u xabanů). Vzájemné srovnání účinnosti a bezpečnosti je tak velmi obtížné.
Variabilita účinku
Při vědomí, že právě nízká variabilita antikoagulace je klíčovým faktorem příznivého efektu nových antikoagulancií, je důvodem se zabývat situacemi, které vedou k vybočení z „relativně bezpečného“ terapeutického okna. Vedle renálních funkcí, tělesné hmotnosti, věku a vlastního rizika krvácení (hodnoceného např. pomocí skóre HAS BLED) se významně uplatní lékové a potravinové interakce. Ty jsou sice ve srovnání s warfarinem méně časté, nicméně vliv řady léků běžně podávaných současně s antikoagulancii – např. amiodaronu, verapamilu či clarithromycinu – nelze podceňovat. Jejich vliv se totiž může projevit v kontextu s působením faktorů jiných – např. při současné snížené eliminaci na podkladě renální nedostatečnosti či při nižší hmotnosti nemocného.
Význam interakcí nových antikoagulancií je dán především velkým počtem pacientů, kteří jsou či v budoucnu budou k léčbě indiko-váni. Rozšiřují se indikace – vedle profylaxe tromboembolie provázející fibrilaci síní je schváleno užití v profylaxi TEN u ortopedických nemocných, v léčbě flebotrombózy a plicní embolie či v extenzi profylaxe u těchto nemocných. Jak je zřejmé, indikace jsou závažné a velmi časté. Současně i počet nemocných vhodných k léčbě je relativně vysoký, ve vyšších věkových dekádách se jedná až o desetinu populace; navíc bohužel o populaci – co se týče lékových interakcí, vlivu faktorů měnících expozici antikoagulanciím i zvýšeného rizika krvácení či trombotických a tromboembolických komplikací – výrazně rizikovou. Z tohoto důvodu je velmi důležité správné vedení léčby.
Cílem této práce je hlouběji se zamyslet nad farmakokinetickými vlastnostmi jednotlivých léčiv a upozornit na limitace léčby z hlediska lékových interakcí a optimálního dávkování za specifických situací.
Farmakokinetické vlastnosti perorálních antikoagulancií
Ideální perorální antikoagulancium by mělo mít standardní, vnějšími vlivy co nejméně ovlivnitelnou biologickou dostupnost po perorálním podání, přiměřeně dlouhý biologický poločas umožňující podání v jedné denní dávce, jednoduché podávání ve vztahu k lékovým interakcím, jídlu a nápojům. Na straně druhé je výhodné rychlé odeznění účinku po přerušení podávání, respektive dostup-nost účinného, nejlépe okamžitě působícího antidota. Těmto vlastnostem se některá léčiva blíží více, jiná jsou ideálu vzdálenější.
Jen málo lékových skupin má tak úzké terapeutické okno, jako mají antikoagulancia. Již relativně malé zvýšení účinku nad optimální hranici významně zvyšuje riziko krvácení, naopak relativně malý pokles pod terapeutickou koncentraci léčiva je spjat se zvýšeným rizi-kem trombózy, tedy na jedné straně hrozí chřtán Charybdy, na straně druhé vábný zpěv zrádné Scylly. Proto je tolik důležité docílit stálé hladiny antikoagulancia bez výraznějších výkyvů, se standardní účinností u různých nemocných.
Warfarin
Warfarin má po perorálním podání sice prakticky 100% biologickou dostupnost a současně dostatečně dlouhý biologický poločas umož-ňující podání v jedné denní dávce, je však vůbec jedním z nejproblémovějších léčiv z hlediska velmi variabilní inter i intraindividuální antikoagulační účinnosti i z hlediska lékových interakcí, současného užití potravy nebo pití nápojů. Je biotransformován prostřednictvím enzymů CYP2C9 a CYP3A4, přičemž CYP2C9 je polymorfní. Navíc warfarin inhibuje vitamin K epoxid reduktázu, která je též poly-morfní. Jednotlivé polymorfní varianty jsou různě citlivé k působení antivitaminů K. To vše vede k předem obtížně odhadnutelnému antikoagulačnímu efektu warfarinu, k nezbytnosti monitorování jeho působení a k velmi širokému rozmezí podávaných dávek, které se mohou pohybovat od 1 mg do 10 mg denně, případně i více. Žádné jiné perorální antikoagulancium nemá tak významné rozdíly v dávkování a žádné jiné léčivo neprovází tolik popsaných lékových interakcí jako právě warfarin.
Nová perorální antikoagulancia
Farmakokinetické vlastnosti všech tří nových perorálních antikoagulancií byly opakovaně popsány v odborné literatuře primární i v rozsáhlejších přehledových článcích, např. [7–9].
Apixaban a rivaroxaban
Apixaban a rivaroxaban (v dávkách vyšších než 10 mg) se po perorálním podání vstřebávají přibližně ze dvou třetin, přičemž potrava ovlivňuje biologickou dostupnost v případě apixabanu jen nepatrně, v případě rivaroxabanu však zajišťuje téměř 100% biologickou dostupnost. Ačkoliv má rivaroxaban biologický poločas přibližně shodný (5–13 hodin) jako apixaban (8–15 hodin), podává se v jedné d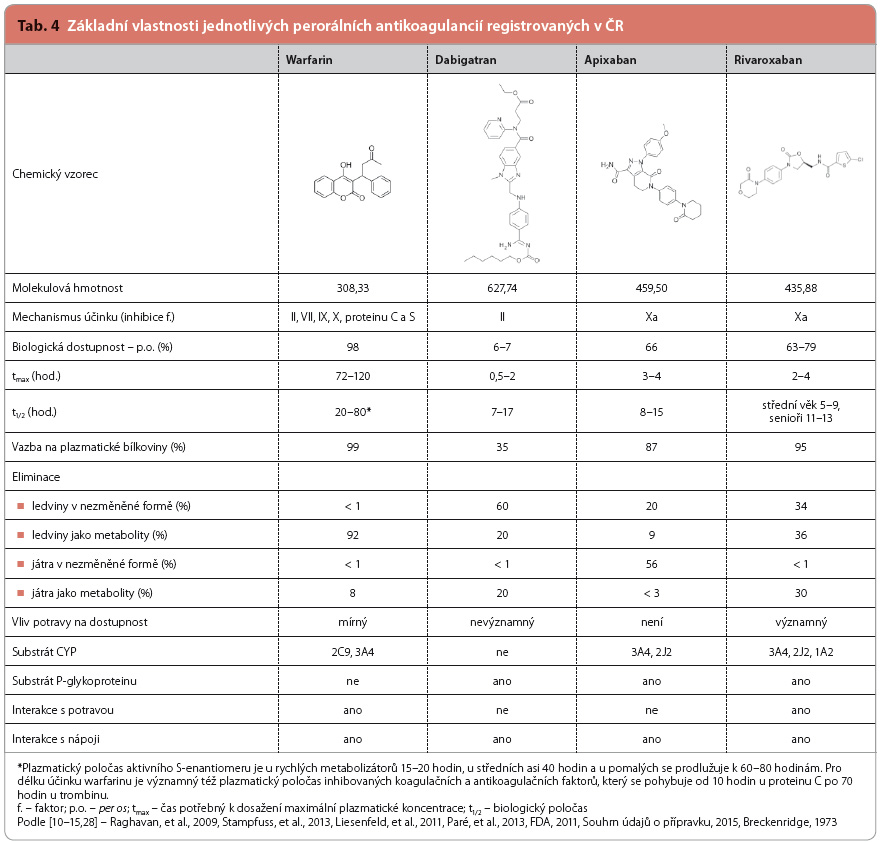 enní dávce, zatímco apixaban se podává ve dvou dílčích dávkách. Obě léčiva jsou substráty CYP3A4 a efluxního transportéru P glykoproteinu (P-gp). Vedle toho jsou obě léčiva biotrasformována dalšími (alternativními) cestami – apixaban z malé části pro-střednictvím CYP2J2, CYP2C8, CYP2C9, CYP1A2 a CYP2C19, rivaroxaban z malé části prostřednictvím CYP2J2 a dalšími cestami nezávislými na cytochromu P450. Apixaban se vylučuje převážně stolicí (56 %) a z menší části močí (29 %), přičemž většina podané dávky se vylučuje v nezměněné formě (68 %) [10]. Rivaroxaban se vylučuje převážně močí (70 %) a z menší části žlučí (30 %), při-čemž většina podané dávky se vylučuje ve formě již neaktivních metabolitů (66 %). Přehled viz tab. 4.
enní dávce, zatímco apixaban se podává ve dvou dílčích dávkách. Obě léčiva jsou substráty CYP3A4 a efluxního transportéru P glykoproteinu (P-gp). Vedle toho jsou obě léčiva biotrasformována dalšími (alternativními) cestami – apixaban z malé části pro-střednictvím CYP2J2, CYP2C8, CYP2C9, CYP1A2 a CYP2C19, rivaroxaban z malé části prostřednictvím CYP2J2 a dalšími cestami nezávislými na cytochromu P450. Apixaban se vylučuje převážně stolicí (56 %) a z menší části močí (29 %), přičemž většina podané dávky se vylučuje v nezměněné formě (68 %) [10]. Rivaroxaban se vylučuje převážně močí (70 %) a z menší části žlučí (30 %), při-čemž většina podané dávky se vylučuje ve formě již neaktivních metabolitů (66 %). Přehled viz tab. 4.
Biologická dostupnost rivaroxabanu je závislá na podávané dávce (výrobce uvádí, že „ve vyšších dávkách je absorpce rivaroxabanu omezena disolucí, dochází ke snížení biologické dostupností a stupeň absorpce se snižuje se zvyšující se dávkou“), a proto se rivaroxa-ban v dávkách 20 mg denně má užívat spolu s jídlem, pouze tak je možné zajistit dostatečnou biologickou dostupnost rivaroxabanu. Ten má totiž, podle výrobce, v dávkách do 10 mg biologickou dostupnost 80–100 %, zatímco v dávkách 20 mg má biologickou dostupnost 66 %, je li podán nalačno, a expozice se zvyšuje o 39 %, je li podán s jídlem [11]. Proto se mají dávky 15 mg, respektive 20 mg, užívat vždy s jídlem.
Dabigatran
Dabigatran se po perorálním podání, vzhledem k vysoké polaritě molekuly, nevstřebává. V klinické praxi se proto používá proléčivo dabigatranu – dabigatran etexilát, z něhož se po perorálním podání vstřebává kolem 6–7 %. Vstřebávání dabigatran etexilátu je částečně závislé na pH obsahu trávicího ústrojí, neboť při současném podávání dabigatranu a inhibitorů protonové pumpy dochází ke snížení biologické dostupnosti dabigatranu o 12,5 % [12]. Toto mírné snížení biologické dostupnosti dabigatranu však neovlivňuje jeho účinnost. Přehled farmakokinetických vlastností je uveden v tab. 4.
Tobolky léčiva musí být užity v celku a jejich obsah nesmí být užíván samostatně, neboť dochází k významnému zvýšení biologické dostupnosti (přibližně o 75 %). Vliv současného podání potravy je minimální. Dabigatran etexilát se rychle a kompletně metabolizuje prostřednictvím karboxylesteráz na dabigatran. Relativně menší význam má polymorfismus této esterázy, genotyp „loss of function“, který se objevuje asi u třetiny populace, je spojen se sníženou bioaktivací dabigatranu – asi o 15 % na každou afunkční alelu [13]. Ovšem i z relativně málo robustních dat je patrná klinická významnost této snížené dostupnosti dabigatranu – riziko krvácení bylo při snížené hladině významně nižší.
Proléčivo dabigatran etexilát je substrátem P-gp, zatímco vlastní účinná látka dabigatran jeho substrátem není. Dabigatran se částečně biotransformuje konjugací prostřednictvím glukuronosyltransferázy za vzniku čtyř částečně farmakologicky účinných glukuronidů. Vylučuje se převážně močí (80 %) a z malé části též žlučí (20 %). Také efluxní pumpa – P-gp – je polymorfní, asi čtvrtina populace má aktivitu vyšší a stejná část naopak aktivitu sníženou. Význam polymorfismu P-gp – jak na úrovni aktivity zvýšené (gain of function), tak snížené (loss of function) – nebyl doložen. V uvedené genetické podstudii mateřské studie RE LY autoři konstatovali slabou statistickou sílu analýzy, nicméně uzavírají, že varianty (esterázy i transportéru) určují systémovou expozici dabigatranu [13].
Ze všech uváděných antikoagulancií je pouze v případě dabigatranu biotransformace nezávislá na cytochromu P450.
Lékové interakce perorálních antikoagulancií
Warfarin je léčivem s nejvyšším popsaným počtem lékových interakcí (je jediným léčivem, které má standardně v databázích lékových interakcí uváděno 300 nebo více lékových interakcí), přičemž mnohé z nich jsou klinicky velmi závažné. Na druhou stranu jen velmi málo lékových interakcí warfarinu lze označit za kontraindikaci současného podávání příslušných léčiv (současné podávání fibrinolytik nebo silných inhibitorů CYP2C9, jako je bukální miconazol).
Ačkoli dabigatran, apixaban a rivaroxaban mají obecně nižší potenciál vyvolávat lékové interakce než warfarin, mají tato léčiva mnohem bohatší omezení, pokud se jedná o současné podávání některých léčiv.
Dabigatran
Proléčivo dabigatran etexilát (nikoliv však aktivní metabolit dabigatran) je substrátem P-gp. Současné podávání dabigatran etexilátu s inhibitory P-gp vede ke zvýšení expozice dabigatranu spojenému se zvýšením rizika krvácivých komplikací, proto je současné podává-ní silných inhibitorů P-gp (ketoconazol, ciclosporin, itraconazol, tacrolimus a dronedaron) považováno za kontraindikované. Tak jako inhibitory P-gp mohou expozici dabigatranu zvyšovat, mohou induktory P-gp expozici dabigatranu snižovat. Opakované podávání ri-fampicinu vedlo ke snížení plochy pod křivkou plazmatické koncentrace léčiva v čase po podání dabigatranu o 67 %, a proto výrobce dabigatranu v ČR i v USA uvádí, že je třeba se současnému podávání induktorů P-gp vyhnout.
Při studiu lékové interakce s dronedaronem bylo zjištěno, že jednorázové podání dabigatranu po opakovaném podávání droneda-ronu v terapeutických dávkách vedlo ke zvýšení plochy pod křivkou o 136 %, zatímco jednorázové podání dabigatranu 2 hodiny před podáním dronedaronu zvýšilo plochu pod křivkou dabigatranu pouze o 30 % [14]. V případě lékové interakce s verapamilem bylo zjištěno, že velikost rozsahu změn farmakokinetických vlastností dabigatranu záleží na lékové formě verapamilu (při užívání léko-vých forem s okamžitým uvolňováním léčivé látky došlo ke zvýšení plochy pod křivkou o 150 %, při užívání retardovaných lékových forem došlo ke zvýšení plochy pod křivkou o 70 %) a na délce podávání obou léčiv, neboť při opakovaném podávání se rozsah zjiš-těných změn snižuje. Nadto velmi záleží na časovém odstupu podání obou léčiv; pokud byl verapamil podán 2 hodiny po podání dabigatranu, došlo ke zvýšení plochy pod křivkou dabigatranu pouze o 20 % a maximální plazmatické koncentrace se prakticky nezměnily.
V rámci klinické studie RE LY byl u zhruba šesti tisíc pacientů s fibrilací síní zkoumán vliv různých faktorů na farmakokinetické vlastnosti dabigatranu podávaného dlouhodobě v denních dávkách 220 mg nebo 300 mg [2,12]. Celkem bylo provedeno 27 706 stanove-ní koncentrace dabigatranu v plazmě, z toho 5,1 % stanovení bylo provedeno u pacientů, kteří současně užívali i verapamil. Bylo zjiště-no, že verapamil zvýšil expozici dabigatranu o 23 %.
Je tedy zřejmé, že:
- k lékovým interakcím dabigatranu s inhibitory P-gp dochází výhradně při procesu vstřebávání,
- inhibice intestinálního P-gp je relativně krátkodobá (a trvá pouze několik hodin),
- závažnost lékové interakce se může měnit dle použité lékové formy a dále dle časových odstupů podávání obou interagujících léčiv.
Význam lékových interakcí pro bioaktivaci dabigatran etexilátu na úrovni karboxylesteráz (zejména karboxylesterázy 1, CES 1) není prověřen, nicméně mnohá psychofarmaka nebo další často užívaná léčiva či potraviny (enalapril, grapefruit, ethanol) mohou být vý-znamnými inhibitory.
Časově velmi omezená interakce na úrovni dostupnosti dabigatran etexilátu je patrně příčinou toho, že v USA není, na rozdíl od Evropy, podávání dabigatranu se silnými inhibitory P-gp považováno za kontraindikované – s podmínkou, že se jedná o pacienty s normální funkcí ledvin [15]. Za předpokladu současného užívání inhibitorů P-gp se v USA v případě pacientů s clearance kreatininu 30–50 ml/min má zvážit redukce dávek dabigatranu na 75 mg 2krát denně a při clearance kreatininu ≤ 29 ml/min a současném podávání se silnými inhibitory P-gp nemá být dabigatran podáván (což je shodné i v ČR).
Apixaban a rivaroxaban
Pro apixaban a rivaroxaban platí, že obě léčiva jsou substráty izoenzymu CYP3A4 a transportéru P-gp. Silné inhibitory CYP3A4 a P-gp nejsou výrobci obou léčiv doporučeny k současnému podávání s apixabanem, respektive s rivaroxabanem. Vzhledem k tomu, že v případě apixabanu a rivaroxabanu jsou substráty CYP3A4 a P-gp vlastní účinné látky, může docházet k interakcím na úrovni CYP3A4 i P-gp jak ve fázi vstřebávání, tak i ve fázi distribuce v organismu či ve fázi eliminace. Z tohoto důvodu nebudou časové odstupy mezi podáním jednotlivých léčiv, případně použitá léková forma hrát u apixabanu nebo rivaroxabanu významnější roli, neboť se nebude jednat o „pouhou“ inhibici intestinálního P-gp, ale o systémovou inhibici CYP3A4 a P-gp.
Která léčiva lze označit za silné inhibitory a jaká je definice silného inhibitoru CYP3A4, je v souhrnech údajů o přípravcích (SPC) všech léčiv registrovaných v ČR na první pohled dosti nejasné. Vycházíme li z tabelárního přehledu FDA (Food and Drug Administrati-on), doporučení EMA (European Medicine Agency), a zejména z posledního doporučení FDA, je výčet silných inhibitorů CYP3A4 a P-gp z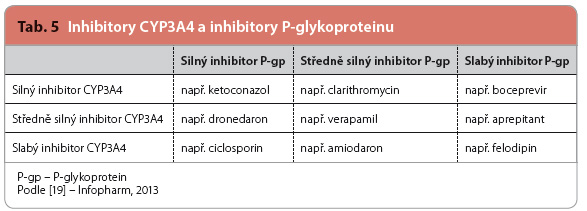 řetelnější [11–18]. Silným inhibitorem CYP3A4 je takové léčivo, které buď zvýší expozici (plochu pod křivkou plazmatické koncentrace léčiva v čase po podání) specifickému substrátu CYP3A4 (nejčastěji je používán midazolam) na 5násobek a více nebo sníží celkovou clearance tohoto substrátu o více než 80 %. Definice silného inhibitoru P-gp vychází ze stejných zdrojů, přičemž za silný inhi-bitor P-gp je považováno léčivo, které zvýší expozici citlivým substrátům P-gp (nejčastěji se používá digoxin nebo fexofenadin) na více než 1,5násobek.
řetelnější [11–18]. Silným inhibitorem CYP3A4 je takové léčivo, které buď zvýší expozici (plochu pod křivkou plazmatické koncentrace léčiva v čase po podání) specifickému substrátu CYP3A4 (nejčastěji je používán midazolam) na 5násobek a více nebo sníží celkovou clearance tohoto substrátu o více než 80 %. Definice silného inhibitoru P-gp vychází ze stejných zdrojů, přičemž za silný inhi-bitor P-gp je považováno léčivo, které zvýší expozici citlivým substrátům P-gp (nejčastěji se používá digoxin nebo fexofenadin) na více než 1,5násobek.
Podle rozsahu změn farmakokinetických vlastností, jak je uvedeno výše, pak lze jednotlivá léčiva relativně snadno (jsou li přísluš-né studie dostupné) rozdělit na zástupce silných, středně silných nebo slabých inhibitorů [19]. Ketoconazol v dávkách 400 mg denně patří k nejsilnějším inhibitorům CYP3A4, neboť zvyšuje expozici substrátu midazolamu více než 15krát, a současně patří k nejsilnějším inhibitorům P-gp, neboť zvyšuje expozici substrátu fexofenadinu více než 2,5krát. Příklady inhibitorů P-gp a CYP3A4 uvádí tab. 5.
Některé silné inhibitory CYP3A4 jsou slabými inhibitory P-gp (např. boceprevir) nebo nemají na refluxní pumpu P-gp žádný rele-vantní vliv (např. voriconazol). V této souvislosti je třeba uvést, že výrobci apixabanu i rivaroxabanu současné podávání voriconazolu nedoporučují. Na druhé straně telaprevir, který splňuje podmínku silného inhibitoru CYP3A4 a P-gp, mezi vyjmenovanými nedoporuče-nými léčivy nefiguruje. Z tohoto důvodu lze předepisujícím lékařům doporučit, aby byli opatrní při současném předepisování léčiv, která jsou významnými inhibitory CYP3A4 a současně významně inhibují efluxní transportní systém P-gp.
Podle názoru autorů by totiž bylo možné usuzovat na to, že z hlediska rozsahu změn farmakokinetických vlastností apixabanu a rivaroxabanu bude inhibice P-gp patrně hrát významnější roli ve srovnání s inhibicí CYP3A4, protože se blokáda efluxní transportní pumpy P-gp uplatní v enterocytu, v hepatocytu i v renální tubulární buňce. Možným odůvodněním by mohlo být zvýšení expozice riva-roxabanu při současném podávání clarithromycinu o 54 % (clarithromycin je silný inhibitor CYP3A4 a podle vyjádření výrobce středně silný inhibitor P-gp). Patrně i z toho důvodu uvádí výrobce rivaroxabanu, že by dronedaron (silný inhibitor P-gp a středně silný inhibitor CYP3A4) neměl být podáván spolu s rivaroxabanem (vzhledem k omezeným klinickým údajům, které jsou k dispozici). To vcelku dobře koresponduje se zjištěním výrobce apixabanu, že slabý inhibitor P-gp naproxen zvyšuje expozici apixabanu o 55 %, naproxen přitom nemá na inhibici CYP3A4 vliv [20].
V s![Graf 1 Změny expozice (plochy pod křivkou) midazolamu (standardnímu substrátu izoenzymu CYP3A4) při současném podávání uvedených léčiv (inhibitorů CYP3A4); podle [18–20] – Drug interaction studies, 2012, Infopharm, 2013, Zhang, et al., 2013.](https://www.remedia.cz/photo-a-30153---.jpg) oučasné době by bylo předčasné vyslovovat definitivní závěry, bylo by třeba mít k dispozici cílené studie se silnými inhibitory P-gp bez vlivu na CYP3A4 (např. s chinidinem) nebo s pouze slabým inhibičním působením na CYP3A4 (např. s ciclosporinem). Pro apixaban i rivaroxaban a ciclosporin jsou již k dispozici údaje zjištěné in vitro na Caco 2 buňkách, ze kterých vyplývá téměř kompletní inhibice efluxu apixabanu, respektive rivaroxabanu [20,21]. Pouze pro úplnost je třeba uvést, že nová studie doložila též inhibici efluxu dabigatranu ciclosporinem na Caco 2 buňkách [21].
oučasné době by bylo předčasné vyslovovat definitivní závěry, bylo by třeba mít k dispozici cílené studie se silnými inhibitory P-gp bez vlivu na CYP3A4 (např. s chinidinem) nebo s pouze slabým inhibičním působením na CYP3A4 (např. s ciclosporinem). Pro apixaban i rivaroxaban a ciclosporin jsou již k dispozici údaje zjištěné in vitro na Caco 2 buňkách, ze kterých vyplývá téměř kompletní inhibice efluxu apixabanu, respektive rivaroxabanu [20,21]. Pouze pro úplnost je třeba uvést, že nová studie doložila též inhibici efluxu dabigatranu ciclosporinem na Caco 2 buňkách [21].
Některé středně silné inhibitory CYP3A4 jsou současně silnými inhibitory P-gp (erythromycin, verapamil). Příklady takových rozdí-lů jsou uvedeny v grafech 1 a 2.
Je třeba zmínit, že schopnost inhibovat CYP3A4 má i grapefruitová šťáva, která je součas![Graf 2 Změny expozice (plochy pod křivkou) digoxinu nebo fexofenadinu (standardním substrátům P-glykoproteinu) při současném podávání uvedených léčiv – inhibitorů P-glykoproteinu; podle [18–20] – Drug interaction studies, 2012, Infopharm, 2013, Zhang, et al., 2013.](https://www.remedia.cz/photo-a-30154---.jpg) ně inhibitorem P glykoproteinu. Americký úřad FDA považuje grapefruitovou šťávu za silný inhibitor CYP3A4/P-gp [18]. Z tohoto důvodu rozhodně nelze k zapíjení perorálních antikoagulancií doporučit právě grapefruitovou šťávu. Je s podivem, že tato informace není žádným z výrobců uváděna v SPC.
ně inhibitorem P glykoproteinu. Americký úřad FDA považuje grapefruitovou šťávu za silný inhibitor CYP3A4/P-gp [18]. Z tohoto důvodu rozhodně nelze k zapíjení perorálních antikoagulancií doporučit právě grapefruitovou šťávu. Je s podivem, že tato informace není žádným z výrobců uváděna v SPC.
Podávání apixabanu a rivaroxabanu se podle výrobců těchto léčiv nedoporučuje v případě současného užívání silných inhibitorů CYP3A4 a P-gp, přičemž výrobce apixabanu uvádí tyto látky: celkově podávané silné inhibitory CYP3A4 i P-gp, jako jsou například azolová antimykotika (např. ketoconazol, itraconazol, voriconazol a posaconazol) a inhibitory HIV proteázy (např. ritonavir), a výrobce rivaroxabanu uvádí následující výčet: systémová azolová antimykotika (jako jsou ketoconazol, itraconazol, voriconazol a posaconazol) nebo inhibitory HIV proteáz (například ritonavir).
Současné podávání léčivých přípravků, které jsou kontraindikované nebo nejsou doporučené, je z praktického hlediska téměř shodné. Z právního hlediska je třeba dodat, že současné podávání kontraindikovaného léčiva nebo současné podávání nedoporučeného léčiva není postupem v souladu s pokyny uvedenými v SPC. Ustanovení § 8 odst. 4 zákona č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů (v platném znění) uvádí: „Ošetřující lékař může, pokud není léčivý přípravek distribuován nebo není v oběhu léčivý přípravek potřebných terapeutických vlastností, použít registrovaný léčivý přípravek způsobem, který není v souladu se souhrnem údajů o přípravku, je li však takový způsob dostatečně odůvodněn vědeckými poznatky.“ Prakticky to znamená, že současné podávání např. ketoconazolu je možné pouze za splnění podmínky uvedené v ustanovení § 8 odst. 4, což ale představuje při dostupnosti warfarinu a možnosti jeho současného podávání s ketoconazolem v podstatě nesplnitelnou podmínku.
Navíc je potřeba mít na paměti, že podle ustanovení § 8 odst. 5 poskytovatel zdravotních služeb odpovídá za škodu na zdraví nebo za usmrcení člověka, k nimž došlo v důsledku podání registrovaného léčivého přípravku způsobem, který není v souladu se SPC, a to i v případě, že podmínky uvedené v § 8 odst. 4 byly splněny. To může pro lékaře nebo pro zdravotnická zařízení představovat značné riziko.
Dávkování perorálních antikoagulancií
Dabigatran
Doporučené dávkování dabigatranu v indikaci prevence CMP/SE u pacientů s nevalvulární fibrilací síní je 150 mg 2krát denně. Toto dávkování zajišťuje jen nevýznamnou fluktuaci plazmatických koncentrací a tím i účinku (statisticky významně vyššího ve srovnání s warfarinem). Změny dávkování musí být provedeny u pacientů starších 80 let (zejména kvůli očekávanému snížení glomerulární filtra-ce), a to na 110 mg 2krát denně. Stejné snížení dávky je třeba provést u pacientů současně užívajících verapamil, respektive je možné dávku snížit po zvážení případného rizika krvácení u konkrétního pacienta (např. při vysokém riziku krvácení u pacienta se středně zá-važnou poruchou funkce ledvin apod.). Protože se dabigatran (a jeho metabolity) vylučují převážně močí, je nezbytné pravidelně (nejmé-ně 1krát ročně) sledovat funkční stav ledvin, konkrétně clearance kreatininu
Apixaban
Doporučené dávkování apixabanu v indikaci prevence CMP/SE u pacientů s nevalvulární fibrilací síní je 5 mg 2krát denně. I v tomto případě zajišťuje toto dávkování jen zanedbatelnou fluktuaci plazmatických koncentrací léčiva a tím i účinku (statisticky významně vyššího ve srovnání s warfarinem). Změny dávkování musí být provedeny při kumulativním výskytu nejméně dvou následujících situací: pacienti starší 80 let, pacienti s tělesnou hmotností ≤ 60 kg a pacienti s plazmatickou koncentrací kreatininu ≥ 133 μmol/l (tj. přibližně s clearance kreatininu < 50 ml/min). V tomto případě se podává 2,5 mg apixabanu 2krát denně.
Rivaroxaban
Doporučené dávkování rivaroxabanu v indikaci prevence CMP/SE u pacientů s nevalvulární fibrilací síní je 20 mg 1krát denně. Zm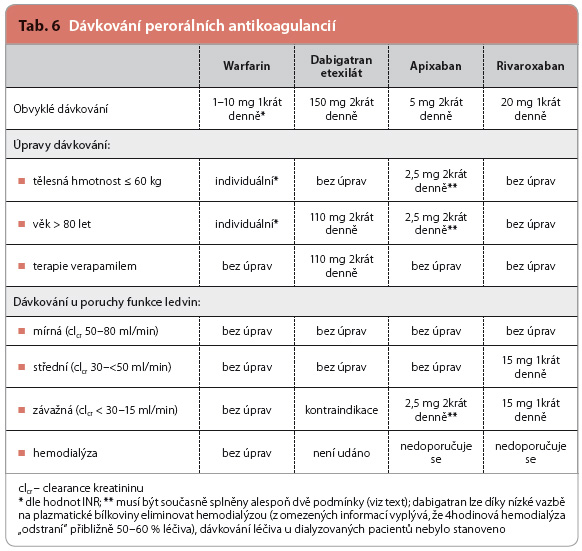 ěny dávkování musí být provedeny v případě středně závažné až závažné poruchy funkce ledvin. V tomto případě se podává 15 mg rivaroxa-banu 1krát denně. Přehled dávkování a jeho případné úpravy shrnuje tab. 6.
ěny dávkování musí být provedeny v případě středně závažné až závažné poruchy funkce ledvin. V tomto případě se podává 15 mg rivaroxa-banu 1krát denně. Přehled dávkování a jeho případné úpravy shrnuje tab. 6.
Shrnutí
Na základě blízkosti farmakokinetických údajů, zejména délky biologického poločasu, lze usuzovat na to, že všechna léčiva ze skupiny nových perorálních antikoagulancií mají velmi obdobnou délku působení. Dabigatran i apixaban se v indikaci CMP/SE podávají ve dvou dílčích dávkách, zatímco rivaroxaban se podává v jedné denní dávce. Na druhou stranu se rivaroxaban v indikaci léčby hluboké žilní trombózy a plicní embolie podává (po dobu prvních tří týdnů terapie) ve dvou dílčích dávkách. Rozdíly v četnosti dávkování jednotli-vých léčiv a jejich účinnosti mohou být předmětem úvah o výhodnosti jedné či druhé frekvence podávání.
Z hlediska důkazů, které jsou v současné době v této oblasti k dispozici, je však třeba konstatovat, že se význam frekvence podávání 1krát denně ve srovnání s frekvencí 2krát denně pravděpodobně poněkud přeceňuje, alespoň co se compliance pacientů týče. V roce 2001 byl publikován rozsáhlý systematický přehled studií, z něhož obecně (napříč všemi studovanými lékovými skupinami) vyplývá, že ačko-liv je compliance pacientů v případě dávkování 1krát denně relativně vysoká (79 ± 14 %, s rozptylem 35–97 %), není statisticky vý-znamně rozdílná od compliance při dávkování 2krát denně (69 ± 15 %, s rozptylem 38–90 %) [22–24]. V obou případech (dávkování 1krát denně a dávkování 2krát denně) však bylo prokázáno, že teprve dávkování 4krát denně, respektive dávkování 3krát denně (v porovnání s dávkováním 1krát denně), je spojeno se statisticky významně zhoršenou compliance pacientů. V případě terapie léčivy kardiovaskulárních onemocnění se compliance pacientů pohybuje mezi 39–93 % s průměrem 73 %, větší rozptyl compliance je spojen s podáváním antihypertenziv (39–93 %) než ostatních sledovaných léčiv v kardiovaskulárních indikacích (64–93 %). Novější metaanalý-za sice prokázala v případě podávání antihypertenziv lepší compliance pacientů při dávkování 1krát denně ve srovnání s dávkováním 2krát denně (poměr šancí, odds ratio – OR – 2,42; 95% CI: 1,33–4,40; p = 0,004), avšak perzistence pacientů při léčbě kardiovaskulár-ních onemocnění byla shodná při podávání přípravku 1krát denně nebo 2krát denně (OR 0,85; 95% CI: 0,65–1,11; p = 0,235) [25]. V nedávné minulosti byla též sledována problematika compliance přímo u pacientů s diagnózou nevalvulárních fibrilací síní, u nichž byla nově zahájena terapie diabetu nebo arteriální hypertenze [26]. Ve studii bylo porovnáváno podávání 1krát denně a 2krát denně ve vztahu k MPR (medication possession ratio, počet dnů, na které je léčba předepsána, dělený počtem dnů mezi jednotlivými vyzvednutími léků) a k PDC (proportion of days covered, počet dnů, kdy měl pacient potřebný lék k dispozici). Při podávání 1krát denně byla zjištěna lepší hodnota MPR (OR 1,26; 95% CI: 1,13–1,41) a lepší hodnota PDC (OR 1,23; 95% CI: 1,07–1,41). Charakteristiky sledovaných pacientů (zejména ve vztahu k věku) však byly ve srovnání s pacienty zařazenými do studií RE LY, ARISTOTLE nebo ROCKET AF zásadně odlišné a nejednalo se o podávání perorálních antikoagulancií, ale perorálních antidiabetik nebo antihypertenziv.
Na základě studií fáze III klinického hodnocení bylo doloženo, že obě léčiva podávaná 2krát denně (dabigatran v dávkách 150 mg 2krát denně a apixaban v dávkách 5 mg 2krát denně) vykázala v příslušných studiích superioritu vůči warfarinu, zatímco účinek rivaro-xabanu podávaného v jedné denní dávce se od účinnosti warfarinu statisticky významně nelišil [1–3]. Je tedy nepravděpodobné, že by podávání v jedné denní dávce bylo klinicky výhodné. Nicméně je třeba zdůraznit, že jakékoliv zásadní porovnání účinnosti a bezpečnosti těchto léčiv není dosud dost dobře možné, neboť to dostupná data v plném rozsahu neumožňují. Chybí přímé srovnání ve studiích he-ad to head.
Je však možné zdůraznit a shrnout stávající rozdíly v míře rizika lékových interakcí. V případě dabigatranu se interakce mohou pro-jevovat prakticky pouze v čase jeho vstřebávání, neboť po vstupu dabigatranu do systémového oběhu, podle dosud známých vlastností tohoto léčiva, k interakcím nedochází; pro apixaban a rivaroxaban naopak platí, že k lékovým interakcím dochází jak v procesu vstřebá-vání těchto léčiv, tak i při jejich biotransformaci a eliminaci. Skutečnost, že apixaban a rivaroxaban jsou substráty CYP3A4 (i když jistě s nevelkou afinitou), musí při poměrně vysokém počtu známých silných inhibitorů tohoto izoenzymu a při vysoké míře současné inhibice P-gp nutně vést k řadě opatrností při současné medikaci již nyní, neboť na téma lékových interakcí nepochybně budou publikovány další upřesňující informace. Tyto informace by měly upřesnit nejen výčet současně podávaných léčiv, jejichž aplikace vyžaduje opatrnost, ale zejména by měly odpovědět na otázku, zda při dlouhodobém podávání těchto léčiv je význam příslušné lékové interakce obdobný vý-znamu zjištěnému při akutním podání, či zda je odlišný.
Zcela na závěr je nutno si položit otázku: Jsou rozdíly v expozici jednotlivým novým antikoagulanciím při současném podávání středně silných či slabších inhibitorů transportéru P-gp či izoenzymu CYP3A4 klinicky významné? Současná léčba inhibitory (zpravidla obou systémů) je v praxi velmi častá. Ke středně silným inhibitorům patří např. verapamil, antiarytmika amiodaron a propafenon, sartany telmisartan a candesartan či psychofarmaka paroxetin, fluoxetin a řada dalších. Ke slabším patří např. atorvastatin a simvastatin.
Samotná kombinace dabigatran etexilátu například se současně podaným verapamilem (240 mg v lékové formě s prodlouženým účinkem) zvýší expozici dabigatranu o 50–70 % [27]. Při chronickém souběhu podávání dabigatranu s verapamilem se zvýšila expozice o 50–60 %. Obdobný, pouze o něco menší význam má současné podávání amiodaronu [12]. Zjištěný vzestup expozice o 50 % je na hranici klinického významu. Nicméně, například rozdíl 30–40 % v dávce dabigatranu (2krát 110 mg versus 2krát 150 mg) vedl k vzestupu rizika velkého krvácení o 10–20 %.
Podobně dochází ke zvýšení expozice při kombinaci rivaroxabanu či apixabanu se středně silnými inhibitory oxidázy CYP3A4 a P-gp – zvýšení expozice xabanům o 20–40 % rovněž nemá zásadní význam. Přistoupí li však faktory další – pokles renálních či jater-ních funkcí, vyšší věk, nízká hmotnost – dosáhne zvýšení expozice již klinicky významných hodnot, bezpečnost léčby pak klesá. V případě apixabanu výrobce počítá s kumulací efektu jednotlivých faktorů zvyšujících expozici (senior, renální nedostatečnost a nízká hmotnost). Při souběhu dvou faktorů doporučuje volit dávku poloviční. Lékové interakce na této úrovni však zatím explicitně neuvádí. Přitom je jejich významnost obdobná a klinik by je měl v zájmu nemocného zohlednit. Ostatní výrobci i regulační orgány – z důvodu zjednodušení dávkování – problém neřeší.
Je to škoda, nerespektování faktorů ovlivňujících riziko krvácení může navodit situaci, která se objevila v prvých měsících po zavedení nových perorálních antikoagulancií v Austrálii a na Novém Zélandu. Neznalost kontraindikací a faktorů zvyšujících riziko krvácení při léčbě novými perorálními antikoagulancii vedla k významnému nárůstu výskytu krvácivých epizod a k přechodné diskreditaci léčby. Chy-ba přitom nebyla v léku, ale v lékaři.
Seznam použité literatury
- [1] Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361: 1139–1151.
- [2] Granger CB, Alexander JH, McMurray JJ, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365: 981–992.
- [3] Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011; 365: 883–891.
- [4] Ruff CT, Giugliano RP, Braunwald E. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta analysis of randomised trials. Lancet 2014; 383: 955–962.
- [5] Wallentin L, Yusuf S, Ezekowitz MD, et al. Efficacy and safety of dabigatran compared with warfarin at different levels of international normalised ratio control for stroke prevention in atrial fibrillation: an analysis of the RE LY trial. Lancet. 2010; 376: 975–983.
- [6] Connolly SJ, Ezekowitz MD, Yusuf S, et al. Newly identified events in the RE LY trial. N Engl J Med 2010; 363: 1875–1876.
- [7] Ericsson BI, Quinlan DJ, Weitz JI. Comparative Pharmacodynamics and Pharmacokinetics of Oral Direct Thrombin and Factor Xa Inhibitors in Development. Clin Phar-macokinet 2009; 48: 1–22.
- [8] Poulsen BK, Grove EL, Husted SJ. New Oral Anticoagulants. A Review of the Literature with Particular Emphasis on Patients with Impaired Renal Function. Drugs 2012; 72: 1739–1753.
- [9] Biondi Zoccai G, Malavasi V, D’Ascenzo D, et al. Comparative effectiveness of novel oral anticoagulants for atrial fibrillation: evidence from pair wise and warfarin controlled network meta analyses. HSR Proc Intensive Care Cardiovasc Anesth 2013; 5: 40–54.
- [10] Raghavan N, Frost CE, Yu Z, et al. Apixaban metabolism and pharmacokinetics after oral administration to humans. Drug Metab Dispos 2009; 37: 74–81.
- [11] Stampfuss J, Kubictza D, Becka M, Mueck W. The effect of food on the absorption and pharmacokinetics of rivaroxaban. Int J Clin Pharmacol Ther 2013; 51: 549–561.
- [12] Liesenfeld HK, Lehr T, Dansirikul C, et al. Population pharmacokinetic analysis of the oral thrombin inhibitor dabigatran etexilate in patients with non valvular atrial fibrillation from the RE LY trial. J Thromb Haemost 2011; 9: 2168–2175.
- [13] Paré G, Eriksson N, Lehr T, et al. Genetic determinants of dabigatran plasma levels and their relation to bleeding. Circulation 2013; 127: 1404–1412.
- [14] Clinical Pharmacology and Biopharmaceutics review. Dabigatran, NDA 20512 (http://www.accessdata.fda.gov/drugsatfda_docs/nda/
- [15] Product Information Pradaxa (USA, April 2013, Boehringer Ingelheim) (http://www.accessdata.fda.
- [16] Drug Development and Drug Interactions: Table of Substrates, Inhibitors and Inducers, FDA (http://www.fda.gov/drugs/developmentapprovalprocess/developmentresources/druginteractionslabeling/ucm093664.htm), navštíveno 10. 3. 2015.
- [17] Guideline on the Investigation of Drug Interactions
- [18] Guidance for Industry. Drug Interaction Studies – Study Design, Data Analysis, Implications for Dosing, and Labeling Recommendations (FDA, February 2012) (http://www.solvobiotech.com/documents
- [19] Databáze lékových interakcí Infopharm, 45. elektronické vydání, 2013.
- [20] Zhang D, He K, Herbst JJ, et al. Characterization of efflux transporters involved in distribution and disposition of apixaban. Drug Metab Dispos 2013; 41: 827–835.
- [21] Gschwind L, Rollason V, Daali Y, et al. Role of P glycoprotein in the uptake/efflux transport of oral vitamin K antagonists and rivaroxaban through the Caco 2 cell model. Basic Clin Pharmacol Toxicol 2013; 113: 259–265.
- [22] Kishimoto W, Ishiguro N, Ludwig Schwellinger E, et al. In Vitro Predictability of Drug drug Interaction Likelihood of P glycoprotein mediated Efflux of Dabigatran Etexilate Based on [I]2/IC50 Threshold. Drug Metab Dispos 2014; 42: 257–263.
- [23] Lopez RD, Al Khatib SM, Wallentin L, et al. Efficacy and safety of apixaban compared with warfarin according to patient risk of stroke and of bleeding in atrial fibrillati-on: a secondary analysis of a randomised controlled trial. Lancet 2012; 380: 1749–1758.
- [24] Claxton AJ, Cramer J, Pierce C. A Systematic Review of the Associations Between Dose Regimens and Medication Compliance. Clin Ther 2001; 23: 1296–1310.
- [25] Srivastava K, Arora A, Kataria A, et al. Impact of reducing dosing frequency on adherence to oral therapies: a literature review and meta analysis. Patient Prefer Adheren-ce 2013; 7: 419–434.
- [26] Laliberte F, Nelson WW, Lefebvre P, et al. Impact of daily dosing frequency on adherence to chronic medications among nonvalvular atrial fibrillation patients. Adv Ther 2012; 29: 675–690.
- [27] Härtter S, Sennewald R, Nehmiz G, Reilly P. Oral bioavailability of dabigatran etexilate (Pradaxa(®)) after co medication with verapamil in healthy subjects. Br J Clin Pharmacol 2013; 75: 1053–1062.
- [28] Breckenridge A, Orme M, Wessling H, et al. Pharmacokinetics and pharmacodynamics of the enantiomers of warfarin in man. Clin Pharmacol Ther 1973; 15: 424–430.