Perspektivní farmakoterapeutické možnosti u diabetické a cytostatiky indukované neuropatie
Diabetická a cytostatiky indukovaná periferní neuropatie patří mezi časté formy periferních neuropatií. I přes rozdílnou primární etiologii mají tyto neuropatie společné patogenetické faktory vedoucí v konečném důsledku k poškození periferních nervů a k podobné symptomatologii. Významnými spojovacími prvky podílejícími se na vzniku diabetické i cytostatiky indukované neuropatie jsou především oxidační stres, zánět a snížené hladiny růstových faktorů. V tomto sdělení jsou shrnuty výsledky preklinických i klinických studií s přírodními látkami trans-resveratrolem, kurkuminem a mangiferinem, které jsou perspektivně využitelné v léčbě neuropatií a jsou vybrány právě na základě společných patogenetických rysů obou forem onemocnění.
Úvod
Periferní neuropatie jsou symptomatologicky i etiologicky rozmanitým souborem onemocnění. Mohou být primárním neurologickým onemocněním, které je způsobeno mechanickým poškozením nervu. Jsou diagnostikovány jako komplikace chronických metabolických onemocnění – diabetická periferní neuropatie (DPN) – nebo mohou být projevem toxicity aplikovaných léčiv – cytostatiky indukovaná periferní neuropatie (CIPN). I přes různou etiologii je jejich primárním znakem poškození periferních nervů, jež vede k řadě nepříjemných symptomů zatěžujících pacienta. DPN a CIPN patří mezi nejčastější formy periferních neuropatií.
DPN je jednou z běžných komplikací diabetu a nejčastějším typem periferní neuropatie vůbec. Vzhledem k poškození různých typů nervových vláken je toto onemocnění značně heterogenní ve své symptomatologii a často může probíhat i v asymptomatické formě. Epidemiologické studie popisující incidenci DPN se ve svých výsledcích značně rozcházejí, pravděpodobně podle metodiky použité pro stanovení DPN. Riziko vzniku DPN roste s délkou trvání diabetu bez ohledu na typ diabetu – u chronických diabetiků incidence přesahuje 50 % [1, 2].
Na rozdí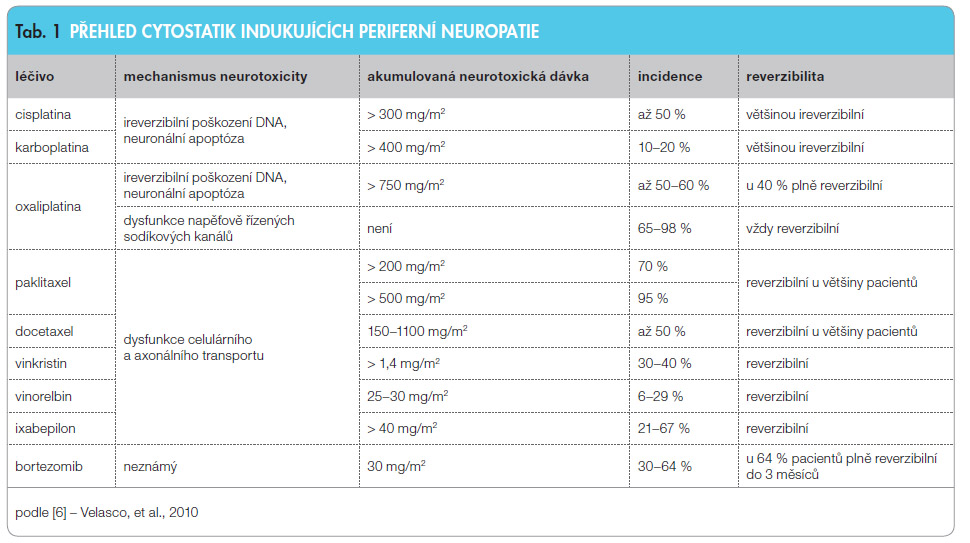 l od DPN je CIPN klasickým nežádoucím účinkem léčiv vycházejícím z nízké selektivní toxicity některých cytostatik, jedná se o nejčastější neurologickou komplikaci spojenou s podáním cytostatik. CIPN postihuje 30–40 % pacientů léčených cytostatiky [3], nejčastěji je ale popisována u pacientů léčených cisplatinou, oxaliplatinou, paklitaxelem, vinkristinem nebo bortezomibem, kde incidence dosahuje i více než 60 % [4, 5]. Riziko vzniku CIPN, závažnost a charakter poškození vzhledem k reverzibilitě závisí nejen na samotném použitém léčivu, ale zejména na jeho dávce a délce expozice, viz tab. 1 [6].
l od DPN je CIPN klasickým nežádoucím účinkem léčiv vycházejícím z nízké selektivní toxicity některých cytostatik, jedná se o nejčastější neurologickou komplikaci spojenou s podáním cytostatik. CIPN postihuje 30–40 % pacientů léčených cytostatiky [3], nejčastěji je ale popisována u pacientů léčených cisplatinou, oxaliplatinou, paklitaxelem, vinkristinem nebo bortezomibem, kde incidence dosahuje i více než 60 % [4, 5]. Riziko vzniku CIPN, závažnost a charakter poškození vzhledem k reverzibilitě závisí nejen na samotném použitém léčivu, ale zejména na jeho dávce a délce expozice, viz tab. 1 [6].
Obě dvě formy periferních neuropatií jsou vážnými komplikacemi primárních onemocnění. DPN se podílí na ulceraci a nutnosti amputace dolních končetin [7] a u onkologických pacientů často dochází ke zlehčování symptomů pacientem vzhledem k obavám souvisejícím se snížením dávky cytostatika, a tím i účinnosti terapie, nebo kvůli obavám z úplného přerušení léčby [6]. Z tohoto pohledu je vhodné vzniku DPN i CIPN předcházet nebo jejich symptomy významně mírnit. Současné terapeutické možnosti jsou zaměřeny především na bolestivé symptomy periferních neuropatií, podávání léčiv je zatíženo výskytem nežádoucích účinků a častými lékovými interakcemi. Nové látky nejen mírnící symptomy, ale zasahující do patogeneze samotného onemocnění by u pacientů s neuropatiemi významně rozšířily farmakoterapeutické možnosti.
Etiologie DPN
Ve stručnosti lze patogenezi DPN shrnout jako kombinaci negativního vlivu hyperglykemie přímo na neuron a poruch mikrocirkulace vedoucích k ischemickému poškození neuronů. Při detailnějším pohledu lze nalézt sedm základních faktorů, které se na poškození periferních neuronů u diabetiků podílejí.
Polyolová metabolická dráha
Přetrvávající hyperglykemie vede ke zvýšené substrátové nabídce pro alternativní cestu metabolizace glukózy přes aldózoreduktázu, která produkuje sorbitol a ten je dále utilizován na fruktózu [8]. Vysoká intracelulární koncentrace sorbitolu vede k hypertonickému prostředí uvnitř neuronu a k úniku osmoticky aktivních komponent myo-inositolu a taurinu z neuronu [9]. Se zvýšením metabolické aktivity aldózoreduktázy klesá i množství intracelulárního NADPH (nikotinamid adenin dinukleotid fosfát) potřebného k regeneraci glutathionu, což se společně s únikem taurinu podílí i na zvýšeném oxidačním stresu uvnitř neuronu. Dalším důsledkem aktivace polyolové dráhy je zvýšená aktivita proteinkinázy C (PKC).
Hexosaminová dráha
Jedním z metabolických meziproduktů při glykolýze je fruktóza-6-fosfát, která je zčásti metabolizována na glukosamin-6-fosfát a dále na uridindifosfát-N-acetyl-glukosamin (UDP-GlcNAc). Tato látka je ligandem různých transkripčních faktorů a mění transkripci specifických genů [8]. Aktivace transkripčního faktoru Sp1 vede následně ke zvýšené expresi genů pro transformační růstový faktor β1 (transforming growth factor beta 1, TGF-β1) nebo inhibitor aktivátoru plazminogenu (plasminogen activator inhibitor, PAI), které se podílejí na endoteliální fibróze a stimulují aterosklerózu [10]. Samotný UDP-GlcNAc také narušuje funkci β-buněk pankreatu zvýšením oxidačního stresu [11].
Proteinkináza C
Zvýšená aktivita PKC je u diabetiků způsobena nadprodukcí diacylglycerolu a vede k aktivaci intracelulárních signálních kaskád, jejichž důsledkem je zvýšení exprese PAI, nukleárního faktoru κB (NF-κB) nebo TGF-β1. Zvýšená množství těchto proteinů vedou ke změnám v endotelu cév a k poškození neurovaskulární cirkulace s následnou ischemizací neuronu. Mimoto je aktivita PKC závislá i na redoxním stavu buňky. Je popsán mechanismus, kterým prooxidační látky zvyšují její aktivitu, zatímco antioxidanty ji inhibují [8]. Stimulaci aktivity PKC lze tedy očekávat i díky oxidačnímu stresu vyvolanému ostatními patogenetickými mechanismy.
Pokročilé glykační produkty
Tyto produkty vznikají neenzymatickou reakcí mezi oxaldehydy, redukujícími cukry a proteiny či lipidy. Glykace vede v buňce k aktivaci jaderných receptorů a ke zvýšené expresi NF-κB, který je mediátorem zánětu, apoptózy a zvyšuje intracelulární oxidační stres přes NADPH oxidázový systém [12].
Poly-(ADP-ribózová) polymeráza (PARP)
Aktivita tohoto enzymu závisí na intracelulárním oxidačně-nitrosačním stresu. Zvýšená produkce kyslíkových a dusíkových radikálů zvyšuje aktivitu PARP, která dále vede ke zvýšené produkci zmíněných radikálů a k oxidačnímu stresu [13].
Zánět
U diabetiků obou typů dochází k nárůstu hladin prozánětlivých mediátorů tumor nekrotizujícího faktoru alfa (TNF-α), TGF-β, NF-κB a interleukinů IL-6 a IL-8 [8]. Na uvedené změny navazuje indukce cyklooxygenázy 2 (COX-2) a inducibilní NO syntázy (iNOS), zvyšuje se produkce prozánětlivých prostaglandinů a interleukinů, aktivují se makrofágy a dochází k respiračnímu vzplanutí a dalšímu poškození neuronu oxidačním stresem [8].
Růstové faktory
Zásadním růstovým faktorem stimulujícím regeneraci neuronu a tvorbu dendritů je nervový růstový faktor (nerve growth factor, NGF). V různých experimentálních modelech diabetu bylo prokázáno, že hyperglykemie snižuje hladiny NGF jak u zvířat, tak i u diabetických pacientů [14].
Etiologie CIPN
Na rozdíl od DPN, která je důsledkem metabolických změn v rámci diabetu, je CIPN nežádoucím účinkem léčiv s různými farmakodynamickými efekty a patofyziologie vzniku CIPN je většinou závislá na konkrétním léčivu. Můžeme však nalézt i společné na struktuře nezávislé mechanismy poškozující neurony, a to zejména v periferiích, které nejsou chráněny hematoencefalickou bariérou.
Růstové faktory
Pokles hladin NGF byl dokumentován jak na zvířecích modelech [15], tak i u pacientů s CIPN [16] po léčbě různými cytostatiky.
Poškození endotelu cév
Při podávání cisplatiny, paklitaxelu a thalidomidu bylo popsáno poškození vasa nervorum u periferních nervů [7]. Toto poškození se následně projeví ischemií nervového vlákna, kterou lze sledovat i u DPN v důsledku poruch mikrocirkulace. Nedostatečná suplementace neuronu kyslíkem vede k poškození mitochondrií a ke zvýšené produkci volných kyslíkových radikálů (VKR), a tedy k oxidačnímu stresu.
Zánět
Poškození nervů v důsledku negativního vlivu cytostatik na endotel vasa nervorum nebo v důsledku přímé destrukce neuronu vede k aktivaci imunitního systému. Aktivují se makrofágy, zvyšuje se produkce různých cytokinů včetně interleukinů IL-6, IL-8, TNF-α, zvyšuje se aktivita COX-2 a iNOS, dochází k poškození mitochondrií [17]. Podobně jako v případě DPN vede zvýšená aktivita imunitního systému k oxidačnímu stresu.
Specifické na struktuře závislé mechanismy
Kromě výše uvedených společných mechanismů způsobujících CIPN využívají jednotlivé molekuly nebo farmakodynamicky podobné látky další cesty, kterými vyvolávají poškození periferních neuronů. Platinová cytostatika se ireverzibilně vážou na DNA, mění její terciární strukturu a aktivují mitogenem aktivované proteinové kinázy (MAPK) [7]. Aktivace MAPK stimuluje intracelulární signální dráhy vedoucí k apoptóze neuronu za účasti VKR a k oxidačnímu stresu [18]. Vinka alkaloidy a taxany poškozují axonální transport, bortezomib interferuje s procesy transkripce, transportu a translace mRNA [7].
Současné farmakoterapeutické možnosti DPN a CIPN
Alg![Obr. 1 Algoritmus symptomatické léčby senzitivně-motorické neuropatie; podle [19] – Dopo-ručený postup diagnostiky a léčby diabetické neuropatie, 2012.SNRI – inhibitory zpětného vychytávání serotoninu a noradrenalinu](https://www.remedia.cz/photo-a-29433---.jpg) oritmus terapie DPN na základě doporučeného standardu České diabetologické společnosti je popsán na obr. 1 [19]. U diabetiků s DPN by po diagnóze a vyloučení jiných možných příčin neuropatie měla následovat snaha o optimální kompenzaci diabetu jako primární příčiny DPN. Symptomatická terapie DPN by měla být dále zahájena léčivy ze skupiny antidepresiv. Vzhledem k častým nežádoucím účinkům tricyklických antidepresiv je vhodné volit nejdříve látky ze skupin selektivních inhibitorů zpětného vychytávání serotoninu (SSRI) a inhibitorů zpětného příjmu noradrenalinu a serotoninu (SNRI). V případě nedostatečné účinnosti lze dále volit z látek s antikonvulzivním účinkem, z opiátů či memantinu. Ovlivnění příznaků DPN je problematické a podávání léčiv je zatíženo značnou incidencí nežádoucích účinků [8]. Specifickým léčivem s antioxidačním účinkem pro terapii DPN je kyselina α-lipoová. Názory na tuto látku se ve studiích i terapeutických standardech rozcházejí, a zatímco provedené metaanalýzy [20, 21] její účinnost spíše potvrzují, některé z aktuálních guidelines nedoporučují kyselinu α-lipoovou u DPN pro nedostatek důkazů [22].Vzhledem k tomu, že je CIPN nežádoucím účinkem aplikace léčiv, lze rozdělit používaná léčiva na dvě skupiny – látky pro prevenci vzniku a rozvoje CIPN a standardní symptomatickou léčbu CIPN. V rámci preventivně aplikovaných látek byly testovány chelatační látky typu kalcium glukonátu a magnezium sulfátu v kombinaci s oxaliplatinou. Studie však musela být přerušena pro podezření z interference s účinností cytostatik [23]. Podobně i přes jisté úspěchy při aplikaci glutathionu není jeho podávání společně s platinovými cytostatiky vhodné kvůli zvýšenému riziku vzniku re
oritmus terapie DPN na základě doporučeného standardu České diabetologické společnosti je popsán na obr. 1 [19]. U diabetiků s DPN by po diagnóze a vyloučení jiných možných příčin neuropatie měla následovat snaha o optimální kompenzaci diabetu jako primární příčiny DPN. Symptomatická terapie DPN by měla být dále zahájena léčivy ze skupiny antidepresiv. Vzhledem k častým nežádoucím účinkům tricyklických antidepresiv je vhodné volit nejdříve látky ze skupin selektivních inhibitorů zpětného vychytávání serotoninu (SSRI) a inhibitorů zpětného příjmu noradrenalinu a serotoninu (SNRI). V případě nedostatečné účinnosti lze dále volit z látek s antikonvulzivním účinkem, z opiátů či memantinu. Ovlivnění příznaků DPN je problematické a podávání léčiv je zatíženo značnou incidencí nežádoucích účinků [8]. Specifickým léčivem s antioxidačním účinkem pro terapii DPN je kyselina α-lipoová. Názory na tuto látku se ve studiích i terapeutických standardech rozcházejí, a zatímco provedené metaanalýzy [20, 21] její účinnost spíše potvrzují, některé z aktuálních guidelines nedoporučují kyselinu α-lipoovou u DPN pro nedostatek důkazů [22].Vzhledem k tomu, že je CIPN nežádoucím účinkem aplikace léčiv, lze rozdělit používaná léčiva na dvě skupiny – látky pro prevenci vzniku a rozvoje CIPN a standardní symptomatickou léčbu CIPN. V rámci preventivně aplikovaných látek byly testovány chelatační látky typu kalcium glukonátu a magnezium sulfátu v kombinaci s oxaliplatinou. Studie však musela být přerušena pro podezření z interference s účinností cytostatik [23]. Podobně i přes jisté úspěchy při aplikaci glutathionu není jeho podávání společně s platinovými cytostatiky vhodné kvůli zvýšenému riziku vzniku re zistence na cytostatickou terapii [24]. Z dalších látek byl aplikován NGF, který má celou řadu lokálních i systémových nežádoucích účinků, nebo glutamin a glutamát, ovšem bez výraznějšího klinického efektu [7], stejně jako vitamin E [25]. Léčiva používaná pro symptomatickou terapii rozvinuté CIPN jsou stejná jako u DPN a jiných neuropatií. Pro volbu vhodného léčiva u bolestivých symptomů CIPN lze použít Klinický standard pro farmakoterapii neuropatické bolesti (tab. 2) [26].
zistence na cytostatickou terapii [24]. Z dalších látek byl aplikován NGF, který má celou řadu lokálních i systémových nežádoucích účinků, nebo glutamin a glutamát, ovšem bez výraznějšího klinického efektu [7], stejně jako vitamin E [25]. Léčiva používaná pro symptomatickou terapii rozvinuté CIPN jsou stejná jako u DPN a jiných neuropatií. Pro volbu vhodného léčiva u bolestivých symptomů CIPN lze použít Klinický standard pro farmakoterapii neuropatické bolesti (tab. 2) [26].
Perspektivy farmakoterapie vycházející z etiologických poznatků
Pokud bychom měli vybr![Obr. 2 Faktory účastnící se patogeneze diabetické a cytostatiky indukované periferní neuropatie; podle [6] – Velasco, et al., 2010; [8] – Edwards, et al., 2008; [17] – Wang, et al., 2012. DAG – diacylglycerol; UDP-GlcNAc – uridindifosfát-N-acetyl-glukosamin; IL – interleukin; MAPK – mitogenem aktivovaná proteinová kináza; MMP – matrixová metaloproteináza; NF – nukleární faktor; PAI – inhibitor aktivátoru plazminogenu; PARP – poly-(ADP-ribózová) polymeráza; PGP – pokročilé glykační produkty; PKC – proteinkináza C; TGF – transformační růstový faktor; TNF – tumor nekrotizující faktor; VKR – volné kyslíkové radikály](https://www.remedia.cz/photo-a-29435---.jpg) at jednu společnou charakteristiku, která je typická pro etiologii jak DPN, tak i CIPN, byl by to oxidační stres a VKR, které se podílejí na poškození neuronů. Kromě toho se mohou významně uplatnit i látky, které by mimo antioxidační aktivitu byly schopné i zvýšit hladiny NGF nebo inhibovat prozánětlivé procesy, viz obr. 2. Vhodné kandidáty splňující výše uvedené podmínky lze nalézt mezi přírodními polyfenolickými antioxidanty.
at jednu společnou charakteristiku, která je typická pro etiologii jak DPN, tak i CIPN, byl by to oxidační stres a VKR, které se podílejí na poškození neuronů. Kromě toho se mohou významně uplatnit i látky, které by mimo antioxidační aktivitu byly schopné i zvýšit hladiny NGF nebo inhibovat prozánětlivé procesy, viz obr. 2. Vhodné kandidáty splňující výše uvedené podmínky lze nalézt mezi přírodními polyfenolickými antioxidanty.
Trans-resveratrol
Jedním z nejlépe prostudovaných polyfenolů s dokumentovanou významnou biologickou aktivitou je trans-resveratrol (RES), který je obsažen výhradně v rostlinných tkáních a v malých množstvích je běžnou součástí lidské diety [27]. V mnoha studiích in vitro a in vivo byly popsány jeho komplexní antioxidační účinky. RES působí nejen jako přímý antioxidant, ale stimuluje i endogenní antioxidační systém zvýšením aktivit antioxidačních a inhibicí prooxidačních en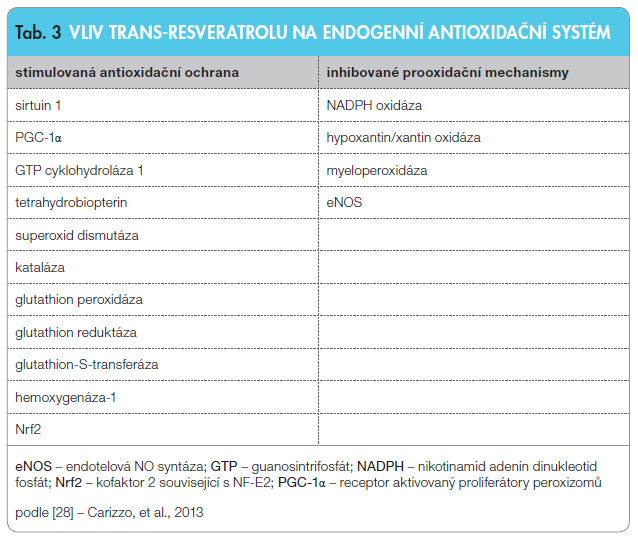 zymů, viz tab. 3 [28]. Antioxidační vlastnosti RES jsou mimo jiné spojovány i s jeho neuroprotektivními vlastnostmi. Po aplikaci RES potkanům dochází ke zvýšení aktivity cerebrální superoxid dismutázy (SOD); její izoforma SOD-2 je zodpovědná za neuroprotektivní účinek RES více než jeho přímé antioxidační účinky [29].
zymů, viz tab. 3 [28]. Antioxidační vlastnosti RES jsou mimo jiné spojovány i s jeho neuroprotektivními vlastnostmi. Po aplikaci RES potkanům dochází ke zvýšení aktivity cerebrální superoxid dismutázy (SOD); její izoforma SOD-2 je zodpovědná za neuroprotektivní účinek RES více než jeho přímé antioxidační účinky [29].
Druhým důležitým efektem RES podílejícím se na jeho protektivním účinku na neurony je modulace neuroinflamačních procesů. Zánět hraje důležitou roli v patogenezi DPN i CIPN a RES blokuje aktivaci signální dráhy NF-κB, což bylo potvrzeno i u diabetických pacientů [28]. Přehled klinických studií s RES zabývajících se antioxidačními a protizánětlivými účinky je shrnut v tab. 4 [30–34]. Není bez zajímavosti, že některé z těchto studií byly provedeny u diabetických pacientů s cílem stanovit vliv RES na hodnoty glykemie a inzulinu u diabetiků 2. typu [32], protože na základě předchozích prací bylo zjištěno, že RES inhibuje aktivitu kináz účastnících se vzniku inzulinové rezistence [30]. V dalších klinických studiích zaměřených na biologickou aktivitu RES u d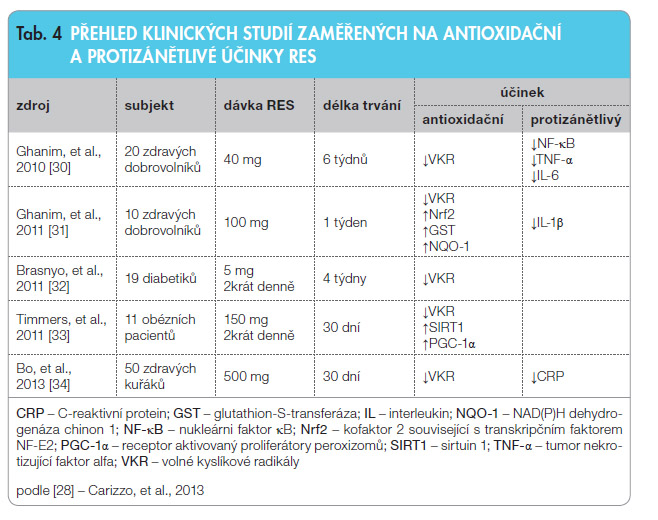 iabetiků bylo zjištěno, že RES v dávce 250 mg aplikovaný po dobu tří měsíců v kombinaci s běžnou terapií snižoval hodnoty glykovaného hemoglobinu, hodnoty systolického krevního tlaku a hladiny celkového cholesterolu [35]. I když aktuální jeden rok trvající studie sledující aplikaci 350 mg extraktu z hroznů s obsahem RES a aplikaci čistého RES v dávce 8 mg nepotvrdila pozitivní působení RES na glykovaný hemoglobin u diabetiků, došlo vlivem testovaných látek k poklesu hodnot proinflamačních mediátorů IL-6, IL-1β a TNF-α [36].
iabetiků bylo zjištěno, že RES v dávce 250 mg aplikovaný po dobu tří měsíců v kombinaci s běžnou terapií snižoval hodnoty glykovaného hemoglobinu, hodnoty systolického krevního tlaku a hladiny celkového cholesterolu [35]. I když aktuální jeden rok trvající studie sledující aplikaci 350 mg extraktu z hroznů s obsahem RES a aplikaci čistého RES v dávce 8 mg nepotvrdila pozitivní působení RES na glykovaný hemoglobin u diabetiků, došlo vlivem testovaných látek k poklesu hodnot proinflamačních mediátorů IL-6, IL-1β a TNF-α [36].
Kromě výrazné biologické aktivity a komplexních protektivních účinků na organismus je pro RES charakteristická i velmi dobrá snášenlivost a minimum nežádoucích účinků. V klinických testech byla perorální aplikace zdravým dobrovolníkům provázena jen mírnými nežádoucími účinky, projevujícími se drážděním gastrointestinálního traktu až při podání dávek vyšších než 1 g denně [37]. Z možných rizik, která mohou být spojena s klinickým použitím RES v indikaci CIPN, je dozajista dobré pamatovat na mírné estrogenní účinky RES zejména u pacientek s hormon-dependentními typy nádorů, jak bylo prokázáno v preklinickém modelu na některých buněčných liniích karcinomu prsu [38]. V preklinickém modelu na myších byla prokázána i farmakokinetická interakce RES s docetaxelem, při jehož podávání došlo ke zvýšení plazmatických hladin vlivem RES [39]. Je však nutno podotknout, že dávka RES (4 mg/kg) aplikovaná v této studii je poměrně vysoká a účinek perorálně podaného RES se může od účinku parenterálně aplikované látky významně lišit.
Kurkumin
Další přírodní látkou s prokázanou širokou biologickou a antioxidační aktivitou a výborným bezpečnostním profilem je kurkumin (KUR). Jedná se o žluté barvivo patřící do skupiny kurkuminoidů. KUR je obsažen v oddencích rostlin rodu kurkuma z čeledi zázvorovitých (Zingiberaceae), Běžně se používá jako součást různých směsí koření (kari), kde často nahrazuje pro své žluté zbarvení šafrán, a velmi často je využíván i jako barvivo v potravinářství (označení E100). Podobně jako RES působí KUR přímo na vzniklé VKR, které inaktivuje, a současně zvyšuje aktivitu endogenních antioxidačních enzymů a tlumí produkci VKR inhibicí COX a lipoperoxidázy [40].
Ve srovnání s účinkem vitaminu E v dávce 200 IU způsobilo podání 500 mg KUR výraznější zvýšení celkové antioxidační kapacity a oproti vitaminu E dokázal KUR snížit i celkové hladiny cholesterolu a hladiny triacylglycerolů [41]. Pozitivní vliv KUR na hladiny lipidů je využitelný zejména u diabetiků, u kterých hyperlipidemie představuje častou komplikaci primárního onemocnění a je zásadním faktorem vedoucím k ateroskleróze, poškození cév, ischemii neuronů, a tím i k rozvoji DPN. Protektivní účinek KUR na vaskulární systém byl sledován přímo u diabetiků 2. typu trpících mikroangiopatií, kde perorální podání 200 mg KUR způsobilo zlepšení parametrů prokrvení periferie [42]. Stejně jako RES je i KUR schopný snižovat glykemii [43] a zvyšovat plazmatické koncentrace inzulinu [44] a působit tak přímo proti primární příčině vzniku DPN.
V neposlední řadě zasahuje KUR do patogeneze neuropatií svými protizánětlivými účinky. V klinické studii s lecitinizovaným KUR došlo po aplikaci 200 mg u pacientů s diagnostikovanou osteoartritidou k signifikantnímu poklesu hladin IL-6, IL-1β a dalších prozánětlivých markerů [45]. Zajímavá z hlediska vlivu KUR na mediátory zánětu je i jeho interakce s RES. Ve studii na nádorových buněčných liniích karcinomu kolona v podmínkách in vitro i in vivo vykazovala kombinace těchto látek synergistický protinádorový efekt, jehož mechanismem je pravděpodobně inhibice NF-κB [46]. Existuje i přímá souvislost mezi zvýšenými hladinami NF-κB a mnoha negativními symptomy pozorovanými u onkologických pacientů, které jsou způsobeny vlivem samotného onemocnění, ale i použité terapie [47].
KUR i RES jsou proto kandidátními léčivy i pro tuto indikaci. Možné využití KUR u onkologických pacientů s různými typy nádorů již bylo testováno v několika klinických studiích s nadějnými výsledky [48].
Světová zdravotnická organizace uvádí jako bezpečnou dávku bez rizika nežádoucích účinků maximální denní příjem do 1 mg KUR na kilogram tělesné hmotnosti [49]. Naproti tomu klinické i preklinické studie často operují s dávkami, které doporučené dávkování mnohonásobně překračují. Je to dáno nízkou biologickou dostupností KUR po perorálním podání. Uvádí se, že měřitelné plazmatické koncentrace kurkuminu je u člověka dosaženo až po podání jednorázové dávky v řádu gramů [50], která je však i po chronické aplikaci dobře tolerována [51]. Možností, jak zvýšit biologickou dostupnost KUR po perorálním podání, je volba mikronizované [52] nebo lecitinizované lékové formy [53]. Plazmatické koncentrace KUR výrazně zvyšuje i jeho kombinace s inhibitorem P-glykoproteinu piperinem. Po perorálním podání 2 g KUR v kombinaci s 20 mg piperinu došlo u zdravých dobrovolníků ke 2000% nárůstu hodnot
plazmatických koncentrací KUR [54].
Mangiferin
Velmi oblíbeným přírodním antioxidantem je i vodný extrakt z kůry mangovníku (Mangifera indica L.), který kromě jiných polyfenolů obsahuje přibližně 10–20 % mangiferinu (MAN). Tato látka se používá v tradiční indické medicíně na základě empirických zkušeností pro terapii imunodeficitních stavů, hepatitid, onemocnění kardiovaskulárního systému a v neposlední řadě i u diabetu [55]. Použití MAN v těchto indikacích bylo následně potvrzeno vědeckými studiemi popisujícími jeho antidiabetické, antioxidační, antiproliferativní, imunomodulační, kardiotonické nebo diuretické vlastnosti [56]. Většina těchto účinků je však popsána pouze v preklinických modelech, i když jejich výsledky jsou jednoznačné. V klinických studiích byly testovány jeho nepřímé antioxidační účinky u osob starších 65 let, kterým byl aplikován vodný extrakt s obsahem MAN. Po 60 dnech došlo k signifikantnímu zvýšení celkové antioxidační kapacity, aktivity SOD a ke snížení koncentrací oxidovaného glutathionu [57]. MAN je však také silným „zhášečem“ VKR bránícím iniciačním fázím řetězových radikálových reakcí včetně lipoperoxidace [58].
Zajímavé z hlediska prevence a terapie DPN jsou i jeho prokázané antidiabetické účinky. MAN v preklinických modelech diabetu snižuje glykemii, hladiny celkového cholesterolu a triacylglycerolů a zvyšuje hladinu HDL [59], popisuje se i mechanismus snížení absorpce glukózy ze střeva [60]. Stejně jako ostatní zmíněné polyfenoly má i MAN, respektive extrakt s MAN jako hlavní složkou, antiflogistické účinky spočívající v inhibici prozánětlivých faktorů typu TNF-α, prostaglandinu E2, fosfolipázy A2 nebo myeloperoxidázy [61].
Vzhledem k možnému využití MAN u onkologických pacientů stojí za pozornost také synergistický efekt MAN a oxaliplatiny. Na různých typech nádorových buněčných linií snižoval MAN potřebné efektivní koncentrace oxaliplatiny 2krát až 3,5krát [62]. Potenciální protektivní účinek MAN lze využít i u radiační terapie tumorů, kde MAN redukuje radiační poškození s maximem účinku v dávce 2 mg/kg [63].
Závěr
DPN a CIPN představují v současnosti obtížně farmakoterapeuticky zvládnutelná onemocnění, v jejichž etiologii se významně uplatňuje oxidační stres. RES, KUR a MAN jsou silné přírodní antioxidanty s dobrým bezpečnostním profilem a aditivními farmakodynamickými vlastnostmi, které zasahují na dalších místech patogeneze neuropatií. Jejich použití u DPN a CIPN je perspektivní možností založenou na racionálním základě provedených studií. Lze předpokládat, že se kombinace uvedených látek bude vyznačovat synergistickým efektem jak z hlediska antioxidační aktivity, tak i z pohledu komplexního neuroprotektivního účinku a uvedené látky jsou použitelné nejen pro terapii, ale i jako profylaktická možnost u nově diagnostikovaných diabetiků a pacientů před zahájením terapie cytostatiky.
Seznam použité literatury
- [1] Dyck PJ, Kratz KM, Karnes JL, et al. The prevalence by staged severity of various types of diabetic neuropathy, retinopathy, and nephropathy in a population-based cohort: the Rochester Diabetic Neuropathy Study. Neurology 1993; 43: 817–824.
- [2] Boulton AJM, Vinik AI, Arezzo JC, et al. Diabetic Neuropathies: A statement by the American Diabetes Association. Diabetes Care 2005; 28: 956–962.
- [3] Wolf S, Barton D, Kottschade L, et al. Chemotherapy-induced peripheral neuropathy: prevention treatment strategies. Eur J Cancer 2008; 44: 1507–1515.
- [4] Von Schlippe M, Fowler CJ, Harland SJ. Cisplatin neurotoxicity in the treatment of metastatic germ cell tumour: Time course and prognosis. Br J Cancer 2001; 85: 823–826.
- [5] Chaundry V, Rowinsky EK, Sartorius SE, et al. Peripheral neuropathy from taxol and cisplatin combination chemotherapy: clinical and electrophysiological studies. Ann Neurol 1994; 35: 304–311.
- [6] Velasco R, Bruna J. Chemotherapy-induced peripheral neuropathy: An unresolved issue. Neurologia 2010; 25: 116–131.
- [7] Thomas PK. Diabetic peripheral neuropathies: Their cost to patient and society and the value of knowledge of risk factors for development of interventions. Eur Neurol 1999; 41: 5–43.
- [8] Edwards JL, Vincent AM, Cheng HT, et al. Diabetic neuropathy: Mechanisms to management. Pharmacol Therapeut 2008; 120: 1–34.
- [9] Stevens MJ, Lattimer SA, Kamijo M. Osmoticallyinduced nerve taurine depletion and the compatibile osmolyte hypothesis in experimental diabetic neuropathy in the rat. Diabetologia 1993; 36: 608–614.
- [10] Gemignani F. Symptomatic and pathogenetic treatment of diabetic neuropathy: Role of alpha-lipoic acid. Neural Regen Res 2010; 5: 781–788.
- [11] Kaneto H, Xu G, Song KH, et al. Activation of the hexosamine pathway leads to deterioration of pancreatic beta-cell function through the induction of oxidative stress. J Biol Chem 2001; 33: 31099–31104.
- [12] Manea A, Manea SA, Gafencu AV, et al. Regulation of NADPH oxidase subunit p22(phox) by NF-κB in human aortic smooth muscle cells. Arch Physiol Biochem 2007; 113: 63–72.
- [13] Obrosova IG, Drel VR, Ilnytska O, et al. Oxidative-nitrosative stress and poly(ADP-ribose) polymerase (PARP) activation in experimental diabetic neuropathy: the relation is revisited. Diabetes 2005; 54: 3435–3441.
- [14] Brewster WJ, Fernyhough P, Diemel LT, et al. Diabetic neuropathy, nerve growth factor and other neurotrophic factors. Trends Neurosci 1994; 17: 321–325.
- [15] Cavaletti G, Pezzoni G, Pisano C, et al. Cisplatin-induced peripheral neurotoxicity in rats reduces the circulating levels of nerve growth factor. Neurosci Lett 2002; 322: 103–106.
- [16] De Santis S, Pace A, Bove L, et al. Patients treated with antitumor drugs displaying neurological deficits are characterized by a low circulating level of nerve growth factor. Clin Cancer Res 2000; 6: 90–95.
- [17] Wang XM, Lehky TJ, Brell JM, et al. Discovering cytokines as targets for chemotherapy-induced painful peripheral neuropathy. Cytokine 2012; 59: 3–9.
- [18] Bragada P, Armesilla A, Silva A, et al. Apoptosis by cisplatin requires p53 mediated p38α MAPK activation through ROS generation. Apoptosis 2007; 12: 1733–1742.
- [19] Doporučený postup diagnostiky a léčby diabetické neuropatie 2012, Česká diabetologická společnost. Dostupné na www.diab.cz.
- [20] Mijnhout GS, Kollen BJ, Alkhalaf A, et al. Alpha Lipoic Acid for Symptomatic Peripheral Neuropathy in Patients with Diabetes: A Meta-Analysis of Randomized Controlled Trials. Int J Endocrinol 2012; 2012: 456279, doi: 10.1155/2012/456279.
- [21] Han T, Bai J, Liu W, et al. A systematic review and meta-analysis of α-lipoic acid in the treatment of diabetic peripheral neuropathy. Eur J Endocrinol 2012; 167: 465–471.
- [22] Devitt M. AAN, AANEM, and AAPMR Publish Guideline for Treatment of Painful Diabetic Neuropathy. Am Fam Physician 2012; 86: 469–470.
- [23] Hochster HS, Grothey A, Childs BH. Use of calcium and magnesium salts to reduce oxaliplatin-related neurotoxicity. J Clin Oncol 2007; 25: 4028–4029.
- [24] Cavaletti G, Marmiroli P. The role of growth factors in the prevention and treatment of chemotherapy-induced peripheral neurotoxicity. Curr Drug Saf 2006; 1: 35–42.
- [25] Kottschade LA, Sloan JA, Mazurczak MA, et al. The use of vitamin E for the prevention of chemotherapy-induced peripheral neuropathy: results of a randomized phase III clinical trial. Support Care Cancer 2011; 19: 1769–1777.
- [26] Bednařík J, Ambler Z, Opavský O, et al. Klinický standard pro farmakoterapii neuropatické bolesti. Cesk Slov Neurol 2012; 75: 93–101.
- [27] Zamora-Ros R, Anders-Lacueva C, Lamuela--Raventós RM, et al. Concentrations of resveratrol and derivatives in foods and estimation of dietary intake in a Spanish population: European Prospective Investigation into Cancer and Nutrition (EPIC)-Spain cohort. Brit J Nutr 2008; 100: 188–196.
- [28] Carrizzo A, Forte M, Damato A, et al. Antioxidant effects of resveratrol in cardiovascular, cerebral and metabolic diseases. Food Chem Toxicol 2013; doi: 10.1016/j.fct.2013.07.021, in press.
- [29] Fukui M, Choi HJ, Ting ZB. Mechanism for the protective effect of resveratrol against oxidative stress-induced neuronal death. Free Radic Biol Med 2010; 49: 800–813.
- [30] Ghanim H, Sia CL, Abuaysheh S, et al. An antiinflammatory and reactive oxygen species suppressive effects of an extract of Polygonum cuspidatum containing resveratrol. J Clin Endocrinol Metab 2010; 95: E1–E8.
- [31] Ghanim H, Sia CL, Korzeniewski K, et al. A resveratrol and polyphenol preparation suppresses oxidative and inflammatory stress response to a high-fat, high-carbohydrate meal. J Clin Endocrinol Metab 2011; 96: 1409–1414.
- [32] Brasnyo P, Molnar GA, Mohas M, et al. Resveratrol improves insulin sensitivity, reduces oxidative stress and activates the Akt pathway in type 2 diabetic patients. Br J Nutr 2011; 106: 1–7.
- [33] Timmers S, Konings E, Bilet L, et al. Calorie restriction-like effects of 30 days of resveratrol supplementation on energy metabolism and metabolic profile in obese humans. Cell Metab 2011; 14: 612–622.
- [34] Bo S, Ciccone G, Castiglione A, et al. Anti-inflammatory and antioxidant effects of resveratrol in healthy smokers a randomized, double-blind, placebo-controlled, cross-over trial. Curr Med Chem 2013; 20: 1323–1331.
- [35] Bhatt JK, Thomas S, Nanjan MJ. Resveratrol supplementation improves glycemic control in type 2 diabetes mellitus. Nutr Res 2012; 32: 537–541.
- [36] Tomé-Carneiro J, Larrosa M, Yáñez-Gascón MJ, et al. One-year supplementation with a grape extract containing resveratrol modulates inflammatory-related microRNAs and cytokines expression in peripheral blood mononuclear cells of type 2 diabetes and hypertensive patients with coronary artery disease. Pharmacol Res 2013; 72: 69–82.
- [37] Brown V, Patel K, Viskaduraki M, et al. Repeat dose study of the cancer chemopreventive agent resveratrol in healthy volunteers: safety, pharmacokinetics and effect on the insulin-like growth factor axis. Cancer Res 2010; 70: 9003–9011.
- [38] Fukui M, Yamabe N, Zhu BT. Resveratrol attenuates the anticancer efficacy of paclitaxel in human breast cancer cells in vitro and in vivo. Eur J Cancer 2010; 46: 1882–1891.
- [39] Lazzaro AD, Camera E, Picardo M, et al. Pharmacokinetics studies in balb/c treated with docetaxel and trans-resveratrol. Eur J Cancer 2009; S7: 125.
- [40] Hatcher H, Planalp R, Cho J, et al. Curcumin: From ancient medicine to current clinical trials. Cell Mol Life Sci 2008; 65: 1631–1652.
- [41] Pungcharoenkul K, Thongnopnua P. Effect of Different Curcuminoid Supplement Dosages on Total In vivo Antioxidant Capacity and Cholesterol Levels of Healthy Human Subjects. Phytother Res 2011; 25: 1721–1726.
- [42] Appendino G, Belcaro G, Cornelli U, et al. Potential role of curcumin phytosome (Meriva) in controlling the evolution of diabetic microangiopathy. A pilot study. Panminerva Med 2011; 53: 43–49.
- [43] Nishiyama T, Mae T, Kishida H, et al. Curcuminoids and sesquiterpenoids in turmeric (Curcuma longa L.) suppress an increase in blood glucose level in type 2 diabetic KK-Ay mice. J Agric Food Chem 2005; 53: 959–963.
- [44] Wickenberg J, Ingemansson SL, Hlebowicz J. Effects of Curcuma longa (turmeric) on postprandial plasma glucose and insulin in healthy subjects. Nutr J 2010; 9: 43.
- [45] Belcaro G, Cesarone MR, Dugall M, et al. Efficacy and safety of Meriva®, a curcumin-phosphatidylcholine complex, during extended administration in osteoarthritis patients. Altern Med Rev 2010; 15: 337–344.
- [46] Majumdar AP, Banerjee S, Nautiyal J, et al. Curcumin synergizes with resveratrol to inhibit colon cancer. Nutr Cancer 2009; 61: 544–553.
- [47] Gupta SC, Kim JH, Kammappan R, et al. Role of nuclear factor-κB-mediated inflammatory pathways in cancer-related symptoms and their regulation by nutritional agents. Exp Biol Med 2011; 236: 658–671.
- [48] Gupta SC, Patchva S, Aggarwal BB. Therapeutic roles of curcumin: Lessons learned from clinical trials. AAPS J 2013; 15: 195–218.
- [49] Evaluation of Certain Food Additives, WHO Technical Report Series, WHO, Geneva 2000, 891.
- [50] Cheng AL, Hsu CH, Lin JK, et al. Phase I clinical trial of curcumin, a chemopreventive agent, in patients with high-risk or pre-malignant lesions. Anticancer Res 2001; 21: 2895–2900.
- [51] Ringman JM, Frautschy SA, Teng E, et al. Oral curcumin for Alzheimer’s disease: tolerability and efficacy in a 24-week randomized, double blind, placebo-controlled study. Alzheimers Res Ther 2012; 4: 43.
- [52] Joshi RP, Negi G, Kumar A, et al. SNEDDS curcumin formulation leads to enhanced protection from pain and functional deficits associated with diabetic neuropathy: An insight into its mechanism for neuroprotection. Nanomed-Nanotechnol 2013; 9: 776–785.
- [53] Marcylo TH, Verschoyle RD, Cooke DN, et al. Comparison of systemic availability of curcumin with that of curcumin formulated with phosphatidylcholine. Cancer Chemother Pharmacol 2007; 60: 171–177.
- [54] Shoba G, Joy D, Joseph T, et al. Influence of piperine on the pharmacokinetics of curcumine in animals and human volunteers. Planta Med 1998; 64: 353–356.
- [55] Sanchez GM, Re L, Giuliani A, et al. Protective effects of Mangifera indica L. extract, mangiferin and selected antioxidants against TPA-induced biomolecules oxidation and peritoneal macrophage activation in mice. Pharmacol Res 2000; 42: 565–573.
- [56] Andreu GP, Delgado R, Velho JA, et al. Iron complexing activity of mangiferin, a naturally occurring glucosylxanthone, inhibits mitochondrial lipid peroxidation induced by Fe(2+)-citrate. Eur J Pharmacol 2005; 513: 47–55.
- [57] Leiro JM, Alvarez E, Arranz JA, et al. In vitro effects of mangiferin on superoxide concentrations and expression of the inducible nitric oxide synthase, tumour necrosis factor-alpha and transforming growth factor-beta genes. Biochem Pharmacol 2003; 65: 1361–1371.
- [58] Pardo-Andreu GL, Philip SJ, Riaño A, et al. Mangifera indica L. (Vimang) Protection against Serum Oxidative Stress in Elderly Humans. Arch Med Res 2006; 37: 158–164.
- [59] Muruganandan S, Srinivasan K, Gupta S, et al. Effect of mangiferin on hyperglycemia and atherogenicity in streptozotocin diabetic rats. J Ethnopharmacol 2005; 97: 497–501.
- [60] Aderibigbe AO, Emudianughe TS, Lawal BS. Antihyperglycaemic effect of Mangifera indica in rat. Phytother Res 1999; 13: 504–507.
- [61] Garrido G, González D, Lemus Y, et al. In vivo and in vitro anti-inflammatory activity of Mangifera indica L. extract (VIMANG®). Pharmacol Res 2004; 50: 143–149.
- [62] Du Plessis-Stoman D, du Preez J, van de Venter M. Combination treatment with oxaliplatin and mangiferin causes increased apoptosis and downregulation of NF-κB in cancer cell lines. Afr J Tradit Complement Altern Med 2010; 8: 177–184.
- [63] Jagetia GC, Baliga MS. Radioprotection by mangiferin in DBAxC57BL mice: a preliminary study. Phytomedicine 2005; 12: 209–215.