Ponatinib v léčbě chronické myeloidní leukemie a Ph‑pozitivní akutní lymfoblastické leukemie
Souhrn:
Ačkoliv byly v léčbě chronické myeloidní leukemie (CML) zaznamenány velké pokroky díky tyrosinkinázovým inhibitorům (TKI), část pacientů zůstává na léčbu první linie rezistentní nebo tuto léčbu netoleruje. Po imatinibu byly objeveny nilotinib, dasatinib a bosutinib, které reprezentují druhou generaci TKI. Jednou z příčin rozvoje rezistence na TKI je přítomnost mutací v kinázové doméně BCR‑ABL. Nejvíce problematickou mutaci představuje mutace T315I, jejíž nositelé jsou rezistentní na všechny TKI druhé generace. S cílem překonat tuto mutaci byl vyvinut ponatinib jako zástupce třetí generace TKI. Ponatinib byl rovněž hodnocen ve studii EPIC v první linii léčby CML (ponatinib vs. imatinib). V této studii byl však zjištěn velký počet závažných cévních komplikací a tato skutečnost vedla k předčasnému zastavení studie.
Key words: chronic myeloid leukemia – therapy – ponatinib – tyrosine kinase inhibitors.
Summary:
Although we have seen a great progress in the treatment of chronic myeloid leukemia (CML) thanks to the tyrosine kinase inhibitors (TKI), some patients are resistant or intolerant to the first line therapy. After imatinib, nilotinib, dasatinib, and bosutinib were developed as representatives of the 2nd generation TKIs. One reason for the development of resistance to TKI is the presence of mutations in the BCR‑ABL kinase domain. The most resistant mutation is T315I, which is insensitive to all 2nd generation TKIs. In order to overcome this mutation, ponatinib (3nd line inhibitor) was developed. Ponatinib was also evaluated in the EPIC study as a first line treatment of CML (ponatinib vs. imatinib). In this study, large number of serious vascular adverse events was recorded, leading to the premature cessation of the study.
Úvod
Rozvoj poznatků v oblasti molekulární biologie a patofyziologie chronické myeloidní leukemie (CML) výrazně změnil možnosti léčby pacientů s tímto onemocněním objevem tyrosinkinázových inhibitorů (TKI), které blokují funkci proteinu BCR ABL1. Jako první z nich byl do klinické praxe uveden imatinib v roce 2001. Zavedení TKI do klinické praxe výrazně zvýšilo pravděpodobnost dlouhodobého přežívání nemocných a v současné době se předpokládaná délka přežití pacienta s CML pohybuje mezi 25–30 lety [1]. Nicméně i přes vysokou účinnost imatinibu existuje skupina nemocných (zhruba 30 %), kteří jsou na tuto léčbu rezistentní nebo ji netolerují. Můžeme zaznamenat rezistenci primární, kdy pacienti nedosáhnou žádné optimální léčebné odpovědi, nebo rezistenci sekundární, při které dojde ke ztrátě optimální odpovědi po její předchozí přítomnosti. Ke známým příčinám rezistence patří inhibice BCR ABL, rozvoj mutací v kinázové doméně, amplifikace genu či overexprese BCR ABL1 nebo vznik klonální evoluce. Mnohé případy rozvoje rezistence jsou však nejasné a jsou předmětem dalšího výzkumu.
Snaha zlepšit léčebné výsledky pacientů vedla k vývoji dalších generací TKI. Nejprve se jednalo o nilotinib a dasatinib jako zástupce TKI druhé generace, které lze v současné době použít již v první linii léčby CML. U nás je pro první linii léčby zatím schválena úhrada nilotinibu. O něco později přichází do praxe bosutinib a reprezentantem TKI třetí generace je ponatinib. V současné době se ve fázi klinického hodnocení nacházejí i další inhibitory, jako např. radotinib a bafetinib. Jednotlivé TKI se liší svojí vazbou na BCR ABL1 a dále mají různé spektrum inhibice řady dalších tyrosinkináz, což vysvětluje i výskyt rozdílných nežádoucích účinků jednotlivých přípravků [2].
V případě, že pacient nedosáhl optimální léčebné odpovědi, musíme nejprve ověřit spolupráci pacienta při léčbě (compliance), která je pro úspěch léčby klíčová. Dále se standardně provádí vyšetření na přítomnost mutací v TKI doméně, neboť výběr TKI v další linii léčby závisí na přítomnosti mutací, na věku a komorbiditách pacienta. Jednotlivé TKI se liší svojí účinností v léčbě při přítomnosti jednotlivých mutací. Nejobávanější z nich představuje rezistentní mutace T315I, proti které je dobře účinný právě ponatinib (tab. 1) [3].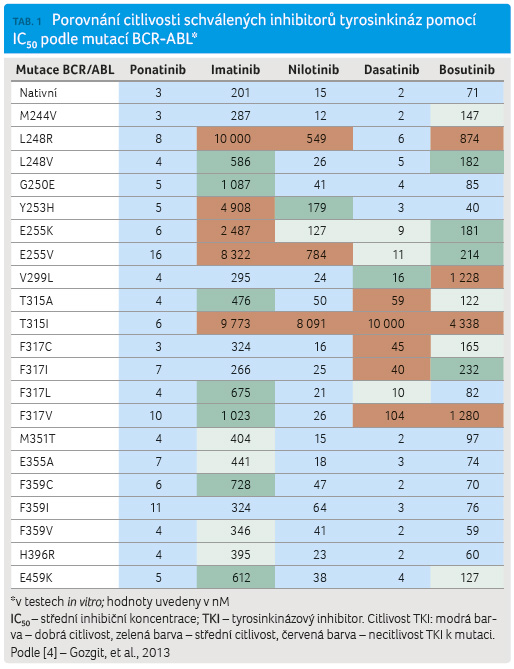
Ponatinib
Ponatinib je silný TKI s tzv. strukturálním prvkem, trojnou vazbou mezi uhlíkovými atomy, která umožňuje jeho vysokoafinitní vazbu k nativní formě BCR ABL a k jejím dalším, mutovaným formám včetně T315I. Ponatinib způsobuje inhibici tyrosinkinázové aktivity ABL a mutované formy ABL T315I při hodnotách střední inhibiční koncentrace IC50 0,4 nM a 2,0 nM. Při testování na buněčných kulturách in vitro byl ponatinib účinný i při zjištěné rezistenci na imatinib, dasatinib a nilotinib dané mutacemi v kinázové doméně BCR ABL. Ponatinib inhibuje další klinicky významné kinázy při hodnotách IC50 nižších než 20 nM a na buněčné úrovni vykazuje rovněž aktivitu proti kinázám RET (ret proto oncogene), FLT3 (fms related tyrosine kinase 3) a KIT (KIT proto oncogene receptor tyrosine kinase) a proti členům rodin kináz FGFR (fibroblast growth factor receptor), PDGFR (platelet derived growth factor receptor) a VEGFR (vascular endothelial growth factor receptor) [4,5].
Ponatinib je užíván perorálně (p.o.) a po podání přípravku je maximální plazmatické koncentrace dosaženo za 4–6 hodin. Po jídle s vysokým nebo s nízkým obsahem tuků se plazmatické expozice ponatinibu nelišily od podmínek nalačno, proto lze ponatinib podávat s jídlem nebo bez jídla. Ponatinib se in vitro ve velké míře (> 99 %) váže na plazmatické bílkoviny. Při podávání dávky ponatinibu 45 mg jedenkrát denně je biologický poločas eliminace 22 hodin a ustáleného stavu je dosaženo po týdnu léčby. Ponatinib je v játrech metabolizován esterázami a amidázami (inaktivace) a cytochromem P450 (CYP3A4), dominantně je poté vylučován stolicí. Vzhledem k metabolizování ponatinibu prostřednictvím izoenzymu CYP3A4 je třeba myslet na možné lékové interakce: silné inhibitory CYP3A4 (např. ketokonazol, itrakonazol, vorikonazol, erytromycin, klaritromycin a grapefruitová šťáva) mohou zvyšovat expozici ponatinibu, naopak silné induktory (např. fenytoin, karbamazepin, rifampicin, fenobarbital, třezalka tečkovaná) mohou expozici ponatinibu snižovat [4,5].
Klinické hodnocení
Studie fáze I
Do studie fáze I bylo zařazeno 60 pacientů s refrakterní CML (chronická fáze 43 pacientů, akcelerovaná fáze 9 pacientů a blastická fáze 8 pacientů) a 5 pacientů s akutní lymfoblastickou leukemií (ALL) s pozitivním filadelfským chromosomem (Ph+). Jednalo se o značně předléčené pacienty (94 % pacientů ≥ 2 TKI, 63 % pacientů ≥ 3 TKI) a mutace byla přítomna u 65 % z nich. Cílem této studie bylo nalezení maximálně tolerované dávky ponatinibu s ověřením bezpečnosti a účinnosti léčiva. U 98 % pacientů s chronickou fází CML bylo dosaženo kompletní hematologické remise (CHR) a u 63 % kompletní cytogenetické remise (CCyR) a 44 % pacientů dosáhlo tzv. velké molekulární odpovědi (MMR). Velmi překvapivým výsledkem byla dále účinnost u pacientů s mutací T315I, kdy 100 % hodnocených dosáhlo CHR, 83 % CCyR a 67 % MMR. Nedávná analýza této studie s mediánem sledování 53,1 měsíce prokázala, že pravděpodobnost setrvání CCyR a MMR u 22 pacientů ze 43 pokračujících v léčbě ponatinibem byla 70 % a 50 %. Na základě výsledků této studie byla určena dávka ponatinibu 45 mg 1× denně jako dávka léčebná [6].
Studie fáze II
Do studie fáze II (PACE) bylo zařazeno 449 pacientů s CML nebo s Ph pozitivní ALL, kteří byli rezistentní na předchozí léčbu dasatinibem či nilotinibem nebo tuto léčbu nesnášeli, dále sem byli zahrnuti pacienti s prokázanou mutací T315I. Jednalo se opět o pacienty předléčené několika TKI: 93 % sledovaných bylo předléčeno dvěma a více TKI a 58 % třemi a více TKI. Dosažené léčebné odpovědi dokumentuje tab. 2. U pacientů s CML v chroni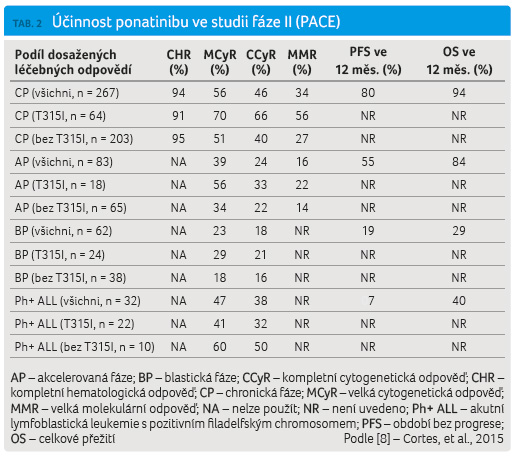 cké fázi bylo po 12 měsících léčby zjištěné přežití bez progrese onemocnění (progression free survival, PFS) 80 % a celkové přežití (overall survival, OS) 94 %. I v této studii byla zaznamenána velmi dobrá léčebná odpověď u pacientů s různými mutacemi včetně T315I. Během léčby ponatinibem se u 21 pacientů objevily nové mutace včetně tzv. složených (≥ 2 mutace v jedné molekule BCR ABL). Poslední výsledky studie PACE s mediánem sledování 36 měsíců ukazují podíl CCyR 53 %, MMR 39 % s předpokládaným PFS a OS po třech letech 60 % a 81 %. Nadále zůstává v rámci této studie ponatinibem léčeno 42 pacientů s CML v chronické fázi. Na základě těchto příznivých výsledků byla v prosinci 2012 léčba ponatinibem schválena americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) do klinické praxe pro pacienty s CML a s Ph+ ALL, u nichž předchozí léčba TKI nebyla účinná nebo kteří tuto léčbu nesnášeli [7–9].
cké fázi bylo po 12 měsících léčby zjištěné přežití bez progrese onemocnění (progression free survival, PFS) 80 % a celkové přežití (overall survival, OS) 94 %. I v této studii byla zaznamenána velmi dobrá léčebná odpověď u pacientů s různými mutacemi včetně T315I. Během léčby ponatinibem se u 21 pacientů objevily nové mutace včetně tzv. složených (≥ 2 mutace v jedné molekule BCR ABL). Poslední výsledky studie PACE s mediánem sledování 36 měsíců ukazují podíl CCyR 53 %, MMR 39 % s předpokládaným PFS a OS po třech letech 60 % a 81 %. Nadále zůstává v rámci této studie ponatinibem léčeno 42 pacientů s CML v chronické fázi. Na základě těchto příznivých výsledků byla v prosinci 2012 léčba ponatinibem schválena americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) do klinické praxe pro pacienty s CML a s Ph+ ALL, u nichž předchozí léčba TKI nebyla účinná nebo kteří tuto léčbu nesnášeli [7–9].
Studie fáze III
Studie fáze III (EPIC) byla otevřena v červenci 2012 a zařazováni byli pacienti s nově diagnostikovanou CML v chronické fázi, kteří byli následně randomizováni v poměru 1 : 1 do větve imatinib 400 mg 1× denně vs. ponatinib 45 mg 1× denně. Cílem studie bylo porovnat účinnost a bezpečnost ponatinibu v první linii léčby CML. V plánu bylo zařazení 528 nemocných, avšak z bezpečnostních důvodů byla tato studie předčasně ukončena v říjnu 2013. Do té doby bylo zařazeno 307 nemocných (155 pacientů do větve s ponatinibem, 152 pacientů do větve s imatinibem). Primární cílový ukazatel, tedy dosažení MMR ve 12 měsících léčby, mohl být hodnocen pouze u 10 pacientů ze skupiny s léčbou ponatinibem a u 13 pacientů léčených imatinibem. Skóre dosažení MMR bylo vyšší u pacientů léčených ponatinibem (80 %) než u léčených imatinibem (38 %), tento rozdíl však nebyl statisticky významný (p = 0,074). Pokud se však podíváme na dosažení MMR v jiném časovém úseku, kde bylo možné hodnotit větší počet pacientů, ukazuje se, že podíl MMR v rameni s ponatinibem je již statisticky vyšší: ve třetím měsíci léčby dosáhlo MMR 31 % pacientů ve skupině s ponatinibem vs. 3 % pacientů ve skupině s imatinibem, v šestém měsíci léčby byla MMR přítomna u 62 % (ponatinib) vs. u 22 % pacientů (imatinib) a v devátém měsíci léčby činil tento rozdíl v jednotlivých skupinách studie 86 % vs. 33 % pacientů. Medián doby do dosažení MMR byl u pacientů léčených ponatinibem 3,3 měsíce a u pacientů s léčbou imatinibem 5,6 měsíce [10,11].
V rame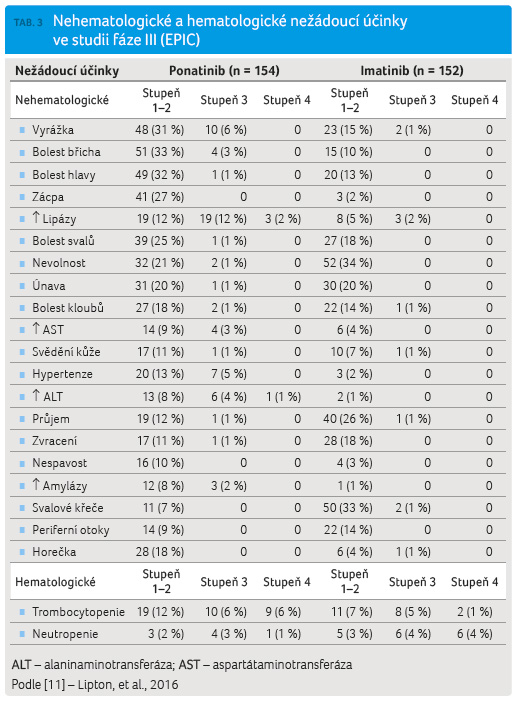 ni s ponatinibem se z nežádoucích účinků nejčastěji vyskytovala bolest hlavy či břicha, zvýšení hodnot lipáz, amyláz či jaterních testů. Naopak u pacientů léčených imatinibem se nejčastěji vyskytovaly zažívací potíže, svalové křeče a především retence tekutin (tab. 3). Nejzávažnější nežádoucí účinek, který byl důvodem ukončení studie, však představoval vyšší výskyt cévních okluzivních komplikací, který se objevil u jedenácti z celkem 154 (11/154; 7 %) pacientů léčených ponatinibem a u tří z celkem 152 (3/152; 2 %) pacientů léčených imatinibem (tab. 4). Cévní komplikace se vyskytovaly poměrně časně po zahájení léčby (medián doby do jejich vzniku byl 3,6 měsíce). Celkem u 10/11 pacientů s cévní komplikací byl přítomen minimálně jeden nebo více rizikových faktorů pro rozvoj cévní komplikace: 8/11 pacientů prodělalo již ischemickou příhodu, 8/11 pacientů trpělo hypertenzí a 6/11 pacientů mělo hypercholesterolemii.
ni s ponatinibem se z nežádoucích účinků nejčastěji vyskytovala bolest hlavy či břicha, zvýšení hodnot lipáz, amyláz či jaterních testů. Naopak u pacientů léčených imatinibem se nejčastěji vyskytovaly zažívací potíže, svalové křeče a především retence tekutin (tab. 3). Nejzávažnější nežádoucí účinek, který byl důvodem ukončení studie, však představoval vyšší výskyt cévních okluzivních komplikací, který se objevil u jedenácti z celkem 154 (11/154; 7 %) pacientů léčených ponatinibem a u tří z celkem 152 (3/152; 2 %) pacientů léčených imatinibem (tab. 4). Cévní komplikace se vyskytovaly poměrně časně po zahájení léčby (medián doby do jejich vzniku byl 3,6 měsíce). Celkem u 10/11 pacientů s cévní komplikací byl přítomen minimálně jeden nebo více rizikových faktorů pro rozvoj cévní komplikace: 8/11 pacientů prodělalo již ischemickou příhodu, 8/11 pacientů trpělo hypertenzí a 6/11 pacientů mělo hypercholesterolemii.
Diskuse
Výskyt cévních komplikací ve studii EPIC byl překvapením, protože ve studii fáze II u pacientů s CML refrakterních k léčbě takto vysoký výskyt zaznamenán nebyl (27 % pacientů s mediánem sledování 38 měsíců). Možným vysvětlením této skutečnosti při analýze obou studií je fakt, že ve studii fáze II byl nižší medián denní dávky ponatinibu (31 mg jednou denně) z důvodu předléčenosti pacientů. Ve studii EPIC byl medián denní dávky 39 mg jednou denně. Je složité nyní spekulovat o tom, zda by např. užití nižší dávky ponatinibu ve studii EPIC snížilo výskyt cévních komplikací [12]. V současné době probíhají další studie s dávkou ponatinibu 15 mg a 30 mg, které snad přinesou odpověď na tuto otázku.
Mechanismus vzniku cévních komplikací není dosud přesně objasněn a je zřejmé, že se bude lišit od patogeneze cévních komplikací, které se objevují při léčbě nilotinibem. Pravděpodobně se jedná o přímý vliv na endoteliální buňky prostřednictvím vazby na angiogenní receptory a tomu by odpovídal poměrně rychlý rozvoj těchto cévních komplikací. Dále se na rozvoji cévních komplikací může spolupodílet inhibice některých dalších kináz (PDGFR, KIT).
Závěr
Ponatinib je v České republice indikován u dospělých pacientů s chronickou myeloidní leukemií ve všech fázích onemocnění, kteří jsou rezistentní na léčbu nilotinibem nebo dasatinibem nebo tuto léčbu netolerují, nebo u pacientů, u kterých je zjištěna rezistentní mutace T315I. U dospělých pacientů s Ph+ ALL je ponatinib indikován při rezistenci na léčbu dasatinibem nebo při její intoleranci nebo u pacientů, kde není vhodná následná léčba imatinibem, rovněž u pacientů s potvrzenou mutací T315I. Přípravek není dosud hrazen zdravotní pojišťovnou, léčba ponatinibem je možná po schválení revizním lékařem dle paragrafu 16 zákona č. 48/1997 Sb., o veřejném zdravotním pojištění.
V klinické praxi se ponatinib používá nejčastěji ve třetí nebo čtvrté linii léčby pacientů s CML po selhání předchozí léčby a při průkazu mutace T315I. Před zahájením léčby je vždy důležité u pacienta zhodnotit kardiovaskulární riziko a ve spolupráci s dalšími specialisty aktivně ovlivňovat přídatné rizikové faktory (hypertenzi, poruchy metabolismu lipidů) s cílem snížit riziko výskytu cévních komplikací.
Seznam použité literatury
- [2] Tanaka R, Kimura S. Abl tyrosine kinase inhibitors for overriding Bcr‑Abl/T315I: from the second to third generation. Expert Rev Anticancer Ther 2008; 8: 1387–1398.
- [3] Hoy SM. Ponatinib: a review of its use in adults with chronic myeloid leukaemia or Philadelphia chromosome‑positive acute lymphoblastic leukaemia. Drugs 2014; 74: 793–806.
- [4] Gozgit JM, Schrock A, Chen TH, et al. Comprehensive analysis of the in vitro potency of ponatinib, and all other approved BCR‑ABL tyrosine kinase inhibitors (TKIs), against a panel of single and compound BCR‑ABL mutants. Blood 2013; 122: 3992.
- [5] Žáčková D. Ponatinib, tyrosinkinázový inhibitor třetí generace, v léčbě pacientů s chronickou myeloidní leukemií. Farmakoterapie 2015; 11: 563–571.
- [6] Talpaz M, Cortes JE, Kantarjian HM, et al. Longer‑term follow up of a phase 1 study of ponatinib in patients (pts) with Philadelphia chromosome‑positive (Ph+) leukemias. J Clin Oncol 2014, 32: 5 (abstract).
- [7] Cortes JE, Kim DW, Pinilla‑Ibarz J, et al. A phase 2 trial of ponatinib in Philadelphia chromosome‑positive leukemias. N Engl J Med 2013; 369: 1783–1796.
- [8] Cortes J, Kim DW, Pinilla‑Ibarz J, et al. Ponatinib efficacy and safety in heavily pretreated leukemia patients: 3‑year results of the PACE trial [abstract P234]. Haematologica 2015; 100 (Suppl 1): 64.
- [9] Baccarani M, Mauro MM, Cortes JE, et al. Long‑term follow‑up of ponatinib efficacy and safety in patients (pts) with the T315I mutation in the phase 1 and phase 2 (PACE) trials [abstract P236]. Haematologica 2015; 100 (Suppl 1): 65.
- [10] Lipton JH, Chuah C, Guerci‑Bresler A, et al. A Phase 3 Trial of Ponatinib Compared with Imatinib in Patients with Newly Diagnosed Chronic Myeloid Leukemia in Chronic Phase (CP‑CML). Blood 2014; 124: 519.
- [11] Lipton JH, Chuah C, Guerci‑Bresler A, et al. Ponatinib versus imatinib for newly diagnosed chronic myeloid leukaemia: an international, randomised, open‑label, phase 3 trial. Lancet Oncol 2016; 17: 612–621.
- [12] Khoury HJ, Cortes JE, Kim DW, et al. Analysis of the cardiovascular risk profile of Ph+ leukemia patients treated with ponatinib. J Clin Oncol 2013; 31: 7048 (abstract).