Postavení montelukastu v léčbě asthma bronchiale u dětí
Asthma bronchiale je chronické zánětlivé onemocnění dýchacích cest, při kterém hrají roli mnohé buňky – žírné buňky, T lymfocyty a eozinofily. Svébytný typ alergického zánětu zvyšuje hyperreaktivitu dýchacích cest na širokou škálu podnětů vedoucí k výraznému zúžení průdušek.
Leukotrieny se vždy nově tvoří z arachidonové kyseliny, která je přítomna ve všech buňkách. Společně s dalšími faktory v patogenezi bronchiálního astmatu vyvolávají leukotrieny vzestup cévní permeability a rozvoj edému, produkci hlenu, bronchokonstrikci a buněčnou infiltraci. U astmatiků byla prokázána zvýšená tvorba leukotrienů po námaze a expozici alergenu. Montelukast, specifický antagonista leukotrienových receptorů, potlačuje bronchokonstrikci vyvolanou alergenem, námahou a chladným vzduchem. V léčbě dětského astmatu doporučuje Globální strategie péče o astma (GINA) i pediatrický dokument PRACTALL antagonisty leukotrienových receptorů jako léčiva pro lehké/středně těžké formy perzistujícího astmatu podávané dlouhodobě v monoterapii. Není-li dosaženo kontroly nad astmatem, je doporučeno kombinovat antileukotrieny s inhalačními kortikoidy nebo přejít na podávání inhalačních kortikoidů. Obráceně se nabízí kombinace inhalačních kortikoidů s antileukotrieny u středně těžkých/těžkých forem astmatu, když léčba kortikoidy nedosahuje při podávání standardních dávek úspěchu.
Úvod
Asthma bronchiale je chronické zánětlivé onemocnění dýchacích cest, při kterém hrají roli mnohé buňky – žírné buňky, T lymfocyty a eozinofily. Svébytný typ alergického zánětu zvyšuje hyperreaktivitu dýchacích cest na širokou škálu podnětů vedoucí k výraznému zúžení průdušek.
Imunopatologická reakce
Antigen/alergen spouští po průniku povrchovými obrannými bariérami po vazbě na povrchové Fce-receptory buněk alergickou reakci I. typu. Alergen aktivuje i nespecifické mechanismy, které vyvolávají akutní zánětlivé změny.
Po průniku antigenu do submukózního prostoru je jeho vazba na imunoglobuliny E (IgE) na povrchu žírných buněk nejdůležitějším podnětem pro rozvoj lokálního akutního alergického zánětu. Na žírných buňkách alergiků byl prokázán větší počet vysokoafinních receptorů pro IgE (FceRI), takže i minimální množství alergenu spouští degranulaci, tj. fúzi cytoplazmatických granul s povrchovou membránou a vylití jejich obsahu – mediátorů akutní alergické reakce. Dochází k uvolnění mediátorů dvojího typu:
- preformovaných mediátorů obsažených v granulách uvnitř buněk (histamin, serotonin, hydrolytické enzymy a proteoglykany, chemotaktické faktory aj.);
- nově vytvořených mediátorů vznikajících aktivitou membránové fosfolipázy A2 z fosfolipidů buněčné membrány (prostaglandiny, leukotrieny, destičky aktivující faktor aj.).
Imunopatologická reakce se manifestuje časnou fází – za 10–30 minut – a pozdní fází – za 4–8 hodin. Společně je označujeme jako duální reakce I. typu přecitlivělosti.
V průběhu časné alergické reakce dochází k uvolnění leukotrienů, které se pak naváží na cysteinyl-leukotrienový receptor typu 1 – receptor CysLT1 (autokrinní proces) na povrchu mastocytů. Následně dochází k uvolnění Ca2+, které ovlivňují alergickou zánětlivou odpověď. Tento autokrinní signál vede opět ke zvýšené tvorbě leukotrienů a k jejich uvolnění, což uzavírá „cysteinylový circulus vitiosus mastocytů“ v rámci alergické reakce a reguluje tak funkci mastocytů a částečně i buněk hladkého svalstva parakrinně uvolněnými leukotrieny. V histaminem aktivovaných makrofázích dochází ke zvýšené tvorbě leukotrienů (leukotrien D4, LTD4) a na druhé straně leukotrieny mohou podporovat uvolňování mediátorů zánětu v dýchacích cestách.
V pozdní fázi se prohlubují změny vyvolané zvýšenou cévní permeabilitou a do perivaskulárních prostorů přestupují buňky zánětu – eozinofily, lymfocyty a minimálně i neutrofily. Dochází k dalšímu rozvoji a následně můžeme prokázat bronchiální hyperreaktivitu.
Žírné buňky
Žírné buňky jsou jedněmi z prvních buněk aktivovaných v průběhu neutrofilního zánětu, neboť se nacházejí na rozhraní vnějšího prostředí a organismu, v pojivové tkáni v okolí krevních a lymfatických cév i v blízkosti nervových pletení. Jejich základní funkcí je obrana proti parazitárním infekcím a hrají významnou roli v regulaci imunitní odpovědi a při komunikaci mezi nervovým a imunitním systémem.
Žírné buňky v mukóze a submukóze dýchacích cest jsou buňky prvého kontaktu. Jsou aktivovány opakovanou expozicí alergenu vyvolávající uvolnění mediátorů, mezi něž patří histamin, CysLTs (cysteinylové leukotrieny), prostaglandiny, PAF (faktor aktivující destičky) a cytokiny IL-1, -2, -3, -4, -5 (interleukin 1–5), GM-CSF (granulocyte-macrophage colony-stimulating factor) a TNF-α (tumor necrosis factor a). Následně tyto mediátory zahajují proces přestupu prozánětlivých buněk z krve – eozinofilů, bazofilů, T lymfocytů a makrofágů.
Neuropeptidy, mezi něž patří například substance P a neurokinin A, jsou lokalizovány na senzorických C vláknech dýchacích cest. Tyto jsou uvolňovány reflexně místně nebo centrálně v průběhu alergické i nealergické reakce alergeny, viry, cigaretovým kouřem, chemickými látkami a dalšími exogenními vlivy. Žírné buňky pod vlivem substance P uvolňují histamin, TNF-a i leukotrieny a tak se významně podílejí na rozvoji neurogenního zánětu.
Eozinofily
Eozinofily jsou představitelem a projevem systémového původu pozdní reakce. Jejich vývoj ovlivňují a řídí IL-3, IL-5 a GM-CSF. Po přestupu eozinofilů skrze cévní endotel do zánětlivé tkáně jsou tyto aktivovány a následně tvoří a uvolňují mediátory CysLTs, prostaglandin E1, PAF, IL-3, -5, -8 a GM-CSF a reaktivní kyslíkové radikály, MBP (hlavní bazický protein), ECP (eozinofilní kationický protein), neurotoxin a eozinofilní peroxidázu. V dalším období potlačují GM-CSF, IL-5, IL-3 a CysLTs apoptózu eozinofilů.
V průběhu protizánětlivé odpovědi u virové infekce dochází v dýchacích cestách ke zvýšené tvorbě IFN-g (interferon g) Th1 lymfocyty. IFN-g zvyšuje expresi receptoru CysLT1 v dýchacích cestách a zvyšuje také odpověď na LTD4.
IFN-g tak ovlivňuje úroveň bronchiální hyperreaktivity v průběhu virové infekce a také i alergické reakce. U dětí s hvízdavým dýcháním vyvolaným virovou infekcí byla prokázána velká množství IFN-g a leukotrienů jak v bronchoalveolární tekutině, tak i ve sputu [1].
Leukotrieny
V roce 1980 Samuelsson prokázal, že SRS-A (slow-reacting substance of anaphylaxis) je tvořena leukotrieny C4, D4 a E4. Za tento objev mu byla udělena v roce 1982 Nobelova cena. Leukotrieny mají svůj název historicky odvozen od leukocytů (předpona „leuko“), neboť se původně předpokládalo, že jsou pouze leukocytárního původu, a z jejich struktury (základ „triene“), neboť mají tři konjugované vazby.
Metabolismus leukotrienů
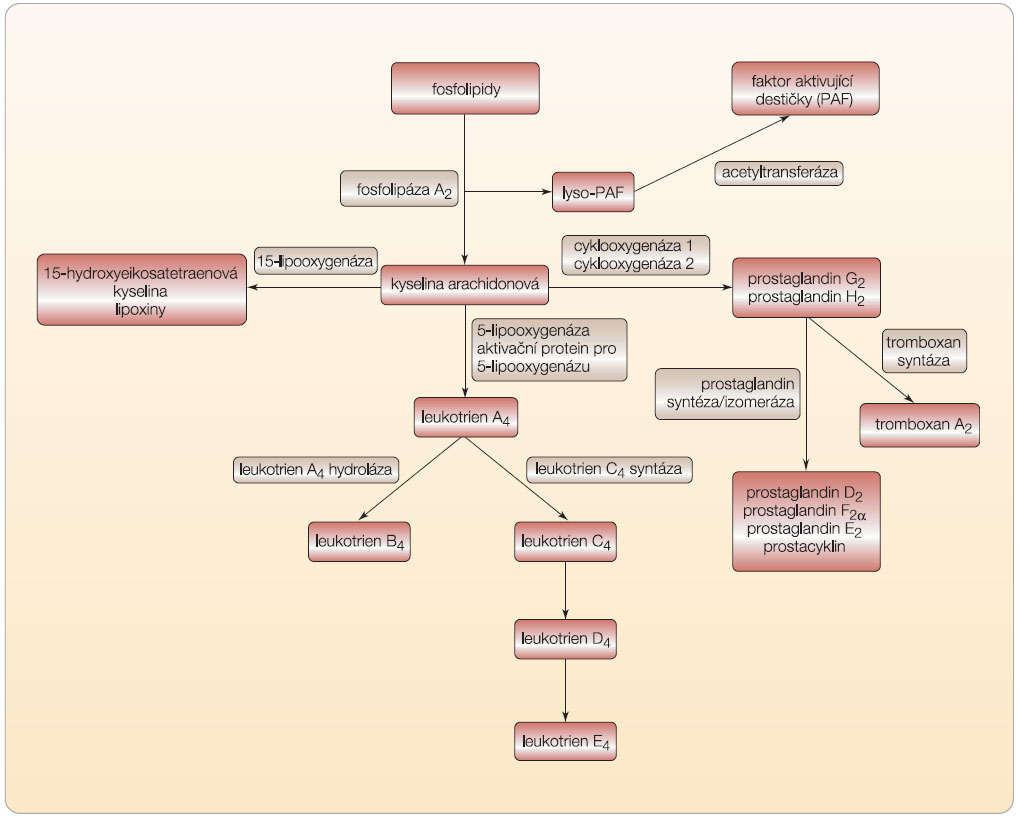 Leukotrieny se vždy nově tvoří z arachidonové kyseliny, která je přítomna ve všech buňkách. Kyselina arachidonová (eikosatetraenová w-6 nenasycená kyselina) je uvolňována z membránových fosfolipidů aktivovanou fosfolipázou A2 (obr. 1).
Leukotrieny se vždy nově tvoří z arachidonové kyseliny, která je přítomna ve všech buňkách. Kyselina arachidonová (eikosatetraenová w-6 nenasycená kyselina) je uvolňována z membránových fosfolipidů aktivovanou fosfolipázou A2 (obr. 1).
Kyselina arachidonová je dále přeměňována třemi cestami:
- cyklooxygenázovou, jejímiž produkty jsou prostaglandiny (PGE2, PGD2, PGF2), prostacyklin (PGI2) a tromboxan (TXA2);
- 5-lipooxygenázovou, kdy postupně vznikají hydroperoxyeikosatetraenové kyseliny (nPETE), které jsou dále metabolizovány na hydroxyeikosatetraenové kyseliny (HETE, hlavní produkty 12-lipooxygenázy a 15-lipooxygenázy), leukotrieny (hlavní produkty 5-lipooxygenázy) a lipoxiny (vznikající společným působením 5-lipooxygenázy a 15-lipooxygenázy);
- oxygenací v přítomnosti cytochromu P-450 vznikají epoxyeikosatrienové kyseliny (EET).
Leukotrien A4 se konvertuje buď na LTB4 pomocí LTA4 hydrolázy, což je charakteristické pro neutrofily, anebo se přemění pomocí LTC4 syntázy a je konjugován s glutathionem na sulfidopeptidový LTC4.
LTC4, LTD4 a LTE4 jsou také známy jako cysteinylové leukotrieny, „cysteinylleukotrieny“ (v anglosaské literatuře též sulfidopeptidové leukotrieny), protože mají ve své struktuře kovalentně přes atom síry navázaný tripeptid obsahující cystein. Vznik sulfidopeptidových leukotrienů je charakteristický pro eozinofily a mastocyty [2].
Cysteinylové receptory
Po vazbě leukotrienů na specifické receptory, které jsou asociovány s G proteinem, se spouští kaskáda reakcí.
Receptor CysLT1 prokázal Drazen v roce 1980 a receptor CysLT2 Labat v roce 1992. Receptor CysLT1 se nachází na plicních makrofázích, buňkách hladkého svalstva, eozinofilech, bazofilech, monocytech i žírných buňkách, B lymfocytech a CD34 buněčných prekurzorech, ve slezině, střevě, placentě, slinivce, prostatě, srdci, mozku, ledvinách, játrech i v tukové tkáni.
Receptory CysLT2 jsou na Purkyňových vodivých vláknech srdce a chromafinních buňkách nadledvinek, mozku, na leukocytech, i dokonce na eozinofilech či makrofázích.
V roce 1995 byly receptory CysLT1 a CysLT2 farmakologicky definovány a byla určena jejich struktura. Receptory jsou složeny ze sedmi transmembranózních domén a asociovány s G proteiny. Ty se skládají ze tří podjednotek – α, β a g, z nichž každá je kódována na jiném genu. Po aktivaci ligandem dochází ke zvýšení hladiny intracelulárního Ca2+ a následně jsou ovlivněny další membránové iontové kanály. Po vazbě leukotrienu na receptor asociovaný s G proteinem se aktivuje tyrozinkináza a je tak zahájen přenos informace. Dochází současně k aktivaci fosfolipázy 2, ke zvýšení transkripce aktivačního proteinu pro fosfolipázu 2, která je kontrolována aktivovanou topoizomerázou I. A tyto počáteční kroky jsou regulovány proteinkinázou C. Předpokládá se, že G proteiny spojují přenos extracelulárních signálů z aktivovaných membránových receptorů k intracelulárním efektorovým molekulám. Současně se ukazuje, že tvorba „druhých poslů“ receptory je spojena s přítomností G proteinů. V buňkách existuje pestré spektrum G proteinů se specifickými funkcemi, avšak mechanismy regulačních funkcí G proteinů ve vztahu k účinkům leukotrienů nejsou stále plně vysvětleny.
Cysteinylový receptor CysLT1 je uložen na chromozomu Xq13-q21, což je oblast s vazbou k atopickému asthma bronchiale. Je složen ze 337 aminokyselin.
Cysteinylový receptor CysLT2 je uložen na chromozomu 13q14.2 a mezi oběma typy receptorů je 38% homologie jejich aminokyselin.
Leukotrieny jsou mediátory akutního i chronického zánětu neutrofilního – nespecifického, ale i alergického. Jejich farmakologická a prozánětlivá aktivita byla prokázána v respiračním, kardiovaskulárním i gastrointestinálním traktu. Úloha leukotrienů v patogenezi asthma bronchiale byla nově potvrzena v klinických studiích s inhibitory 5-lipooxygenázy, inhibitory proteinu aktivujícího 5-lipooxygenázu (FLAP-inhibitory) a antagonisty receptoru LTD4 (LT-antagonisty).
Leukotrieny společně s dalšími faktory patogeneze bronchiálního astmatu vyvolávají:
- vzestup cévní permeability a rozvoj edému,
- produkci hlenu,
- bronchokonstrikci,
- buněčnou infiltraci.
Ad 1. Mediátory – např. histamin, destičky aktivující faktor, prostaglandin E2, substance P a leukotrieny – mohou vyvolat zvýšení cévní permeability s exsudací plazmy a vznik edému.
Ad 2. LTC4 a LTD4 společně s dalšími mediátory (histaminem, PG, PAF a tromboxanem A2) vyvolávají zvýšenou tvorbu hlenu.
Ad 3. LT jsou až 3000krát potentnějšími bronchokonstriktory, než je histamin či PG. LTD4 v inhalaci vyvolává v dýchacích cestách 100–10 000krát větší bronchokonstrikční odpověď než u zdravých jedinců. U lidí byl prokázán specifický receptor pro LTD4 a dnes se označuje jako receptor CysLT1 a receptor CysLT2, který ovlivňuje stabilitu cévní stěny. Atypický receptor CysLT byl prokázán v dýchacích cestách na základě reakcí s antagonisty – existuje aktivita vyvolaná LTD4 /LTE4, ale také samostatně vyvolaná LTC4. Odpověď na inhalaci LTD4 a LTE4 se rozvíjí během 4–6 minut, kdežto odpověď na podání LTC4 nastane za 10–20 minut [3].
Asthma bronchiale a neurogenní zánět
Neurogenní zánět je, vedle infekčního a alergického, třetí formou zánětu. Přes svůj klíčový význam v řadě patologických stavů byl neurogenní zánět dlouho předmětem hypotéz, teprve metody molekulární a buněčné biologie přinesly jeho plný popis a pochopení.
První popsal princip neurogenního zánětu Bayliss před 100 lety, když přednesl svá pozorování, že nervová stimulace neuronů dorzálních kořenů vyvolává vazodilataci, a že tedy tyto neurony nejenom přenášejí aferentní informaci spinální míchou do centrálního nervového systému, ale mají též eferentní funkci.
Senzorické nervy horních i dolních dýchacích cest obsahují zásoby neurotransmiterů (neuromediátorů), jako je substance P, VIP (vazoaktivní intestinální peptid), tachykininů – neurokinin A, neurokinin B a další. Účinek substance P je prozánětlivý a imunostimulační.
Tachykininy jsou mediátory uvolňované reflexně místně nebo centrálně v průběhu alergické i nealergické reakce – alergeny, viry, cigaretový kouř, chemické látky, znečištěné prostředí. Tachykininy vyvolávají bronchokonstrikci, zvyšují vaskulární permeabilitu a aktivuji cholinergní neurotransmisi. Žírné buňky pod vlivem substance P uvolňují histamin, TNF-α, leukotrieny. U astmatiků vyvolává inhalace tachykininů bronchokonstrikci [4].
Neuropeptidy dále mají i imunomodulační efekt na eozinofily, neutrofily, lymfocyty, monocyty a žírné buňky. Většina jejich aktivit je spouštěna aktivitou specifických receptorů NK1 a NK2.
Tachykininy zvyšují tvorbu leukotrienů v dýchacích cestách. Z toho můžeme usuzovat, že vlastní účinek neurokininů je vyvolán nepřímo uvolněním leukotrienů! A proto můžeme závěrem říci, že účinek podání montelukastu potlačující odpověď na neuropeptidy, který byl prokázán dalšími studiemi, je logický. Důkazem provázanosti různých forem zánětlivé odpovědi je i zjištění, že samotné leukotrieny vyvolávají uvolnění tachykininů. Eozinofily mají na povrchu receptory NK1, a tak tachykininy mohou spustit tvorbu leukotrienů a tím propojovat neurogenní a alergický zánět. Je tu opět malý circulus vitiosus – tachykininy zvyšují tvorbu LT a LT zvyšují uvolnění tachykininů, eozinofily uvolňují hlavní bazický protein (MBP) a ten ničí receptory M2 – neurogenní a alergický zánět.
V rámci časné reakce zánětu vyvolává virová infekce fyziologickou obrannou tvorbu leukotrienů a rychle se vrací do klidových podmínek, ale může být následně zvýšena stimulací žírných buněk přítomných v plicní tkáni a následně uvolněnými neurotransmitery, např. substancí P, z terminálních senzorických nervů. Jak mediátory uvolněné ze žírných buněk, tak mediátory uvolněné z nervových vláken působí synergicky a prohlubují tak zánětlivou odpověď [5].
Je tak vytvořena smyčka vlivů, které navzájem ovlivňují aktivitu žírných buněk a nervových vláken. Účinky leukotrienů prohlubují zánětlivou odpověď v organismu a účinky neurogenního, infekčního, ale i alergického zánětu se sčítají – v imunologický zánět [6]. Tyto poznatky opodstatňují podání antileukotrienů v průběhu virové infekce jako prevence virem indukované exacerbace asthma bronchiale.
Asthma bronchiale u dětí
Asthma bronchiale je heterogenní choroba s variabilním přirozeným průběhem. Ačkoliv v rozvinutých zemích je dispozice k atopii přítomna u 40 % populace, postižení dolních dýchacích cest astmatem se projevuje u 7–10 % jedinců v populaci. U dětí je ve skutečnosti riziko k aeroalergenům ještě nižší, 4–11 % v populaci. Z toho vyplývá, že podmínkou pro rozvoj astmatu je přítomnost tkáňově specifických faktorů, které vedou k rozvoji dispozice atopického fenotypu v chorobu postihující dýchací cesty. Zúžení pohledu na příčinu rozvoje astmatu jen na alergenovou senzibilizaci jako na důležitou součást astmatu, pokus snížit senzibilizaci nebo jí zabránit např. vyloučením alergenů má jen malý nebo žádný vliv na vývoj astmatu u dětí. Jiné studie dokonce prokázaly vzestup senzibilizace při pokusu o vyloučení alergenů. Jednou z možností, jak vysvětlit tyto rozporuplné výsledky, je fakt, že snížením množství alergenů dochází i ke snížení expozice potenciálně ochranným složkám, jako jsou ligandy toll-like receptorů endotoxinu a chitinu a dalších mikrobiálních produktů, které jsou společně s alergeny součástí inhalovaného prachu. Senzibilizace per se asi není dominantní příčinou rozvoje astmatu.
Většina astmatu začíná v prvních letech života (1–3 roky) jako perzistující fenotyp s hvízdavým dýcháním. Zájem se soustřeďuje na odhalení prvních známek patologických změn přestavby na počátku při vzniku onemocnění – na strukturální změny průduškové stěny, na ztluštění subepiteliální lamina reticularis, na takzvanou epiteliálně mezenchymální trofickou jednotku (epithelial-mesenchymal trophic unit, EMTU). Na počátku musíme uvažovat o narušené bariérové ochranné funkci epitelu. Epiteliální buňky astmatiků tvoří méně interferonů, což snižuje obrannou reakci proti virům; dochází ke zvýšené replikaci virů a následnému cytotoxickému poškození epitelu. ![Obr. 2 Fenotypy dětského astmatu; podle [8] – Bacharier, et al., 2008.](https://www.remedia.cz/photo-a-28305---.jpg) Nealergické negativní vlivy pak představuje kouření v těhotenství a v prvních letech života, znečištění životního prostředí. Vlivy vnějšího prostředí můžeme ovlivnit příjmem antioxidantů a vitaminů v ovoci a zelenině [7].
Nealergické negativní vlivy pak představuje kouření v těhotenství a v prvních letech života, znečištění životního prostředí. Vlivy vnějšího prostředí můžeme ovlivnit příjmem antioxidantů a vitaminů v ovoci a zelenině [7].
U dětí v kojeneckém a předškolním věku je stále obtížná jasná definice asthma bronchiale a tím i diferenciální diagnóza obstruktivních stavů u dětských pacientů. Na základě klinického obrazu onemocnění a předpokládané vyvolávající příčiny můžeme rozlišit několik fenotypů choroby s odlišnou prognózou vývoje. Používané dělení asthma bronchiale na různé fenotypy se odlišuje od významu fenotypu zavedeného genetiky. Posledním doporučením k hodnocení asthma bronchiale u dětí je dokument vzniklý v rámci projektu PRACTALL (Practical Allergy), ve kterém jsou rozlišovány tři hlavní fenotypy, viz obr. 2 [8].
V prvních letech života se objevují příznaky dětského astmatu, a toto období je proto pro další vývoj onemocnění zásadní. Stáří dětského pacienta ovlivňuje výběr léků i jejich aplikační formu. Dětský věk z těchto důvodů dělíme do čtyř skupin:
- kojenci a batolata (do 2 let věku),
- předškolní děti (3–5 let),
- školní děti (6–12 let),
- dospívající.
Ve strategii léčby je třeba brát v úvahu klinický fenotyp astmatu u dětí a léčbu individualizovat.
Antileukotrieny
Poznání úlohy leukotrienů v patogenezi eozinofilního zánětu vedlo k vývoji léčiv – antileukotrienů.
Antileukotrieny potlačují kromě jiného influx eozinofilů a snižují i celkový počet eozinofilů v periferní krvi. Jejich efekt se projevuje ovlivněním zánětlivých procesů i bronchiální hyperreaktivity u chronického asthma bronchiale a dochází též k úpravě plicních funkcí.
Antileukotrieny se objevily v léčbě asthma bronchiale v roce 1996 v USA; prvním z nich byl zileuton, inhibitor syntézy leukotrienů, následoval zafirlukast, antagonista cysteinylových receptorů leukotrienů. Dalšími antagonisty jsou pranlukast a nejnovější montelukast, uvedený na trh v roce 1998.
V současnosti jsou na trhu k dispozici dva perorální preparáty: zafirlukast, který je určen pro pacienty starší 12 let a podává se dvakrát denně na lačno, a montelukast ve formě ochucené žvýkací tablety (5 mg) podávané jednou denně (večer před spaním) pro děti od 5 let, ochucené žvýkací tablety (4 mg) pro děti od 2 let do 5 let, granule (4 mg) pro děti od 6 měsíců do 5 let a tablety (10 mg) pro dospělé. Montelukast je kompetitivní specifický antagonista receptoru pro leukotrieny – LTC4, LTD4 a LTE4. Po podání byl prokázán účinek na časnou a pozdní fázi odpovědi, která byla vyvolána inhalačním alergenem. Již dávka 5 mg per os významně blokuje bronchokonstrikci vyvolanou inhalací LTD4.
Selektivita antileukotrienů byla prokázána v pracích, kdy se sledovala jejich aktivita u adrenergních receptorů (a1, α2, β1, β2), receptorů pro histamin (H1, H2), serotonin (5-HT2), muskarinové receptory nebo receptory pro tromboxany (TP1, TP2). Vazba na receptor EP1 pro prostaglandin E2 je 10 000krát slabší než vazba na leukotrienové receptory.
U aspirinového asthma bronchiale, kde spouštěcím mechanismem jsou nesteroidní protizánětlivé léky včetně salicylátů, jsou antileukotrieny nezbytnou součástí kombinované léčby [9].
Farmakologické vlastnosti montelukastu
Farmakologická skupina
Montelukast je kompetitivní specifický antagonista leukotrienových receptorů. Biochemické a farmakologické studie prokázaly, že se váže s vysokou afinitou a selektivitou na receptor CysLT1 (přednostně před ostatními farmakologicky důležitými receptory dýchacího traktu, jako jsou například prostanoidní, cholinergní nebo b-adrenergní receptory). Montelukast se řadí do anatomicko-terapeuticko-chemické skupiny léčiv určených k terapii asthma bronchiale mezi antileukotrieny, kde má přidělen kód R03DC03.
Chemické a fyzikální vlastnosti
Montelukast je chemicky (S,E)-2-(1-((1-(3-(2-(7-chloroquinolin-2-yl)vinyl)fe-nyl)-3-(2-(2-hydroxypropan-2-yl)fenyl)propyl-thio)methyl)cyklopropyl)octová kyselina. Vyskytuje se ve formě sodné soli (obr. 3).
Sumární vzorec je C35H35ClNNaO3S; relativní molekulová hmotnost je 608,17. Montelukast sodný je hygroskopický bílý prášek, opticky aktivní, volně rozpustný v ethanolu, methanolu, vodě a prakticky nerozpustný v acetonitrilu [10]. 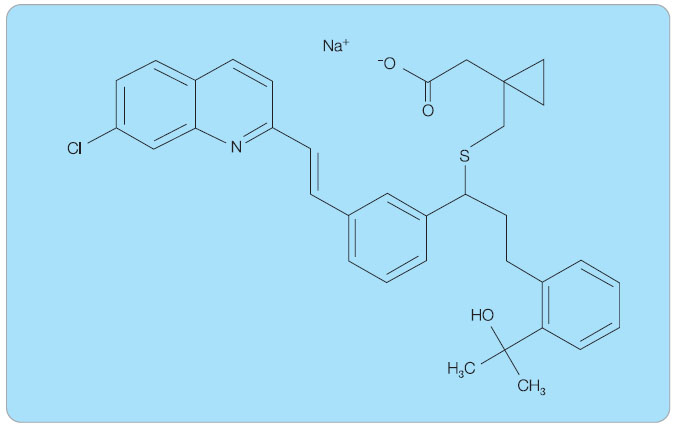
Farmakodynamické vlastnosti
Montelukast je sloučenina se silným protizánětlivým účinkem, aktivní po perorálním podání. Biochemické a farmako-logické studie prokázaly, že se váže s vysokou afinitou a selektivitou na receptor CysLT1 (přednostně před ostatními farmakologicky důležitými receptory dýchacího traktu, jako jsou například receptory prostanoidní, cholinergní nebo b-adrenergní). Montelukast silně inhibuje fyziologický účinek leukotrienů LTC4, LTD4, LTE4 na receptor CysLT1 bez jakéhokoliv agonistického účinku.
U astmatických pacientů montelukast silně inhibuje cysteinyl-leukotrienové receptory. Schopnost montelukastu inhibovat cysteinyl-leukotrienové receptory byla prokázána ve studii, ve které dávka 5 mg (i nižší) významně blokovala bronchokonstrikci indukovanou pomocí LTD4. Po perorálním podání způsoboval montelukast bronchodilataci během 2 hodin. Tento účinek měl aditivní efekt na bronchodilataci způsobenou β-agonisty.
Farmakokinetické vlastnosti
Montelukast se po perorálním podání rychle a téměř úplně vstřebává. U žvýkacích tablet s obsahem 5 mg montelukastu bylo u dospělých na lačno dosaženo maximální koncentrace (cmax) za 2 hodiny po podání. Průměrná biologická dostupnost po perorálním podání byla 73 %. Při dlouhodobém užívání nemá jídlo klinicky významný vliv.
Bezpečnost a účinnost byly prokázány v klinických studiích, ve kterých se podávaly 5mg žvýkací tablety a 10mg potahované tablety bez ohledu na dobu požití jídla.
Montelukast je vázán z více než 99 % na plazmatické bílkoviny. Studie na potkanech s radioaktivně značeným montelukastem prokázala, že látka přechází jen minimálně přes hematoencefalickou bariéru. Po 24 hodinách po podání byla i v ostatních tkáních koncentrace radioaktivně značeného materiálu minimální.
Montelukast je z velké části v organismu metabolizován. Při studiích in vitro s lidskými jaterními mikrozomy se prokázalo, že na biodegradaci montelukastu se podílí cytochrom P-450 3A4 a 2C9. Na základě dalších výsledků s lidskými jaterními mikrozomy se ukázalo, že terapeutické koncentrace montelukastu v plazmě neinhibují žádný z cytochromů P-450 3A4, 2C9, 1A2, 2A6, 2C19 nebo 2D6 [11, 12].
Klinické studie
Studie růstu
Dvě kontrolované studie prokázaly, že montelukast neovlivňuje u předpubertálních dětských astmatiků rychlost růstu. Ve studii s dětmi ve věku od 6 do 11 let byla rychlost růstu měřená rychlostí růstu kratší dolní končetiny u dětí léčených montelukastem v dávce 5 mg jednou denně po dobu 3 týdnů ve srovnání s placebem podobná a u pacientů léčených inhalací budesonidu (200 µg dvakrát denně) po dobu 3 týdnů byla statisticky významně nižší ve srovnání s placebem.
Ve 12týdenní placebem kontrolované studii s dětskými pacienty ve věku 2 až 5 let montelukast podávaný v dávce 4 mg jednou denně ve srovnání s placebem jednoznačně zlepšoval parametry zmírňování astmatu bez ohledu na současnou antiastmatickou terapii. U 60 % pacientů nebyla použita žádná jiná antiastmatická terapie. Ve srovnání s placebem montelukast významně zmírňoval denní symptomy (včetně kašle, sípání, obtížného dýchání a omezení aktivity) i noční symptomy. Ve srovnání s placebem montelukast významně snižoval i užívání β-agonistů „podle potřeby“ a záchranné terapie kortikoidy [13].
Vliv na bronchokonstrikci vyvolanou tělesným pohybem
Ve 12týdenní studii montelukast významně omezoval rozsah a trvání poklesu FEV1 nad 60 minut po cvičení, maximální procentuální snížení FEV1 po cvičení a dobu k návratu k normě na 5 % hodnoty FEV1 před cvičením. V období léčby přetrvával spolehlivě ochranný účinek, což znamená, že se nevyvinula tolerance. V samostatné zkřížené studii byl zjištěn ochranný účinek po podání dvou jednodenních dávek u dětí ve věku od 6 do 14 let, které užívaly žvýkací tablety s obsahem 5 mg účinné látky; tento účinek přetrvával po celou dobu dávkovacího intervalu (24 hodin).
Ovlivnění zánětu
Během klinické studie montelukast zamezoval jak časné, tak pozdní fázi bronchokonstrikce vyvolané antigenem. Byl zkoumán vliv montelukastu na eozinofily v periferní krvi a dýchacím traktu, neboť infiltrace těchto buněk je pro astma charakteristická. V klinické studii ve fázi IIb/III montelukast snižoval počet eozinofilů v periferní krvi asi o 15 % ve srovnání s placebem. U dětí ve věku 6 až 14 let snížil přípravek montelukast za 8 týdnů léčby počet eozinofilů ve srovnání s placebem o 13 %. Montelukast ve srovnání s placebem také významně snížil počet eozinofilů ve sputu.
Bezpečnost antileukotrienů
Z výsledků provedených studií i z klinických zkušeností plyne, že antileukotrieny mají minimální nežádoucí účinky a jsou vnímány jako všeobecně bezpečná léková skupina.
Postavení antileukotrienů v terapii astmatu
Studium léčebného mechanismu antileukotrienů a detailnější poznání účinků leukotrienů v celé šíři probíhajících imunopatologických reakcí u asthma bronchiale, jejichž příčinou je chronický eozinofilní zánět, přineslo někdy až neočekávané nové poznatky. Zatím prokázaná genetická dispozice zakódovaná na více než 80 místech lidského genomu a potvrzený účinek desítek cytokinů a mediátorů podílejících se na rozvoji eozinofilního zánětu nás informuje o mnohovrstevnosti a složitosti této nemoci. Je jasné, že ovlivnění jedné skupiny příčinných faktorů nemůže „vyléčit“ astma. Na druhé straně, u časně diagnostikovaného astmatu s geneticky determinovanou významnou rolí leukotrienů a zakódovanou receptorovou odpovědí na podání antileukotrienů je v populaci část astmatiků odpovídajících na léčbu antileukotrieny a ty jim přinášejí kontrolu nemoci a zlepšení kvality života.
Protizánětlivá léčba zřejmě zatím nedokáže zastavit některé mechanismy rozvoje astmatu, má jasnou úlohu v léčbě i z hlediska zabránění vzniku exacerbací a dosažení kontroly nad nemocí.
Globální strategie péče o astma (GINA) i pediatrický dokument PRACTALL doporučuje antagonisty cysteinylových leukotrienů v léčbě dětského astmatu pro lehké/ středně těžké formy perzistujícího astmatu v dlouhodobém podání jako monoterapii (u lehkých forem, u fenotypu astmatu indukovaného viry, u pozátěžových forem astmatu). Není-li dosaženo kontroly nad astmatem, je doporučeno léky kombinovat nebo přejít na podávání inhalačních kortikoidů. Obráceně se nabízí kombinace inhalačních kortikoidů s antileukotrieny u středně těžkých/těžkých forem astmatu, když léčba kortikoidy nedosahuje při podávání standardních dávek úspěchu. Nic se však nemění na tom, že inhalační kortikoidy jsou základním ![Obr. 4 Doporučené schéma vedení léčby; podle [8] – Bacharier, et al., 2008.](https://www.remedia.cz/photo-a-28307---.jpg) prostředkem v léčbě perzistujících forem astmatu u dětí i dospělých. Antileukotrieny byly také zařazeny do léčby astmatu s alergickou rýmou [14].
prostředkem v léčbě perzistujících forem astmatu u dětí i dospělých. Antileukotrieny byly také zařazeny do léčby astmatu s alergickou rýmou [14].
U části dětí v kojeneckém a batolecím věku dochází ke spontánní remisi potíží, a proto je nutné při dobré a přetrvávající kontrole nad nemocí léčbu zkusit vysadit a vyčkat dalšího průběhu. Pokud dojde k relapsu nemoci, je pravděpodobné, že se jedná o projevy perzistující, a léčba bude potřebná dlouhodobě. Současné doporučené postupy odlišují terapeutické postupy u dětí do dvou let věku a u dětí starších, viz obr. 4 [8].
Léčba astmatu u dětí do věku dvou let
V této věkové skupině se klade důraz především na řešení příznaků, a proto je v první volbě léčby doporučováno podávání bronchodilatancií, především správné podávání inhalačního b2-agonisty pomocí inhalačního nástavce.
U dětí s prokázanou alergickou senzibilizací je doporučena dlouhodobá preventivní léčba s užitím inhalačních kortikoidů; u dětí se závažnějšími perzistujícími příznaky se doporučuje i podávání antagonistů leukotrienových receptorů – montelukastu v lékové formě granulátu, která je schválena pro pacienty od 6 měsíců věku.
Léčba astmatu u dětí od dvou let věku
U dětí starších dvou let jsou základem léčby vždy léky preventivní. V úvahu přichází buď preventivní podávání nízké dávky inhalačního kortikoidu nebo zavedení terapie antagonisty receptorů pro leukotrieny. Léčba se odvíjí od dosažené kontroly nad astmatem.
Závěr
Montelukast patří k zavedené dlouhodobé protizánětlivé léčbě průduškového astmatu a astmatu s alergickou rýmou podle doporučení mezinárodních dokumentů GINA, PRACTALL a ARIA. Léková forma montelukast 4 mg granule doplňuje věkové indikace a poskytuje tak možnost použití montelukastu pro všechny věkové kategorie od 6 měsíců věku do dospělosti:
- granule 4 mg (6 měsíců–5 let);
- žvýkací tableta 4 mg (2–5 let);
- žvýkací tableta 5 mg (6–14 let);
- tableta 10 mg (od 15 let).
Jeho předností je bezpečnost u léčených dětských astmatiků. A v neposlední řadě je významná také adherence pacientů k léčbě montelukastem, neboť je to lék podávaný per os jedenkrát denně, a pacienty je proto upřednostňován před pravidelně podávanými inhalačními formami léků.
Hlavním cílem léčby astmatu u všech věkových skupin je dosažení kontroly nad astmatem. Systém kontroly nad astmatem v tomto pojetí je interaktivním vztahem mezi lékařem a pacientem. Stupeň kontroly nad astmatem hodnotí svými prostředky lékaři, ale na monitorování astmatu a hodnocení stupně kontroly se musí podílet, a to velmi aktivně, i pacient. Významně se tedy uplatňuje v rozhodování o vedení léčby individuální odpověď pacienta na stanovenou léčbu. Léčba je zahájena a pak upravována v nepřetržitém plynulém cyklu (zhodnocení kontroly nad astmatem, léčení k dosažení kontroly, monitorování k udržení kontroly), který je řízen podle stupně kontroly nad astmatem každého jednotlivého pacienta [15].
Seznam použité literatury
- [1] Kopřiva F. Chronický eozinofilní zánět a asthma bronchiale. 1. vyd. Praha: Maxdorf, 2003. 224 s.
- [2] Mastalerz L, Kumik J. Antileukotriene drugs in the treatment of asthma. Pol Arch Med Wewn 2010; 3: 103–108.
- [3] Kopřiva F. Leukotreiny. Úloha v klinické medicíně, mechanismy účinku. 1. vyd. Praha: Maxdorf, 2005. 141 s.
- [4] Groneberg DA, Harrison S, Dinh QT, et al. Tachykinins in the respiratory tract. Curr Drug Targets 2006; 8: 1005–1010.
- [5] Bisgaard H, Flores-Nunez A, Goh A, et al. A. Study of montelukast for the treatment of respiratory symptoms of post-respiratory syncytial virus bronchiolitis in children. Am J Respir Crit Care Med 2008; 8: 854–860.
- [6] Kopřiva F, Lavický J. Neurogenní zánět. 1. vyd. Praha: Maxdorf, 2009. 244 s.
- [7] Pohunek P. Diagnostika a léčba astmatu v časném dětském věku. Současné aspekty péče o děti s obstrukčními potížemi. Postgraduální medicina 2009; 2: 171–177.
- [8] Bacharier LB, Boner A, Carlsen KH, et al. Diagnosis and treatment of asthma in childhood: a PRACTALL consensus report. Allergy 2008; 63: 5–34.
- [9] Montuschi P, Peters-Golden ML. Leukotriene modifiers for asthma treatment. Clinical Experimental Allergy; 40: 1732–1741.
- [10] Singulair http://www.merck.com/product/usa/ pi_circulars/s/singulair/singulair_pi.pdf Accessed 31. 1. 2011
- [11] Souhrn údajů o přípravku Singulair 4 mg granule, datum revize textu 14.10.2009. www.sukl.cz
- [12] Jarvis B, Markham A. Montelukast: a review of its therapeutic potential in persistent asthma. Drugs 2000; 59: 891–928.
- [13] Bisgaard H, Zielen S, Garcia-Garcia ML, et al. Montelukast reduces asthma exacerbations in 2- to 5-year-old children with intermittent asthma. Am J Respir Crit Care Med 2005; 4: 315–322.
- [14] Global strategy for asthma management and prevention, www.ginasthma.org
- [15] Špičák V. Ciklesonid v léčbě dětského astmatu. Remedia 2009; 19: 73–75.