Postavení teriflunomidu v léčbě roztroušené sklerózy
Souhrn:
Roztroušená skleróza mozkomíšní (RS) je chronické zánětlivé autoimunitní onemocnění centrální nervové soustavy postihující převážně mladé lidi ve věku 20–40 let. Nadále patří mezi nevyléčitelná onemocnění a do poloviny devadesátých let minulého století byla víceméně neléčitelná. V současnosti je na trhu celá řada přípravků schopných ovlivnit průběh onemocnění (tzv. disease modifying drugs, DMD) až zastavit nárůst invalidity. Teriflunomid je prvním perorálním DMD první linie léčby. Jedná se o aktivní metabolit leflunomidu, který se používá již od roku 1998 k léčbě aktivní revmatoidní artritidy. Je indikován k léčbě nemocných po klinicky izolovaném syndromu (první demyelinizační příhoda) a u nemocných s relabující remitující formou RS. Je schopen snížit aktivitu onemocnění (počet relapsů, progresi invalidity) o 30 % ve srovnání s placebem. Vzhledem k perorální lékové formě a k minimu nežádoucích účinků je teriflunomid velmi dobře tolerovaným přípravkem. Pro potenciální teratogenitu by ovšem neměl být podáván ženám ve fertilním věku bez účinné antikoncepce.
Klíčová slova:
multiple sclerosis – teriflunomide – mechanism of action – efficacy – adverse effects.
Summary:
Multiple sclerosis (MS) is a chronic inflammatory autoimmune disease of the central nervous system, affecting mostly young people between 20 and 40 years of age. It is still considered incurable and, until mid 90 ties, it has been virtually untreatable. Currently, many disease modifying drugs (DMDs) are available, the use of which can sometimes halt the progression of disability. Teriflunomide is the first oral DMD within the first line of treatment. It is an active metabolite of leflunomide, which has been used for the treatment of active rheumatoid arthritis since 1998. It is indicated in patients with a recent history of clinically isolated syndrome (first demyelinating event) and in those with relapsing remitting MS. It can lower the disease activity (relapse rate, disability progression) by 30% compared to placebo. Being taken orally and having minimal side effects, teriflunomide is a very well tolerated drug. However, it should not be given to fertile women without effective contraception because of its potential teratogenicity.
Roztroušená skleróza mozkomíšní (RS) je chronické zánětlivé autoimunitní onemocnění centrální nervové soustavy (CNS) vedoucí k demyelinizaci nervových vláken a k jejich následné ztrátě. Postihuje především mladé lidi ve věku 20–40 let, dvakrát častěji ženy než muže, a je nejčastější příčinou jejich invalidizace [1]. Česká republika patří k oblastem s vysokým výskytem RS, prevalence onemocnění se udává 170 nemocných na 100 000 obyvatel. Incidence, tedy počet nově diagnostikovaných pacientů s RS, je 11,7/100 000 obyvatel za rok [2]. Roztroušená skleróza mozkomíšní dosud patří k nevyléčitelným chorobám, ale včasnou diagnostikou a adekvátní léčbou lze v současnosti její aktivitu zastavit.
V minulosti účinná terapie neexistovala a lékaři pouze přihlíželi postupující invalidizaci nemocných. Zlom nastal v polovině devadesátých let minulého století, kdy do klinické praxe vstoupil interferon β a následně glatiramer acetát. Jde o první léčiva schopná ovlivnit průběh onemocnění, tzv. disease modifying drugs (DMD). K dalšímu výraznému posunu v léčbě RS došlo v poslední dekádě s nástupem monoklonálních protilátek, nových imunomodulancií a imunosupresiv. V současnosti je léčba pacientů s RS v České republice stratifikována do dvou linií léčby DMD. Obecně je léčba DMD první linie indikována na počátku onemocnění, po první klinické atace onemocnění, která je označována jako klinicky izolovaný syndrom (clinically isolated syndrome, CIS), anebo u relabující‑remitující formy RS, pokud u nemocného dojde alespoň ke dvěma atakám onemocnění za jeden rok. Tyto léky jsou schopny snížit počet atak onemocnění o 30–40 % ve srovnání s placebem. Do této kategorie patří interferon β‑1a, interferon β‑1b, glatiramer acetát a teriflumonid. V případě nedostatečné účinnosti léčiv první linie se známkami přetrvávající aktivity onemocnění je indikována eskalace léčby. O aktivní RS hovoříme při přítomnosti klinických atak, kdy dochází k rozvoji nového neurologického deficitu, při nárůstu počtu a objemu demyelinizačních ložisek v CNS při vyšetření magnetickou rezonancí (MR) nebo v případě vychytávání kontr![Obr. 1 Předpokládaný mechanismus účinku terifl unomidu; podle [6] – Bar, et al., 2014.](https://www.remedia.cz/photo-a-30509---.jpg) astní látky (gadolinia) v aktivních lézích. Ke druhé linii DMD patří natalizumab, fingolimod, dimethylfumarát a nejnovější alemtuzumab. Tato léčiva mají potenciál snížit počet klinických atak v rozpětí od 58 % (dimethylfumarát) po 80 % (alemtuzumab) oproti placebu [3].
astní látky (gadolinia) v aktivních lézích. Ke druhé linii DMD patří natalizumab, fingolimod, dimethylfumarát a nejnovější alemtuzumab. Tato léčiva mají potenciál snížit počet klinických atak v rozpětí od 58 % (dimethylfumarát) po 80 % (alemtuzumab) oproti placebu [3].
Teriflunomid je prvním perorálním přípravkem DMD první linie. Jedná se o aktivní metabolit leflunomidu, který se používá již od roku 1998 k léčbě aktivní revmatoidní artritidy. K léčbě relabující‑remitující formy RS byl americkým Úřadem pro potraviny a léky (Food and Drug Administration, FDA) schválen v září 2012, u Evropské lékové agentury (European Medicines Agency, EMA) získal registraci v srpnu 2013 [4], v České republice je dostupný od listopadu 2014. Od dubna 2015 jej lze podat i v indikaci CIS [5].
Mechanismus účinku
Mechanismus účinku teriflunomidu není zcela jasný. Pravděpodobně způsobuje snížení počtu aktivovaných lymfocytů schopných přestupu přes hematoencefalickou bariéru do CNS. Selektivně inhibuje aktivitu mitochondriálního enzymu dihydroorotát dehydrogenázy účastnícího se syntézy pyrimidinů, která je velmi intenzivní u rychle se dělících buněk. Tato reverzibilní inhibice enzymu dihydroorotát dehydrogenázy má za následek reverzibilní cytostatický účinek na klonálně expandující aktivované T‑lymfocyty a B‑lymfocyty uplatňující se v patogenezi RS. Pomalu se dělící buňky (lymfocyty, non‑lymfoidní buňky) nejsou postiženy, protože syntéza pyrimidinů zde probíhá jiným způsobem, takže imunitní funkce těchto buněk zůstávají zachovány (obr. 1) [4,6].
Farmakokinetické vlastnosti
Biologická dostupnost teriflunomidu dosahuje téměř 100 % a z více než 99 % se váže na plazmatické proteiny. Metabolismus v játrech probíhá nezávisle na cytochromu P450 a teriflunomid je vylučován stolicí. Biologický poločas teriflunomidu je 18 dní, ovšem v důsledku vazby na plazmatické bílkoviny přetrvává v organismu osm měsíců až dva roky [5].
Klinické zkušenosti
Účinnost teriflunomidu byla zkoumána v několika randomizovaných, dvojitě zaslepených klinických hodnoceních kontrolovaných placebem, kde se posuzovala účinnost teriflunomidu v dávce 7 mg a 14 mg. První z nich bylo klinické hodnocení fáze II trvající 36 měsíců. Bylo do něho zapojeno 179 pacientů ve věku 18–65 let s klinicky definitivní RS s hodnotou Kurtzkeho škály EDSS (Expanded Disability Status Scale) ≤ 6 (pacienti jsou schopni chůze do vzdálenosti nejméně 120 m s oporou jedné hole), kteří prodělali tři ataky za dva roky nebo alespoň jednu ataku za rok. Prioritou bylo posouzení účinnosti teriflunomidu na aktivitu onemocnění sledovatelnou vyšetřením MR, tedy počtem aktivních lézí sytících se gadoliniem. Sekundárními cílovými ukazateli byly další MR parametry, počet atak za rok (annualised relapse rate, ARR) a progrese invalidity daná hodnotou škály EDSS [4].
Vzhledem k dobrým výsledkům následovala čtyřicetiměsíční studie fáze III TEMSO (Teriflunomide Multiple Sclerosis Oral). Bylo do ní zařazeno 1 088 pacientů s relabující‑remitující formou RS ve věku 18–55 let s EDSS ≤ 5 (pacienti schopní ujít nejméně 200–300 m bez opory), kteří prodělali alespoň dvě ataky za dva roky nebo alespoň jednu ataku za rok, přičemž k poslední atace došlo více než 60 dní před randomizací. Základním sledovaným parametrem byl ARR, sekundárním cílovým ukazatelem byla progrese EDSS v průběhu 12 týdnů a známky aktivity onemocnění na MR – objem ![Graf 1a–d Srovnání sledovaných parametrů (roční míra relapsů, objem demyelinizačních lézí, počet lézí vychytávajících gadolinium) ve studiích TOWER (a) a TEMSO (b–d); podle [4] – Miler, 2015.](https://www.remedia.cz/photo-a-30510---.jpg) demyelinizačních lézí, počet lézí vychytávajících gadolinium a počet T1‑hyperintenzních lézí. Ve studii TEMSO byla potvrzena 31% redukce ARR ve srovnání s placebem a 30% snížení rizika progrese invalidity. Podle analýzy MR vyšetření došlo k 67% snížení počtu lézí vychytávajících gadolinium (přímé známky recentní aktivity nemoci), ke snížení počtu nových a k redukci velikosti již stávajících demyelinizačních lézí [7,8].
demyelinizačních lézí, počet lézí vychytávajících gadolinium a počet T1‑hyperintenzních lézí. Ve studii TEMSO byla potvrzena 31% redukce ARR ve srovnání s placebem a 30% snížení rizika progrese invalidity. Podle analýzy MR vyšetření došlo k 67% snížení počtu lézí vychytávajících gadolinium (přímé známky recentní aktivity nemoci), ke snížení počtu nových a k redukci velikosti již stávajících demyelinizačních lézí [7,8].
Současně probíhalo klinického hodnocení TOWER (Teriflunomide Oral in People With Relapsing Multiple Sclerosis) se stejnými vstupními kritérii a sledovanými klinickými parametry (ARR, progrese EDSS) jako u studie TEMSO s výjimkou podmínky posledního relapsu RS více než 30 dní od randomizace. Dle získaných dat teriflunomid snižuje počet relapsů s následky o 36,6 % (teriflunomid v dávce 14 mg) a o 31,3 % (teriflunomid v dávce 7 mg), počet relapsů s nutností hospitalizace o 33,6 %, počet relapsů přeléčených intravenózními kortikosteroidy o 35,7 % a počet těžkých relapsů o 52,5 % ve srovnání s placebem [9,10] (graf 1a–d).
Dále proběhlo 48týdenní randomizované, jednostranně zaslepené multicentrické klinické hodnocení 3. fáze TENERE, kterého se účastnilo 324 pacientů s relabující‑remitující formou RS ve věku od 18 let s EDSS ≤ 5,5 (pacienti schopní ujít vzdálenost alespoň 100 m bez opory). V tomto hodnocení se srovnávala účinnost teriflunomidu v dávce 7 mg a 14 mg (dávka zaslepena) s interferonem β‑1a v dávce 44 mg aplikovaným 3× týdně subkutánně (nezaslepeno). Hlavním sledovaným ukazatelem byla doba do selhání léčby daná relapsem RS nebo ukončením léčby z jakéhokoli důvodu. Dále byl sledován ARR, stupeň únavy a spokojenost s léčbou, které byly zjišťovány samoposuzovacími dotazníky. K selhání léčby došlo u 37,8 % nemocných léčených teriflunomidem a u 42,3 % nemocných, kterým byl podáván interferon β‑1a, tento rozdíl nebyl statisticky signifikantní. S léčbou teriflunomidem byli ovšem nemocní spokojenější, zejména v parametrech„vedlejší účinky“ a „jednoduchost léčby“ [7,11].
Posledním klinickým hodnocením je 108týdenní studie TOPIC (Oral Teriflunomide for Patients with First Clinical Episode Suggestive of Multiple Sclerosis). Účastnilo se ho 614 pacientů, kteří prodělali CIS před méně než 90 dny a měli alespoň dvě T2‑hyperintenzní ložiska na MR o velikosti ≤ 3 mm.
Z výsledků studie vyplývá snížení rizika přechodu do klinicky definitivní RS (rozvoj druhého relapsu) při podávání teriflunomidu v dávce 14 mg (poměr rizik, hazard ratio – HR: 0,574; interval spolehlivosti, confidence interval – 95% CI: 0,379–0,869; p = 0,0087) a v dávce 7 mg (HR: 0,628; 95% CI: 0,416–0,949; p = 0,0271) [12].
Indikace a kontraindikace
Vzhledem k výsledkům výše uvedených klinických hodnocení a zjištěné účinnosti byl teriflunomid spolu s interferony a glatiramer acetátem zařazen mezi DMD první linie.
Teriflunomid je indikován k léčbě pacientů s CIS, který si svou závažností vyžádal přeléčení intravenózními kortikosteroidy a kde bylo vyloučeno jiné onemocnění. Dále se podává pacientům s relabující‑remitující formou RS s vysokou klinickou aktivitou, tzn. těm, kteří prodělali dva dokumentované a léčené relapsy za rok a jejich invalidita nepřesahuje hodnotu EDSS 4,5. Při splnění těchto podmínek je léčba teriflunomidem hrazena z prostředků veřejného zdravotního pojištění [5].
Kontraindikací podání teriflunomidu je přítomnost imunodeficitu, závažná infekce, těžká porucha funkce jater, ledvin, kostní dřeně spojená s leukopenií, anemií a s trombocytopenií, se stavy s nízkou koncentrací plazmatických bílkovin, jako je např. nefrotický syndrom a přecitlivělost na některou ze složek přípravku. Současně by teriflunomid neměl být podáván ženám ve fertilním věku bez účinné antikoncepce, těhotným a kojícím ženám vzhledem k jeho potenciální teratogenitě. V případě otěhotnění či plánování gravidity je možno provést urychlenou eliminaci teriflunomidu z organismu podáváním cholestyraminu v dávce 8 g 3× denně po dobu 11 dní. Poté se stanovuje plazmatická koncentrace teriflunomidu, a to alespoň dvakrát v rozmezí 14 dní. Za bezpečnou se považuje hodnota nižší než 0,02 mg/l. Pak je nutné vyčkat dalších šest týdnů a až pak se lze pokoušet o graviditu. Variantou léčby cholestyraminem je podávání aktivního uhlí v dávce 50 g každých 12 hodin, což je ale technicky dosti obtížné [4].
Nežádoucí účinky
Mezi nejčastější nežádoucí účinky podávání teriflunomidu (tab. 1) patří elevace hodnot jaterních testů, především alaninaminotransferázy (ALT). Více než trojnásobná elevace hodnot ALT byla zaznamenána u 6,2 % nemocných léčených teriflunomidem v dávce 14 mg a u 5,8 % nemocných léčených teriflunomidem v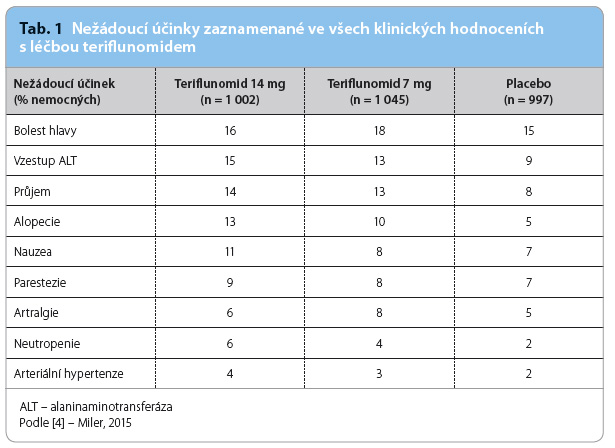 dávce 7 mg. K tomuto zvýšení hodnot ALT dochází převážně v prvním roce léčby a jejich normalizace nastává většinou spontánně bez přerušení léčby. Proto je doporučena monitorace jaterních testů každé dva týdny v průběhu prvních šesti měsíců léčby teriflunomidem, dále pak každé dva měsíce.
dávce 7 mg. K tomuto zvýšení hodnot ALT dochází převážně v prvním roce léčby a jejich normalizace nastává většinou spontánně bez přerušení léčby. Proto je doporučena monitorace jaterních testů každé dva týdny v průběhu prvních šesti měsíců léčby teriflunomidem, dále pak každé dva měsíce.
Dalším nežádoucím účinkem je snížení počtu leukocytů, a to převážně lymfocytů a neutrofilů, průměrně o 15 % ve srovnání s placebem v průběhu prvních šesti týdnů léčby, které obvykle přetrvává po celou dobu léčby.
V klinických hodnoceních byl rovněž pozorován vzestup krevního tlaku – u nemocných léčených teriflunomidem v dávce 14 mg průměrně o 2,7 mm Hg a u nemocných léčených dávkou 7 mg o 2,3 mm Hg systolického krevního tlaku, u diastolického tlaku představoval vzestup méně než 2 mm Hg. Celkem byla hypertenze hlášena jako nežádoucí účinek u 4,3 % (teriflunomid v dávce 14 mg) nemocných a u 3,1 % (teriflunomid v dávce 7 mg) nemocných. Alopecii nebo spíše intenzivnější vypadávání vlasů či změnu jejich textury udávalo 13,9 % (teriflunomid 14 mg) nemocných a 5,1 % (teriflunomid 7 mg) nemocných, a to především v průběhu prvních šesti měsíců léčby. Pouze u 1,3 % nemocných byla alopecie příčinou ukončení léčby.
U 1,9 % (teriflunomid 14 mg) pacientů a u 1,4 % (teriflunomid 7 mg) pacientů byla diagnostikována polyneuropatie či mononeuropatie (např. syndrom karpálního tunelu) regredující po ukončení podávání teriflunomidu. Nebyla zaznamenána vyšší incidence těžkých infekcí, malignit ani lymfoproliferací. V klinických hodnoceních však byly zaznamenány případy tuberkulózy, proto je vhodné před zahájením léčby teriflunomidem provést testování na latentní infekci [4,7].
Velmi důležitou skutečností je zachování funkčnosti imunitního systému, včetně odpovědi na vakcinaci inaktivovanými neoantigeny či tzv. recall vakcínami [8], např. léčba teriflunomidem není kontraindikací k sezonní vakcinaci proti chřipce [13]. Vakcinace živými atenuovanými vakcínami se pro riziko infekcí nedoporučuje [8].
Shrnutí
Z výčtu možných nežádoucích účinků pramení klinická doporučení, která je vhodné provést před zahájením léčby teriflunomidem a v jejím průběhu (tab. 2). Při přechodu z léčby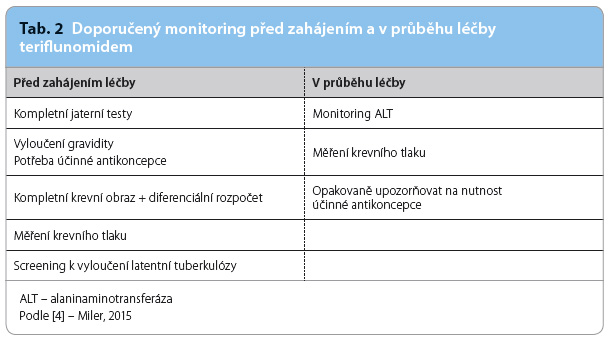 interferony či glatiramer acetátem na léčbu teriflunomidem není nutný žádný časový odstup, ale při eskalaci na účinnější terapii (DMD 2. linie) je vzhledem k biologickému poločasu teriflunomidu doporučeno dodržet 3,5měsíční tzv. vymývací (wash‑out) periodu jako prevenci kumulace imunosupresivního účinku [5].
interferony či glatiramer acetátem na léčbu teriflunomidem není nutný žádný časový odstup, ale při eskalaci na účinnější terapii (DMD 2. linie) je vzhledem k biologickému poločasu teriflunomidu doporučeno dodržet 3,5měsíční tzv. vymývací (wash‑out) periodu jako prevenci kumulace imunosupresivního účinku [5].
Závěrem lze říci, že teriflunomid je vzhledem k perorální lékové formě a vzhledem k minimu nežádoucích účinků velmi dobře tolerovaným přípravkem. Je velmi vítanou variantou DMD první linie při intoleranci jejich injekční aplikace. Menším diskomfortem pro pacienty může být frekventní monitorace hodnot jaterních testů v průběhu prvních šesti měsíců léčby. Pro potenciální teratogenitu by neměl být podáván ženám ve fertilním věku bez účinné antikoncepce.
Seznam použité literatury
- [1] Havrdová E, a kol. Neuroimunologie. Praha: Maxdorf, 2001.
- [2] Havrdová E, Piťha J. Klinický standard pro dg. a léčbu RS a NMO, březen 2012.
- [3] Sládková V, Mareš J. Eskalační terapie roztroušené sklerózy. Postgraduální medicína 2015; 17: 52–58.
- [4] Miler AE. Teriflunomide: A Once daily Oral Medication for the Treatment of Relapsing Forms of Multiple Sclerosis. Clin Ther 2015; 37: 2366–2380.
- [5] Summary of product characteristics (SPC) Aubagio. Dostupné na: http://www.sukl.cz/modules/medication/detail.php?kod=0194319. Navštíveno dne 7. 2. 2016.
- [6] Bar Or A, Pachner A, Menguy Vacheron F, et al. Teriflunomide and its mechanism of action in multiple sclerosis. Drugs 2014; 74: 659–674.
- [7] Bayas A., Mäurer M. Teriflunomide for the treatment of relapsing–remitting multiple sclerosis: patient preference and adherence. Patient Prefer Adherence 2015; 9: 265–274.
- [8] O‘Connor P, Wolinsky JS, Confavreux C, et al. Randomized trial of oral teriflunomide for relapsing multiple sclerosis. N Engl J Med 2011; 365: 1293–1303.
- [9] Miller AE, Macdonell R, Comi G, et al. Teriflunomide reduces relapses with sequelae and relapses leading to hospitalizations: results from the TOWER study. J Neurol 2014; 261: 1781–1788.
- [10] O‘Connor PW, Lublin FD, Wolinsky JS, et al. Teriflunomide reduces relapse related Neurological sequelae, hospitalizations and steroid use. J Neurol 2013; 260: 2472–2480.
- [11] Vermersch P, Czlonkowska A, Grimaldi LM, et al. Teriflunomide versus subcutaneous interferon beta 1a in patients with relapsing multiple sclerosis: a randomised, controlled phase 3 trial. Mult Scler 2014; 20: 705–716.
- [12] Miller AE, Wolinsky JS, Kappos L, et al. Oral teriflunomide for patients with a first clinical episode suggestive of multiple sclerosis (TOPIC): a randomised, double blind, placebo controlled, phase 3 trial. Lancet Neurol 2014; 13: 977–986.
- [13] Bar Or A, Freedman MS, Kremenchutzky M, et al. Teriflunomide effect on immune response to influenza vaccine in patients with multiple sclerosis. Neurology 2013; 81: 552–558.