Pozice blokátorů imidazolinových receptorů v léčbě hypertenze
Léčebné ovlivnění zvýšeného tonu sympatického nervového systému (SNS) vychází z režimových opatření a z farmakologické léčby. Mezi léčiva, která přímo ovlivňují zvýšenou aktivitu SNS, patří především centrálně působící antihypertenziva. Používání léčiv I. generace (a-methyldopa, klonidin, guanfacin) je často doprovázeno relativně vyšším výskytem vedlejších účinků. Novější skupina látek selektivně se vážících na centrální imidazolinové receptory I1 (centrálně působící látky II. generace – rilmenidin, moxonidin) má ve srovnání s I. generací podstatně lepší tolerovatelnost při zachování srovnatelného antihypertenzního účinku.
I1-imidazolinové receptory jsou zapojeny do okamžité i dlouhodobé kontroly TK. Blokátory imidazolinových receptorů (rilmenidin) díky selektivní vazbě na tyto receptory účinně a dlouhodobě snižují krevní tlak u hypertenzních pacientů, příznivě ovlivňují aktivitu sympatiku a vagu směrem k autonomní rovnováze u normotoniků a zlepšují baroreflexní senzitivitu u pacientů s hypertenzí. Účinnost v monoterapii je srovnatelná s ostatními antihypertenzivy první volby. Je možné kombinovat je s těmito antihypertenzivy, nejvhodnější je patrně kombinace s diuretiky, blokátory kalciových kanálů a s inhibitory ACE. Vzhledem k příznivému metabolickému účinku jsou vhodné u hypertoniků s přidruženými chorobami.
Úvod
Hypertenze je nejčastějším kardiovaskulárním onemocněním. V České republice postihuje jednu třetinu dospělé populace ve věku 25–64 let [1]. V řadě epidemiologických studií bylo prokázáno, že hypertenze je závažným rizikovým faktorem pro ischemickou chorobu srdeční, srdeční selhání, cévní mozkové příhody, renální selhání a pro ischemickou chorobu dolních končetin. V posledních desetiletích bylo na základě výsledků velkých klinických studií rovněž jasně prokázáno, že pokles hodnot krevního tlaku (TK) významně snižuje kardiovaskulární nemocnost a úmrtnost. Již při hodnotách TK 115/75 mm Hg se riziko rozvoje kardiovaskulárních onemocnění s každým vzestupem TK o 20/10 mm Hg zdvojnásobuje. Důsledná primární prevence má nezastupitelnou roli. Dosažení cílových hodnot TK klade mnohem větší požadavky na správné vedení léčby hypertenze a na edukaci pacienta. Medikamentózní léčba hypertenze má být zvažována již u nemocných s vysokým normálním krevním tlakem (130–139/8 5 –89 mm Hg) po prodělané cévní mozkové nebo koronární příhodě, s manifestní ischemickou chorobou srdeční, u diabetiků nebo u osob s kumulací rizikových faktorů [2]. I když se v ČR podařilo dosáhnout poklesu úmrtnosti na cévní onemocnění mozku a na ischemickou chorobu srdeční, nemůžeme být zatím spokojeni s dosažením cílových hodnot TK u hypertoniků. Cílového TK pod hranicí 140/90 mm Hg dosahuje jen asi 38 % léčených nemocných [3, 4].
Důležitým faktorem při dosažení cílového TK je dobře vedená terapie hypertenze. Normalizace krevního tlaku nelze u většiny hypertoniků dosáhnout monoterapií. U většiny potřebujeme k dosažení cílových hodnot krevního tlaku dvojkombinaci, často trojkombinaci, a někdy i čtyřkombinaci antihypertenziv. Moderní antihypertenzivum dle současných požadavků nesnižuje pouze TK, ale splňuje požadavky na metabolickou neutralitu, dobrou snášenlivost, jednoduché dávkování a bezpečnou kombinovatelnost s ostatními skupinami antihypertenziv. Tato kritéria velmi dobře splňují právě blokátory imidazolinových receptorů, které lze s výhodou použít pro kombinační léčbu hypertenze.
Autonomní nervový systém, regulace TK a kardiovaskulární riziko
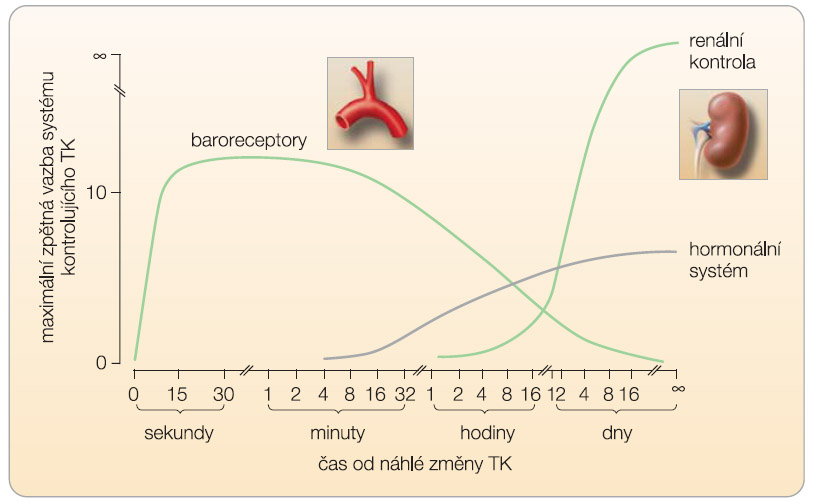 Autonomní nervový systém (ANS) je hlavním řídicím systémem organismu, kde zastává jednak funkci regulační, jednak funkci integrační. Kombinací těchto funkcí zajišťuje ANS integritu organismu jako celku. Porušení rovnováhy ANS proto hraje významnou roli při vzniku a progresi mnoha kardiovaskulárních onemocnění. ANS je tvořen dvěma základními jednotkami: sympatickým a parasympatickým nervovým systémem (SNS, PNS). ANS má klíčové postavení v regulaci TK, která se odehrává na několika úrovních ( graf 1 ) [5]:
Autonomní nervový systém (ANS) je hlavním řídicím systémem organismu, kde zastává jednak funkci regulační, jednak funkci integrační. Kombinací těchto funkcí zajišťuje ANS integritu organismu jako celku. Porušení rovnováhy ANS proto hraje významnou roli při vzniku a progresi mnoha kardiovaskulárních onemocnění. ANS je tvořen dvěma základními jednotkami: sympatickým a parasympatickým nervovým systémem (SNS, PNS). ANS má klíčové postavení v regulaci TK, která se odehrává na několika úrovních ( graf 1 ) [5]:
- okamžitá regulace realizovaná bezprostředně, tzv. krátkodobá regulace (vysokotlaké a nízkotlaké baroreceptory, respiračně-kardiovaskulární reflexy, centrální a periferní chemoreflex), která funguje v horizontu sekund až desítek sekund;
- střednědobá regulace (humorální mechanismy) v horizontu minut až desítek minut;
- mechanismy dlouhodobé regulace (systém tlakové natriurézy) v řádu hodin až dnů a tzv. regulační systémy vyššího řádu (systémy cirkadiánního, ontogenetického řízení TK atp.).
Opakovaně bylo prokázáno, že dlouhodobě působící stres vede ke zvýšené stimulaci autonomních nervových center v oblasti hypotalamu. Dochází k poruše rovnováhy mezi tonem SNS a PNS. Odtud je nadměrná aktivita sympatiku přenášena do periferie prostřednictvím tří základních os:
- osy hypotalamo-hypofyzární,
- osy noradrenalinové,
- osy renin-angiotenzinové.
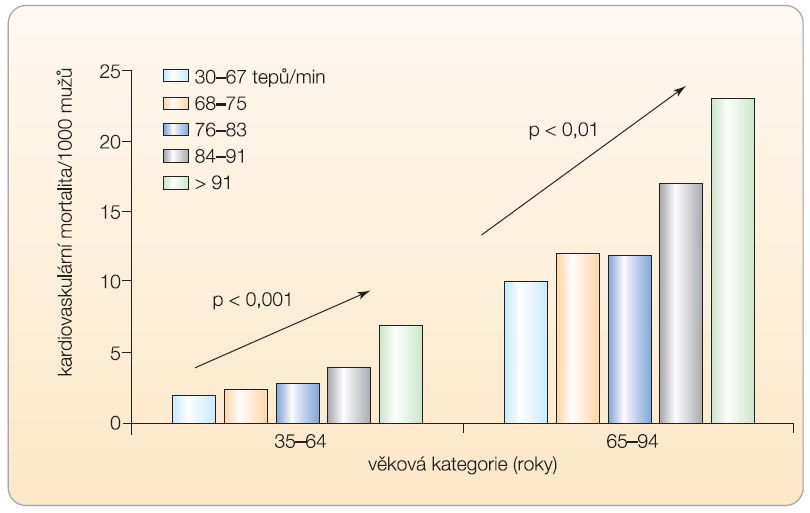 Všechny 3 osy se podílejí na patofyziologii hypertenze a řady dalších kardiovaskulárních onemocnění. SNS se tak rovněž uplatňuje ve vývoji poruch glukózového a lipidového metabolismu. Zvýšená aktivita ANS má úzký vztah i k metabolickým rizikovým faktorům, jako je hyperinzulinémie, hyperglykémie a hypercholesterolémie. To velmi dobře dokládá řada epidemiologických sledování, např. Framinghamská studie, která ukázala na vztah mezi stoupající srdeční frekvencí (nejdostupnějším ukazatelem aktivity SNS) a zvyšující se koronární, kardiovaskulární i celkovou úmrtností ( graf 2 ) [6]. Vyšší aktivita SNS zvyšuje rovněž riziko náhlé smrti i riziko arytmií. Existují důkazy o vyšší aktivitě sympatiku u lidí s nezdravým životním stylem – u kuřáků, u lidí s nadměrným příjmem potravy i u osob se sedavým způsobem života.
Všechny 3 osy se podílejí na patofyziologii hypertenze a řady dalších kardiovaskulárních onemocnění. SNS se tak rovněž uplatňuje ve vývoji poruch glukózového a lipidového metabolismu. Zvýšená aktivita ANS má úzký vztah i k metabolickým rizikovým faktorům, jako je hyperinzulinémie, hyperglykémie a hypercholesterolémie. To velmi dobře dokládá řada epidemiologických sledování, např. Framinghamská studie, která ukázala na vztah mezi stoupající srdeční frekvencí (nejdostupnějším ukazatelem aktivity SNS) a zvyšující se koronární, kardiovaskulární i celkovou úmrtností ( graf 2 ) [6]. Vyšší aktivita SNS zvyšuje rovněž riziko náhlé smrti i riziko arytmií. Existují důkazy o vyšší aktivitě sympatiku u lidí s nezdravým životním stylem – u kuřáků, u lidí s nadměrným příjmem potravy i u osob se sedavým způsobem života.
Více než třetina hypertoniků má vyšší aktivitu SNS. Nerovnováha ANS, resp. zvýšená aktivita SNS, však může být nejen příčinným faktorem hypertenze, ale může se prostřednictvím svých regulačních mechanismů podílet na „fixaci“ hypertenze, její progresi a následných orgánových komplikacích. Zvýšená aktivita SNS aktivuje renin-angiotenzinový systém (RAAS) a oba systémy vedou svými mechanismy k zadržování sodíku, zvýšení intravaskulárního i extravaskulárního objemu tekutin, k vazokonstrikci a remodelaci tepen, k dysfunkci endotelu či k rozvoji inzulinové rezistence, která představuje prozánětlivý a prokoagulační stav vedoucí k urychlené aterogenezi a k vysokému riziku kardiovaskulárních nemocí. Lze proto shrnout, že aktivita sympatického nervového systému zprostředkovává společný výskyt hypertenze a metabolických poruch a podílí se tak na orgánových změnách a následně na zvýšeném kardiovaskulárním riziku. Možnost ovlivnění aktivity ANS tak představuje velmi zajímavý diagnostický a léčebný cíl.
Imidazolinové receptory a jejich úloha v regulaci TK
I 1 -imidazolinové receptory byly objeveny teprve nedávno. První údaje o jejich existenci pocházejí z roku 1984 [7]. Zjistilo se, že rostrální ventrolaterální formace (RVF) prodloužené míchy, která je vazomotorickým centrem, obsahuje kromě oblastí citlivých na katecholaminy i oblast, jež je citlivá na imidazolin a na látky s příbuznou imidazolinovou strukturou. Tato oblast byla nazvána laterální retikulární jádro (LRJ). V experimentu vedla aplikace látek s imidazolinovou strukturou do LRJ ke snížení sympatické aktivity a k poklesu krevního tlaku. Toto zjištění vedlo profesora Bousqueta k závěru, že se v LRJ nacházejí receptory schopné rozpoznat imidazolinovou strukturu, a proto je pojmenoval jako imidazolinové receptory. Později bylo zjištěno, že látky typu imidazolinu stimulují vlastní specifický receptor, jehož struktura je odlišná od adrenergních receptorů.
Typy imidazolinových receptorů
Použití radioaktivně značených ligandů umožnilo potvrzení existence několika podtypů imidazolinových receptorů, které se liší svojí funkcí i lokalizací v buňce. Důležitým znakem imidazolinových receptorů je skutečnost, že nevážou katecholaminy, čímž se zásadně liší od adrenergních receptorů. Na základě současných poznatků dělíme imidazolinové receptory do tří skupin: I 1 , I 2 a další imidazolinové receptory [5]. I 1 -imidazolinové receptory jsou charakterizovány schopností vázat přednostně klonidin a idazoxan. Doposud byly prokázány v mozkovém kmeni a v ledvinách. V mozkovém kmeni se nacházejí zejména v oblasti laterálního retikulárního jádra, kde jsou zapojeny do regulace sympatické aktivity. Stimulace I 1 -receptorů LRJ vede k vzestupu krevního tlaku. Nacházejí se rovněž v tubulech ledvin, kde se podílejí na regulaci vylučování sodíku a vody (viz dále). I 2 -imidazolinové receptory jsou v organismu rozšířeny mnohem více než receptory I 1 . Byly nalezeny v buňkách řady tkání (hepatocyty, trombocyty, adipocyty, buňky myometria a placenty). Nacházejí se převážně v mitochondriích. Vzhledem k jejich různorodému výskytu zůstává jejich funkce dosud neobjasněna. Nezdá se však, že by hrály významnou roli v regulaci TK. Další imidazolinové receptory (non-I 1 , non-I 2 ) byly objeveny v β -buňkách pankreatu, v žilní stěně a v aortě. Jejich lokalizace v buňce je zřejmě podobná jako u I 1 -receptorů – v buněčné membráně. Jejich funkce zatím není známa.
Význam imidazolinových receptorů v mozkovém kmeni
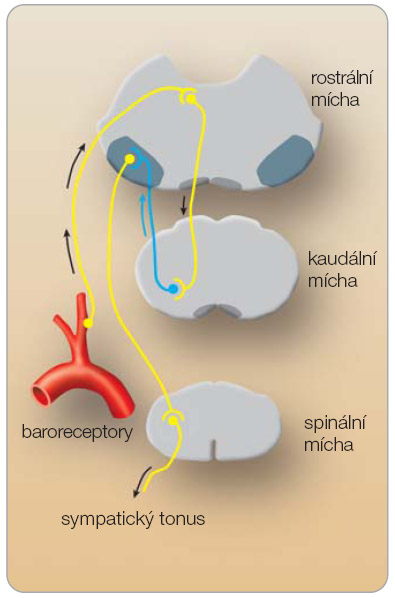 V prodloužené míše se nacházejí tři oblasti, které ovlivňují regulaci krevního tlaku:
V prodloužené míše se nacházejí tři oblasti, které ovlivňují regulaci krevního tlaku:
- nucleus tractus solitarii (NTS),
- interneurony uložené v kaudální ventrolaterální oblasti prodloužené míchy,
- rostrální ventrolaterální formace, která obsahuje i laterální retikulární jádro (viz výše).
V oblasti prodloužené míchy I 1 -imidazolinové receptory pravděpodobně ovlivňují regulaci krevního tlaku zprostředkovanou baroreflexem. Možný mechanismus je znázorněn na obr. 1 [5].
Imidazolinové receptory v ledvinách
I 1 -imidazolinové receptory byly nalezeny v dalším klíčovém orgánu regulace krevního tlaku – v ledvinách [8]. Nacházejí se v proximálních tubulech ledvin a jsou odlišné od receptorů adrenergních. Jejich přímý účinek je pravděpodobně zprostředkován ovlivněním sodíkoprotonové pumpy (Na+/H+ pumpy) v bazolaterální membráně buněk proximálního tubulu.
Blokátory imidazolinových receptorů – význam v léčbě hypertenze
Blokátory imidazolinových receptorů (moxonidin, rilmenidin) působí zejména v prodloužené míše a v ledvinách, čímž ovlivňují dva klíčové orgány regulace krevního tlaku. V oblasti prodloužené míchy je hlavním účinkem pokles sympatické aktivity [9].
Sympatoinhibiční účinek lze shrnout do těchto bodů:
- snížení stimulace srdce sympatikem při malém ovlivnění srdeční fyziologie,
- snížení stimulace cév sympatikem se snížením periferní rezistence,
- snížení sympatické stimulace sekrece reninu,
- snížení stimulace ledvin sympatikem, který ovlivňuje reabsorpci vody a sodíku,
- pokles sekrece vazopresinu.
Tento sympatoinhibiční účinek má fyziologické důsledky, mezi něž patří mimo jiné úprava baroreflexu a snížení sekrece vazokonstrikčních hormonů. Látky této skupiny díky své selektivitě k I 1 -imidazolinovým receptorům neovlivňují v terapeutických dávkách α 2 -receptory. Nevyvolávají proto ortostatickou hypotenzi a sedaci, což jsou nežádoucí účinky typické pro léčiva, která zprostředkovávají svoji antihypertenzní účinnost přes α 2 -adrenergní receptory (např. klonidin). Moxonidin a rilmenidin mají také minimální afinitu k postsynaptickým a 1 -receptorům (1000krát menší než k α 2 -receptorům) a při dlouhodobém podávání nemají vazokonstrikční účinky [10]. Účinek v ledvinách je zprostředkován dvěma cestami: snížením tonu renálního sympatiku (vlivem poklesu centrální aktivity sympatiku) a přímým účinkem na I 1 -imidazolinové receptory [11]. Snížení tonu renálního sympatiku vede ke zlepšení prokrvení ledvin, k poklesu uvolňování reninu a ke snížení reabsorpce sodíku a vody (na základě mechanismů regulovaných přímo sympatikem). Účinek v ledvinách je zřejmě zesílen i nezávislým působením I 1 -imidazolinových receptorů na sodíkoprotonovou pumpu. Kombinací těchto účinků dochází ke snížení reabsorpce sodíku a vody, a tím k poklesu TK.
Blokátory I 1 -imidazolinových receptorů a hypertenze
Blokátory I 1 -imidazolinových receptorů korigují hypertenzi prostřednictvím snížení nadměrného tonu sympatiku a snížení reabsorpce sodíku a vody v proximálních tubulech ledvin.
K důsledkům prvního účinku patří inhibice sympatiku:
- snížení periferní rezistence prostřednictvím omezení sympatického vazokonstrikčního vlivu na arterie,
- snížení sympatické stimulace srdeční frekvence snížením aktivity systému renin-angiotenzin-aldosteron,
- snížení objemu tělesného sodíku a tekutin.
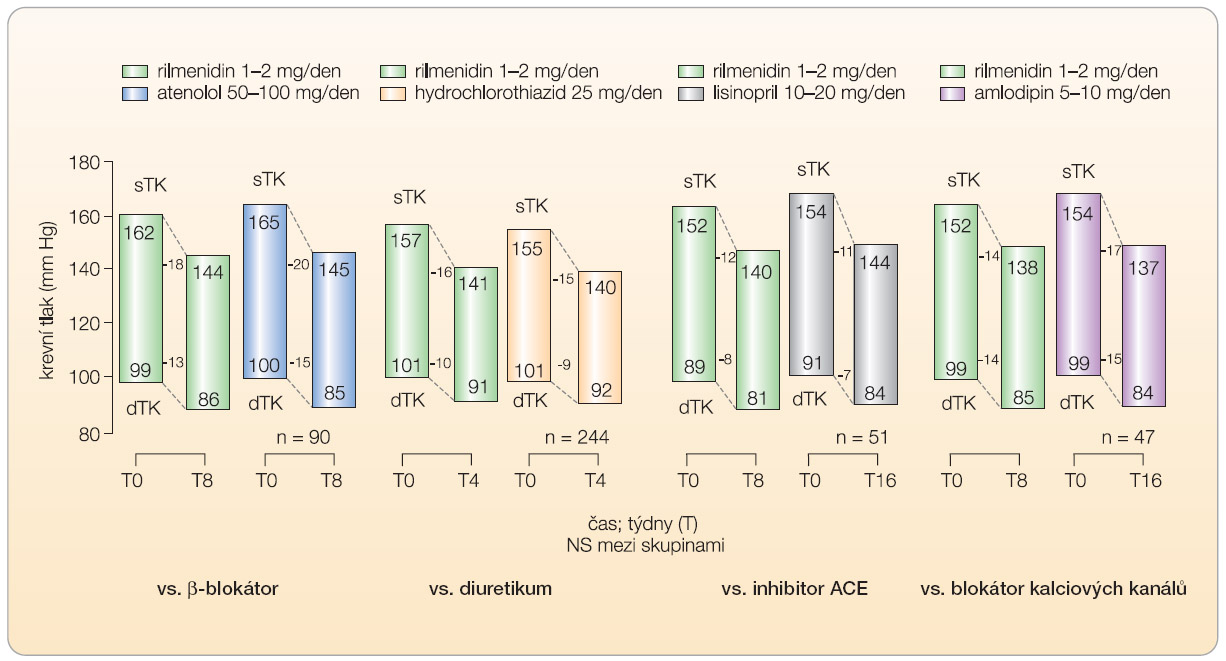 Regulace krevního tlaku ledvinami je definována jako neomezená, to znamená, že funguje tak dlouho, dokud není ustavena rovnováha mezi stávajícím TK a jeho „nastavenou“ výškou [12]. Kompenzační schopnosti ledvin, jakkoli nastupují opožděně, jsou tak teoreticky neomezené. Antihypertenzní účinnost blokátorů I 1 -imidazolinových receptorů je velmi dobře dokumentována v řadě klinických studií. Je srovnatelná z hlediska poklesu systolického a diastolického TK a normalizace TK s referenčními antihypertenzivy ze skupiny diuretik, β -blokátorů, inhibitorů ACE či blokátorů kalciových kanálů ( graf 3 ) [13–18]. Velmi dobrá antihypertenzní účinnost je prokázána jak v monoterapii, tak v kombinaci s běžně používanými antihypertenzivy a rovněž jak u pacientů s hypertenzí nekomplikovanou dalšími onemocněními, tak u pacientů s přidruženými rizikovými faktory [19]. Díky svému souběžnému působení na nervový i renální mechanismus regulace TK zabraňují blokátory I 1 -imidazolinových receptorů potenciální „kompenzaci“ svého účinku a tím minimalizují možnost vzniku tolerance.
Regulace krevního tlaku ledvinami je definována jako neomezená, to znamená, že funguje tak dlouho, dokud není ustavena rovnováha mezi stávajícím TK a jeho „nastavenou“ výškou [12]. Kompenzační schopnosti ledvin, jakkoli nastupují opožděně, jsou tak teoreticky neomezené. Antihypertenzní účinnost blokátorů I 1 -imidazolinových receptorů je velmi dobře dokumentována v řadě klinických studií. Je srovnatelná z hlediska poklesu systolického a diastolického TK a normalizace TK s referenčními antihypertenzivy ze skupiny diuretik, β -blokátorů, inhibitorů ACE či blokátorů kalciových kanálů ( graf 3 ) [13–18]. Velmi dobrá antihypertenzní účinnost je prokázána jak v monoterapii, tak v kombinaci s běžně používanými antihypertenzivy a rovněž jak u pacientů s hypertenzí nekomplikovanou dalšími onemocněními, tak u pacientů s přidruženými rizikovými faktory [19]. Díky svému souběžnému působení na nervový i renální mechanismus regulace TK zabraňují blokátory I 1 -imidazolinových receptorů potenciální „kompenzaci“ svého účinku a tím minimalizují možnost vzniku tolerance.
Blokátory I 1 -imidazolinových receptorů a metabolická neutralita
Blokátory I 1 -imidazolinových receptorů nezasahují do metabolismu sacharidů, a to ani u diabetiků 1. a 2. typu. Studie u pacientů s diabetem mellitem 2. typu v průběhu 12 měsíců ukázala nejen účinné snížení TK léčbou rilmenidinem, ale také snížení lačné glykémie (z výchozích 7,2 ± 1,8 mmol/l na 6,8 ± 1,7 mmol/l na konci sledování)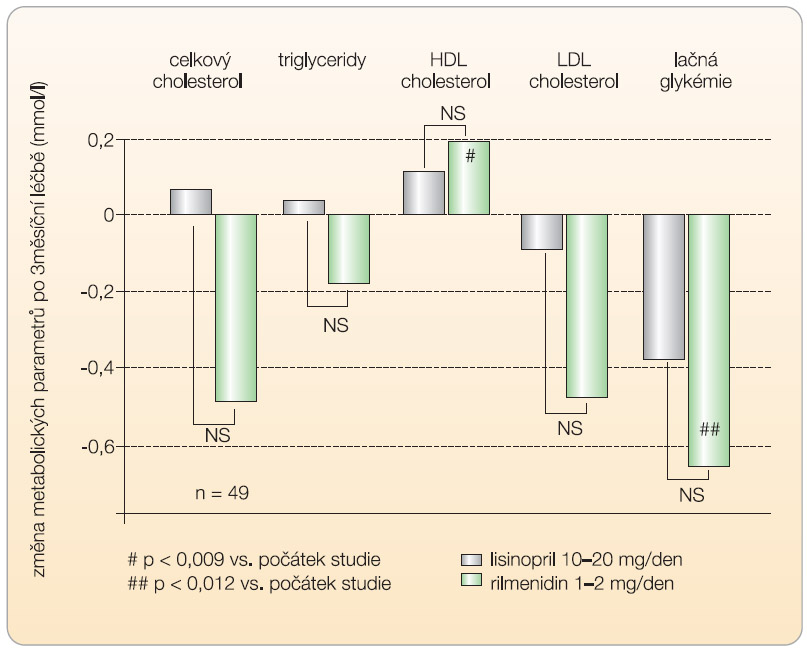 a plazmatických koncentrací triglyceridů (z 1,76 ± 0,82 mmol/l na 1,63 ± 0,72 mmol/l) [20]. Dvojitě zaslepená, kontrolovaná, randomizovaná studie proti amlodipinu sledovala kromě účinků rilmenidinu na TK také inzulinovou rezistenci a parametry trombogeneze. Ukázala, že rilmenidin výrazně snížil glykémii nalačno i po zátěži glukózou ve 120. minutě orálního glukózového tolerančního testu a zlepšil inzulinovou rezistenci [17]. Léčiva této skupiny jsou neutrální rovněž ve vztahu k lipidovému metabolismu nebo mají v porovnání s ostatními antihypertenzivy na metabolismus lipidů mírně příznivý vliv. Studie s rilmenidinem dokládají zvýšení hladin HDL cholesterolu a významný pokles hladin LDL cholesterolu a triglyceridů ( graf 4 ) [13, 21].
a plazmatických koncentrací triglyceridů (z 1,76 ± 0,82 mmol/l na 1,63 ± 0,72 mmol/l) [20]. Dvojitě zaslepená, kontrolovaná, randomizovaná studie proti amlodipinu sledovala kromě účinků rilmenidinu na TK také inzulinovou rezistenci a parametry trombogeneze. Ukázala, že rilmenidin výrazně snížil glykémii nalačno i po zátěži glukózou ve 120. minutě orálního glukózového tolerančního testu a zlepšil inzulinovou rezistenci [17]. Léčiva této skupiny jsou neutrální rovněž ve vztahu k lipidovému metabolismu nebo mají v porovnání s ostatními antihypertenzivy na metabolismus lipidů mírně příznivý vliv. Studie s rilmenidinem dokládají zvýšení hladin HDL cholesterolu a významný pokles hladin LDL cholesterolu a triglyceridů ( graf 4 ) [13, 21].
Blokátory I 1 -imidazolinových receptorů a ochrana cílových orgánů
Snížení aktivity SNS má za následek nejenom snížení TK, ale má rovněž významnou úlohu v ovlivnění orgánových změn hypertenze, jako je hypertrofie levé komory, a příznivě ovlivňuje diastolickou funkci levé komory i agregaci destiček [22, 23]. U hypertoniků s hypertrofií levé komory (HLK) došlo při léčbě rilmenidinem k významnému zlepšení parametrů HLK, snížení LVMI (left ventricular mass index) o 16,4 %, ke 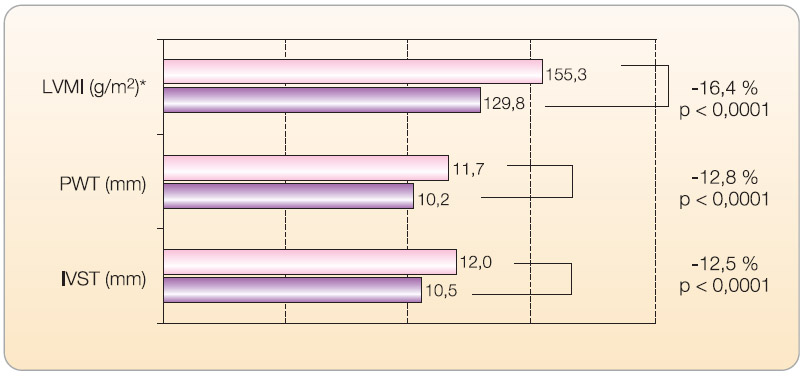 snížení tloušťky mezikomorového septa o 12,5 % a ke snížení tloušťky zadní stěny komory o 12,8 % (p < 0,001). Léčba rovněž zlepšila diastolickou funkci levé srdeční komory [24]. Obdobný účinek byl pozorován ve studii VERITAS ( graf 5 ) u pacientů s HLK při vstupu do studie [22]. Blokátory I 1 -imidazolinových receptorů mají rovněž renoprotektivní účinek ve smyslu snížení rizika mikroalbuminurie [25].
snížení tloušťky mezikomorového septa o 12,5 % a ke snížení tloušťky zadní stěny komory o 12,8 % (p < 0,001). Léčba rovněž zlepšila diastolickou funkci levé srdeční komory [24]. Obdobný účinek byl pozorován ve studii VERITAS ( graf 5 ) u pacientů s HLK při vstupu do studie [22]. Blokátory I 1 -imidazolinových receptorů mají rovněž renoprotektivní účinek ve smyslu snížení rizika mikroalbuminurie [25].
Snášenlivost blokátorů I 1 -imidazolinových receptorů
Seznam použité literatury
- [1] Cífková R, Škodová Z, Lánská V, et al. Prevalence, awareness, treatment, and control of hypertension in the Czech Republic. Results of two nationwide cross-sectional surveys in 1997/1998 and 2000/2001, Czech Post-MONICA Study. J Hum Hypertens 2004; 18: 571–579.
- [2] Widimský J, Cífková R, Špinar J, et al. Doporučení diagnostických a léčebných postupů u arteriální hypertenze – verze 2007. Doporučení České společnosti pro hypertenzi. Vnitř lék 2008; 54: 101–118.
- [3] Jozífová M, Cífková R, Škodová Z, et al. Porovnání léčby hypertenze a rizikového profilu hypertoniků v obecné populaci a na specializovaném pracovišti. Cor Vasa 2003; 45: 533–541.
- [4] Widimský J sr., Sachová M, Lánská V, et al. Vysoká prevalence a špatná kontrola hypertenze v ordinacích praktických lékařů. Vnitř lék 2005; 51: 1087–1094.
- [5] Souček M, Kára T, et al. Klinická patofyziologie hypertenze. Praha, Grada Publishing, 2003.
- [6] Kannel WB, Kannel C, Paffenbarger RS Jr, et al. Heart rate and cardiovascular mortality: the Framingham Study. Am Heart J 1987; 113: 1489–1494.
- [7] Bousquet P, Feldman J, Schwartz J. Central cardiovascular effects of alpha adrenergic drugs: differences between catecholamines and imidazolines. J Pharmacol Exp Ther 1984; 230: 232–236.
- [8] Parini A, Coupry I, Graham RM, et al. Characterization of an imidazoline/guanidinium receptive site distinct from the alpha 2-adrenergic receptor. J Biol Chem 1989; 264: 11874–11878.
- [9] Bousquet P, Feldman J. Drugs acting on imidazoline receptors: a review of their pharmacology, their use in blood pressure control and their potential interest in cardioprotection. Drugs 1999; 58: 799–812.
- [10] Bricca G, Dontenwill M, Molines A, et al. Rilmenidine selektivity for imidazoline receptors in human brain. Eur J Pharmacol 1989; 163: 373–377.
- [11] Kline RL, Cechetto DF. Renal effects of rilmenidine in anesthetized rats: importance of renal nerves. J Pharmacol Exp Ther 1993; 266: 1556–1562.
- [12] Guyton AC. Kidneys and fluid in blood pressure regulativ (small volume but large pressure ganges). Hypertension 1992; 19: 12–18.
- [13] Anichkov DA, Ahostak NA, Schastnaya OV. Comparison of rilmenidine and lisinopril on ambulatory blood pressure and plasma lipid and glucose levels in hypertensive women with metabolic syndrome. Curr Med Res Opin 2005; 21: 113–119.
- [14] Pelemans W, Corcoran C, Van Dersel A, et al. Efficacy and safety of rilmenidine in elderly patients – comparison with hydrochlorothiazide. The Belgian Multicentre Study Group. Am J Cardiol 1994; 74: A51–57.
- [15] Fiorentini C, Guillet C, Guazzi M. A multicentre double-blind trial comparing rilmenidine 1 mg and hydrochlorothiazide 25 mg in 244 patients. Arch Mal Coeur 1989; 82: 39–46.
- [16] Dallochio M, Gosse P, Fillastre JP, et al. Rilmenidine, a new antihypertensive agent, in the first-line treatment of Essentials hypertension. A multicentre double-blind study versus atenolol. Presse Med 1991; 20: 1265–1271.
- [17] De Luca N, Izzo R, Fontana D, et al. Heamodynamic and metabolic effects of rilmenidine in hypertensive patiens with metabolic syndrome X. A double-blind parallel study versus amlodipine. J Hypertens 2000; 18: 1515–1522.
- [18] Widimský J, Sirotiaková J. Efficacy and tolerability of rilmenidine compared with isradipine in hypertensive patients with features of metabolic syndrome. Curr Med Res Opin 2006; 22: 1287–1294.
- [19] Widimský J. Výsledky sledování rizikových faktorů a klinických účinků rilmenidinu u nemocných s arteriální hypertenzí – projekt METABOLIC. Farmakoterapie 2008; 3: 325–328.
- [20] Meredith PA, Reid JL. Efficacy and tolerability of long-term rilmenidine treatment in hypertensive diabetic patients. A retrospective analysis of a General practice study. Am J Cardiovasc Drugs 2004; 4: 195–200.
- [21] Konrady AO, Kasherininov YR, Shavarov AA, et al. How can we block sympathetic overactivity? Effects of rilmenidine and atenolol in overweight hypertensive patients. J Hum Hypertens 2006; 20: 398–406.
- [22] Farsang C, Lengyel M, Borbas S, et al. VERITAS Investigators. Value of rilmenidine therapy and its combination with perindopril on blood pressure and left ventricular hypertrophy in patients with essential hypertension (VERITAS). Curr Med Res Opin 2003; 19: 205–217.
- [23] Remková A, Kratochvílová H. Effect of the new centrally acting antihypertensive agent rilmenidine on endothelial and platelet function in essential hypertension. J Hum Hypertens 2002; 16: 549–555
- [24] Lengyel M, Borbas S, Zorandi A. Regression of left ventricular hypertrophy in mild-to-moderate hypertension in one year of treatment with rilmenidine. Eur Heart J 2000; 21 (Suppl.): 101.
- [25] Bauduceau B, Mayaudon H, Dupuy O. Efficacy of rilmenidine versus captopril on microalbuminuria: a pilot study in hypertensive type 2 diabetics. J Cardiovasc Risk 2000; 7: 57–61.
- [26] Ostermann G, Brisgand B, Schmitt J, at al. Efficacy and acceptability of rilmenidine for mild-to-moderate systemic hypertension. Am J Cardiol 1998; 61: 76D–80D.
- [27] Souček M. Rilmenidin. Farmakoterapie 2007; 3: 329–337.