Přehled lékových interakcí specifických léků používaných u roztroušené sklerózy
Souhrn:
Paleta léčiv používaných v léčbě roztroušené sklerózy se v poslední době významně rozšířila, přičemž se některá z těchto léčiv podávají perorálně. Pacienti trpící roztroušenou sklerózou obvykle užívají současně řadu dalších léčiv, která omezují některé symptomy onemocnění, respektive se podávají k léčbě dalších souběžných onemocnění. Kombinace některých léčiv pak mohou vést k lékovým interakcím. Mohou se vyskytnout lékové interakce farmakodynamického typu, typicky to bývá při kombinaci dvou imunosupresivně působících léčiv, častější jsou však lékové interakce farmakokinetického typu, kde může docházet k ovlivnění biotransformace léčiv (např. teriflunomid repaglinid) nebo k ovlivnění jejich transportu (např. teriflunomid rosuvastatin). Předkládaný přehled má za cíl shrnout poznatky o lékových interakcích do jediného, pokud možno stručného dokumentu.
Key words: multiple sclerosis, drug interactions, interferon beta, glatiramer acetate, natalizumab, alemtuzumab, fingolimod, teriflunomide, dimethylfumarate, fampridine.
Summary:
The spectrum of drugs used for treatment of multiple sclerosis has widened substantially during the last years, some of these drugs being administered orally. Patients suffering from multiple sclerosis usually take many different drugs at the same time to alleviate the symptoms of multiple sclerosis and to treat comorbidities. Combinations of some drugs can lead to interactions. Pharmacodynamic interactions typically occur when two immunosuppressants are combined; however, pharmacokinetic interactions are more common, influencing the biotransformation of the drugs (e.g. teriflunomide repaglinid) or their transportation (teriflunomide rosuvastatin).The aim of this overview is to summarize the knowledge concerning the above interactions into a single and preferably short document.
Úvod
Roztroušená skleróza (RS) je chronické autoimunitní onemocnění bílé hmoty centrální nervové soustavy (CNS), které vede ke ztrátě myelinu v zánětlivých ložiscích a k difuzní ztrátě axonů. Začíná nejčastěji mezi 20. a 30. rokem věku. V 85 % případů má zpočátku relabující‑remitující průběh se střídáním atak a remisí, který později po vyčerpání rezerv nervového systému často přechází do fáze sekundárně‑progresivní, kdy ubývá atak a narůstá míra invalidity. V 15 % případů je průběh primárně progresivní – jedná se o formu RS bez relapsů a remisí, kdy se míra invalidity zhoršuje již od počátku onemocnění. Vzácně se vyskytuje malignější varianta relabující‑progredující RS, kdy dochází k relapsům nemoci a ke zhoršování invalidity i v období mezi nimi.
Prevalence RS je 170 případů na 100 tisíc obyvatel, což v ČR odpovídá přibližně 18 tisícům nemocných. V nedávné době byla do klinické praxe zavedena řada účinných léčiv ze skupiny imunomodulačních přípravků, jež u remitující formy RS dokáží zpomalit průběh a oddálit invalidizaci. Dále se u RS v kterémkoli stadiu choroby používají symptomatická léčiva.
Léčba RS je dlouhodobá a probíhá ve specializovaných centrech pro demyelinizační onemocnění. Diagnostika a postupy léčby jsou popsány v Klinickém standardu z března 2012 [1]. V průběhu života bývají pacienti s RS léčeni i jinými lékaři pro jiná onemocnění, typicky praktickými lékaři, internisty, psychiatry a dalšími specialisty. Tito lékaři by měli brát v potaz nejen samotné onemocnění RS, ale i podávání léčiv specifických pro léčbu RS s jejich nežádoucími účinky i lékovými interakcemi.
Zatímco léčba akutní ataky RS spočívá v podávání pulsní léčby kortikosteroidy s případným provedením výměnné plazmaferézy, v chronické fázi se podávají imunomodulancia, která se řadí mezi tzv. léky modifikující onemocnění (DMD, disease modifying drugs) nebo léčbu modifikující onemocnění (DMT, disease modifying therapy). U většiny pacientů se léčba zahajuje aplikací interferonu β nebo glatiramer acetátu [2]. Tato léčba má největší účinek v prvých letech nemoci. Její zahájení po první atace prodlužuje dobu do další ataky na dvojnásobek a omezuje postižení CNS patrné na magnetické rezonanci (MR), což má za následek oddálení invalidity. Bohužel u jedné třetiny pacientů ztrácejí tato léčiva po několika letech účinnost, u jedné třetiny pacientů nejsou účinná vůbec. Někteří pacienti tyto injekčně aplikované přípravky netolerují.
Pacientovi, u něhož se touto léčbou nepodaří docílit stabilizace onemocnění, by měla být nabídnuta léčba eskalační, která má vyšší účinnost, ale je také spojena s určitými riziky. Takovými léčivy jsou v současn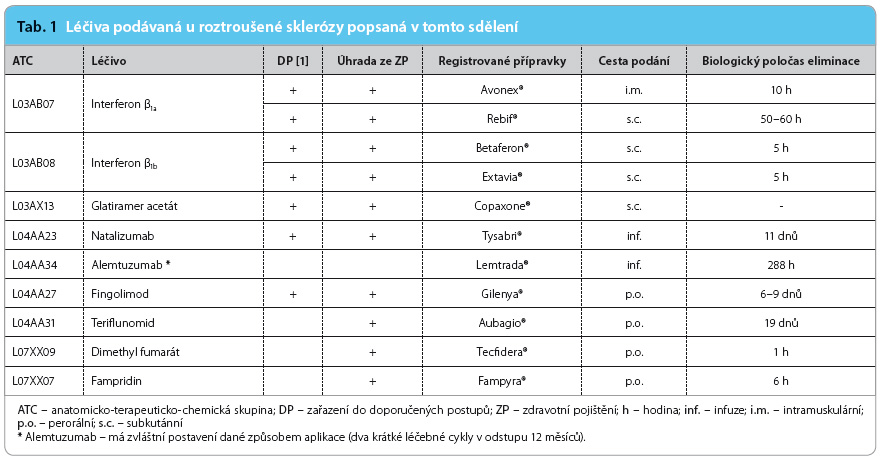 é době natalizumab nebo fingolimod [1], respektive teriflunomid, dimethyl fumarát nebo alemtuzumab [3]. K uváděným rizikům patří jednak výskyt nežádoucích účinků, z nichž některé jsou obecně velmi závažné (např. progresivní multifokální leukoencefalopatie v případě podávání natalizumabu), jednak výskyt lékových interakcí, z nichž některé mohou mít značný klinický význam.
é době natalizumab nebo fingolimod [1], respektive teriflunomid, dimethyl fumarát nebo alemtuzumab [3]. K uváděným rizikům patří jednak výskyt nežádoucích účinků, z nichž některé jsou obecně velmi závažné (např. progresivní multifokální leukoencefalopatie v případě podávání natalizumabu), jednak výskyt lékových interakcí, z nichž některé mohou mít značný klinický význam.
Cílem tohoto sdělení je podat základní a pokud možno stručný přehled známých informací o lékových interakcích léčiv používaných v léčbě RS. Přehled obsahuje informace o lékových interakcích léčiv uvedených v tab. 1. Nejsou popsány interakce řady dalších léčiv používaných v léčbě RS, jako jsou kortikosteroidy, mitoxanthron, cyclophosphamid, azathioprin a další.
Obecná rizika léčiv používaných při roztroušené skleróze ve vztahu k lékovým interakcím
Obecně lze předpokládat vznik následujících interakcí či jiných rizik:
U imunosupresivně působících léčiv (viz tab. 2) lze očekávat sní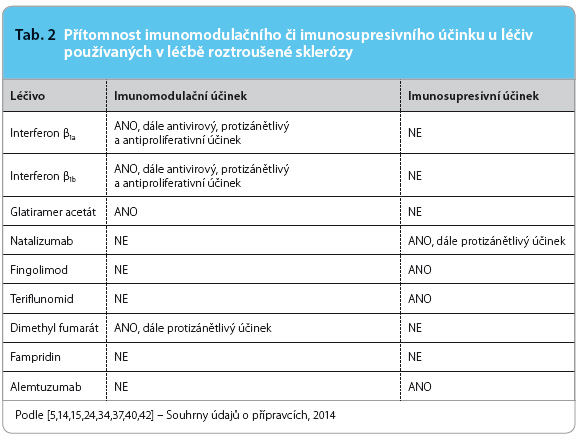 žení odolnosti vůči infekcím při současném podávání s jinými imunosupresivy (např. s ciclosporinem, azathioprinem, sirolimem, tacrolimem, everolimem, kyselinou mykofenolovou, ale též s glukokortikoidy), a to zejména u těch léčiv, při jejichž podávání byl zaznamenán vyšší počet infekčních onemocnění.
žení odolnosti vůči infekcím při současném podávání s jinými imunosupresivy (např. s ciclosporinem, azathioprinem, sirolimem, tacrolimem, everolimem, kyselinou mykofenolovou, ale též s glukokortikoidy), a to zejména u těch léčiv, při jejichž podávání byl zaznamenán vyšší počet infekčních onemocnění.
V případě podávání imunosupresivně působících léčiv se nedoporučuje očkovat živými oslabenými vakcínami, přičemž v některých případech je takový postup považován dokonce za kontraindikovaný (zejména při vakcinaci proti žluté zimnici).
V případě podávání imunosupresivně působících léčiv při současné léčbě antibiotiky je třeba se vyvarovat použití nízkých dávek (dolní hranice dávkovacího rozmezí antibiotika) a je třeba pacienta upozornit na nezbytnost co nejlepší compliance (nejen na nutnost dodržování intervalů podávání antibiotik, ale i na vztah podávání antibiotika a jídla, případně nevhodných nápojů).
V případě podávání potenciálně hepatotoxických léčiv (nebo léčiv, při jejichž užívání byl zaznamenán vyšší výskyt elevace hodnot jaterních transamináz) pokud možno nepodávat jiná potenciálně hepatotoxická léčiva (např. nesteroidní antiflogistika – NSA, methotrexat nebo methyldopu), respektive volit méně rizikové kombinace; např. jsou‑li indikována NSA, neměl by být nimesulid lékem prvé volby.
V případě užívání potenciálně nefrotoxických léčiv se doporučuje nepodávat jiná potenciálně nefrotoxická léčiva (např. aminoglykosidová či glykopeptidová antibiotika, kličková diuretika nebo NSA), respektive volit méně rizikové kombinace.
Při potřebě změny terapie nebo při potřebě podávání nebo aplikace léčiva, které nelze s již podávaným léčivem použít souběžně, je obecně třeba vycházet z toho, že za bezpečnou dobu vymývací periody (washout period) lze považovat uplynutí nejméně pěti biologických poločasů léčiva.
Například v případě fampridinu by to bylo 5 × 6 h = 30 hodin, avšak v případě např. fingolimodu by to bylo 9 × 5 = 45 dnů a v případě teriflunomidu by to dokonce bylo 19 × 5 = 95 dnů.
Lékové interakce jednotlivých léčiv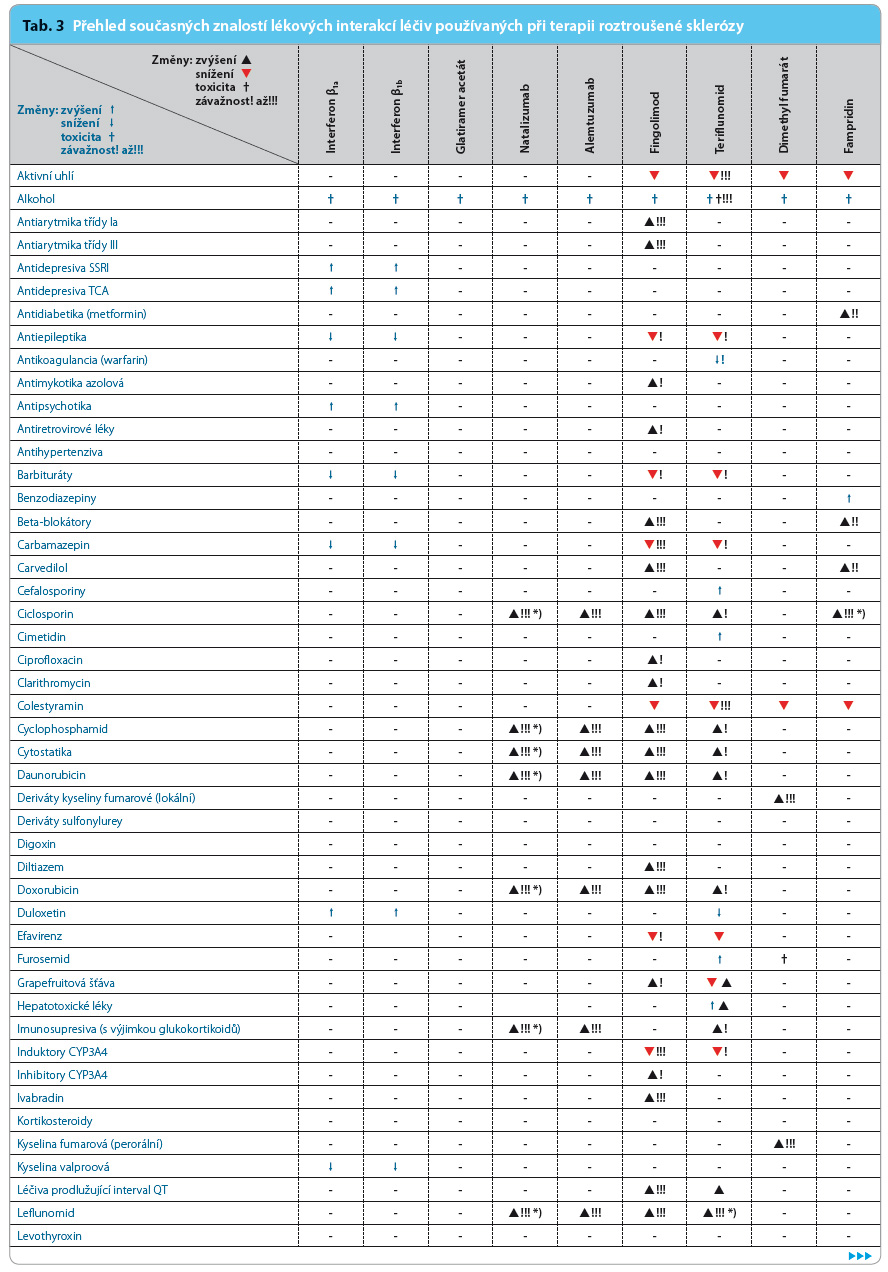
Přehled v současnosti známých lékových interakcí léčiv používaných v léčbě RS uvádí tab. 3.
Interferon β1a, β1b
Kontraindikované současné podávání jiných léků
Ve vztahu k lékovým interakcím nejsou uvedeny kontraindikace pro současné podávání jiných léčiv. Uvádí je však výrobce natalizumabu, který považuje současné podávání natalizumabu s interferonem β za kontraindikované.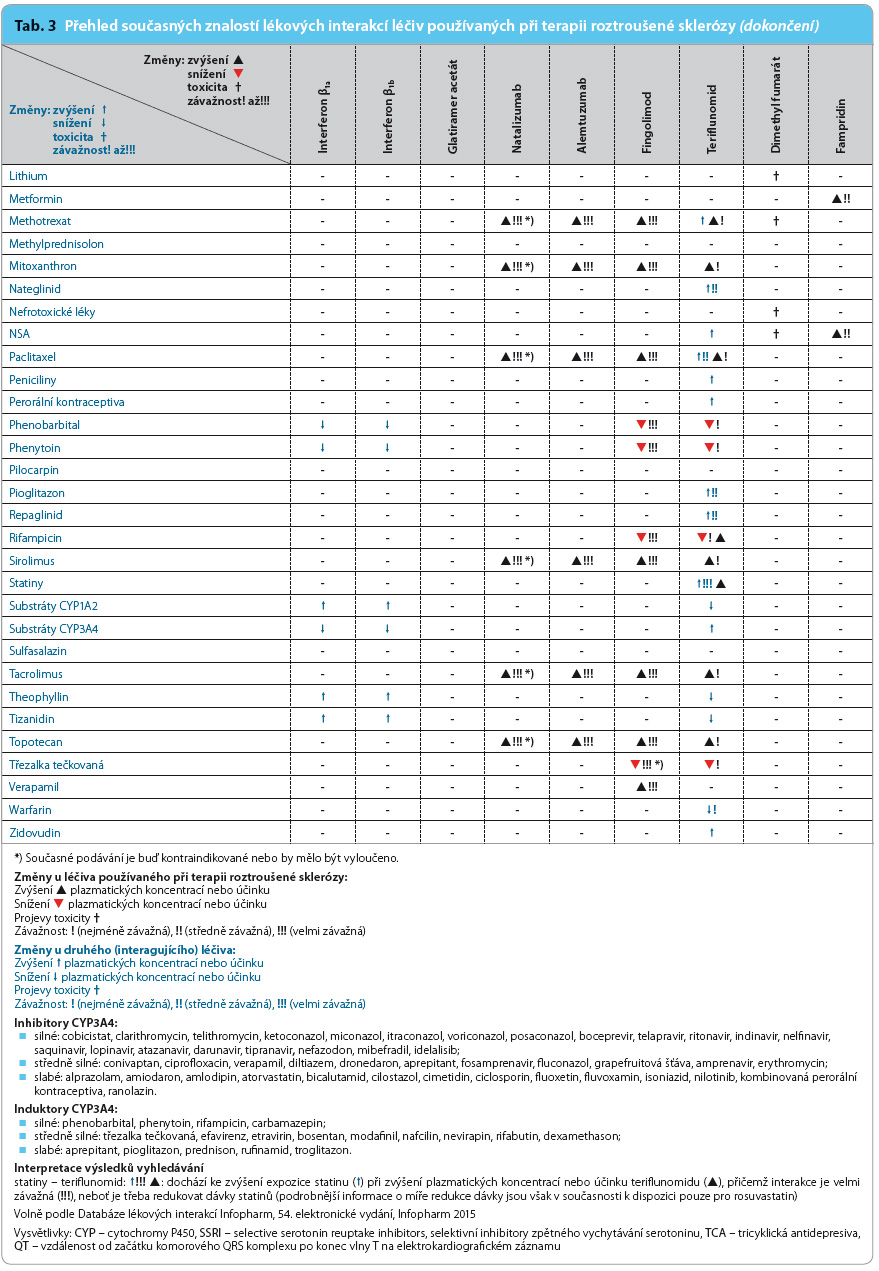
Lékové interakce
Interferon β1a i β1b je podle studií in vitro slabým až středně silným inhibitorem CYP1A2 a slabým smíšeným inhibitorem/induktorem CYP3A4 [4]. Obdobnou informaci uvádějí výrobci interferonů β a varují buď obecně před léčivy „s úzkou terapeutickou šířkou nebo s úzkým indexem“ [5]. Studie in vivo s interferonem α však žádnou inhibiční aktivitu in vivo neprokázaly [6] a studie in vivo s interferonem β nebyly dosud provedeny. Nadto byla v minulosti inhibiční aktivita vůči některým izoenzymům cytochromu P450 popsána [7] u cytokinů (konkrétně u interleukinů). Biotransformace theophyllinu je inhibována interferonem β [8]; teoreticky proto nelze vyloučit interakce mezi interferonem β a substráty CYP1A2, jako je např. estradiol, fluvoxamin, imipramin, clomipramin, clozapin, olanzapin, metoprolol, mexiletin, ondansetron, tizanidin nebo kofein. Klinický význam těchto případných interakcí patrně nebude velký, neboť kdyby tomu tak bylo, jistě by již bylo publikováno mnoho kasuistik či studií o ovlivnění biotransformace tizanidinu, fluvoxaminu nebo estradiolu, což jsou léčiva relativně běžně podávaná pacientům a pacientkám s RS.
Očkování během léčby interferonem β je možné, včetně očkování živými oslabenými očkovacími látkami. Imunologická odpověď organismu na očkování např. protichřipkovou vakcínou se u pacientů léčených interferonem β v zásadě neliší od neléčené populace [9,10].
Hepatotoxicita
Při postmarketingovém sledování bylo zaznamenáno v souvislosti s podáváním interferonu β postižení jater včetně zvýšení hodnot jaterních transamináz, autoimunitní hepatitidy, hepatitidy a jaterního selhání [11]. V některých případech se tyto reakce projevily při současném podávání jiných léčivých přípravků s potenciální hepatotoxicitou [12] nebo při podávání přípravků tradiční indické medicíny [13]. Možnost současného vlivu více léčivých přípravků nebo jiných hepatotoxických látek (například alkoholu) nebyla stanovena. Pacienti mají být sledováni s ohledem na příznaky jaterního postižení a je nutná opatrnost při současném podávání interferonů s jinými potenciálně hepatotoxickými léčivými přípravky včetně alkoholu.
Nefrotoxicita
Během léčby přípravky obsahujícími interferon β byly hlášeny případy nefrotického syndromu spojeného s různými základními nefropatiemi, nezávisle na délce léčby. Doporučuje se pravidelně sledovat časné příznaky, např. edém, proteinurie a poruchy funkce ledvin, zejména u pacientů s vysokým rizikem poškození ledvin.
Glatiramer acetát
Kontraindikované současné podávání jiných léků
Ve vztahu k lékovým interakcím se žádné léčivé přípravky neuvádějí jako kontraindikované. Uvádí je však výrobce natalizumabu [14], podle nějž je současné podávání natalizumabu s glatiramer acetátem kontraindikované.
Lékové interakce
Interakce glatiramer acetátu s jinými léčivými přípravky nebyly ve formálních studiích hodnoceny [15]. Na základě známých vlastností glatiramer acetátu nelze klinicky významné lékové interakce předpokládat. Výrobce glatiramer acetátu nabádá k opatrnosti u pacientů léčených carbamazepinem nebo phenytoinem, neboť se jedná o léčiva s vysokou vazbou na plazmatické bílkoviny a glatiramer acetát by je potenciálně mohl z této vazby vytěsnit, protože má též silnou vazebnou afinitu k plazmatickým bílkovinám. Vzhledem k odlišným vazebným bílkovinám (carbamazepin i phenytoin se váží na kyselý α1‑glykoprotein, zatímco glatiramer acetát se váže na albumin) však patrně vůbec nemůže k interakci na této úrovni dojít.
Imunologická odpověď organismu na očkování např. protichřipkovou vakcínou je u pacientů léčených glatiramer acetátem oproti zdravým kontrolám snížena, přičemž rozdíl byl významný jak statisticky, tak i klinicky [16]. To ovšem neznamená, že by nebylo možné z důvodu snížení bezpečnosti aplikovat pacientům léčeným glatiramer acetátem očkovací látky, je však třeba počítat s možným snížením účinnosti očkování.
Hepatotoxicita
Nebyly publikovány žádné práce, které by popisovaly případnou hepatotoxicitu glatiramer acetátu, výrobce též neuvádí vyjma zvýšení hodnot jaterních transamináz žádné projevy hepatotoxicity glatiramer acetátu [15].
Nefrotoxicita
Obdobně nebyly publikovány žádné práce, které by popisovaly případnou nefrotoxicitu glatiramer acetátu, ani výrobce neuvádí takové nežádoucí účinky [15].
Natalizumab
Kontraindikované současné podávání jiných léků
Současné podávání natalizumabu s interferony β nebo s glatiramer acetátem je kontraindikované [14].
Lékové interakce
Jiné než výše uvedené „kontraindikované“ lékové interakce natalizumabu výrobce neuvádí [14]. V USA je natalizumab schválen též v indikaci Crohnova choroba a v této indikaci by podle výrobce neměl být současně podáván s imunosupresivy (mercaptopurin, azathioprin, ciclosporin nebo methotrexat) nebo s inhibitory tumor nekrotizujícího faktoru alfa (TNFα) [17]. Přestože z výsledků rozsáhlé kontrolované studie SENTINEL (n = 1 171) [18] vyplynula dobrá účinnost kombinace interferonu β s natalizumabem, byl zaznamenán výskyt dvou případů progresivní multifokální leukoencefalopatie, z toho jeden případ s fatálním koncem. Je proto třeba věnovat zvýšenou pozornost pacientům, kteří před zahájením aplikace natalizumabu užívali imunosupresivně působící léčiva, přičemž velmi důležité je stanovení správného intervalu tzv. vymývací periody. Ta by měla činit v případě předchozí aplikace interferonů β 6 týdnů, v případě předchozího podávání azathioprinu 3 měsíce a při předchozí aplikaci mitoxanthronu 6 měsíců [19]. Současné podávání imunosupresivních léčiv s výjimkou kortikosteroidů nelze doporučit.
Očkování proti chřipce bylo spojeno s obdobnou imunologickou reakcí jako očkování u osob neléčených natalizumabem a lze jej tedy považovat za bezpečné a účinné [20]. K obdobným výsledkům dospěla studie porovnávající imunologickou reakci na aplikaci tetanového toxoidu (TT) [21], kdy u všech očkovaných pacientů bylo dosaženo ochranné hladiny protilátek anti‑TT IgG. Nejsou známy žádné informace o účinnosti a bezpečnosti aplikace živých oslabených vakcín pacientům léčeným natalizumabem, a proto je vhodné provést případná potřebná očkování před zahájením aplikace natalizumabu.
Kuřáctví může vést, dosud neznámým mechanismem, ke zvýšení rizika vzniku protilátek [22], přičemž poměr šancí u kuřáků ve srovnání s nekuřáky (celkem hodnocen úctyhodný počet 1 338 pacientů léčených natalizumabem) činil 2,4 (interval spolehlivosti – 95% CI: 2,1–4,4).
Hepatotoxicita
Ve výsledcích spontánních hlášení nežádoucích účinků Food and Drug Administration (FDA) v období let 2004–2008 bylo zahrnuto celkem 6 pacientů s vážným poškozením funkce jater [23]. Ve čtyřech případech došlo ke zvýšení hodnot jaterních transamináz a k hyperbilirubinemii již po první aplikaci natalizumabu.
Nefrotoxicita
Nebyly publikovány žádné práce, které by popisovaly případnou nefrotoxicitu natalizumabu, ani výrobce takové nežádoucí účinky neuvádí [14].
Fingolimod
Kontraindikované současné podávání jiných léků
Výrobce fingolimodu v ČR žádná kontraindikovaná současně užívaná léčiva neuvádí [24]. V části Souhrnu údajů o přípravku věnované zvláštním upozorněním a opatřením pro použití výrobce uvádí, že by fingolimod neměl být podáván pacientům léčeným antiarytmiky třídy Ia (např. chinidinem, disopyramidem) nebo třídy III (např. amiodaronem, sotalolem). Výrobce fingolimodu v USA považuje takové současné podávání antiarytmik třídy Ia a třídy III za kontraindikované [25].
Lékové interakce
Fingolimod je substrátem CYP4F2 (> 80 %) a z menší části též CYP2D6 (< 10 %), CYP2E1 (< 10 %) a dále je malým podílem biotransformován (< 1 %) CYP3A4, CYP4F3B a CYP4F12 [26]. Fingolimod není inhibitorem ani induktorem žádného z izoenzymů cytochromu P450 [26]. Ve studii u zdravých dobrovolníků vedlo podávání středně silného inhibitoru CYP4F2 (a současně také silného inhibitoru CYP3A4) ketoconazolu ke zvýšení expozice fingolimodu o 71 % a zvýšení expozice aktivnímu metabolitu fingolimodu o 67 % (50–85 % na 90% hladině spolehlivosti) [27], nejsou však třeba žádná speciální opatření [24]. Výrobce fingolimodu sice upozorňuje, že při současném podávání inhibitorů CYP3A4 je třeba opatrnosti, avšak fingolimod je tímto izoenzymem metabolizován naprosto minoritně a např. současné podávání středně silného inhibitoru CYP3A4 diltiazemu nevedlo ke změnám farmakokinetických vlastností fingolimodu. Zvýšení expozice fingolimodu o 41 % při současném podávání clarithromycinu [26] je pravděpodobně způsobeno slabou inhibiční aktivitou clarithromycinu vůči CYP4F2.
Polyinduktory cytochromu P450, jako je rifampicin, carbamazepin, phenobarbital, phenytoin, efavirenz nebo třezalka tečkovaná (Hypericum perforatum), mohou snižovat expozici fingolimodu, respektive jeho aktivnímu metabolitu. V dosud nepublikované studii u zdravých dobrovolníků [26] vedlo podávání carbamazepinu v dávkách 600 mg 2krát denně ke snížení expozice fingolimodu o 40 % a ke snížení expozice jeho aktivnímu metabolitu o 28 %.
Výrobce fingolimodu v ČR v části Souhrnu údajů o přípravku označené jako Zvláštní upozornění a opatření pro použití uvádí, že podávání fingolimodu nesmí být zahájeno u pacientů léčených β‑blokátory a blokátory vápníkových kanálů snižujícími tepovou frekvenci (např. verapamilem, diltiazemem nebo ivabradinem) [24]. Výrobce dále doplňuje, že léčba fingolimodem je možná pouze v případě, že předpokládaný prospěch vyváží možná rizika, že je nezbytná konzultace s kardiologem a v případě, že nelze ukončit podávání léčiv s bradykardizujícím účinkem, je třeba určit vhodný způsob monitorování pacienta při zahájení terapie fingolimodem. Důvodem pro pečlivé monitorování je skutečnost, že pokles srdeční frekvence po podání první dávky fingolimodu začíná během jedné hodiny a je nejvyšší během šesti hodin. V následujících dnech terapie je pokles tepové frekvence obvykle mírnější a během několika týdnů ve většině případů zcela odezní. Monitoring pacientů je však alespoň po dobu 6 hodin nutný u všech pacientů, u nichž je léčba fingolimodem zahajována.
Lze tedy shrnout, že souběžná léčba fingolimodem a léčivy s bradykardizujícím účinkem je možná za zvýšené opatrnosti a při zajištěném monitorování pacienta. Experimentální důkazy týkající se ovlivnění tepové frekvence fingolimodem v kombinaci s dalšími léčivy byly získány ve studii u zdravých dobrovolníků, kde byla podána jednorázová dávka fingolimodu (v supraterapetické výši 5 mg) samotná nebo po předchozím podávání atenololu v dávkách 50 mg podávaných po dobu 5 dnů, respektive retardovaného diltiazemu podávaného v dávkách 240 mg též po dobu 5 dnů. Průměrná nejnižší tepová frekvence při podávání samotného atenololu byla 55 tepů/min, při podávání samotného fingolimodu 51 tepů/min a při současném podávání atenololu a fingolimodu 42 tepů/min. Byly pozorovány značné interindividuální rozdíly, u pacientů s tepovou frekvencí vyšší než 50 tepů/min vedl fingolimod k hlubšímu poklesu tepové frekvence než u pacientů s tepovou frekvencí nižší než 50 tepů/min, kde fingolimod vyvolal pouze malé prohloubení bradykardie způsobené atenololem. Hodnoty krevního tlaku zůstaly nezměněny.
Průměrná nejnižší tepová frekvence při podávání samotného diltiazemu dosahovala 67 tepů/min, při podávání samotného fingolimodu 55 tepů/min a při současném podávání diltiazemu a fingolimodu 69 tepů/min. Hodnoty krevního tlaku zůstaly nezměněny. Diltiazem nezměnil farmakokinetické parametry fingolimodu.
Bradykardii navozenou fingolimodem lze antagonizovat atropinem. Ve studii u zdravých dobrovolníků vedlo podání jednorázové supraterapeutické dávky fingolimodu ve výši 5 mg k tepové frekvenci 51 ± 5 tepů/min za 4 hodiny po podání; byl‑li podán fingolimod současně s nitrožilní aplikací atropinu, dosahovala tepová frekvence 4 hodiny po podání fingolimodu 66 ± 6 tepů/min [28]. Atropin přitom neovlivňoval farmakokinetické vlastnosti fingolimodu.
Obdobně, avšak jiným mechanismem, lze antagonizovat bradykardii navozenou fingolimodem aplikací isoprenalinu (β‑sympatomimetikum). V další studii u zdravých dobrovolníků [29] byly postupně aplikovány infuze isoprenalinu či placeba, přičemž první byla aplikována 2 hodiny před perorálním podáním fingolimodu opět v supraterapeutické dávce 5 mg, další čtyři infuze pak byly aplikovány v rozmezí 3–6 hodin po podání fingolimodu. Dávky isoprenalinu byly určeny tak, aby bylo dosaženo tepové frekvence 100–120 tepů/min. Dávky isoprenalinu nutné k antagonizaci bradykardie navozené fingolimodem bylo nutné zvýšit o 41 %.
Fingolimod neinteraguje s ciclosporinem [30], s kombinovanými hormonálními perorálními kontraceptivy [31], s baclofenem [26], gabapentinem [26], oxybutyninem [26], amantadinem [26] nebo s amitriptylinem [26]. Současné podávání pregabalinu [26], modafinilu [26], fluoxetinu a paroxetinu [26], a především perorálních i nitrožilně aplikovaných kortikosteroidů [26] má jen minimální vliv na expozici fingolimodu (mírné snížení expozice v rozsahu přibližně 5–20 %).
Výrobce fingolimodu uvádí, že během léčby fingolimodem a až dva měsíce po jejím ukončení může být vakcinace méně účinná. Použití živých oslabených vakcín může vést k riziku infekcí a je třeba se mu vyhnout [24]. Očkování TT nebo polyvalentní pneumokokovou vakcínou (PPV‑23) u zdravých dobrovolníků užívajících fingolimod v dávkách 0,5 mg nebo 1,25 mg denně, respektive užívajících placebo, prokázalo [32], že fingolimod neovlivnil anti‑TT imunogenicitu při podávání v dávkách 0,5 mg. Podávání fingolimodu však vyvolalo mírný až střední pokles hodnot anti‑KLH (Keyhole Limpet Hemocyanin) a anti‑PPV‑23 IgG a IgM ve srovnání s placebem. Zcela recentní studie provedená u pacientů s RS [33] pak mimo jiné prokázala, že imunologická odpověď na aplikaci TT nebo na aplikaci protichřipkové vakcíny byla snížena ve srovnání s pacienty užívajícími placebo, přičemž zjištěné rozdíly byly významné nejen statisticky, ale i klinicky.
Hepatotoxicita
Bylo hlášeno zvýšení hodnot jaterních transamináz [24], zejména alanin aminotransferázy (ALT), ale též gama‑glutamyltransferázy (GGT) a aspartát aminotransferázy (AST). Recidiva zvýšení hodnot jaterních transamináz se objevila u některých pacientů po opětovném zahájení terapie, což signalizuje souvislost s fingolimodem. Fingolimod by se neměl podávat pacientům se závažným poškozením jater (třída Child‑Pugh C). U pacientů, u kterých se rozvinou příznaky ukazující na jaterní poškození, jako například nevysvětlitelná nauzea, zvracení, bolesti břicha, únava, nechutenství nebo žloutenka a/nebo tmavá moč, by měla být zkontrolována aktivita jaterních enzymů a podávání fingolimodu by mělo být ukončeno, pokud se potvrdí významné poškození jater (např. aktivita jaterních transamináz vyšší než pětinásobek ULN – horní hranice normy, upper limit of normal) a/nebo zvýšení sérové koncentrace bilirubinu).
Nefrotoxicita
Nebyly publikovány žádné práce, které by popisovaly případnou nefrotoxicitu fingolimodu, ani výrobce takové nežádoucí účinky neuvádí [24].
Teriflunomid
Kontraindikované současné podávání jiných léků
Výrobce teriflunomidu v ČR nepovažuje za kontraindikované současné podávání žádného léčiva. Uvádí však, že souběžné podávání leflunomidu není doporučováno, neboť teriflunomid je aktivním metabolitem leflunomidu [34]. Naproti tomu výrobce teriflunomidu v USA považuje současné podávání leflunomidu za kontraindikované [35].
Lékové interakce
Teriflunomid je v organismu jen minimálně metabolizován, přičemž převažují biotransformační cesty nezávislé na oxidaci (tedy bez účasti cytochromu P450), jako je hydrolýza a konjugace. Na druhou stranu je teriflunomid více nebo méně významným inhibitorem některých izoenzymů cytochromu P450, in vivo zejména CYP2C8 a CYP3A4 a nelze vyloučit, že též CYP2C9 [36]. Současně je teriflunomid induktorem CYP1A2. Vedle toho teriflunomid inhibuje transportní systémy BCRP (Breast Cancer Resistance Protein), OATP1B1 (Organic Anion Transporter Polypeptide 1B1), OAT3 (Organic Anion Transporter 3) a OCT2 (Organic Cation Transporter 2) [36]. Teriflunomid však sám není substrátem BCRP nebo P‑glykoproteinu. Z výčtu je zřejmé, že teriflunomid může vést při současném podávání s řadou léčiv k lékovým interakcím. Prakticky žádné relevantní informace o lékových interakcích teriflunomidu však dosud nebyly v odborné literatuře publikovány. Z tohoto důvodu je možné vycházet pouze z údajů poskytnutých výrobcem pro účely registrace FDA [36], které jsou veřejně dostupné.
Teriflunomid lze považovat za středně silný inhibitor CYP2C8. V dosud nepublikované studii [36] u zdravých dobrovolníků vedlo jeho podávání ke zvýšení expozice substrátu CYP2C8 repaglinidu o 140 % (tedy na 2,4násobek). Dále je třeba teriflunomid považovat za slabý inhibitor CYP3A4, neboť při jeho podávání došlo ke zvýšení expozice substrátům CYP3A4 midazolamu o 27 %, ethinylestradiolu o 54 % nebo levonorgestrelu o 41 % [36]. Zatímco klinický význam inhibice CYP3A4 je vcelku zanedbatelný, může být inhibice CYP2C8 klinicky významná, zejména při podávání léčiv, která jsou substráty CYP2C8 a současně mají tzv. úzkou terapeutickou šíři. Při výběru kombinovaného perorálního kontraceptiva je díky tomu, že se vedle inhibice CYP3A4 s největší pravděpodobností uplatňují i další mechanismy, vhodné volit léčivé přípravky s velmi nízkou dávkou ethinylestradiolu (20 µg nebo méně).
V dosud nepublikované studii u zdravých dobrovolníků vedlo opakované podávání teriflunomidu ke snížení expozice kofeinu o 55 % (o 50–60 % na 90% hladině spolehlivosti). Výrobce teriflunomidu proto uvádí, že během léčby teriflunomidem je nutné s opatrností používat léčivé přípravky metabolizované CYP1A2 (např. duloxetin, alosetron, theophyllin a tizanidin), neboť teriflunomid může snižovat jejich účinnost [34].
Současné podávání rifampicinu vedlo v dosud nepublikované studii u zdravých dobrovolníků ke snížení expozice teriflunomidu o 21 % při současném zvýšení maximálních plazmatických koncentrací o 17 % [36], což svědčí o mechanismu interakce založeném na inhibici OATP1B1 v játrech způsobené rifampicinem. V dosud nepublikované studii vedlo podávání induktorů transportních systémů carbamazepinu, phenobarbitalu, phenytoinu a extraktů z třezalky tečkované ke snížení plazmatických koncentrací teriflunomidu o 21–35 % [36], a proto výrobce teriflunomidu uvádí, že rifampicin a jiné známé silné induktory cytochromu P450 a transportérů, jako je např. carbamazepin, phenobarbital, phenytoin a třezalka tečkovaná, je nutné během léčby teriflunomidem používat opatrně [34]. V této souvislosti je nutné upozornit, že indukční aktivitu má vedle třezalky tečkované celá řada dalších rostlin nebo jejich extraktů (česnek, čajovníkovec kapský, šalvěj červenokořenná a další), podrobný výčet by však přesáhl možnosti tohoto článku.
V dosud nepublikovaných studiích teriflunomid neovlivňoval farmakokinetické vlastnosti omeprazolu (substrát CYP2C19), metoprololu (substrát CYP2D6) nebo bupropionu (substrát CYP2B6). Ačkoli ani ovlivnění farmakokinetických vlastností warfarinu (substrát CYP2C9) nebylo klinicky významné, došlo ke snížení hodnot INR (international normalized ratio) o 25 %, což lze považovat za klinicky významné, a proto výrobce teriflunomidu doporučuje pečlivě monitorovat INR při kombinované léčbě warfarinem a teriflunomidem [34].
Z hlediska rozsahu změn farmakokinetických vlastností jsou klinicky patrně nejvýznamnější interakce teriflunomidu, jejichž mechanismus vychází z jeho inhibičního působení na výše uvedené transportní systémy. Podávání teriflunomidu vedlo v dosud nepublikované studii u zdravých dobrovolníků ke zvýšení expozice rosuvastatinu (substrát BCRP a OATP1B1) o 151 %. Výrobce teriflunomidu k tomu uvádí, že při podávání rosuvastatinu v kombinaci s teriflunomidem doporučuje snížit dávku rosuvastatinu na 50 % [34]. Při podávání substrátů BCRP (např. sulfasalazinu nebo doxorubicinu) nebo substrátů OATP1B1 (např. simvastatinu, atorvastatinu, pravastatinu nebo repaglinidu) v kombinaci s teriflunomidem nabádá výrobce teriflunomidu též k opatrnosti a při projevech zvýšené expozice uvedeným léčivům pak doporučuje redukci jejich dávek [34]. Podávání teriflunomidu vedlo v dosud nepublikované studii u zdravých dobrovolníků ke zvýšení expozice cefacloru (substrát OAT3) o 54 %. Výrobce teriflunomidu proto doporučuje blíže nespecifikovanou opatrnost při současném podávání teriflunomidu se substráty OAT3 (jako jsou např. cefaclor, benzylpenicilin, ciprofloxacin, indomethacin, ketoprofen, furosemid, cimetidin, methotrexat nebo zidovudin) [34].
Velmi zajímavým typem lékových interakcí teriflunomidu jsou kombinace s léčivy, která se používají k urychlení eliminace teriflunomidu ve všech situacích, kdy je třeba teriflunomid co nejdříve z organismu odstranit (např. u závažných život ohrožujících infekcí, u závažných hematologických nežádoucích účinků, u těžkých kožních reakcí, u potvrzené periferní neuropatie nebo při těhotenství). Předně je třeba uvést, že teriflunomid má velmi dlouhý biologický poločas eliminace – kolem 19 dnů, plazmatických koncentrací nižších než 0,02 mg/l je za normálních okolností dosahováno po přibližně 8 měsících, v individuálních případech (způsobených polymorfismy transportních systémů) však mohou plazmatické koncentrace převyšující 0,02 mg/l přetrvávat i dva roky. Zrychlená eliminace je zajišťována podáváním colestyraminu nebo aktivního uhlí. Princip zrychlené eliminace i příslušné farmakokinetické parametry byly ověřeny s použitím leflunomidu [37], jehož aktivním metabolitem teriflunomid je. Při potřebě zrychlené eliminace se ukončí podávání teriflunomidu a podává se colestyramin v dávkách 8 g 3krát denně po dobu 11 dnů, alternativně lze podávat aktivní uhlí v dávkách 50 g 2krát denně (přibližně v intervalu 12 hodin) též po dobu 11 dnů. Po dokončení podávání léčiva se v odstupu 14 dnů provedou dvě měření plazmatické koncentrace teriflunomidu; jsou‑li zjištěny hodnoty nižší než 0,02 mg/l, je nutné vyčkat s početím ještě 6 týdnů, je‑li plazmatická koncentrace teriflunomidu vyšší, může být nezbytné zrychlenou eliminaci opakovat.
Očkování neživými očkovacími látkami během léčby teriflunomidem je možné, jak bylo prokázáno v případě protichřipkové vakcíny [38]. Imunologická odpověď byla u pacientů léčených dávkou 7 mg denně prakticky totožná (78 %) s imunologickou odpovědí u pacientů léčených interferonem β (82 %) a byla mírně nižší u pacientů léčených teriflunomidem v dávkách 14 mg denně (61 %).
Používání živých oslabených vakcín je spojeno s rizikem infekcí, a proto je třeba se mu vyhnout. U pacientů se závažnou aktivní infekcí je nutné odložit zahájení léčby teriflunomidem až na dobu do vyléčení [34].
Hepatotoxicita
U pacientů léčených teriflunomidem bylo pozorováno zvýšení hodnot jaterních transamináz zejména v průběhu prvních 6 měsíců od začátku léčby [34]. Před zahájením léčby teriflunomidem je nutné zkontrolovat hodnoty jaterních testů. To je poté třeba opakovat každé dva týdny v průběhu prvních 6 měsíců od začátku léčby a následně pak každých 8 týdnů nebo dle klinických známek a příznaků, jakými může být např. nevysvětlená nauzea, zvracení, bolest břicha, únava, anorexie nebo ikterus a/nebo přítomnost tmavé moči. Při 2–3násobném zvýšení aktivity ALT nad ULN musí být aktivita monitorována každý týden. Pokud existuje podezření na poškození jater, léčbu teriflunomidem je nutné ukončit; při zvýšených hodnotách jaterních transamináz (více než trojnásobek ULN) je také vhodné zvážit ukončení léčby. U pacientů s hepatopatií a u alkoholiků je třeba postupovat se zvýšenou opatrností. Teriflunomid lze obdobně jako leflunomid považovat za hepatotoxické léčivo [39], proto je třeba postupovat s opatrností, pokud pacient užívá jiná hepatotoxická léčiva, např. nimesulid; pití alkoholu při léčbě teriflunomidem je třeba vyloučit.
Nefrotoxicita
Nebyly publikovány žádné práce, které by popisovaly případnou nefrotoxicitu teriflunomidu, ani výrobce takové nežádoucí účinky neuvádí [34].
Alemtuzumab
Kontraindikované současné podávání jiných léků
Nejsou uváděny žádné kontraindikace současného podávání jiných léků [40].
Lékové interakce
Výrobce alemtuzumabu v ČR [40] i v USA [41] uvádí doporučení, aby požadavky na imunizaci byly u pacientů splněny alespoň 6 týdnů před začátkem léčby. Schopnost vyvolat imunitní odpověď na jakoukoli vakcínu po léčbě nebyla hodnocena. Bezpečnost imunizace živými oslabenými vakcínami po léčebném cyklu nebyla formálně hodnocena v kontrolovaných klinických studiích s RS a tato léčba nemá být podána pacientům s RS, kteří v nedávné době podstoupili cyklus léčby.
Dimethyl fumarát
Kontraindikované současné podávání jiných léků
Nejsou uváděny žádné kontraindikace jiných současně podávaných léků [42].
Lékové interakce
Dimethyl fumarát není inhibitorem ani induktorem žádného z izoenzymů cytochromu P450. Dimethyl fumarát se biotransformuje na glukózu a většina podané dávky se metabolizuje až na oxid uhličitý, který se eliminuje dýcháním. Užití dimethyl fumarátu současně s jídlem neovlivňuje jeho celkovou expozici. Potrava snižuje maximální plazmatické koncentrace dimethyl fumarátu a poměrně významně prodlužuje čas nutný k jejich dosažení (z přibližně dvou hodin na více než pět hodin), a především snižuje výskyt návalů horka [44], což může být využito ke snížení intenzity tohoto nežádoucího účinku.
Výrobce dimethyl fumarátu uvádí, že by mělo být postupováno s opatrností při současném podávání protinádorové nebo imunosupresivní terapie [42], a dále doporučuje nepodávat dimethyl fumarát současně s přípravky, které obsahují deriváty kyseliny fumarové (lokální nebo systémové). V této souvislosti je nutné upozornit, že řada léčivých látek je v lékových formách přítomna jako sůl kyseliny fumarové (množství fumarátu je v tomto případě obvykle prakticky zanedbatelné), především však některé léčivé přípravky obsahují v lékových formách kyselinu fumarovou jako pomocnou látku (v blíže nespecifikovaném množství, což lze považovat za jisté riziko), přitom se jedná o celkem 98 léčivých přípravků, z nichž 26 je v současné době v ČR reálně obchodováno.
V dosud nepublikované studii u zdravých dobrovolníků [44] nebyly zjištěny žádné statisticky nebo klinicky významné změny farmakokinetických vlastností dimethyl fumarátu při jeho současném podávání s interferonem β, respektive s glatiramer acetátem. Současné podání standardní lékové formy kyseliny acetylsalicylové v dávkách 325 mg nemělo též vliv na farmakokinetické vlastnosti dimethyl fumarátu, avšak výrazně snížilo výskyt návalů horka [44,45]. Výrobce dimethyl fumarátu v ČR přesto současné podávání kyseliny acetysalicylové nedoporučuje [42] – na rozdíl od výrobce v USA [43].
Výrobce dimethyl fumarátu v ČR uvádí, že očkování během léčby dimethyl fumarátem nebylo hodnoceno [42]. Není známo, zda léčba dimethyl fumarátem vede ke snížení účinnosti některých vakcín. Živé vakcíny mohou zvýšit riziko klinické infekce a pacientům léčeným dimethyl fumarátem by měly být podávány pouze ve výjimečných případech, kdy je toto potenciální riziko převýšeno rizikem plynoucím z neočkování daného jednotlivce.
Dále výrobce dimethyl fumarátu uvádí, že při konzumaci středně velkého množství alkoholu nebyly účinky dimethyl fumarátu změněny a nebyl zjištěn zvýšený výskyt nežádoucích účinků. Konzumace velkého množství neředěných alkoholických nápojů s vysokým obsahem alkoholu (více než 30 % alkoholu) může vést k rychlejšímu rozpouštění dimethyl fumarátu, a tudíž ke zvýšené frekvenci gastrointestinálních nežádoucích účinků [42].
Hepatotoxicita
Nebyly publikovány žádné práce, které by popisovaly případnou hepatotoxicitu dimethyl fumarátu, ani výrobce takové nežádoucí účinky neuvádí [42].
Nefrotoxicita
Dimethyl fumarát může být nefrotoxický [42]. Výrobce dimethyl fumarátu proto uvádí, že souběžná léčba s nefrotoxickými léčivy (jako jsou aminoglykosidy, diuretika, NSA, lithium) může u pacientů užívajících dimethyl fumarát vést ke zvýšení výskytu renálních nežádoucích účinků (např. proteinurie).
Fampridin
Kontraindikované současné podávání jiných léků
Výrobce fampridinu v ČR [46] považuje za kontraindikované současné užívání léčivých přípravků, které jsou inhibitory transportérů organických kationtů 2 (OCT2), například s cimetidinem.
Kombinace s inhibitory OCT2 je poněkud nejasná, neboť v odborných publikacích je uváděna řada léčiv, která jsou inhibitory OCT2, avšak klinický význam takových inhibicí není obvykle blíže specifikován a nepochybně může být pro různé substráty OCT2 (k nimž patří i fampridin) odlišný. Mezi silnými inhibitory OCT2 jsou zmiňovány [47] desipramin, imipramin, chinidin, trimethoprim a verapamil. Další autoři [48] uvádějí celkem 20 „silných“ inhibitorů OCT2, přičemž je zmíněn imatinib, ipratropium bromid, mebeverin, rabeprazol, takrin a tolterodin (uvedeny jsou pouze léčivé látky registrované v ČR). V novější publikaci jiní autoři [49] též zmiňují carvedilol. Elektronický zdroj informací [50] uvádí celkem 27 léčivých látek, přičemž v ČR je z nich v systémových lékových formách registrováno pouze jedenáct: bupropion, desipramin, dipyridamol, exemestan, imatinib, imipramin, olanzapin, ondansetron, rabeprazol, tolterodin a trimethoprim. Inhibiční potenciál vůči OCT2 u některých léčiv dosud nebyl in vivo jednoznačně prokázán.
Lékové interakce
Fampridin je vylučován především ledvinami v nezměněné formě, přičemž aktivní renální sekrece pokrývá přibližně 60 % podané dávky; OCT2 je transportér odpovědný za aktivní sekreci fampridinu. Z tohoto důvodu výrobce fampridinu v ČR považuje současné podávání fampridinu s inhibitory OCT2, například s cimetidinem, za kontraindikované a v případě současného podávání fampridinu s léčivými přípravky, které jsou substráty OCT2, například s carvedilolem, propranololem nebo metforminem, nabádá k opatrnosti.
Pacienti zařazení do klinických studií s fampridinem byli léčeni buď interferonem β nebo glatiramer acetátem a při souběžném podávání těchto léčiv nebyly pozorovány žádné projevy lékové interakce. V dosud nepublikované studii provedené výrobcem fampridinu bylo zjištěno, že současné podávání fampridinu s baclofenem nevede k ovlivnění farmakokinetických vlastností baclofenu.
Výrobce fampridinu v USA [51] uvádí, že žádné lékové interakce nebyly dosud popsány.
Hepatotoxicita
Nebyly publikovány žádné práce, které by popisovaly případnou hepatotoxicitu fampridinu, ani výrobce takové nežádoucí účinky neuvádí [46].
Nefrotoxicita
Nebyly publikovány žádné práce, které by popisovaly případnou nefrotoxicitu fampridinu, ani výrobce takové nežádoucí účinky neuvádí [46].
Závěr
Léčiva používaná při terapii RS lze z hlediska rizika vzniku lékových interakcí rozdělit do dvou podskupin. Do první podskupiny je možné zařadit interferony β a glatiramer acetát. Do druhé skupiny pak ostatní léčiva s imunomodulačními (dimethyl fumarát) či imunosupresivními (natalizumab, alemtuzumab, fingolimod a teriflunomid) vlastnostmi. Zatímco podávání léčiv první skupiny v zásadě k žádným lékovým interakcím nevede, což platí zejména pro glatiramer acetát, jsou ve druhé skupině léčiv některé lékové interakce poměrně významné a znalost takových interakcí vede k vyšší bezpečnosti terapie.
Zvláštní kapitolou lékových interakcí jsou vzájemné kombinace imunomodulačních, a především imunosupresivních léčiv. I v tomto případě platí, že nejbezpečnějším léčivem je s největší pravděpodobností glatiramer acetát. K rizikovým léčivům je naopak nezbytné zařadit natalizumab, a zejména alemtuzumab, které není vhodné kombinovat s jinými léčivy této skupiny.
Vzhledem k vlastnostem některých léčiv používaných v léčbě RS (která jsou substráty různých izoenzymů cytochromu P450 nebo různých transportních efluxních i influxních systémů nebo mají inhibiční či indukční účinek na tyto struktury) lze v budoucnosti očekávat postupné rozšiřování informací o lékových interakcích, jež máme v současnosti k dispozici. Potenciálně nejvíce lékových interakcí, včetně dosud neznámých a možná i zcela nečekaných, lze předpokládat v případě teriflunomidu. Některé informace se jistě budou zpřesňovat, přičemž nejvíce relevantních informací by mohlo přinést používání příslušných léčiv v podmínkách běžné klinické praxe a pečlivé sledování lékaři s tím, že by podezření na lékové interakce hlásili Státnímu ústavu pro kontrolu léčiv (http://www.sukl.cz/nahlasit‑nezadouci‑ucinek); optimální přitom je vyplnit přímo formulář hlášení v elektronické podobě (http://www.sukl.cz/modules/undesired/report.php).
Seznam použité literatury
- [1] Národní sada klinických standardů: Klinický standard pro diagnostiku a léčbu roztroušené sklerózy a neuromyelitis optica, březen 2012, (http://www.czech neuro.cz/data/q/O/V/0031 rs odborna.pdf).
- [2] Havrdová E. Aktuální možnosti léčby roztroušené sklerózy. Farmakoterapie 2011; 7: 647–652.
- [3] Piťha J. Současné možnosti a zásady farmakoterapie relabující remitující roztroušené sklerózy. Remedia 2014; 24: 375–383.
- [4] Delaporte E, Renton KW. Cytochrome P4501A1 and cytochrome P4501A2 are downregulated at both transcriptional and post transcriptional levels by conditions resulting in interferon alpha/beta induction. Life Sci 1997; 60: 787–796.
- [5] Souhrny údajů o přípravcích obsahujících interferon beta, dostupné na www. ema.europa.eu: Avonex®(interferon β1a), 2014 (http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_Information/human/000102/WC500029425.pdf), Rebif® (interferon β1a), 2014 (http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_Information/human/000136/WC500048681.pdf), Betaferon® (interferon β1b), 2014 (http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_Information/human/000081/WC500053225.pdf), Extavia® (interferon β1b), 2014 (http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_Information/human/000933/WC500034701.pdf).
- [6] Pageaux GP, le Bricquir Y, Berthou F, et al. Effects of interferon alpha on cytochrome P 450 isoforms 1A2 and 3A activities in patients with chronic hepatitis C. Eur J Gastroenterol Hepatol 1998; 10: 491–495.
- [7] Abdel Razzak Z, Loyer P, Fautrel A, et al. Cytokines down regulate expression of major cytochrome P 450 enzymes in adult human hepatocytes in primary culture. Mol Pharmacol 1993; 44: 707–715.
- [8] Okuno H, Takasu M, Kano H, et al. Depression of drug metabolizing activity in the human liver by interferon beta. Hepatology 1993; 17: 65–69.
- [9] Pellegrino P, Carnovale C, Perrone V, et al. Efficacy of vaccination against influenza in patients with multiple sclerosis: The role of concomitant therapies. Vaccine 2014; 32: 4730–4735.
- [10] Olberg HK, Cox RJ, Nostbakken JK, et al. Immunotherapies influence the influenza vaccination response in multiple sclerosis patients: an explorative study. Mult Scler 2014; 20: 1074–1080.
- [11] Byrnes V, Afdhal N, Challies T, Greenstein PE. Drug induced liver injury secondary to interferon beta (IFN beta) in multiple sclerosis. Ann Hepatol 2006; 5: 56–59.
- [12] Fontana RJ, Hayashi P, Bonkovsky HL, et al. Presentation and outcomes with clinically apparent interferon beta hepatotoxicity. Dig Dis Sci 2013; 58: 1766–1775.
- [13] Tremlett H, Fu P, Yoshida E, Hashimoto S. Symptomatic liver injury (hepatotoxicity) associated with administration of complementary and alternative products (Ayurveda AP Mag Capsules(®)) in a beta interferon treated multiple sclerosis patient. Eur J Neurol 2011; 18: e78–79.
- [14] Souhrn údajů o přípravku: Tysabri® (natalizumab), 2014 (http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_Information/human/000603/WC500044686.pdf).
- [15] Souhrn údajů o přípravku: Copaxone® (glatiramer acetát), 2014 (http://www.sukl.cz/modules/medication/search.php).
- [16] Olberg HK, Cox RJ, Nostbakken JK, et al. Immunotherapies influence the influenza vaccination response in multiple sclerosis patients: an explorative study. Mult Scler 2014; 20: 1074–1080.
- [17] Full Prescribing Information: Tysabri® (natalizumab), 2013 (http://www.accessdata.fda.gov/drugsatfda_docs/label/2013/125104s840s847s889lbl.pdf).
- [18] Rudick RA, Stuart WH, Calabresi PA, et al.; SENTINEL Investigators. Natalizumab plus interferon beta 1a for relapsing multiple sclerosis. N Engl J Med 2006; 354: 911–923.
- [19] Gold R, Jawad A, Miller DH, et al. Expert opinion: Guidelines for the use of natalizumab in multiple sclerosis patiens previously treated with immunomodulating therapies. Neuroimmun 2007; 187: 156–158.
- [20] Vågberg M, Kumlin U, Svenningsson A. Humoral immune response to influenza vaccine in natalizumab treated MS patients. Neurol Res 2012; 34: 730–733.
- [21] Kaufman M, Pardo G, Rossman H, et al. Natalizumab treatment shows no clinically meaningful effects on immunization responses in patients with relapsing remitting multiple sclerosis. J Neurol Sci 2014; 341: 22–27.
- [22] Hedström A, Alfredsson L, Lundkvist Ryner M, et al. Smokers run increased risk of developing anti natalizumab antibodies. Mult Scler 2013; 20: 1081–1085.
- [23] Bezabeh S, Flowers CM, Kortepeter C, Avigan M. Clinically significant liver injury in patients treated with natalizumab. Aliment Pharmacol Ther 2010; 31: 1028–1035.
- [24] Souhrn údajů o přípravku: Gilenia® (fingolimod), 2014 (http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_Information/human/002202/WC500104528.pdf).
- [25] Full Prescribing Information: Gilenia® (fingolimod), 2014 (http://www.accessdata.fda.gov/drugsatfda_docs/label/2014/022527s009lbl.pdf).
- [26] Clinical Pharmacology and Biopharmaceuticals: Gilenia® (fingolimod), 2010 http://www.accessdata.fda.gov/drugsatfda_docs/nda/2010/022527Orig1s000clinpharmr.pdf
- [27] Kovarik JM, Dole K, Riviere GJ, et al. Ketoconazole increases fingolimod blood levels in a drug interaction via CYP4F2 inhibition. J Clin Pharmacol 2009; 49: 212–218.
- [28] Kovarik JM, Slade A, Riviere GJ, et al. The ability of atropine to prevent and reverse the negative chronotropic effect of fingolimod in healthy subjects. Br J Clin Pharmacol 2008; 66: 199–206.
- [29] Kovarik JM, Riviere GJ, Neddermann D, et al. A mechanistic study to assess whether isoproterenol can reverse the negative chronotropic effect of fingolimod. J Clin Pharmacol 2008; 48: 303–310.
- [30] Kovarik JM, Schmouder RL, Barilla D, et al. FTY720 and cyclosporine: evaluation for a pharmacokinetic interaction. Ann Pharmacother 2004; 38: 1153–1158.
- [31] David OJ, Ocwieja M, Meiser K, et al. Pharmacokinetics of fingolimod (FTY720) and a combined oral contraceptive coadministered in healthy women: drug drug interaction study results. Int J Clin Pharmacol Ther 2012; 50: 540–544.
- [32] Boulton C, Meiser K, David OJ, Schmouder R. Pharmacodynamic effects of steady state fingolimod on antibody response in healthy volunteers: a 4 week, randomized, placebo controlled, parallel group, multiple dose study. J Clin Pharmacol 2012; 52: 1879–1890.
- [33] Kappos L, Mehling M, Arroyo R, et al. Randomized trial of vaccination in fingolimod treated patients with multiple sclerosis. Neurology 2015; 84: 872–879.
- [34] Souhrn údajů o přípravku: Aubagio® (teriflunomid), 2014 (http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_Information/human/002514/WC500148682.pdf).
- [35] Full Prescribing Information: Aubagio® (teriflunomide), 2014 (http://www.accessdata.fda.gov/drugsatfda_docs/label/2014/202992s001lbl.pdf).
- [36] Clinical Pharmacology and Biopharmaceuticals: Aubagio® (teriflunomide), 2012 (http://www.accessdata.fda.gov/drugsatfda_docs/nda/2012/202992Orig1s000ClinpharmR.pdf).
- [37] Souhrn údajů o přípravku: Arava® (leflunomid), 2014 (http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_Information/human/000235/WC500026289.pdf).
- [38] Bar Or A, Freedman MS, Kremenchutzky M, et al. Teriflunomide effect on immune response to influenza vaccine in patients with multiple sclerosis. Neurology 2013; 81: 552–558.
- [39] Thomas RH, Wakefield RA. Oral disease modifying therapies for relapsing remitting multiple sclerosis. Am J Health Syst Pharm 2015; 72: 25–38.
- [40] Souhrn údajů o přípravku: Lemtrada® (alemtuzumab), 2014 (http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_Information/human/003718/WC500150521.pdf).
- [41] Full Prescribing Information: Lemtrada® (alemtuzumab), 2014 (http://www.accessdata.fda.gov/drugsatfda_docs/label/2014/103948s5139lbl.pdf).
- [42] Souhrn údajů o přípravku: Tecfidera® (dimethyl fumarate), 2014 (http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_Information/human/002601/WC500162069.pdf).
- [43] Full Prescribing Information: Tecfidera® (dimethyl fumarate), 2014 (http://www.accessdata.fda.gov/drugsatfda_docs/label/2014/204063s003s008s010lbl.pdf).
- [44] Clinical Pharmacology and Biopharmaceuticals: Tecfidera® (dimethyl fumarate), 2013 (http://www.accessdata.fda.gov/drugsatfda_docs/nda/2013/204063Orig1s000ClinPharmR.pdf).
- [45] Sheikh SI, Nestorov I, Russell H, et al. Tolerability and pharmacokinetics of delayed release dimethyl fumarate administered with and without aspirin in healthy volunteers. Clin Ther 2013; 35: 1582–1594.
- [46] Souhrn údajů o přípravku: Fampyra® (fampridin), 2014 (http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_Information/human/002097/WC500109956.pdf).
- [47] Fujita T, Urban TJ, Leabman MK, et al. Transport of drugs in the kidney by the human organic cation transporter, 0CT2 and its genetic variants. J Pharm Sci 2006; 95: 25–36.
- [48] Kido Y, Matsson P, Giacomini KM. Profiling of a prescription drug library for potential renal drug drug interactions mediated by the organic cation transporter 2. J Med Chem 2011; 54: 4548–4558.
- [49] Müller F, König J, Hoier E, et al. Role of organic cation transporter OCT2 and multidrug and toxin extrusion proteins MATE1 and MATE2 K for transport and drug interactions of the antiviral lamivudine. Biochem Pharmacol 2013; 86: 808–815.
- [50] http://www.straighthealthcare.com/organic cation transporter 2.html
- [51] Full Prescribing Information: Fampyra® (fampridin), 2014 (http://www.accessdata.fda.gov/drugsatfda_docs/label/2013/022250s006lbl.pdf).