Přehled přípravků s erytropoetickou aktivitou
Erytropoetin je peptidický hormon stimulující erytropoezu. Je stručně popsán mechanismus jeho účinku. Vlastnosti přirozeného erytropoetinu mají epoetiny připravené metodami genového inženýrství, které našly uplatnění zejména v léčbě anémie u chronické renální insuficience. Strukturální modifikací molekuly byly připraveny epoetiny druhé generace (darbepoetin alfa a pegepoetin beta). Po uplynutí patentové ochrany původních epoetinů bylo ke klinickému použití schváleno několik nových přípravků – biosimilars epoetinů. Z nových látek se studují inhibitory prolinhydroxylázy, hematid a erytropoetin mimetické peptidy.
K plynulé tvorbě červených krvinek je nutný nejen dostatečný přísun všech složek podílejících se na syntéze hemoglobinu, tj. železa, folátů a vitaminu B12, ale zejména dostatečná koncentrace hematopoetického růstového faktoru stimulujícího produkci a vyzrávání elementů červené řady v kostní dřeni. Tímto růstovým faktorem je erytropoetin.
Erytropoetin
Již v roce 1906 byla poprvé vyslovena hypotéza, že arteriální hypoxie stimuluje výdej zvláštního humorálního faktoru, který reguluje produkci červených krvinek [1]. Trvalo více než 50 let, než byla tato hypotéza experimentálně potvrzena a byl objeven glykoproteinový hormon, který byl nazván erytropoetin [2]. V následujících letech byl erytropoetin (EPO) podrobně charakterizován jako primární regulátor erytropoezy působící prostřednictvím specifické interakce s receptory pro EPO (EPOR), jež se nacházejí na progenitorových buňkách v kostní dřeni. Stimuluje proliferaci a působí vyzrávání elementů červené řady, zvyšuje expresi genů pro transferin, pro globin a expresi enzymů pro syntézu hemu [3]. Je kódován genem na chromozomu 7. Během embryonálního vývoje je syntetizován převážně v játrech, po narození v peritubulárních buňkách kortexu ledvin a jen zhruba z 10 % v játrech. Produkci EPO zvyšuje výšková hypoxie, ztráta krve, otrava oxidem uhelnatým, anémie. Naopak velká transfuze nebo pobyt ve vysokém atmosférickém tlaku syntézu EPO tlumí. Kromě toho je tvorba EPO ovlivněna některými působky. Růstový hormon, hormon štítné žlázy, noradrenalin, prostaglandiny a testosteron produkci EPO stimulují, estrogeny ji tlumí. 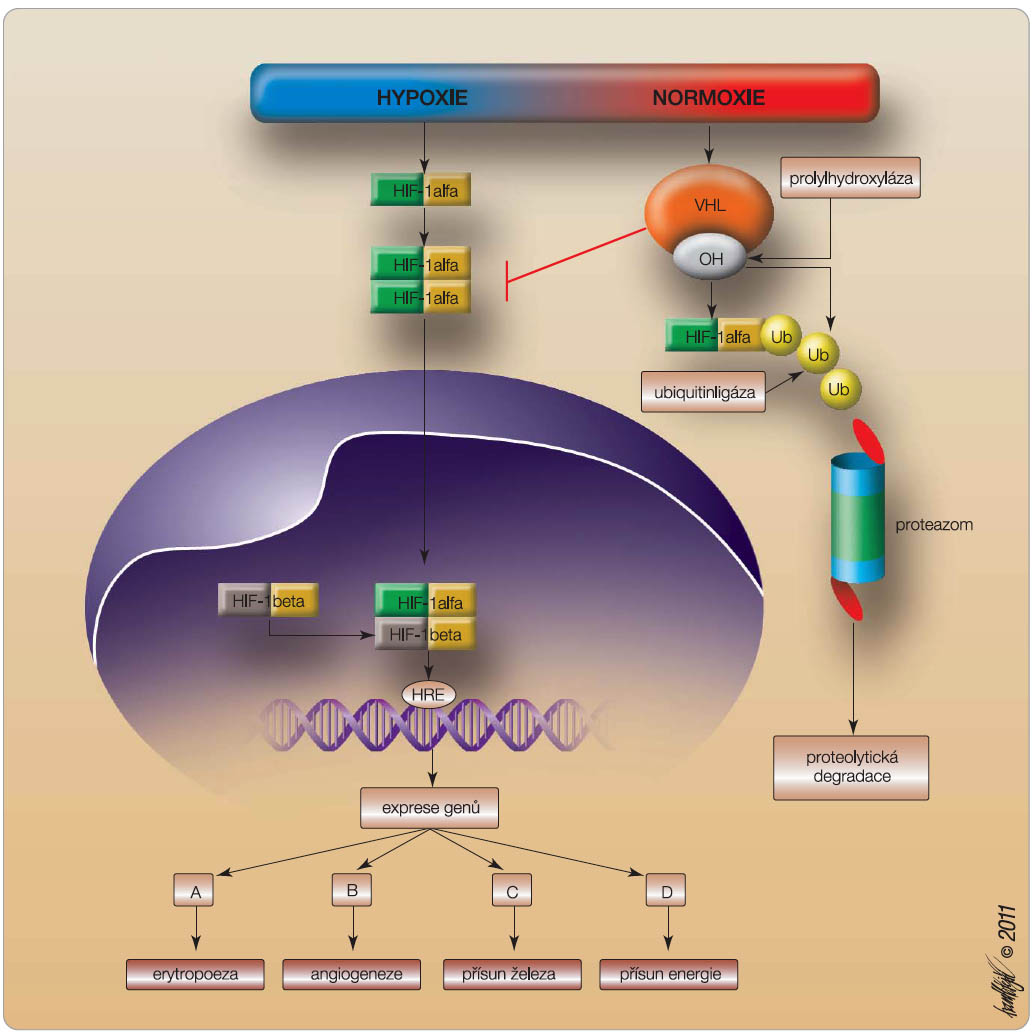 Patologická nadprodukce EPO působící polyglobulii byla popsána u některých nádorů (karcinom mozečku, hepatocelulární karcinom, karcinom ledviny). Během hypoxemie syntéza EPO prudce stoupá. Je pod kontrolou citlivého regulačního mechanismu v ledvinách, kde hraje roli transkripční faktor HIF-1alfa (hypoxia inducible factor-1) [4]. Ten proniká při hypoxii do jádra buněk ledvin, zde podléhá dimerizaci s HIF-1beta, váže se na HRE (hypoxia response element) a spouští transkripci a expresi celé řady genů, jak je schematicky znázorněno na obr. 1. Dostatečné množství progenitorů zajišťuje i transkripční faktor GATA 1, který blokuje jejich apoptózu výdejem antiapoptotického proteinu BclXL [4]. Kromě exprese genu pro erytropoetin se zvyšuje exprese genu pro VEGF se stimulací angiogeneze, exprese genu pro transferin zajišťující přísun železa, exprese genů stimulujících glykolytické enzymy a přísun energie. Za normoxie je HIF-1alfa za účasti tumor supresorového genu VHL (von Hippel-Lindau) prolylhydroxylázou oxidován a následně degradován ubiquitinovým-proteazomovým komplexem [5]. Reaktivitu regulačního centra snižují některé cytokiny, např. TNF, interferon gama a interleukin 1, které jsou zvýšeně exprimovány u různých onemocnění, především u maligních nádorů nebo u revmatoidní artritidy. Podílejí se tak na vzniku anémie u těchto chorob. Fyziologické hodnoty EPO jsou u mužů 9,6–26,0 U/l, u žen 11,0–30,0 U/l.
Patologická nadprodukce EPO působící polyglobulii byla popsána u některých nádorů (karcinom mozečku, hepatocelulární karcinom, karcinom ledviny). Během hypoxemie syntéza EPO prudce stoupá. Je pod kontrolou citlivého regulačního mechanismu v ledvinách, kde hraje roli transkripční faktor HIF-1alfa (hypoxia inducible factor-1) [4]. Ten proniká při hypoxii do jádra buněk ledvin, zde podléhá dimerizaci s HIF-1beta, váže se na HRE (hypoxia response element) a spouští transkripci a expresi celé řady genů, jak je schematicky znázorněno na obr. 1. Dostatečné množství progenitorů zajišťuje i transkripční faktor GATA 1, který blokuje jejich apoptózu výdejem antiapoptotického proteinu BclXL [4]. Kromě exprese genu pro erytropoetin se zvyšuje exprese genu pro VEGF se stimulací angiogeneze, exprese genu pro transferin zajišťující přísun železa, exprese genů stimulujících glykolytické enzymy a přísun energie. Za normoxie je HIF-1alfa za účasti tumor supresorového genu VHL (von Hippel-Lindau) prolylhydroxylázou oxidován a následně degradován ubiquitinovým-proteazomovým komplexem [5]. Reaktivitu regulačního centra snižují některé cytokiny, např. TNF, interferon gama a interleukin 1, které jsou zvýšeně exprimovány u různých onemocnění, především u maligních nádorů nebo u revmatoidní artritidy. Podílejí se tak na vzniku anémie u těchto chorob. Fyziologické hodnoty EPO jsou u mužů 9,6–26,0 U/l, u žen 11,0–30,0 U/l.
Stimulace erytropoezy není jedinou fyziologickou rolí EPO. Působí též na endoteliální buňky, kde zvyšuje expresi nitric acid syntázy ovlivňující regeneraci neuronů po ischemickém poškození, a je důležitým faktorem pro retinální fotoreceptory, a tím i protektivním faktorem diabetické retinopatie. Zlepšuje též funkci myokardu svým účinkem na regeneraci jeho mikrovaskulatury.
Epoetiny první generace
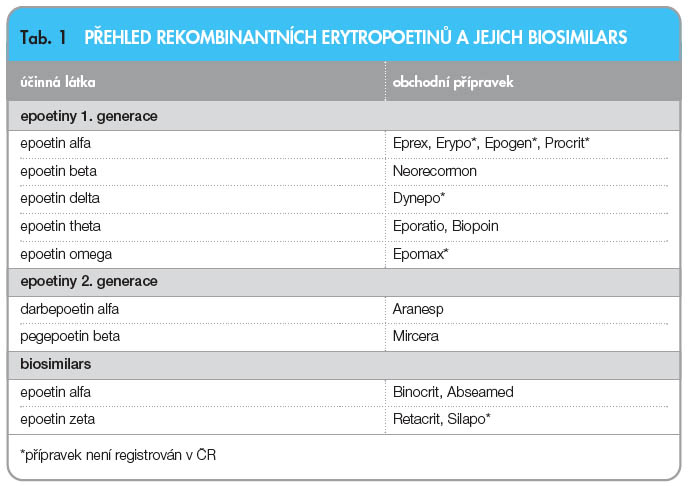 V roce 1987 byl EPO poprvé připraven rekombinantní technikou – vnesením genu pro EPO do buněk ovaria čínského křečka. V následujících letech se objevily na trhu první rekombinantní EPO – epoetiny alfa a beta [6]. Oba mají identickou sekvenci aminokyselin [7]. V dalších letech byly pak zavedeny do výroby další epoetiny – epoetin theta a omega, které se vzájemně liší větvením polysacharidové části molekuly [8]. Epoetin delta je prvním z epoetinů připravených na lidských buněčných liniích, ale jeho účinky i použití jsou analogické s ostatními epoetiny (tab. 1).
V roce 1987 byl EPO poprvé připraven rekombinantní technikou – vnesením genu pro EPO do buněk ovaria čínského křečka. V následujících letech se objevily na trhu první rekombinantní EPO – epoetiny alfa a beta [6]. Oba mají identickou sekvenci aminokyselin [7]. V dalších letech byly pak zavedeny do výroby další epoetiny – epoetin theta a omega, které se vzájemně liší větvením polysacharidové části molekuly [8]. Epoetin delta je prvním z epoetinů připravených na lidských buněčných liniích, ale jeho účinky i použití jsou analogické s ostatními epoetiny (tab. 1).
Biologické účinky
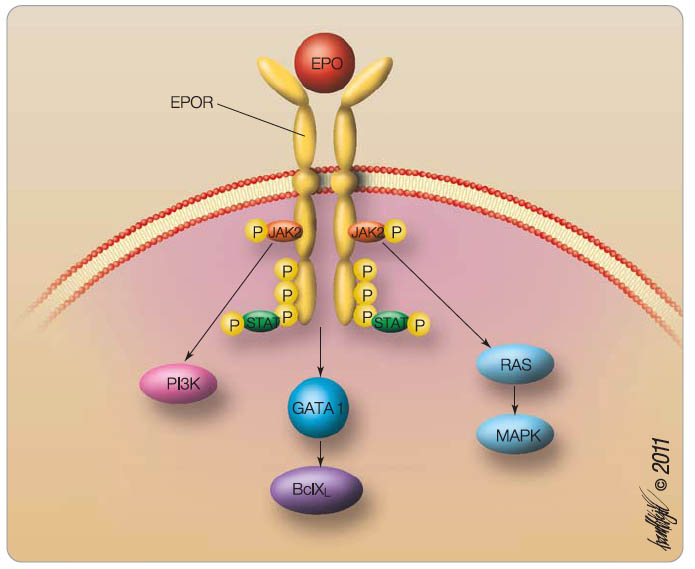 Biologická účinnost je u všech zmíněných epoetinů srovnatelná [9]. Podobně jako endogenní EPO se váží na cytokinové receptory (EPOR), které se nacházejí na progenitorech červené řady v kostní dřeni. Po vazbě epoetinu na extracelulární doménu receptoru se spustí transdukční kaskáda, která je znázorněna na obr. 2. Po internalizaci a intracelulární transdukci je komplex EPO-EPOR proteolyticky štěpen v lysozomech [10].
Biologická účinnost je u všech zmíněných epoetinů srovnatelná [9]. Podobně jako endogenní EPO se váží na cytokinové receptory (EPOR), které se nacházejí na progenitorech červené řady v kostní dřeni. Po vazbě epoetinu na extracelulární doménu receptoru se spustí transdukční kaskáda, která je znázorněna na obr. 2. Po internalizaci a intracelulární transdukci je komplex EPO-EPOR proteolyticky štěpen v lysozomech [10].
EPOR byly prokázány i na povrchu buněk některých nádorů. Z toho se usuzovalo, že léčba epoetiny může mít stimulační účinek na nádorový růst, což však se podařilo doložit pouze u nádorů ORL oblasti, nikoliv u jiných solidních nádorů [11]. Vzestup koncentrace EPO je závislý na aplikované dávce epoetinu.
Klinické využití
Klíčové uplatnění našly epoetiny v nefrologii, především u nefrektomovaných dialyzovaných pacientů, u nichž chybí hlavní zdroj přirozeného erytropoetinu [12]. Koncentrace EPO je snížená i u chronické renální insuficience a aplikace epoetinů může tak korigovat anémii i v předdialyzačním období [13]. Léčba epoetiny zlepšuje kvalitu života nemocných, i když na vzniku anémie se může podílet i nedostatek železa. Proto je u nemocných, u nichž koncentrace železa klesne pod hladinu 100 mg/l nebo kde je saturace transferinu nižší než 20 %, vhodná doplňková léčba železem. Dále lze epoetiny využít v hematologii po transplantaci kostní dřeně. Zde spolu s ostatními hematopoetickými růstovými faktory urychlují normalizaci krevního obrazu. Užitečné mohou být epoetiny i v léčbě anémie u thalasemie [14]. V onkologii se doporučují ke korekci anémie u nemyeloidních malignit (nehodgkinské lymfomy, mnohočetný myelom, chronická lymfatická leukemie) a u solidních nádorů po radioterapii nebo po chemoterapii. Zvláště účinné se jeví podání epoetinů po léčebných režimech obsahujících platinové deriváty, které svým nefrotoxickým účinkem snižují produkci EPO. Epoetiny alfa a beta lze použít též ke zvýšení výtěžnosti erytrocytů odebíraných před operací k následné autotransfuzi. V pediatrii jsou indikace k léčbě epoetiny podobné. Dávkování není jednotné, zpravidla se podává pacientům s renální insuficiencí 3krát týdně v dávce 30 IU/kg, u nádorových onemocnění se doporučují vyšší dávky.
Nežádoucí účinky
Léčba epoetiny je zpravidla dobře tolerována. Nejčastějším nežádoucím účinkem je hypertenze, trombotické příhody (trombóza shuntů), mohou se objevit bolesti kloubů, křeče, hypersenzitivní reakce, vzácně čistá aplazie červené řady – PRCA (pure red cell aplasia). Vzniká tehdy, pokud epoetin vyvolá tvorbu specifických neutralizačních protilátek proti epitopu proteinové části molekuly (která je identická s přirozeným EPO).
Epoetiny druhé generace
Snaha posílit biologickou efektivitu a trvání účinku epoetinů vedla ke hledání modifikace jejich molekul, která by zlepšila farmakokinetické parametry. V současné době jsou ke klinickému použití určeny dva epoetiny druhé generace.
Darbepoetin alfa má 5 sacharidových řetězců vázaných na dusík, ve srovnání se 3 řetězci u epoetinů první generace. Hyperglykosylace prodlužuje biologický poločas, snižuje afinitu k EPOR a zpomaluje internalizaci komplexu darbepoetin-EPOR endocytózou [15]. To prodlužuje setrvání darbepoetinu v cirkulaci a umožňuje jeho aplikaci v delších časových intervalech ve srovnání s epoetiny první generace. Darbepoetin se osvědčil jak v léčbě anémie u chorob ledvin, tak u nádorových onemocnění po protinádorové chemoterapii [16]. Dobré zkušenosti s darbepoetinem jsou též při stabilizování hodnot hemoglobinu u nemocných s myelodysplastickým syndromem, kde tento epoetin pomáhá zlepšovat kvalitu života a snižuje potřebu krevních transfuzí [17]. Tolerance léčby je velmi dobrá, nežádoucí účinky (hypertenze, trombóza) se vyskytují omezeně a jsou dobře zvládnutelné.
Pegepoetin beta (methoxy-polyethylenglykol-epoetin beta) je kovalentní konjugát epoetinu beta vytvořeného rekombinantní technologií s lineárním methoxy- polyethylenglykolem [18]. Má asi 45krát nižší afinitu k EPOR, pomaleji se váže, ale vazba je pevnější, což se projeví prodlouženým poločasem po nitrožilním i podkožním podání (140 hodin). Vazba snižuje imunogenitu. Nedochází k endocytóze, EPOR není degradován v lysozomu, zůstává na povrchu a může být opakovaně aktivován. Proto byl pegepoetin beta označován jako CERA (continuous EPO receptor activator). Nevýhodou trvalé stimulace může být postupná desenzitizace a down-regulace EPOR. Delší poločas umožňuje aplikaci pouze 1krát za 2–4 týdny. Je určen k léčbě anémie u chronické renální insuficience, ale dosud se nepoužíval v léčbě anémie u nádorových onemocnění. Častým nežádoucím účinkem je hypertenze, méně často trombózy, makulopapulózní exantém nebo reakce z přecitlivělosti.
Biosimilars epoetinů
Ekonomická náročnost léčby epoetiny vedla farmaceutické společnosti k přípravě analogických a lacinějších přípravků, jako jsou u chemicky definovaných látek tzv. generika.
Na rozdíl od chemicky definovaných léků nelze u biotechnologických farmak kvůli složitému výrobnímu procesu i vlastní struktuře molekul vyráběných po skončení patentové ochrany hovořit o generikách [19]. Americký FDA zvolil pro tato „biogenerika“ či biologické medicinální produkty termín „follow-on biologic“, v Evropě se používá termín biosimilars. Ve výrobním procesu mohou mezi originálními biotechnologickými léky a biosimilars vznikat rozdíly ve struktuře molekuly a jejich vlastnostech, každý výrobce používá poněkud odlišnou buněčnou linii. Proto vývoj biosimilars představuje značně složitý proces. Nejnáročnější je klinické testování, jež stanoví farmakokinetiku, farmakodynamiku a musí přinést spolehlivý doklad o podobnosti, stejné účinnosti s originální látkou a o její zaměnitelnosti. Požaduje se, aby nebyla odlišná ani aplikační cesta a spektrum nežádoucích účinků. Přes tuto ![Graf 1 Vzestup koncentrace hemoglobinu po léčbě HX575 (modrá křivka) a po léčbě srovnávacím epoetinem alfa (šedá křivka); podle [23] – Haag-Weber, et al., 2009.](https://www.remedia.cz/photo-a-28506---.jpg) náročnost a velmi přísná schvalovací kritéria schválila Evropská komise (EMA) již větší počet biosimilars ke klinickému použití [20, 21]. Kromě růstového hormonu a hematopoetického faktoru G-CSF (filgrastimu) jsou to biosimilars epoetinů. Biosimilar epoetinu alfa (HX575) byl registrován v Evropské unii (EMA) jako ekvivalentní přípravek epoetinu alfa v léčbě anémie u pacientů s chronickou renální insuficiencí léčených hemodialýzou. V kontrolované randomizované a dvojitě zaslepené multicentrické studii uskutečněné v 56 dialyzačních centrech byla potvrzena nejen terapeutická ekvivalence s komparátorovým epoetinem alfa, ale též identický bezpečnostní profil [22]. Převedení léčby z komparátorového epoetinu alfa na HX575 neovlivnilo stabilitu koncentrace hemoglobinu ani potřebnou velikost dávky. Účinnost a bezpečnost HX575 byla ověřena též při léčbě symptomatické anémie u pacientů se solidními nádory na 19 specializovaných onkologických pracovištích podle zásad správné klinické praxe [23]. Pacienti dostávali podkožně 3krát týdně 150 IU/kg tělesné hmotnosti HX 575, kontrolní skupina stejnou dávku porovnávacího epoetinu alfa. Léčebná odezva posuzovaná podle vzestupu koncentrace hemoglobinu byla v obou skupinách prakticky identická, viz graf 1. Biosimilar epoetinu zeta prokázal ve srovnávacích studiích rovněž identický biologický účinek a zaměnitelnost s referenčním epoetinem beta [24, 25].
náročnost a velmi přísná schvalovací kritéria schválila Evropská komise (EMA) již větší počet biosimilars ke klinickému použití [20, 21]. Kromě růstového hormonu a hematopoetického faktoru G-CSF (filgrastimu) jsou to biosimilars epoetinů. Biosimilar epoetinu alfa (HX575) byl registrován v Evropské unii (EMA) jako ekvivalentní přípravek epoetinu alfa v léčbě anémie u pacientů s chronickou renální insuficiencí léčených hemodialýzou. V kontrolované randomizované a dvojitě zaslepené multicentrické studii uskutečněné v 56 dialyzačních centrech byla potvrzena nejen terapeutická ekvivalence s komparátorovým epoetinem alfa, ale též identický bezpečnostní profil [22]. Převedení léčby z komparátorového epoetinu alfa na HX575 neovlivnilo stabilitu koncentrace hemoglobinu ani potřebnou velikost dávky. Účinnost a bezpečnost HX575 byla ověřena též při léčbě symptomatické anémie u pacientů se solidními nádory na 19 specializovaných onkologických pracovištích podle zásad správné klinické praxe [23]. Pacienti dostávali podkožně 3krát týdně 150 IU/kg tělesné hmotnosti HX 575, kontrolní skupina stejnou dávku porovnávacího epoetinu alfa. Léčebná odezva posuzovaná podle vzestupu koncentrace hemoglobinu byla v obou skupinách prakticky identická, viz graf 1. Biosimilar epoetinu zeta prokázal ve srovnávacích studiích rovněž identický biologický účinek a zaměnitelnost s referenčním epoetinem beta [24, 25].
Jiné přípravky s erytropoetickou aktivitou
Kromě rekombinantních EPO a jejich biosimilars lze erytropoezu stimulovat ještě jinými látkami – ESA (erythropoiesis-stimulating agents), z nichž většina je teprve ve fázi klinických zkoušek. Některé z nich se však jeví jako perspektivní.
Peginesatid je pegylovaný syntetický peptid s erytropoetickou aktivitou. Vazba na polyethylenglykol prodlužuje jeho poločas v cirkulaci, což umožňuje podávání ve 3–4týdenních intervalech [26]. Přípravek není imunogenní, dobře se toleruje. V léčbě anémie u dialyzovaných nemocných je stejně účinný jako epoetiny. Podobně příznivé výsledky byly publikovány i po léčbě nedialyzovaných nemocných. Peginesatid je stabilní při pokojové teplotě. Působí vzestup koncentrace hemoglobinu i v případech PRCA vzniklé po aplikaci epoetinů.
EMPs (erythropoietin mimetic peptides) jsou malé peptidy schopné aktivovat EPOR. Jsou méně potentní než přirozené ligandy, ale ve formě dimeru mají dostatečnou erytropoetickou aktivitu [27]. Jejich výhodou je možnost perorální aplikace a komplexní stimulace erytropoezy, včetně mobilizace železa. Nevýhodou, která by mohla omezit klinické využití, je imunogenita přípravku [28].
Inhibitory HIF prolylhydroxylázy se také označují jako HIF stabilizátory, neboť blokáda prolylhydroxylázy zamezí degradaci HIF-1alfa a zvýší transkripci závislou na HIF, což vede ke zvýšení koncentrace EPO [29]. Jak je patrno z obr. 1, je role HIF-1alfa mnohostranná a kromě erytropoezy je ovlivněna i transkripce angiogenních faktorů. Zkouší se přípravek s kódovým označením FG2216, kde po podání jedné perorální dávky došlo up-regulací genu pro EPO k dramatickému vzestupu koncentrace erytropoetinu (z 8 IU/ml na 240 IU/ml).
Závěr
Epoetiny i ostatní látky stimulující erytropoezu našly své uplatnění v klinické praxi a přispěly ke zlepšení kvality života nemocných. Skutečnost, že stimulace erytropoezy zvyšuje transportní schopnost pro kyslík, která prodlouží dobu do vyčerpání organismu při zátěži o více než 100 %, vedla ke zneužívání látek stimulujících erytropoezu pro doping ve vrcholovém sportu. Takové použití epoetinů však není bez rizika. Zvýšený hematokrit zvyšuje viskozitu krve a při současné dehydrataci po vyčerpávajícím výkonu hrozí vznik hyperviskózního syndromu, nebezpečí trombózy a embolie. Náhlá úmrtí sportovců po vrcholných výkonech jsou dokladem tohoto rizika.
Seznam použité literatury
- [1] Carnot P, Deflandre C. Sur l’activité hématopoietique des serum au cours de la régenération du sang. Acad Sci M 1906; 3: 384–389.
- [2] Erslev AJ. Humoral regulation of red cell production. Blood 1953; 8: 349–355.
- [3] Adam Z, Krejčí M, Vorlíček J. Erytropoetin v hematologii a onkologii. Vnitř Lék 1996; 42: 285–289.
- [4] Ferreira R, Ohneda K, Yamamoto M, et al. GATA1 function, a paradigm for transcription factors in hematopoiesis. Mol Cel Biol 2005; 25: 1215–1227.
- [5] Higgs DR, Wood WG. Erythropoiesis, p12–25 in: Offbrand AV. et al: Postgraduate Hematology 6th ed., 2011, Villey-Blackwell, Oxford.
- [6] Klener P, et al. Cytokiny ve vnitřním lékařství. Grada-Avicenum, Praha 1997.
- [7] Storring PI, Tiplady RJ, Gaines Das RE, et al. Epoetin alfa and beta differ in their erythropoietin isoform composition and biological properties. Brit J Haematol 1998; 100: 79–89.
- [8] Kandus BA, Varl J, Buturovic J, et al. A comparison between epoetin omega and epoetin alfa in the correction of anemia in hemodialysis patients: a prospective controlled study. Artur Organs 2002; 26: 91–97.
- [9] Jelkmann W. Efficacy of recombinant erythropoietins: is there unity of international units? Nephrol Dial Transplant 2009; 24: 1366–1368.
- [10] Štaud F. Molekulární farmakologie látek stimulujících erytropoézu. Remedia 2007, 17: 485–493.
- [11] La Montagne HR, Butler J, Marshall D, et al. Recombinant epoetin do not stimulate tumor growth in erytropoietin receptor-positive breast carcinoma. Mol Cancer Ther 2006, 2: 347–355.
- [12] Fishbane S. Anemia in chronic kidney diseases: status of new therapies. Curr Opin Nephrol Hypertens 2009; 18: 112–115.
- [13] Schmid H, Schiffl H. Erythropoiesis stimulating agents and anaemia of end-stage renal disease. Cardiovasc Hematol Agents Med Chem 2010; 8: 163–172.
- [14] Kumchev E, Koytchev R, Dimitrakov D, et al. Effect od epoetin zeta for correction of renal anemia in hemodialysis patients with thalassemia minor. Adv Ther 2008; 25: 1375–1378.
- [15] Minnerup J, Schabitz WR. Darbepoetin alfa and chronic kidney disease. N Engl J Med 2010; 362: 653–654.
- [16] Nagel S, Kellner O, Engel-Riedel W, et al. Addition of darbepoetin alfa to dose-dense chemotherapy: results from randomized phase II trial in small-cell lung cancer patients receiving carboplatin plus etoposide. Clin Lung Cancer 2011; 12: 62–69.
- [17] Giraldo P, Nomdedeu B, Loscertales J, et al. Darbepoetin alpha for the treatment of anemia in patients with myelodysplastic syndromes. Cancer 2006; 107: 2807–2816.
- [18] Curran MP, McCormack PL. Methoxy polyethylene glykol-epoetin beta: a review of its use in the management of anaemia associated with chronic kidney disease. Drugs 2008; 68: 1139–1156.
- [19] Svoboda T. Problematika originálních léčiv, generických přípravků a biosimilars. Záměny léků dnes a zítra s ohledem na riziko spojené s biotechnologiemi. Klin Onkol 2010; 23: 416–420.
- [20] Jelkmann W. Biosimilars epoetins and other „follow-on“ biologics: Update on the european experiences. Amer J Hematol 2010; 85: 771–780.
- [21] Macdougal IC. Biosimilar epoetins. Nephrol Dial Transplant 2009; 5: 1699–1700.
- [22] Niederwieser D, Schmitz S. Biosimilar agents in oncology/hematology: from approval to practice. Eur J Haematol 2011; 86: 277–288.
- [23] Haag-Weber M, Vetter A, Thyroff-Freisinger, et al. Theraputic equivalence, long-term efficacy and safety of HX575 in the treatment of anemia in chronic renal failure patients receiving hemodialysis. Clin Nephrol 2009; 72: 380–390.
- [24] Weigang-Kohlerov K, Vetter A, Thyroff-Fresinger: HX575, recombinant human epoetin alfa, for the treatment if chemotherapy-associated symptomatic anemia in patients with solid tumors. Onkologie 2009; 32: 168–174.
- [25] Brinks V, Hawe A, Basmeleh AH, et al. Quality of original and biosimilar epoetin products. Pharm Res 2011; 28: 386–393.
- [26] Hogan M. Peginesatide as safe and efficacious as epoetin in trials of dialysis patients. Nephrology Times 2010; 3: 8–10.
- [27] Vadas O, Hartley O, Rose K. Characterization of new multimeric eryhropoietin receptor agonists. Biopolymers 2008; 90: 496–502.
- [28] Agarwal N, Prchal JN. Erythropoietic agents and the elderly. Semin Hematol 2008; 45: 267–275.
- [29] Ivan M. HIF-prolyl hydroxylase inhibitors: From basic science to clinical trials. J Clin Med 2006; 1: 67–90.