Protichřipkové vakcíny
Chřipka je infekční virové onemocnění, které postihne každým rokem značnou část světové populace a je příčinou úmrtí tisíců lidí na celém světě. Přestože očkování představuje efektivní možnost prevence, je v naší zemi proočkovanost populace stále nízká. Očkování proti chřipce je sice indikováno především pro rizikové skupiny obyvatel, ale je možno očkovat další skupiny obyvatel, které z něj mohou mít prospěch. V současné době se intenzivně pracuje na vývoji nové „univerzální“ očkovací látky proti chřipce, která by odstranila nutnost každoročního přeočkování. Další výzkumné aktivity směřují k zavedení nových z imunologického hlediska výhodných způsobů aplikace. Není-li možno podat očkovací látku či se předpokládá nedostatečná účinnost očkovací látky, je vhodné použít terapeuticky nebo profylakticky protichřipková antivirotika. Kombinace vakcinace a antivirotik zvyšuje účinek prevence onemocnění a měla by být zvážena u imunodeficientních osob a dalších rizikových skupin. Očkování a protichřipková antivirotika by sehrály klíčovou úlohu v ochraně před pandemickým virem chřipky. Na vývoji vakcíny proti viru ptačí chřipky jako potenciálnímu kandidátu budoucí pandemie se intenzivně pracuje.
Úvod
Chřipka je nejčastější lidské infekční onemocnění, které každoročně postihne 10 % světové populace a v době pandemie téměř 40–50 %. Na rozdíl od běžných virových infekcí horních dýchacích cest je chřipka závažným onemocněním, které je každoročně příčinou úmrtí tisíců lidí na celém světě. Chřipka je však bohužel stále považována nejen laickou, ale i odbornou veřejností za banální infekci. U jinak zdravých osob probíhá toto onemocnění benigně, odlišná je situace u tzv. rizikových osob. Lidé starší 65 let s chronickým onemocněním dýchacích cest a srdce jsou častěji postiženi bakteriálními komplikacemi a také zhoršením základního onemocnění. Proto u nich často dochází k hospitalizacím a úmrtím. U mladších osob způsobuje onemocnění chřipkou značné ekonomické ztráty v důsledku pracovní neschopnosti.
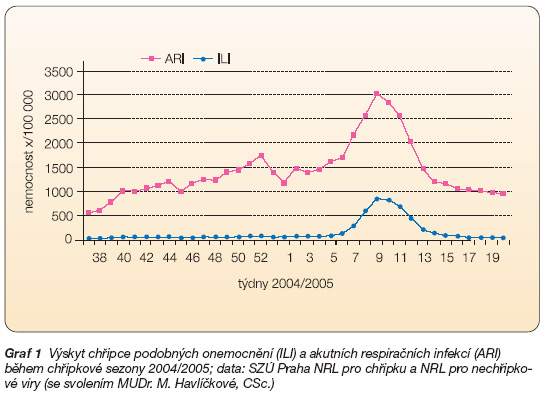
Mezi základní typické příznaky chřipky patří rychle stoupající horečka (v úvodní fázi onemocnění doprovázená zimnicí a třesavkou), bolest hlavy, svalů, pocit únavy, nechutenství. Současně se objevuje bolest v krku, pocit ucpaného nosu a suchý, dráždivý, bolestivý kašel, který velice často přechází po několika dnech v kašel produktivní. Při nekomplikovaném průběhu trvá chřipka 7–10 dní. Je velice důležité si uvědomit, že ne každé onemocnění projevující se kašlem, bolestí v krku, rýmou či lehce zvýšenou teplotou je chřipka. Aby se odlišily nemoci „z nachlazení" od závažnějších onemocnění, jako je např. chřipka, byl v České republice zaveden termín ILI (Influenza Like Illness) pro chřipce podobné onemocnění. ILI je charakterizováno horečkou 38 °C a vyšší, která je doprovázena kašlem, bolestí v krku nebo myalgií. Pokud dotyčný pacient neudává příznaky typické pro ILI, je jeho onemocnění řazeno do skupiny ARI (akutní respirační infekce). Graf 1 ukazuje, že ILI se vyskytují od konce ledna v souvislosti s výskytem skutečné chřipky [1].
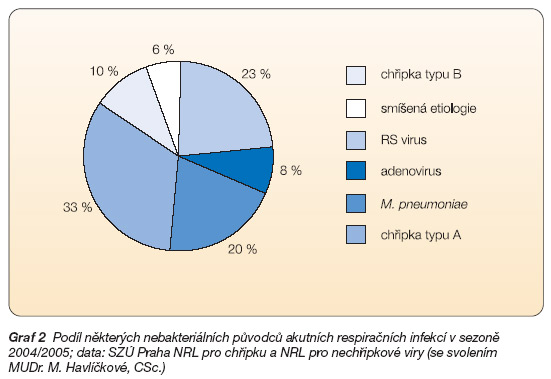
ARI se objevují již od podzimních měsíců. Jsou často způsobeny rinoviry, koronaviry a RS viry. Podíl některých nebakteriálních agens na struktuře akutních respiračních infekcí v sezoně 2004/2005 uvádí graf 2 [1].
Virus chřipky
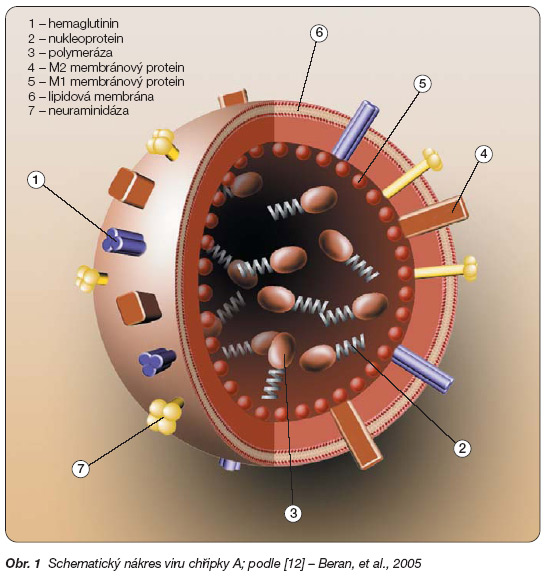
Chřipkové viry jsou tři – A, B a C. Virus chřipky A objevili v roce 1933 Smith, Laidlaw a Anders, virus chřipky B v roce 1939 Francis a virus chřipky C objevil Taylor v roce 1950. Jedná se o RNA viry čeledi Orthomyxoviridae, která obsahuje 4 rody – virus Influenzy A, Influenzy B, Influenzy C a Thogoto virus [2]. Základem viru je jednovláknová RNA, která vytváří virový nukleoprotein. Obal tvoří lipidová membrána, kterou prochází glykoproteinové antigeny hemaglutinin a neuraminidáza (obr. 1).
Tyto antigeny jsou rozhodující pro přesnou identifikaci virů chřipky v diagnostice i pro výrobu vakcín. Povrchový glykoproteinový antigen H (hemaglutinin) umožňuje uchycení viru na receptoru buňky, antigen N (neuraminidáza) je zodpovědný za uvolnění virio-nů z povrchu hostitelské buňky. Změna jednoho nebo obou povrchových antigenů se označuje jako shift, tato změna znamená vznik pandemie, protože v populaci nejsou přítomny protilátky proti nově vzniklému subtypu viru. Onemocnění chřipkou tak postihne velkou část světové populace. Téměř každoročně však dochází k drobným změnám viru, tzv. driftu. Proti takto změněnému viru se vytvářejí protilátky lehce odlišné od kmene, který způsoboval onemocnění v předchozím roce. Taková změna je příčinou téměř každoročních epidemií, které postihují jen část populace. Imunita k povrchovým glykoproteinovým antigenům, zvláště hemaglutininu, redukuje vznik infekce a zmírňuje průběh onemocnění. Infekce jedním subtypem viru navozuje částečnou protekci i proti virům jiného subtypu.
Očkovací látky proti chřipce – minulost a současnost
Díky poznání a identifikaci etiologických agens způsobujících epidemie bylo možno připravit očkovací látky proti chřipce. Ve 40. letech 20. století byly publikovány Salkem, Francisem, Pearsonem a spolupracovníky práce týkající se celosvětově prvního použití monovalentní inaktivované vakcíny proti chřipce, při němž byl virus získán pomnožením na kuřecích zárodcích. Tyto očkovací látky byly použity jen u vybraných skupin osob. V bývalé ČSR bylo také připraveno několik typů chřipkových vakcín. První zpráva pochází od Gallia, který v roce 1956 zpracoval přehled etiologie, epidemiologie a laboratorní diagnostiky chřipky. Tato vakcína byla připravena metodou absorpce na embryonální erytrocyty. Nevýhodou inaktivované celovirionové očkovací látky však byla značná reaktogenita. V 60. letech byla v ČSR používána československá očkovací látka Adinvira. Při výrobě této očkovací látky byla použita metoda zonální ultracentrifugace, která značně snížila množství balastních látek. Přesto tato vakcína vykazovala po intramuskulárním podání značnou reaktogenitu. Našla své uplatnění pro intranazální aplikace. Pokrokem v očkování v ČSR bylo v 70. letech zavedení celovirionové čištěné vakcíny Purinvira a štěpené vakcíny Subinvira vyráběné v 70. letech na Slovensku. V současné době existují tři základní typy chřipkových vakcín.
1. Inaktivovaná celovirionová trivalentní vakcína
Tato očkovací látka obsahuje celý inaktivovaný virus, vyznačuje se dobrou imunogenitou, ale také značnou reaktogenitou, za kterou je zodpovědný lipidový obal. V České republice není k dispozici pro očkování, ve světě zažívá určitou renesanci. V současnosti se aplikuje menší množství antigenu intradermálně.
2. Inaktivovaná štěpená „split" trivalentní vakcína
Vakcína je vyrobena z inaktivovaných virových částic, které jsou rozštípány a poté frakcionovány, reaktogenní lipidy jsou odstraněny. Vyznačuje se nízkou reaktogenitou a vysokou imunogenitou. Je to jeden z nejvíce vyráběných, distribuovaných a aplikovaných typů protichřipkových vakcín.
3. Inaktivovaná subjednotková trivalentní vakcína
Obsahuje pouze antigeny hemaglutinin a neuraminidázu, které jsou odděleny od nukleoproteinu i obalu viru. U tohoto typu vakcíny je zjišťována nízká reaktogenita.
Vzhledem k tomu, že se při chřipkových epidemiích často vyskytují dva typy viru chřipky A a ojediněle typ B, bylo doporučeno WHO používat trivalentní vakcíny se dvěma subtypy viru chřipky A a jedním subtypem viru chřipky B. Výběr je každoročně prováděn WHO, zvlášť pro severní a jižní polokouli, jedná se o kmeny příbuzné těm, které způsobovaly onemocnění nejčastěji v předchozím roce. Informaci o vhodných kmenech je třeba výrobcům vakcín dodat do února, šest až devět měsíců před distribucí. Očkovací látky se získávají z vysoce čištěných kmenů chřipky pomnožením na alantoidní tekutině kuřecích embryí. Inaktivace se provádí formalinem či b-propionlaktonem. Koncentrace antigenu vakcíny se zajišťuje před aktivací i po inaktivaci vysokoobrátkovou centrifugací. Každá dávka očkovací látky obsahuje v 0,5 ml 15 mg antigenu od každého ze tří typů pro daný rok zvolených virů; tedy celkově 45 mg antigenu hemaglutininu.
Pro chřipkovou sezonu 2006/2007 byly WHO doporučeny pro severní polokouli následující typy chřipkového viru:
– A/New Caledonia/20/99 (H1N1) – like virus: 15 mg
– A/Wisconsin/67/2005 (H3N2) – like virus (A/Wisconsin/67/2005 (H3N2) a A/Hiroshima/52/2005): 15 mg
– B/Malaysia/2506/2004 – like virus (B/ Malaysia/2506/2004 virus a B/Ohio/ 1/2005): 15 mg
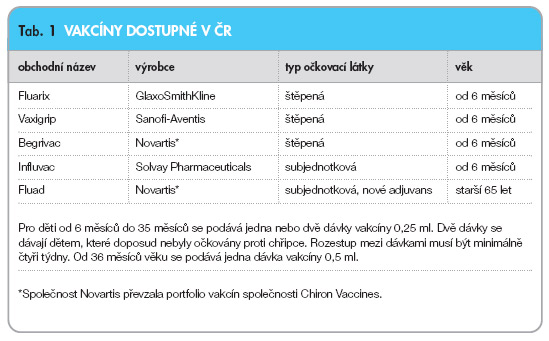
Přehled očkovacích látek dostupných v ČR uvádí tab. 1.
Imunologické aspekty vakcinace proti chřipce
Ideální očkovací látka proti chřipce by měla komplexně stimulovat imunitní systém. To znamená v prvé řadě vytvářet jak slizniční, tak celkovou protilátkovou odpověď a aktivovat T-buněčnou složku imunity. Ve skutečnosti doposud vyráběné vakcíny nejsou schopny stimulovat imunitní systém takto komplexně. Vždy totiž jedna z cest stimulace imunitního systému očkované osoby převažuje. Podle převládajícího typu antigenu je možno protichřipkové vakcíny rozdělit do několika tříd:
1. T-I (na thymu nezávislé) exogenní antigeny
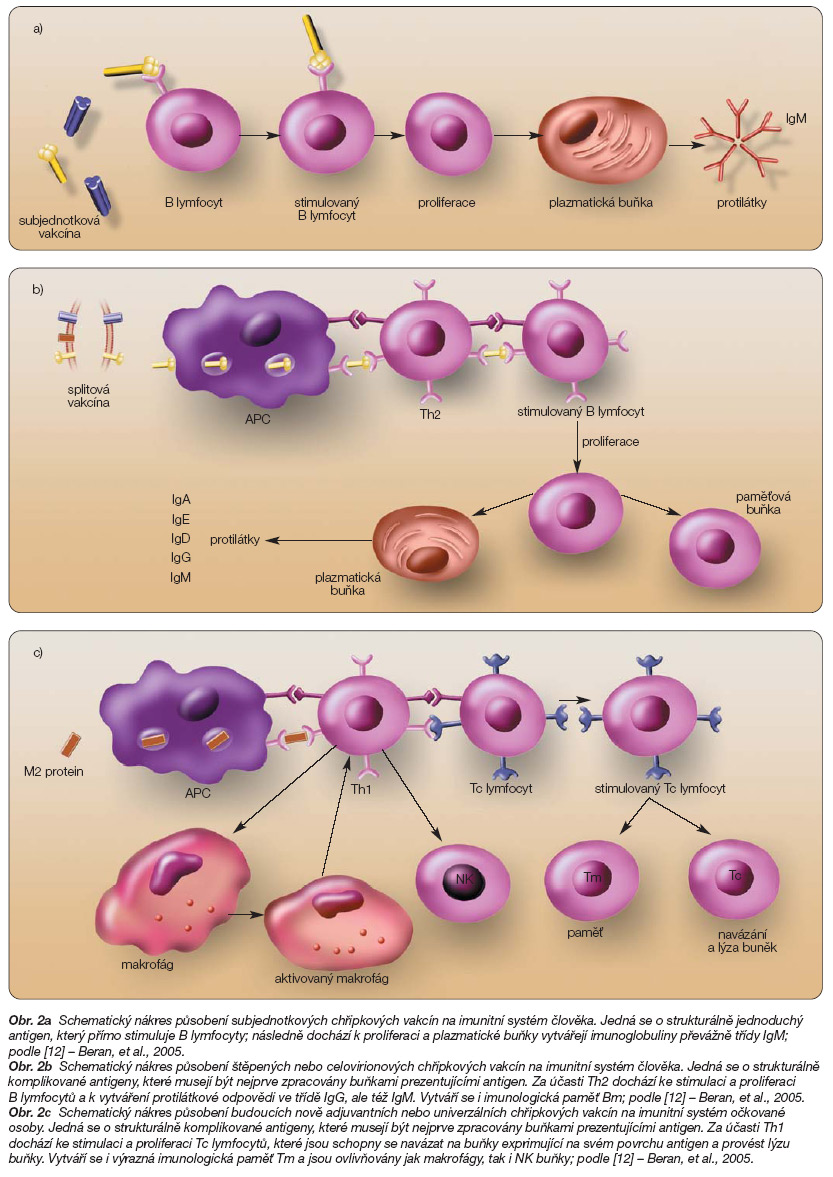
Prototypem jsou subjednotkové protichřipkové vakcíny. Tvorba protilátek je navozena přímou stimulací B lymfocytů (obr. 2a).
2. T-D (na thymu závislé) exogenní antigeny
Tvorba protilátek je navozena stimulací B lymfocytů za přítomnosti buněk prezentujících antigen a pomocných T lymfocytů. Inaktivované splitové nebo celovirionové vakcíny vyvolají tento typ imunitní odpovědi (obr. 2b).
3. T-D endogenní antigeny
Navozují specifickou buněčnou imunitu (obr. 2c). Navození tohoto typu imunity je cílem univerzální vakcíny nebo vakcín se sníženým obsahem antigenu, ale s adjuvans stimulujícím celulární imunitu. Oba směry jsou v současné době předmětem výzkumných aktivit.
V poslední době dochází jen k drobným změnám ve složení stávajících registrovaných protichřipkových očkovacích látek. Jsou ale též zaváděny nové aplikační formy. Intramuskulární podání očkovací látky bude v budoucnu s velkou pravděpodobností nahrazeno intradermální aplikací či podáním antigenu na povrch sliznice [3, 4]. Důvodem k této změně je skutečnost, že v kůži je podstatně větší množství APC než ve svalu. V praxi by to znamenalo možnost snížení objemu vakcíny i aplikovaného antigenu.
Imunitní odpověď po vakcinaci
Očkování proti chřipce se u dospělých osob a větších dětí provádí každý rok aplikací 1 dávky vakcíny intramuskulárně, nejlépe do deltového svalu ještě před chřipkovou epidemií. U dětí, které ještě nebyly očkovány a nepřišly do kontaktu s chřipkovým virem, se doporučuje podat další dávku za 28 dní. Jeden týden po očkování má protilátky asi 59 % osob, což potvrzuje domněnku o rychlé imunitní odpovědi. U většiny zdravých dospělých jedinců se protilátky vytvoří za 2 týdny po očkování a vrcholu hladiny v krvi dosahují mezi 4.–6. týdnem. Hladiny protilátek proti antigenům chřipkového viru postupně klesají a za 6 měsíců jsou poloviční proti postvakcinační hodnotě, měřitelné protilátky přetrvávají 3–6 let. Protilátky proti hemaglutininu jsou vždy ve vyšších hodnotách než proti neuraminidáze. Osoby starší 65 let vytvářejí nižší titry protilátek. V imunitním systému starších osob dochází k tzv. dysregulaci. Na této změně se podílí snížený počet periferních B lymfocytů, zvýšená tvorba autoprotilátek, nízká afinita a polyklonalita protilátek. Ve stáří dochází ke značné redukci prvního a částečně i druhého signálu.
Proočkovanost u nás a ve světě
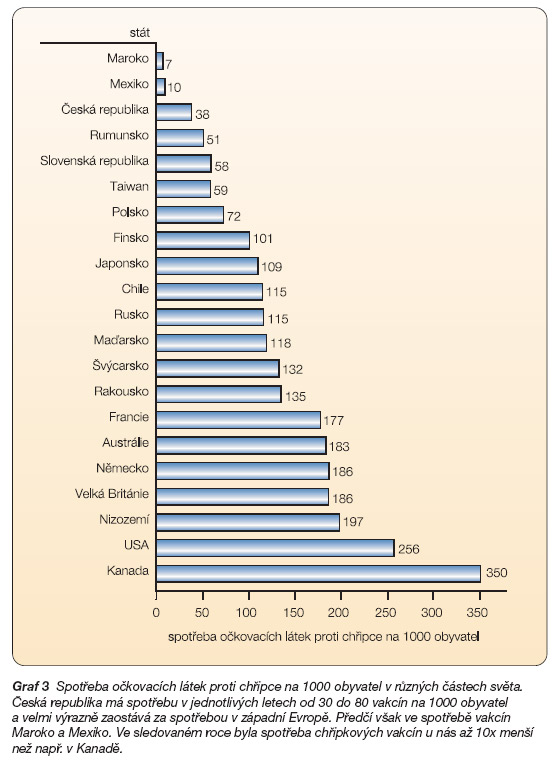
Proočkovanost populace je u nás stále nízká, pohybuje se okolo 4 %, zatímco v západoevropských zemích je výrazně vyšší, proočkováno je 10–15 % populace [5]. Imunizace proti chřipce v Kanadě je přibližně 10x vyšší než u nás.
Mezi hlavní důvody nízké proočkovanosti patří strach z nežádoucích účinků očkování, nezájem o tuto problematiku, neochota praktických lékařů poskytovat informace a v neposlední řadě i nutnost úhrady vakcíny. V sezoně 2002/2003 a 2003/2004 byla sledována proočkovanost populace proti chřipce v šesti evropských zemích. Tato studie si kladla za cíl zhodnotit proočkovanost ve dvou po sobě jdoucích chřipkových sezonách, zjistit nejčastější důvody, které vedou subjekty k tomu, že se nechají či naopak nenechají očkovat proti chřipce [6]. Sledování se zúčastnilo 20 118 subjektů. Procento očkovaných stouplo z 21,3 % v první sezoně na 23,2 % v průběhu druhé sezony.
Nejčastějším důvodem, proč se lidé nechali dobrovolně očkovat proti chřipce, bylo to, že považují chřipku za závažné onemocnění a chtěli tomuto onemocnění očkováním předejít. Dalším důvodem byla rada lékaře či zdravotní sestry, též obava z nákazy vlastní rodiny či přátel. Lidé, kteří se nenechali nikdy očkovat proti chřipce, nejčastěji uvedli jako důvod to, že neočekávají, že chřipkou onemocní, očkování jim nebylo nabídnuto či nebylo doporučeno praktickým lékařem. Ze studie vyplynulo, že široká veřejnost by byla mnohem více proočkována, kdyby se jí dostalo dostatečného množství informací o účinnosti a bezpečnosti očkovacích látek i o chorobě samotné. Praktický lékař je osobou, která by měla podat široké veřejnosti tyto informace a vysvětlit výhody očkování proti chřipce. Proočkovanost v různých státech světa je znázorněna v grafu 3 [5].
Reakce po očkování
Očkování je celkem dobře snášeno. Asi u 20 % očkovaných se projeví nezávažné nežádoucí reakce, jako je bolestivost v místě vpichu, otok či zarudnutí v místě vpichu, častá je únava několik hodin po očkování, horečka není častým symptomem po očkování.
Závažné nežádoucí reakce jsou velmi vzácné. V roce 1976 se v USA vyskytl v poměru 1 : 100 000 syndrom Guillain-Barr `e po očkování proti prasečí chřipce. Vzácnou závažnou reakcí, se kterou je třeba počítat, je anafylaktická reakce.
Kontraindikací očkování proti chřipce je akutní horečnaté onemocnění, přecitlivělost na kteroukoliv složku vakcíny (především na vaječnou bílkovinu nebo na polymyxin B, formalin či gentamicin), závažná reakce s alterací stavu po předchozí aplikaci vakcíny. Relativní kontraindikací je těhotenství; ve III. trimestru je možno očkovat.
Cílové skupiny pro očkování
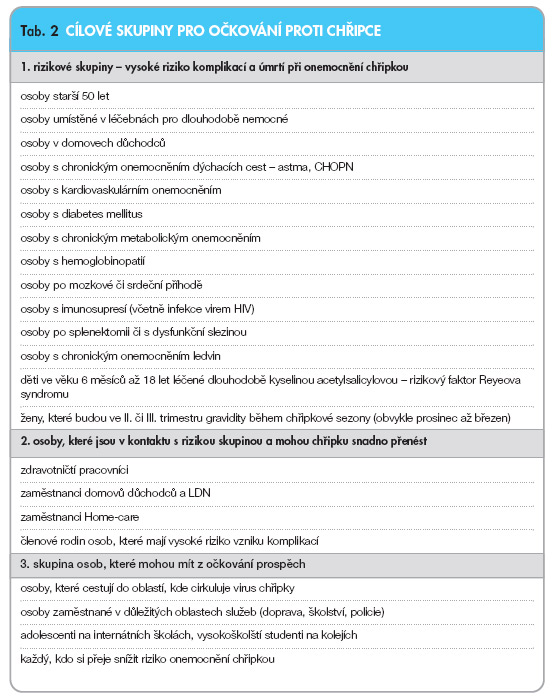
Očkování proti chřipce inaktivovanými komerčně dostupnými vakcínami je považováno za jedno z nejdůležitějších preventivních protiepidemických opatření. Očkování rizikových skupin výrazně přispívá ke snížení negativního dopadu případné chřipkové epidemie či pandemie na populaci jako celek. Úmrtí nejsou způsobena jen chřipkovým virem, nýbrž komplikacemi, zejména sekundární bakteriální pneumonií nebo dekompenzací srdečního či plicního onemocnění. V České republice je pravidelné očkování povinné a je vymezeno § 45 a následujícími zákona č. 258/2000 Sb. o ochraně veřejného zdraví. Vakcinace je v ČR zaměřena na osoby patřící do rizikových skupin podle vyhlášky MZ ČR č. 439/2000 Sb. Očkování proti infekčním nemocem ve znění vyhlášky 30/2004 Sb.: „Očkování proti chřipce se provede každý rok u fyzických osob umístěných v léčebnách pro dlouhodobě nemocné, domovech důchodců, domovech-penzionech pro důchodce. Očkování se provede též u fyzických osob umístěných v ústavech sociální péče, pokud tyto osoby trpí chronickými nespecifickými onemocněními dýchacích cest, srdce, cév a ledvin nebo diabetem." Pro tyto výše uvedené skupiny je očkování bezplatné, vakcína je centrálně nakupována MZ ČR a je distribuována lékařům na vyžádání prostřednictvím krajské hygienické stanice.
V současnosti je hrazeno očkování proti chřipce ze zdravotního pojištění všem osobám starším 65 let a osobám mladším, které trpí chronickým onemocněním srdce, plic, cév, ledvin a diabetem. Dále je očkování doporučeno osobám, které jsou důležité pro chod státu (policie, soudy, školy), ale není hrazeno ani MZ ČR ani zdravotními pojišťovnami.
Důležitá je i imunizace malých dětí proti chřipce. V průběhu chřipkové sezony 2003/2004, během níž dominovala driftová varianta viru A/Fujian/411/2002, došlo k výraznému nárůstu komplikací chřipky a mortality v dětském věku [7, 8]. Ve skupině 153 úmrtí spojených s onemocněním chřipkou u pacientů mladších 18 let byl průměrný věk 3 roky. 47 % procent zemřelých dětí bylo před onemocněním chřipkou zcela zdrávo. Nejvyšší mortalita byla u dětí mladších 6 měsíců. Nejčastěji stanovenou diagnózou před smrtí byla pneumonie (49 %), sepse či šok (34 %), laryngotracheobronchitida či krup (20 %), diseminovaná intravaskulární koagulopatie (12 %), bronchiolitida (8 %) a encefalopatie (6 %). Ze 102 bakteriálních vyšetření byla prokázána koinfekce bakteriemi ve 24 %, nejčastěji byl vykultivován Staphylococcus aureus, často rezistentní k meticilinu. Tato zjištění vedla k rozhodnutí Advisory Committee on Immunization Practices doporučit očkování proti chřipce každoročně pro děti ve věku 6–23 měsíců, těhotné ženy, všechny členy rodiny a pro osoby starající se o děti mladší než 6 měsíců [9]. Přehled cílových skupin očkování proti chřipce uvádí tab. 2 [10, 11].
Průkaz efektivnosti očkování proti chřipce
Ve Škoda Auto se pokusili vyhodnotit efektivitu očkování proti chřipce u mladé práceschopné populace. Do studie bylo zahrnuto 23 782 zaměstnanců, z nichž se 5079 nechalo v podzimních měsících roku 2000 očkovat vakcínou Begrivac. Onemocněním podobným chřipce onemocnělo 1,3 % osob ve skupině očkovaných, ve skupině neočkovaných 6,9 %, tzn. asi 5krát více. Efektivita vakcinace dosahovala 81,2 %. Očkování proti chřipce tak velmi výrazně snižuje nemocnost v období chřipkové epidemie.
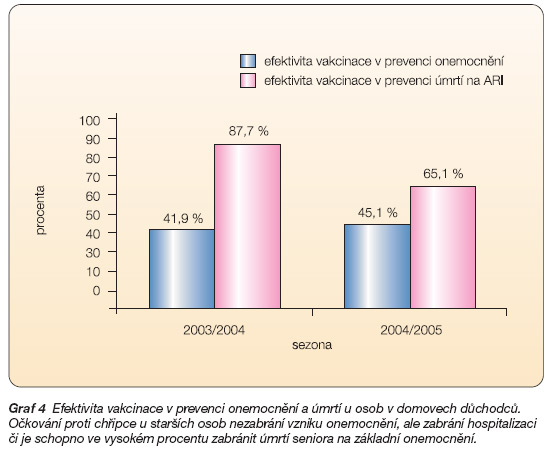
Mezi institucionalizovanými seniory byla provedena v chřipkových sezonách 2003/2004/2005 klinická studie k vyhodnocení efektivity imunizace proti chřipce. Bylo do ní zahrnuto během prvního roku 1250 osob a v druhém roce 1383 osob umístěných v 16 domovech důchodců v Královéhradeckém a Pardubickém kraji. V obou letech dosáhla efektivita vakcinace proti chřipce v prevenci akutní respirační infekce 41,9 %, resp. 45,1 % a v prevenci úmrtí na ARI 87,7 %, resp. 65,1 % (graf 4).
Výsledky prvního roku této studie potvrdily skutečnost, že očkování proti chřipce u starších osob nezabrání onemocnění, ale zabrání hospitalizaci či je schopno ve vysokém procentu zabránit úmrtí.
Na těchto číslech se významnou mírou podílí fakt, že v sezoně 2004/2005 se vyskytovalo ve sledovaném souboru 9krát více případů chřipky. Očkování ve skupině seniorů umístěných v domovech důchodců prokázalo velice pozitivní efekt ve snižování zdravotních následků způsobených chřipkovým virem [12].
Příprava univerzální vakcíny
V současné době používané očkovací látky proti chřipce typu A a B jsou neúčinné, dojde-li náhle k neočekávané změně chřipkového viru. Výrazným zdokonalením vakcinace proti chřipce by bylo zavedení očkovací látky, která je méně citlivá na vznik antigenních změn. Dosud provedené studie ukazují, že imunologické aktivity namířené proti relativně neměnným virovým strukturám mohou snížit počet onemocnění a úmrtnost na toto onemocnění. Nejslibnější se zdá být relativně stálá doména M2 proteinu [13]. M2 protein se podílí na regulaci pH viru poté, co se virus dostane do hostitelské buňky. Vodíkové ionty procházejí M2 kanálem, vstupují do intersticia virových částic a vyvolají odloučení M1 proteinu, což vede ke vstupu ribonukleoproteinu do buněčného jádra a k replikaci viru. M2 protein obsahuje malou neglykosylovanou doménu s 23 aminokyselinami – M2e. Tato oblast prokazuje jen malé změny mezi různými typy lidského chřipkového viru typu A. Studie prováděné u myší a fretek prokázaly, že specifické protilátky proti M2e, ačkoli nezabránily infekci, omezily následně replikaci viru, zmírnily onemocnění a snížily úmrtnost [14–18]. Doposud provedená pozorování prokázala minimální antigenní variabilitu M2e, specifické protilátky M2e omezují replikaci viru in vitro. Nové „univerzální" vakcíny obsahující M2 protein by pravděpodobně stimulovaly humorální i T-buněčnou imunitu a odstranily by nutnost každoročního přeočkování.
Vakcíny pro případ vzniku pandemické chřipky
Kromě každoročně se vyskytujících chřipkových epidemií se pravidelně objevují chřipkové pandemie. Pandemie chřipky se objeví vždy, když dojde ke vzniku nového chřipkového kmene s novým hemaglutininem, a rozšíří se v populaci, která se vyznačuje nízkou či nulovou imunogenitou k tomuto hemaglutininu. V průběhu 20. století bylo lidstvo postiženo pandemií chřipky celkem třikrát – v roce 1918, 1957 a 1968. Pandemie chřipky v roce 1918, nazývaná také Španělská chřipka, byla způsobena virem chřipky A H1N1 a vyžádala si na celém světě 40 milionů lidských životů [19]. V roce 1957 se v Asii objevil virus chřipky A H2N2. Dle odhadů podlehly tomuto onemocnění asi 2 miliony lidí. Třetí pandemie chřipky v 20. století začala v Honkongu v roce 1968, původcem byl virus H3N2. Tato pandemie byla mnohem mírnější než dvě předchozí. Důvodem se zdá být již existující imunita proti antigenu – neuraminidáze N2, který se vyskytoval v průběhu předchozí pandemie. Svou úlohu v mírnějším průběhu sehrála bezesporu i vyšší dostupnost penicilinových a makrolidových antibiotik.
V současné době není možno přesně určit, kdy se objeví nová pandemie chřipky a jaký typ viru ji způsobí. Nedojde-li k účinnému zásahu, způsobí příští pandemie chřipky dle odhadů jen ve Spojených státech 89–207 tisíc úmrtí, 314–734 tisíc hospitalizací a bude nutno ambulantně ošetřit desítky milionů pacientů [20]. Ekonomický dopad pandemie by byl obrovský.
Znovuobjevení se vysoce patogenního kmene H5N1 v Asii značně zvýšilo zájem o potenciální vznik pandemie a vedlo k vysoké úrovni přípravy pro případ, že by skutečně tato eventualita nastala. Dvě základní opatření by mohla pomoci pandemii předejít či značně snížit závažnost vzniklé pandemie chřipky. Jedná se o očkování a užití antivirotik. V současné době je většina aktivit zabývajících se vývojem vakcín zaměřena na virus H5N1 , příští chřipková pandemie však může být způsobena úplně jiným typem ptačího viru či virem vzniklým zkřížením genetické informace viru ptačí a lidské chřipky. Po objevení se ptačích chřipkových virů bylo učiněno několik pokusů o vytvoření vakcín proti těmto typům virů. Studie zabývající se inaktivovanými vakcínami proti H9N2 a H5 subtypům ukázaly, že tyto vakcíny jsou jen velice slabě imunogenní ve srovnání s epidemickými kmeny lidské chřipky H1N1 a H3N2. Aby například bylo dosaženo dostatečné hladiny neutralizačních protilátek, musí být inaktivovaná vakcína proti subtypu ptačí chřipky podána ve dvou dávkách a musí obsahovat adjuvans [21–26]. V současné době se intenzivně pracuje na přípravě vakcíny založené na genetické rekombinaci oslabeného viru A/AA/6/60ca a antigenů aktuálně cirkulujících ptačích virů.
Protichřipková antivirotika
Ačkoli očkování představuje hlavní způsob prevence proti chřipce, jsou situace, kdy je není možno použít. V takovém případě přicházejí na řadu velice účinná antivirotika. Během kterékoli chřipkové sezony může dojít ke změně viru – antigennímu driftu – poté co již bylo rozhodnuto o složení vakcíny pro danou chřipkovou sezonu. Tato náhlá změna viru může zapříčinit nízkou účinnost vakcíny a propuknutí onemocnění zejména v rizikové skupině osob. Z tohoto důvodu představují chřipková antivirotika důležitou součást prevence i léčby v období epidemie chřipky. V období pandemie by tyto přípravky zřejmě sehrály klíčovou úlohu.
V současné době existují na trhu čtyři dostupná protichřipková antivirotika. Jedná se o amantadin, rimantadin, zanamivir a oseltamivir. Amantadin a rimantadin jsou účinné v prevenci a léčbě proti chřipce typu A, nikoliv však proti typu B. Obě tyto látky blokují iontový kanál tvořený M2 proteinem, čímž zabrání vstupu vodíkových iontů; následkem je pak znemožnění replikace viru [27–29].
Podání těchto antivirotik může být spojeno s výskytem nežádoucích účinků. Amantadin stimuluje vyplavení katecholaminů, což má vliv na centrální nervový systém [30]. Z tohoto důvodu se mohou po podání vyskytnout deprese, nespavost či úzkost. Vysoké plazmatické koncentrace mohou způsobit halucinace či křeče [31–33]. Po užití amantadinu či rimantadinu bylo dále popsáno zvracení, nauzea, dyspepsie [32, 34]. Jsou-li tato antivirotika podávána profylakticky denně v rizikovém období, je účinnost srovnatelná s inaktivovanými vakcínami. V nedávném sledování bylo dosaženo průměrné efektivity amantadinu a rimantadinu v prevenci chřipky 61 % a 72 % [35]. Tato antivirotika jsou též účinná v terapii chřipky, je-li s léčbou započato v prvních dvou dnech onemocnění [32, 34]. Obě antivirotika jsou nyní dostupná jen pro perorální podání. Rezistence k amantadinu či rimantadinu může být způsobena mutací vedoucí ke změně aminokyseliny v M2 kanálu [28, 29]. Kmeny, které jsou rezistentní k amantadinu, jsou rezistentní k ribavirinu a naopak. K vývoji takto rezistentních kmenů dochází velice rychle během léčby asi u 23–35 % pacientů [36]. Vysoká rezistence k inhibitorům M2 kanálu byla zaznamenána nedávno u chřipkového viru typu A H3N2 v několika asijských zemích, v Severní Americe i v Evropě [37]. Tyto rezistentní kmeny se velice rychle šíří v domovech důchodců a v kolektivech [37].
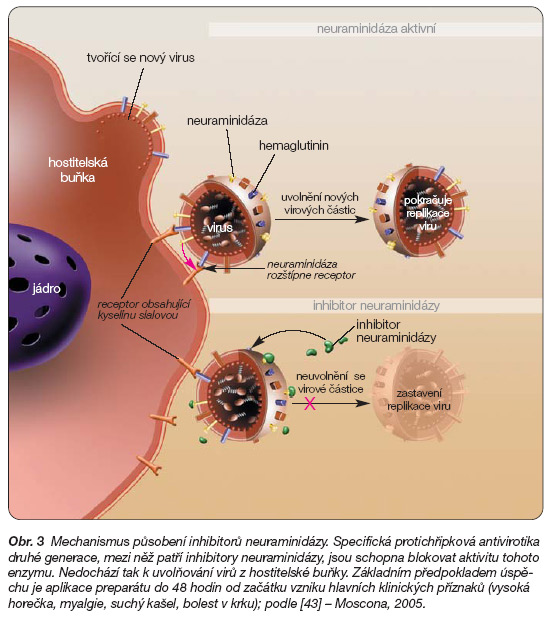
Druhou skupinu chřipkových antivirotik tvoří zanamivir a oseltamivir. Obě tyto látky působí stejným mechanismem a stejně efektivně na chřipku typu A i B [38–42]. Jedná se o inhibitory neuraminidázy (obr. 3).
Neuraminidáza hraje klíčovou úlohu v proniknutí viru do buňky a v uvolnění viru z infikované buňky. Inhibice neuraminidázy předchází infekci a redukuje závažnost onemocnění. Pokusy na zvířatech poukazují na skutečnost, že neuraminidáza hraje úlohu v synergismu mezi infekcí způsobenou virem Influenzy a Streptoccocus pneumoniae, což vysvětluje důvod snížení výskytu bakteriální pneumonie jako sekundární komplikace v průběhu terapie inhibitory neuraminidázy [43].
Zanamivir je v současné době dostupný pouze pro inhalační podání, oseltamivir je podáván perorálně. Z nežádoucích účinků se v průběhu užívání oseltamiviru nejčastěji objevuje nauzea a zvracení [44]. Podání zanamiviru by mělo být zváženo u pacientů trpících chronickým respiračním onemocněním, jelikož může vyvolat bronchospasmus [45]. Oba preparáty jsou doporučovány pro léčbu chřipky u pacientů, u kterých netrvají příznaky onemocnění déle než dva dny.
Na základě publikovaných výsledků je patrné, že příznaky onemocnění odezněly o 1–1,5 dne dříve ve skupině léčených osob ve srovnání se skupinou, které bylo podáno placebo [40–42]. V některých studiích došlo i k poklesu četnosti komplikací, jako je sinusitida, purulentní bronchitida, otitis media a další vyžadující antibiotickou terapii [40–42]. Obě látky byly též účinné v prevenci onemocnění za předpokladu, že byly podány před expozicí chřipkovému viru v průběhu epidemie.
Mutace vedoucí k rezistenci k inhibitorům neuraminidázy se objevila asi u 1,5 % pacientů léčených oseltamivirem. Virus influenzy A H5N1 se záměnou aminokyseliny v neuraminidáze způsobující vysokou rezistenci k oseltamiviru byl izolován od 2 z 8 vietnamských pacientů během terapie oseltamivirem. Obě pacientky zemřely na chřipku typu A (H5N1), a to i přes včasné zahájení terapie u jedné z nich. Tato pozorování upozorňují na možnost vzniku rezistence, která se může objevit v průběhu terapie oseltamivirem a může být provázena zhoršením klinického stavu. V takovémto případě by měla být terapie chřipky typu A (H5N1) doplněna o další antivirotika [46].
Na základě doposud získaných poznatků je možno formulovat obecná doporučení pro použití antivirotik v prevenci a léčbě influenzy. Profylaxe by měla být podána osobám, pro které představuje chřipka riziko závažných komplikací a které z různého důvodu nebyly očkovány. Osoby s imunodeficitem by měly být očkovány, ale vzhledem k nízké imunitní odpovědi by jim též měla být podávána profylakticky antivirotika v období epidemie. Profylaxe antivirotiky by měla být zvážena i u dalších skupin osob, jelikož kombinace očkování a profylaxe antivirotiky výrazně zvyšuje ochranu proti tomuto onemocnění [11]. V současné době je pro profylaxi onemocnění chřipkou typu A doporučován amantadin či rimantadin. Pro prevenci chřipky typu A se běžně nepoužívají oseltamivir a zanamivir, důvodem je vysoká cena obou přípravků. Pro prevenci onemocnění chřipkou typu B může být podán oseltamivir či zanamivir.
Léčba chřipky by měla být zahájena u osob z rizikových skupin bez ohledu na to, zda byly či nebyly očkovány. Účinnost léčby byla prokázána, byla-li zahájena do 2 dnů po začátku příznaků, za logické se však považuje zahájit léčbu i u pacientů s 3–4denní anamnézou chřipkovitého onemocnění, jedná-li se o osoby rizikové, jelikož mohou mít z léčby značný prospěch.
Pro léčbu chřipky je schválen amantadin u dospělých, není doporučován u dětí do dvanácti let. Rimantadin je schválen pro léčbu a profylaxi chřipky typu A u dospělých, pro profylaxi chřipky typu A u dětí starších jednoho roku.
Zanamivir je schválen pro dospělé a děti starší dvanácti let, oseltamivir je v současné době dostupný pro dospělé osoby ve formě tobolek, pro děti starší jednoho roku ve formě perorální suspenze. Přestože je cena inhibitorů neuraminidázy vyšší, jejich užití je preferováno vzhledem k působení proti viru chřipky typu B, nižšímu výskytu komplikací a nižšímu riziku vzniku rezistence.
Závěr
Očkování proti chřipce představuje dnes velice účinnou možnost prevence proti chřipce. Je nezbytné takto chránit zejména rizikové skupiny pacientů, ale i zdravé osoby, pro které chřipka v době epidemie znamená značné ekonomické ztráty způsobené pracovní neschopností. Vakcinace u mladých osob zabrání onemocnění, u osob starých onemocnění nezabrání, omezí však závažnost onemocnění, sníží počet hospitalizací a úmrtnost. Není-li možno očkovat nebo se předpokládá, že vakcinace by nemusela být dostatečně účinná, měla by být podána ve skupině rizikových osob protichřipková antivirotika. Kombinace očkování a profylaxe antivirotiky zvyšuje ochranu proti chřipce.
Práce na publikaci byla podporována Výzkumným záměrem Fakultní nemocnice Hradec Králové MZO 00179906.
Obr. 1 Schematický nákres viru chřipky A; podle [12] – Beran, et al., 2005
Obr. 2a Schematický nákres působení subjednotkových chřipkových vakcín na imunitní systém člověka. Jedná se o strukturálně jednoduchý antigen, který přímo stimuluje B lymfocyty; následně dochází k proliferaci a plazmatické buňky vytvářejí imunoglobuliny převážně třídy IgM; podle [12] – Beran, et al., 2005.
Obr. 2b Schematický nákres působení štěpených nebo celovirionových chřipkových vakcín na imunitní systém člověka. Jedná se o strukturálně komplikované antigeny, které musejí být nejprve zpracovány buňkami prezentujícími antigen. Za účasti Th2 dochází ke stimulaci a proliferaci B lymfocytů a k vytváření protilátkové odpovědi ve třídě IgG, ale též IgM. Vytváří se i imunologická paměť Bm; podle [12] – Beran, et al., 2005.
Obr. 2c Schematický nákres působení budoucích nově adjuvantních nebo univerzálních chřipkových vakcín na imunitní systém očkované osoby. Jedná se o strukturálně komplikované antigeny, které musejí být nejprve zpracovány buňkami prezentujícími antigen. Za účasti Th1 dochází ke stimulaci a proliferaci Tc lymfocytů, které jsou schopny se navázat na buňky exprimující na svém povrchu antigen a provést lýzu buňky. Vytváří se i výrazná imunologická paměť Tm a jsou ovlivňovány jak makrofágy, tak i NK buňky; podle [12] – Beran, et al., 2005.
Obr. 3 Mechanismus působení inhibitorů neuraminidázy. Specifická protichřipková antivirotika druhé generace, mezi něž patří inhibitory neuraminidázy, jsou schopna blokovat aktivitu tohoto enzymu. Nedochází tak k uvolňování virů z hostitelské buňky. Základním předpokladem úspěchu je aplikace preparátu do 48 hodin od začátku vzniku hlavních klinických příznaků (vysoká horečka, myalgie, suchý kašel, bolest v krku); podle [43] – Moscona, 2005.
Graf 1 Výskyt chřipce podobných onemocnění (ILI) a akutních respiračních infekcí (ARI) během chřipkové sezony 2004/2005; data: SZÚ Praha NRL pro chřipku a NRL pro nechřipkové viry (se svolením MUDr. M. Havlíčkové, CSc.)
Graf 2 Podíl některých nebakteriálních původců akutních respiračních infekcí v sezoně 2004/2005; data: SZÚ Praha NRL pro chřipku a NRL pro nechřipkové viry (se svolením MUDr. M. Havlíčkové, CSc.)
Graf 3 Spotřeba očkovacích látek proti chřipce na 1000 obyvatel v různých částech světa. Česká republika má spotřebu v jednotlivých letech od 30 do 80 vakcín na 1000 obyvatel a velmi výrazně zaostává za spotřebou v západní Evropě. Předčí však ve spotřebě vakcín Maroko a Mexiko. Ve sledovaném roce byla spotřeba chřipkových vakcín u nás až 10x menší než např. v Kanadě.
Graf 4 Efektivita vakcinace v prevenci onemocnění a úmrtí u osob v domovech důchodců. Očkování proti chřipce u starších osob nezabrání vzniku onemocnění, ale zabrání hospitalizaci či je schopno ve vysokém procentu zabránit úmrtí seniora na základní onemocnění.
Seznam použité literatury
- [1] Havlíčková M, Otavová M, Kynčl J, et al. Surveillance akutních respiračních infekcí (ARI) v České republice v sezoně 2004/2005. Zprávy Centra Epidemiol Mikrobiol 2005;14/6: 286–293.
- [2] Luke CJ, Subbarao K. Vaccines for Pandemic Influenza. Emerging Infectious Diseases 2006; 12: 66–72.
- [3] Belshe RB, Mendelman PM, Treanor J, et al. The efficacy of live attenuated, cold–adapted, trivalent, intranasal influenza virus vaccine in children. N Engl J Med 1998; 338: 1405–1412.
- [4] Belshe RB, Gruber WC, Mendelman PM, et al. Efficacy of vaccination with live attenuated, cold–adapted, trivalent, intranasal influenza virus vaccine against a variant (A/Syndey) not contained in the vaccine. J Pediatr 2000; 136: 168–175.
- [5] Essen van GA, Palache AM, Forleo E, Fedson DS. Influenza vaccination in 2000: recommendations and vaccine use in 50 developed and rapidly developing countries. Vaccine 2003; 21: 1780–1785.
- [6] Szucs TD, Müller D. Influenza vaccination coverage rates in five European countries – a population based cross – sectional analysis of two consecutive influenza seasons. Vaccine 2005; 23: 5055–5063.
- [7] Podewils LJ, Liedtke LA, McDonald LC, et al. A national survey of severe influenza-associated complications among children and adults. Clin Infect Dis 2005; 40: 1693–1696.
- [8] Bhat N, Wright JG, Broder KR, et al. Influenza associated deaths among children in the UnitedStates, 2003–2004. N Engl J Med 2005; 353: 2559–2567.
- [9] Centers for Disease Control. Prevention and control of influenza. MMWR Morb Mortal Wkly Rep 2005; 54: 1–40.
- [10] Prevention and control of influenza: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep 2000; 49 (RR-3): 1–38.
- [11] Couch RB. Prevention and Treatment of Influenza. N Engl J Med 2000; 343: 1778–1787.
- [12] Beran J, Havlík J. Chřipka – klinický obraz–prevence-léčba 2005. Maxdorf Jesenius, 2. vyd. Praha, 2005.
- [13] Gerhard W, Mozdzanowska K, Zharikova D. Prospects for Universal Influenza Virus Vaccine. Emerging Infectious Diseases 2006; 12: 569–574.
- [14] Frace AM, Klimov AI, Rowe T, et al. Modified M2 proteins produce heterotypic immunity against influenza A virus. Vaccine 1999; 17: 2237–2244.
- [15] de Filette M, Min Jou W, Birkett A, et al. Universal influenza A vaccine: optimization of M2 based constructs. Virology 2005; 337: 149–161.
- [16] Mozdzanowska K, Feng J, Eid M, et al. Induction of influenza type A virus specific resistance by immunization of mice with a synthetic multiple antigenic peptide vaccine that contains ectodomains of matrix protein 2. Vaccine 2003; 21: 2616–2626.
- [17] Fan J, Liang X, Horton MS, et al. Preclinical study of influenza virus A M2 peptide conjugate vaccines in mice, ferrets, and rhesus monkeys. Vaccine 2004; 22: 2993–3003.
- [18] Liu W, Li H, Chen YH. N- terminus of M2 protein could induce antibodies with inhibitory activity against influenza virus replication. FEMS Immunol Med Microbiol 2003; 35: 141–146.
- [19] Johnson NP, Mueller J. Updating the accounts: global mortality of the 1918–1920 “Spanish“ influenza pandemic. Bull Hist Med 2002; 76: 105–115.
- [20] Meltzer MI, Cox NJ, Fukuda K. The economic impact of pandemic influenza in the United States: priorities for intervention. Emerging Infectious Diseases 1999; 5: 659–671.
- [21] Hehme N, Engelmann H, Kunzel W, et al. Pandemic preparedness: lessons learnt from H2N2 and H9N2 candidate vaccines. Med Mikrob Immunol 2002; 191: 203–208.
- [22] Stephenson I, Nicholson KG, Gluck R, et al. Safety and antigenicity of whole virus and subunit influenza A /HongKong/1073/99 (H9N2) vaccine in healthy adults phase I randomised trial. Lancet 2003; 362: 1959–1966.
- [23] Nicholson KG, Colegate AE, Podda A, et al. Safety and antigenicity of non-adjuvanted and MF59 – adjuvanted influenza A/Duck/Singapore/97 (H5N3) vaccine: a randomised trial of two potential vaccines against H5N1 influenza. Lancet 2001; 357: 1937–1943.
- [24] Stephenson I, Nicholson KG, Colegate A, et al. Boosting immunity to influenza H5N1 with MF59-adjuvanted H5N3 A /Duck/Singapore/97 vaccine in primed human population. Vaccine 2003; 21: 1687–1693.
- [25] Stephenson I, Bugarini R, Nicholson KG, et al. Cross-reactivity to highly pathogenic avian influenza H5N1 viruses after vaccination with nonadjuvanted and MF59-adjuvanted influenza A/Duck/ Singapore /97 (H5N3) vaccine: a potential priming strategy. J Infect Dis 2005; 191: 1210–1215.
- [26] Treanor JJ, Wilkinson BE, Masseoud F, et al. Safety and immunogenicity of a recombinant hemagglutinin vaccine for H5 influenza in humans. Vaccine 2001; 19: 1732–1737.
- [27] Bui M, Whittaker G, Helenius A. Effect of M1 protein and low pH on nuclear transport of influenza virus ribonucleoproteins. J Virol 1996; 70: 8391–8401.
- [28] Hay AJ. The action of adamantanamines against influenza A viruses: inhibition of the M2 ion channel protein. Semin Virol 1992; 3: 21–30.
- [29] Tosteson MT, Pinto LH, Holsinger LJ, et al. Reconstitution of the influenza virus M2 ion channel in lipid bilayers. J Membr Biol 1994; 142: 117–126.
- [30] Vernier VG, Harmon JB, Stump JM, et al. The toxicologic and pharmacologic properties of amantadine hydrochloride. Toxicol Appl Pharmacol 1969; 15: 642–665.
- [31] Couch RB. Respiratory virus infections. In: Galasso GJ, Whitley RJ, Merigan TC, eds. Antiviral agents and human viral diseases. 4th ed. Philadelphia: Lippincott-Raven, 1997; 369–413.
- [32] Symmetrel (amantadine hydrochloride). Chadds Ford, Pa.: Endo Pharmaceuticals, 1998 (package insert).
- [33] Dolin R, Reichman RC, Madore HP, et al. A controlled trial of amantadine and rimantadine in the prophylaxis of influenza A infection. N Engl J Med 1982; 307: 580–584.
- [34] Flumadine (rimantadine hydrochloride). St. Louis: Forest Pharmaceuticals, 1998 (package insert).
- [35] Demicheli V, Jefferson T, Rivetti D, et al. Prevention and early treatment of influenza in healthy adults. Vaccine 2000; 18: 957–1030.
- [36] Hayden FG. Amantadine and rimantadine – clinic aspects. In: Richman DD, ed. Antiviral drug resistance. New York, John Wiley, 1996; 65–77.
- [37] Hayden FG. Respiratory viral threats. Curr Opin Infect Dis 2006; 19: 169–178.
- [38] Kim CU, Lew W, Williams MA, et al. Influenza neuraminidase inhibitors possessing a novel hydrophobic interaction in the enzyme active site: design, synthesis, and structural analysis of carbocyclic sialic acid analogues with potent anti-influenza activity. J Am Chem Soc 1997; 119: 681–690.
- [39] von Itzstein M, Wu W-Y, Kok GB, et al. Rational design of potent sialidase – based inhibitors of influenza virus replication. Nature 1993; 363: 418–423.
- [40] Hayden FG, Osterhaus ADME, Treanor JJ, et al. Efficacy and safety of neuraminidase inhibitor zanamivir in the treatment of influenza virus infections. N Engl J Med 1997; 337: 874–880.
- [41] Management of Influenza in the Southern Hemisphere Trialists Study Group. Randomised trial of efficacy and safety of inhaled zanamivir in treatment of influenza A and B virus infections. Lancet 1998; 352: 1877–1881.
- [42] Hedrick JA, Barzilai A, Behre U, et al. Zanamivir for treatment of symptomatic influenza A and B infection in children five to twelve years of age: a randomized controlled trial. Pediatr Infect Dis J 2000; 19: 410–417.
- [43] Moscona A. Neuraminidase Inhibitors for Influenza. N Engl J Med 2005; 353: 1363–1373.
- [44] Tamiflu (oseltamivir phosphate) capsules. Nutley N.J.: Roche Laboratories, 2000 (package insert).
- [45] Relenza (zanamivir for inhalation). Research triangle Park N.C.: Glaxo Wellcome, 1999 (package insert).
- [46] de Jong MD, Thanh TT, Khanh TH, et al. Oseltamivir Resistance during Treatment of Influenza A (H5N1) Infection. N Engl J Med 2005; 353: 2667–2672.