Průlomová bolest
Souhrn:
Za průlomovou bolest (PB) označujeme přechodné zvýšení intenzity potíží u pacientů trpících chronickou bolestí (CHB), u nichž je jinak zaznamenána relativně stabilní úleva od CHB při její základní léčbě. Průlomová bolest může být způsobena určitou činností nemocného (například pohyb nebo kašel), avšak může vzniknout také bez jasné příčiny. Rozvoj PB je vysoce variabilní a její prevalence u pacientů s CHB se pohybuje mezi 40‒90 %. Bolest má většinou rychlý nástup a vrcholu dosahuje mezi 5‒30 minutami svého trvání, které obvykle nepřesahuje jednu hodinu. Průlomová bolest může mít nociceptivní nebo neuropatický charakter, ale může být i smíšená. Velmi důležité je její správné a včasné rozpoznání, neboť PB je převážně velmi silná a významně ovlivňuje kvalitu života pacientů. V posledních letech byl v České republice do léčby PB zaveden transmukózní fentanyl, který se řadí do skupiny rychle působících silných opioidů. Transmukózní fentanyly díky svým lipofilním vlastnostem velmi dobře procházejí skrze mukózu a hematoencefalickou bariéru, a proto po jejich aplikaci dochází k rychlé úlevě od bolesti. V článku jsou popsány rovněž další lékové i nelékové možnosti terapie PB.
Key words: chronic pain, breakthrough pain, diagnostics, treatment, opioids, transmucosal fentanyl.
Summary:
Breakthrough pain (BTP) is a transient exacerbation of pain experienced by chronic pain patients with relatively stable and adequate control of their baseline pain. This pain may be caused by actions of the patient such as movement or coughing but may occur for no identifiable reason. BTP is highly variable, with a prevalence ranging from 40% to 90%. Its onset is usually rapid, the time to its peak severity ranging from 5 to 30 min. Usually, it doesn’t last for more than 60 min. BTP may be nociceptive, neuropathic or a mixture of both. BTP is often severe and can greatly interfere with all aspects of daily living. It is very important to identify BTP correctly and in time. Rapid acting transmucosal fentanyl formulations have been introduced in the past few years for the treatment of BTP in the Czech Republic. Transmucosal fentanyl, a lipophilic drug, is capable of a fast passage through the mucosa and then across the blood‑brain barrier to provide analgesia quickly. In this article, we also describe other drug and non‑drug treatment possibilities of dealing with BTP.
Úvod
Termín průlomová bolest (PB) poprvé použili Portenoy a Hagen v roce 1989 [1]. Za průlomovou bolest (angl. breakthrough pain), také někdy nazývanou „bolest z pozadí“, považujeme náhlé, přechodné a krátkodobé vzplanutí bolesti, jež se objevuje u pacientů i přes jejich trvalou léčbu opioidy (tedy preventivně nastavenou terapii ke zvládnutí chronické bolesti). Dostatečně kontrolovaná léčba základní chronické bolesti je nezbytná k tomu, aby bylo možno použít rychle působící silné opioidy pro terapii PB. Každá PB by měla být posouzena komplexně s přihlédnutím k charakteru, intenzitě bolesti a frekvenci bolestivých atak. Léčba PB se liší u bolesti s rychlým nebo s pomalým nástupem bolestivé epizody. Rozdílný postup také budeme volit podle původu PB (u nádorového či nenádorového onemocnění). Tato forma bolesti má významný vliv na kvalitu života, pacientovo strádání a utrpení, má psychologické a sociálně ekonomické dopady a často velmi komplikuje léčbu chronické bolesti [2].
Akutní bolest
V akutních fázích poruchy zdraví má bolest význam signálu nemoci, nebezpečí a ukazuje na narušení integrity organismu. Akutní bolest (AB) trvá krátkodobě (řádově dny, maximálně 4‒6 týdnů) a je z biologického hlediska účelná. Léčení prvotní příčiny základního onemocnění je zásadním a logickým medicínským krokem. Ani v této fázi onemocnění by však nemocný neměl trpět bolestí, a to nejen z hlediska lékařské etiky. Symptomatická léčba má hluboký smysl a AB je nutno vždy neodkladně a razantně léčit [3].
Pro AB, ve srovnání s bolestí chronickou, je typické, že je relativně dobře ovlivnitelná. Rozhodující roli má farmakoterapie. Často lze vystačit s jednou léčebnou modalitou. Racionálně vedená farmakoterapie má klíčový význam, ale i u AB jsou však v některých případech důležité rovněž nefarmakologické postupy. Cílem léčby AB je dosažení dostatečné analgezie při současném kauzálním postupu. Při nedostatečné léčbě AB dochází k rozvoji nepříznivých patofyziologických změn a k prohloubení stresu se všemi negativními důsledky. Efektivně vedená léčba AB má též preventivní význam z hlediska rizika přechodu do chronické bolesti (vývoj „paměti bolesti“ v mozku na podkladě změn v jeho neuroplasticitě).
Chronická bolest
Syndrom chronické bolesti (CHB) se vyznačuje neustupující bolestí trvající déle než 3‒6 měsíců. Za chronickou je třeba považovat bolest i při kratším trvání, pokud přesahuje dobu obvyklou pro dané onemocnění či poruchu. Chronická, dlouhotrvající bolest nemá žádnou biologicky užitečnou funkci a je zdrojem tělesných, duševních i sociálních útrap. Původ CHB a zejména příčiny jejího udržování jsou mnohdy nejasné. Proto není vždy možné určit příčinu přetrvávající bolesti. Z tohoto důvodu je léčba CHB daleko problematičtější a komplikovanější než léčba AB. Cílem léčebných postupů u CHB by nemělo být jen její zmírnění, ale i úprava a ev. obnovení funkční zdatnosti v dosažitelné míře v oblasti fyzické, psychické i sociální. Důležitým principem, který zvyšuje efektivitu léčby CHB, je komplexní přístup, tedy použití postupů farmakologických i nefarmakologických [4].
Chronická bolest je velmi častou příčinou návštěvy pacienta u lékaře a představuje velký zdravotní problém. V Evropě trpí CHB kolem 19 % populace. Na rozdíl od AB nemá CHB varovný charakter. Vlastní nemoc spojená s bolestivým stavem již často odezněla nebo přešla do chronického stadia. U mnoha nemocných je CHB přítomna i bez identifikovatelné organické patologie. Tuto situaci lze z dnešního pohledu vysvětlit změnami v CNS, k nimž dochází v průběhu procesu vnímání bolesti a při přechodu akutní bolesti v chronickou. Nervový systém je dynamická struktura modulující převod bolestivé aferentace na několika úrovních. Klíčovou strukturou regulace bolestivé aferentace jsou zadní rohy míšní. V genezi bolestivého prožitku hraje zásadní roli i paměť, emoce a řada dalších faktorů jako např. genetické a etnické vlivy. Změny v CNS ve smyslu neuroplasticity, periferní a centrální senzitizace a sekundární hyperalgezie jsou pravděpodobně podkladem pro některé syndromy CHB. Jejich diagnostika je v praxi založena zejména na základě vyhodnocení klinického stavu. Jsou důkazy i o tom, že neléčená těžká forma CHB může vést až k mozkové atrofii. Nemocní s CHB jsou často velmi precizně vyšetřeni, přesto dominantní problém, tedy bolest, zůstává nevyřešen nebo mu není věnována náležitá pozornost. Tito nemocní mají řadu společných znaků: depresivní ladění, chronickou spánkovou deprivaci, únavu, sníženou fyzickou a psychickou výkonnost, narušené sociální a rodinné vztahy, existenční a ekonomické problémy. Celkový obraz bývá tak typický, že rozvinutý syndrom CHB je v současnosti označován za onemocnění sui generis.
Důležité je, aby léčebný postup byl vždy náležitě koordinován a individualizován. Léčba zaměřená jen na jeden aspekt CHB či využívající pouze jedinou terapeutickou modalitu velmi pravděpodobně nepřinese dlouhodobý efekt. Opakovaně se ukazuje, že léčba CHB je efektivní tehdy, je li uplatňován multidisciplinární přístup [5].
Obecně léčbou CHB sledujeme tyto základní cíle: úlevu od bolesti, zlepšení spánku, zlepšení funkčního stavu a kvality života. V ideálním případě to zahrnuje i obnovení pracovní schopnosti. Zlepšení funkčnosti znamená rovněž navození pocitu psychického zdraví, zlepšení často narušených rodinných a sociálních vztahů. Konečným výsledkem dobře vedené léčby je pak zlepšení kvality života pacienta.
Základním krokem úspěšného přístupu k CHB je zhodnocení algického stavu a stanovení diagnózy bolesti. Stanovení patofyziologického typu bolesti a její vlastní příčiny je vodítkem pro vhodný typ léčby. Nociceptivní bolest vzniká aktivací nociceptorů při intaktním nervovém systému a relativně dobře reaguje na neopiodní a opioidní analgetika. Neuropatická bolest je způsobena patologickou aktivitou poškozených nervových struktur a vhodnější první volbou jsou antikonvulzivní léky či antidepresiva (tzv. adjuvantní léčiva ‒ koanalgetika). Některé typy CHB mají složitý původ a patří do kategorie smíšené bolesti zahrnující oba základní patofyziologické typy bolesti. Zde se k léčbě využívají jak primární analgetika, tak koanalgetika, nezapomínáme ani na další nelékové (zejména psychorehabilitační) či intervenční (např. nervové blokády a neuromodulace) postupy. Standardem je hodnocení intenzity bolesti pomocí vizuálně numerické či analogové škály (NRS, VAS) [5,6].
Nádorová a nenádorová bolest
Chronickou bolest v základě dělíme na nenádorovou bolest (CHNNB) a bolest vyvolanou nádorovým onemocněním (CHNB). Bolest je jedním z nejčastějších a nejobávanějších symptomů nádorového onemocnění. Její prevalence a intenzita obvykle narůstá v závislosti na progresi nádoru. V pokročilých a konečných stadiích trpí bolestí až 90 % pacientů. Epidemiologické studie prokazují, že 30–50 % onkologicky nemocných popisuje svou bolest jako středně silnou až silnou a 75–90 % pacientů s bolestí udává, že významným způsobem ovlivňuje jejich běžný život.
Bolest onkologicky nemocných může být vyvolána přímo nádorem (např. infiltrací měkkých tkání nádorem, nádorovou stenózou nebo obstrukcí dutých orgánů, kostními metastázami, infiltrací či kompresí nervových struktur) nebo následnou onkologickou léčbou (např. bolestivé syndromy po amputacích, thorakotomii, mastektomii a krční disekci, komplikace osteoporózy, periferní neuropatie a plexopatie po chemoterapii a radioterapii) [6].
Definice a charakteristika průlomové bolesti
Průlomová bolest postihuje 60–93 % onkologických pacientů a je charakterizována nástupem během několika sekund až minut a krátkou dobou trvání (10‒60 minut). U většiny pacientů dosahuje PB svého maxima během 5–15 minut, její nástup je u nemocných spojen s poklesem funkční kapacity, s nárůstem anxiozity a deprese. Pacienti s nedostatečně léčenou PB udávají výrazně menší spokojenost s léčbou CHB [6].
V současné době je přijímána tato definice PB: „Přechodné zhoršení bolesti, které vzniká buď spontánně, nebo v souvislosti s konkrétním předvídatelným či nepředvídatelným spouštěcím mechanismem, přes relativně stabilní a dostatečně kontrolovanou základní CHB.“
Definice PB u nenádorové bolesti se odvozuje od PB u bolesti nádorové, ale vlastní definice není stanovena. Její výskyt je podobný nebo o něco nižší než u nádorové bolesti, odhaduje se kolem 74 %. Neonkologická průlomová bolest se nejvíce podobá AB pooperační či traumatické a též má významný vliv na kvalitu života, pacientovo strádání, je spojena s psychickými a ekonomickými dopady a též velmi komplikuje léčbu základní CHB [2].
Nejčastější výskyt PB je při bolestivých onemocněních v oblasti dolních zad, dále se často objevuje u revmatoidní artritidy, osteoartritidy, migrény, postherpetické neuralgie, fibromyalgie a diabetické polyneuropatie. Většinou se jedná o bolest nociceptivní (38 %), méně o bolest neuropatickou (18 %), viscerální (4 %), často (ve 40 %) se jedná o bolesti smíšené, tedy s nociceptivní i s neuropatickou složkou [6].
Etiologie vzniku průlomové bolesti
Příčina vzniku PB nemusí být známa
a předpokladatelná (stres, přepětí, počasí), v některých
případech může být předvídatelná (kašel, defekace, určitá
námaha, bolestivé intervence) a pak je PB možné vhodnou
analgetickou léčbou preventivně zabránit, či alespoň její
intenzitu zmírnit (tab. 1).
Zpravidla je však
obtížně předvídatelná: 48 % nemocných udává, že záchvat
nedokážou nikdy předpovědět, 19 %
jich je schopno ataku občas předvídat a pouze 19 % udává,
že příchod ataky poznají vždy.
Diagnostika PB je poměrně jednoduchá a lze při ní využít pěti cílených otázek (tab. 2). Je též možné použít dotazník PB (tab. 3). Důležitým údajem je rychlost (tedy doba do nástupu PB) a délka trvání epizody PB, což jsou faktory, dle nichž se volí nejvhodnější léčba. Nezbytné je tedy zjistit u pacienta všechny důležité okolnosti vzniku a průběhu PB [6].
Terapie průlomové bolesti
Podle charakteru a trvání PB volíme jednu z těchto strategií:
- Zvýšení dávky základní (pravidelné) analgetické medikace
- Podání záchranné dávky analgetika
Zvýšení
základní (pravidelné) analgetické medikace je indikováno
u náhlých a velmi krátkých epizod PB (trvajících
několik sekund či minut). V těchto případech nejsou žádné
lékové formy účinné (dostatečně rychlé), včetně parenterální či transmukózní formy ke zvládnutí vzniklé
PB. Výjimku představují krátké epizody bolesti spojené
s léčebnými procedurami (procedurální bolesti, např.
převazy), popř. s rehabilitačními procedurami (např.
polohování), které se dají preventivně vhodně podanou
analgetickou léčbou většinou dobře zvládnout. Dále ke zvýšení
základní dávky opioidů přistupujeme, jestliže ke zhoršení
bolesti či ke zvýšenému výskytu epizod PB dochází
pravidelně ke konci dávkovacího intervalu. Výjimečně (méně
často a méně vhodně) se může v těchto případech
dávkovací interval zkrátit. Třetí indikací k navýšení
základní dávky je případ, kdy se ataky PB objevují častěji,
tedy více než čtyřikrát denně.
V jiných případech vzniku PB používáme pro jejich
zvládnutí vhodnou a dostupnou lékovou, popř. jinou léčebnou
intervenci [4].
parenterální či transmukózní formy ke zvládnutí vzniklé
PB. Výjimku představují krátké epizody bolesti spojené
s léčebnými procedurami (procedurální bolesti, např.
převazy), popř. s rehabilitačními procedurami (např.
polohování), které se dají preventivně vhodně podanou
analgetickou léčbou většinou dobře zvládnout. Dále ke zvýšení
základní dávky opioidů přistupujeme, jestliže ke zhoršení
bolesti či ke zvýšenému výskytu epizod PB dochází
pravidelně ke konci dávkovacího intervalu. Výjimečně (méně
často a méně vhodně) se může v těchto případech
dávkovací interval zkrátit. Třetí indikací k navýšení
základní dávky je případ, kdy se ataky PB objevují častěji,
tedy více než čtyřikrát denně.
V jiných případech vzniku PB používáme pro jejich
zvládnutí vhodnou a dostupnou lékovou, popř. jinou léčebnou
intervenci [4].
Zahájení léčby průlomové bolesti
Včasné zahájení léčby atak PB je prevencí neadekvátního zvyšování základní dávky opioidu a brání následné kumulaci nežádoucích účinků léčby opioidy při možném překročení nejvyšší bezpečné denní dávky.
Optimální lék
pro léčbu PB by měl mít rychlý a relativně krátkodobý
účinek, dostatečný analgetický účinek, minimum nežádoucích
účinků a nízké riziko lékových interakcí. Typ zvolené
léčby se liší pro předvídatelnou PB s rychlým
(do 5–10 minut) a s pozvolným (do 30–40
minut) nástupem epizody bolesti. U onkologických pacientů se
téměř vždy jedná o PB s rychlým nástupem intenzity
bolesti.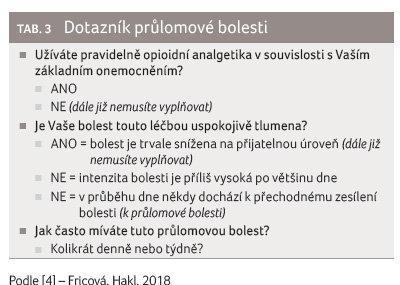
Při léčbě PB se nejčastěji rozhodujeme mezi opioidem v tabletové formě či v roztoku s rychlým (immediate release, IR) uvolňováním a transmukózní formou fentanylu, kterou preferujeme u onkologického typu bolesti. Vzhledem k potřebnosti rychlého nástupu účinné analgezie (do 10‒15 minut) není vhodné použití perorální aplikace opioidů pro léčbu PB u onkologických pacientů.
Při použití IR morfinu je velikost jednotlivé dávky pro léčbu PB obvykle v rozmezí 5‒15 % celkové denní dávky opioidu. Při použití fentanylu v transmukózní formě je třeba dávku individuálně titrovat [5].
Léčba PB se liší u bolesti s rychlým nebo pomalým nástupem bolestivé epizody. Rozdílný postup také budeme volit podle původu PB (nádorová či nenádorová) – u nádorové převážně volíme formu fentanylu v transmukózní formě. Nejčastěji se rozhodujeme mezi opioidem v tabletové formě či v roztoku s rychlým uvolňováním a transmukózní formou fentanylu. PB by měla být u každého pacienta efektivně a přitom bezpečně řešena, opakovaně vyhodnocována a dle možností by se jí mělo předcházet [4,6].
Léčba průlomové bolesti nenádorové etiologie
U stavů CHNNB je obtížné až nemožné použití rychle působících opioidů, protože transmukózní fentanyly jsou v České republice schváleny pouze pro léčbu PB nádorové etiologie.
Ke zvládnutí PB u CHNNB vycházíme z pravidel léčby této bolesti použitím klasického třístupňového analgetického žebříčku. Vhodné analgetikum vybíráme dle intenzity bolesti, rychlosti jejího nástupu a předpokládané délky trvání PB. Opioidy s postupným uvolňováním, tzv. slow release (SR) opioidy, jsou k léčbě PB nevhodné. K léčbě mírné a středně silné PB se mohou použít neopioidní analgetika (např. paracetamol) a kombinovaná léčiva, např. paracetamol se slabými opioidy (tramadol, kodein), spíše výjimečně se používají nesteroidní antiflogistika, popř. ketamin, zejména kvůli nežádoucím účinkům [7].
Dále se pro léčbu nenádorové PB mohou použít slabé opioidy (tramadol ve formě kapek či kapslí) a rychle působící silné opioidy (IR morfin a IR tapendatol). Z morfinových rychle působících (tedy do 15–20 minut) přípravků se v minulosti často používal morfin připravený magistraliter ve formě roztoku, v současné době je možné předepisovat na opioidní recepty IR morfin v síle 10 mg nebo 20 mg. Dle recentních studií se perorálně aplikovaný morfin s rychlým uvolňováním doporučuje použít v případech předvídatelné bolesti (např. procedurální či při mytí nebo výměně oblečení) a u bolestí, které mají pomalejší nástup a trvají déle než 60 minut [6].
Samozřejmě, že pro léčbu PB je výhodné použít i parenterální formu pro rychlejší nástup účinku. Nejrychleji působí aplikace intravenózní (i.v.) – např. morfin či piritramid v dávce 1–5 (10) mg i.v. ‒, popř. intramuskulární, či lépe subkutánní aplikace. Avšak uvedené aplikace jsou možné většinou jen ve zdravotnických zařízeních či přivolanými lékaři, ev. specializovanými zdravotníky, což velmi omezuje jejich dostupnost. Zejména i.v. aplikace se používají pro léčbu akutní ‒ pooperační bolesti. Výhodné je použití ve formě tzv. pacientem kontrolované analgezie (patient controlled analgesia, PCA), kdy si nemocný sám může speciálním systémem dle pokynů lékaře přidávat určité (lékařem nastavené) množství opioidů (většinou morfin či piritramid) při náhlém zhoršení akutní (pooperační) bolesti. Speciálním přístupem je PCA aplikace opioidů, většinou morfinu v léčbě těch nejsložitějších forem CHB pomocí speciálního dávkovacího systému (podkožně umístěné vysoce sofistikované pumpy) do subarachnoidálního (intratekálního) prostoru. Jedná se o jeden z typů tzv. neuromodulační analgetické léčby [3].
Tapentadol
Tapentadol je nejnovější silný opioid používaný v ČR. Lék vykazuje synergický duální efekt – agonistický účinek na μ opioidních receptorech (MOR) a inhibici zpětného vychytávání noradrenalinu (NRI). Ve srovnání s ostatními silnými opioidy vykazuje rovněž příznivý bezpečnostní profil – nízký výskyt nežádoucích účinků a relativně pomalý rozvoj tolerance.
Tapentadol je účinnou látkou, která umožňuje v léčbě bolesti využít jak pomalu, tak rychle nastupující formy tohoto léku. Užití jednoho, tedy stejného typu opioidu dává výrazně lepší představu o celkovém množství užívané látky a snižuje riziko výskytu nežádoucích účinků. Dle doporučení by léčba CHNNB měla začít dávkou tapentadolu 50 mg každých 12 hodin s maximální denní dávkou 600 mg za 24 hodin. V rámci IR formy je dostupný tapentadol v dávkách 50 mg, 75 mg a 100 mg; tato rychle působící forma je vhodná k léčbě PB, AB a je využitelná při titraci základní analgetické dávky tapentadolu. IR tapentadol je indikovaný pro řešení PB u CHNNB (v ČR je zatím preskripční omezení použití tapendatolu pouze pro léčbu neonkologické bolesti) [6].
Opioidy určené pro řešení epizod průlomové bolesti nádorové etiologie
Tyto léky byly vytvořeny na základě silného syntetického opioidu fentanylu. Fentanyl je účinný analog anilinopiperidinu, který je vysoce lipofilní. Proto je rychle distribuován do tkání bohatých na lipidy, do krevního oběhu a snadno prochází hematoencefalickou bariérou. Fentanyl pro léčbu PB je dostupný ve formě spreje v transnazálním systému, v tabletách pro bukální aplikaci, v sublinguálních tabletách a ve formě bukálního filmu [5].
Transmukózní fentanyly
Transmukózní fentanyly jsou v ČR schváleny pro léčbu PB u onkologických pacientů. Volíme je, pokud většina epizod PB rychle nastupuje. Tato terapie je dosti jednoduchá, bezpečná a může pomoci zajistit kvalitní léčbu PB u CHNB i v domácích podmínkách bez nutnosti účasti zdravotnického personálu a intervenčních způsobů aplikace. Rychlost aplikace tímto způsobem je téměř srovnatelná s i.v. aplikací, začátek analgetického efektu nastává do 7–10 minut, plný analgetický účinek se rozvíjí do 30 minut a odeznění účinku nastává nejpozději do čtyř hodin.
Transmukózní fentanyly se používají v indikaci PB u dospělých pacientů s lokálně pokročilým nebo metastazujícím karcinomem a s optimalizovanou základní terapií CHNB v případě, že selhala léčba podáním záchranné dávky neopioidních a opioidních analgetik v jiné lékové formě. Lék je určen pro pacienty, kterým je podávána pravidelná opioidní medikace, přičemž denní dávka opioidu by měla odpovídat alespoň 60 mg p.o. morfinu SR, což odpovídá přibližně 25 μg/h fentanylu transdermálně, 40 mg oxykodonu nebo 8 mg hydromorfonu v p.o. formě [1].
Je nutné dodržovat indikační kritéria a respektovat základní kontraindikace léku. Transmukózní fentanyly by neměli užívat pacienti s přecitlivělostí (alergií) na fentanyl nebo na kteroukoliv jinou složku přípravku, dále nemocní trpící závažnou respirační depresí či závažným obstrukčním onemocněním plic. Pozor je nutné dát při užití u pacientů se syndromem obstrukční spánkové apnoe [6].
Preference použití jednotlivých typů transmukózních fentanylů záleží na mnoha okolnostech, např. na přídatných onemocněních, suchosti či zánětu v ústech. Důležité jsou i preference pacienta a jeho odpovědnost, spolupráce a též určitá manuální zdatnost. Nezbytná je proto vždy dostatečná edukace pacienta a jeho zaučení v technice použití daného léku.
Sublinguální tablety
Transmukózní fentanyl podaný sublinguálně se rychle a spolehlivě absorbuje a jeho plazmatické koncentrace jsou úměrné podané dávce. Fentanyl podléhá metabolismu prvního průchodu játry (first pass effect).
Pokyny pro správnou aplikaci: Pokud není dosaženo adekvátní analgezie do 15–30 minut od počátku podání jedné tablety o síle 100 μg, lze užít druhou 100μg tabletu. Jestliže se ani tak nedosáhne dostatečné úlevy, mělo by se při léčbě další epizody PB zvážit zvýšení dávky na další vyšší dostupnou sílu. Při jedné epizodě by neměly být použity více než dvě dávky vhodné síly; síla druhé (dodatečné) tablety by měla být zvýšena ze 100 μg na 200 μg až při dávce 400 μg. Nepoužívají se dávky vyšší než 800 μg.
Pokud je potřeba kombinovat jednotlivé dávky fentanylu, pacientovi pomáhá odlišný tvar jednotlivých tablet různé síly (100 μg, 200 μg, 300 μg, 400 μg, 600 μg, 800 μg).
Tablety se nesmějí polykat, musejí se nechat zcela rozpustit bez žvýkání či cucání. Při suchosti ústní sliznice je nezbytné její dostatečné zvlhčení vodou před aplikací tablety [6].
Nosní sprej
Intranazální aplikace transmukózního fentanylu je umožněna díky vysoké propustnosti nosní sliznice pro lipofilní látky. Celkový objem nosní dutiny je 15–20 ml a povrch nosní sliznice je 150–180 cm2. Intranazální epitel má husté cévní zásobení s velmi vysokou krevní perfuzí, která umožní rychlou absorpci intranazálně aplikovaných látek, především liposolubilních. Intranazální podávání obchází metabolismus prvního průchodu játry, výhodou je tato aplikační forma také u nemocných s xerostomií nebo mukozitidou dutiny ústní. Pro pacienty představuje tento způsob podání opioidu neinvazivní a většinou velmi snadnou aplikaci.
Pokyny k dávkování: Pokud není dosaženo adekvátní analgezie do 10 minut od aplikace dávky 50 μg, lze aplikovat druhou dávku stejné síly. Jestliže není ani tak dosaženo dostatečné úlevy, mělo by se při léčbě další epizody PB zvážit zvýšení dávky na další vyšší dostupnou sílu. Při jedné epizodě by neměly být použity více než dvě dávky vhodné síly. Maximální dávka k řešení epizody PB je 400 μg (2× 200 μg) [6].
Bukální tablety fentanylu
Tablety by měly být vyjmuty z obalu až těsně před podáním a aplikují se mezi dáseň a tvář. Alternativně může být tableta rozpuštěna pod jazykem. Tableta se většinou rozpustí do 25 minut a uvolňuje účinnou látku, která se vstřebává přímo do krevního řečiště. Po 30 minutách může pacient zbylé kousky tablety polknout a zapít sklenicí vody. Tablety se nesmějí lámat ani drtit a neměly by se cucat, žvýkat nebo polykat celé. Nemocní by neměli nic jíst ani pít, dokud je tableta v ústech.
Pokyny ke správné aplikaci: Neliší se od pokynů pro použití sublinguálních tablet.
Bukální film
Bioadhezivní vrstva obsahuje fentanyl citrát. Film přilne uvnitř úst během několika sekund při kontaktu s vlhkou bukální sliznicí, neaktivní vrstva izoluje bioadhezivní vrstvu od bukální sliznice. Po aplikaci se bukální film začne rozpouštět po několika minutách a je zcela rozpuštěn během 15–30 minut. K dobrému rozpouštění filmu je zapotřebí zvlhčení bukální sliznice, pokud není v ústech možno spontánně zajistit dostatečné množství slin.
Pokyny ke správné aplikaci: Jestliže není dosaženo adekvátní analgezie do 30 minut od počátku aplikace jednoho filmu, mělo by se při léčbě další epizody PB zvážit zvýšení dávky na další vyšší dostupnou sílu. Během titrace je možné použít kombinaci nižších dávek bukálních filmů k dosažení následující vyšší dávky. Pokud se po podání určité síly dávky dosáhne adekvátní úlevy od bolesti, následující ataky PB by měly být léčeny touto dávkou. Není li dosaženo adekvátní úlevy od bolesti do 30 minut po podání bukálního filmu o síle 1 200 μg, je třeba zvážit jiné možnosti léčby PB.
Udržovací léčba (platí pro všechny typy transmukózních fentanylů): Jakmile byla během titrace stanovena účinná dávka, měla by být léčba bolesti udržována touto dávkou (maximálně čtyři denně). Při titraci i udržovací léčbě je třeba před léčbou další epizody PB vyčkat nejméně čtyři hodiny [6].
Další možnosti ovlivnění průlomové bolesti
Ke spíše
výjimečným možnostem neopioidního přístupu k ovlivnění
PB patří použití N2O
(oxidu dusného) v inhalační formě, při němž dochází
k ovlivnění bolesti během několika minut od počátku
inhalace. V ČR je dostupný přípravek Entonox, což je směs
plynů (50 % oxidu dusného a 50 % kyslíku). Vyvážený
poměr oxidu dusného/kyslíku zajišťuje dobré okysličení
a minimalizuje riziko nadměrné sedace. Entonox je účinné
analgetikum s rychlým nástupem účinku a snadným
podáváním, které se po ukončení inhalace rychle odbourává
z těla (do 5‒10 minut). Přípravek Entonox se podává
přes inhalační masku (k dispozici jsou i dětské formy
masek), kdy pacient po zacvičení nebo s pomocí jiné
osoby vdechuje směs plynů dávkovanou nádechovým ventilem.
Entonox nabízí alternativu pro akutní pomoc i v dalších
situacích, kdy se vyžaduje rychlá a řízená úleva
od bolesti. Úspěšně se využívá např. u akutních
traumat, repozicí fraktur, manipulací s klouby, bolestivých
diagnostických zákroků, punkcí žíly, ošetřování ran,
drenáží abscesů i u porodů.
Výjimečně se pro
ovlivnění PB používají i nefarmakologické postupy.
Anekdotické kazuistiky popisují použití psychorelaxačních
technik či akupunktury [7].
Velmi důležitá (a někdy opomíjená či podceňovaná) je prevence vzniku PB, zejména u předvídatelných situací pro jejich vznik. Zde je potřebná vysoká zainteresovanost ošetřujícího lékaře, dostatečné poučení pacienta (popř. jeho rodiny a okolí) o vzniku PB a o možnostech její prevence.
Nezbytné je zabezpečení dostupnosti všech možností k omezení vzniku PB (např. použití vhodných rehabilitačních pomůcek a zdravotně sociálních opatření).
Komplexní přístup při zvládání průlomové bolesti
Nezbytné je včasné zahájení léčby
atak PB, které ve výsledku může přispět ke snížení
základních dávek opioidu a zabránit vzniku nežádoucích
účinků spojených s nadměrným užíváním opioidních
i neopioidních analgetik. V léčbě PB je zcela zásadní,
aby trvalá (základní) perzistentní bolest byla dobře
kontrolována. To se většinou podaří při vhodné kombinaci
opioidů, neopioidních analgetik a koanalgetik, případně
použitím dalších i nefarmakologických či intervenčních
postupů v rámci multidisciplinárního přístupu v léčbě
CHB (tab. 4).
Závěr
Průlomová bolest by neměla být nikdy přehlížena a podceňována. Naopak u každého takto postiženého pacienta by měla být PB efektivně řešena a opakovaně vyhodnocována dle vývoje bolestivého stavu a dle možností by se jí mělo předcházet.
Určitě by bylo vhodné, kdyby se v ČR postupně podařilo rozšířit použití transmukózních fentanylů, tedy schválit proplácení této léčby ze zdrojů veřejného zdravotnictví při preskripci určenými specialisty (odbornostmi) v indikovaných stavech CHNNB. Tím by získal možnost kvalitní a účinné léčby PB větší počet pacientů i v domácích podmínkách, což by určitě vedlo nejen ke zkvalitnění jejich života, ale i ke snížení jinak nezbytných a časově i finančně zatěžujících lékařských intervencí.
Seznam použité literatury
- [1] Janknegt R, Van den Beuken M, Schiere S, et al. Rapid acting fentanyl formulations in breakthrough pain in cancer. Drug selection by means of the system of objectified judgement analysis. Eur J Hosp Pharm 2018; 25: 1‒18.
- [2] Dekel BGS, Remondini F, Gori A. Development, validation and psychometric properties of a diagnostic/prognostic tool for breakthrough pain in mixed chronic‑pain patients. Clin Neurol Neurosurg 2016; 141: 23‒29.
- [3] Vrba I, Hakl M. Opioidy v akutní a přednemocniční péči. In: Kozák J (ed.). Opioidy. Praha: Mladá fronta, 2018: 390‒410.
- [4] Fricová J, Hakl M. Farmakoterapie nenádorové průlomové bolesti. Metodické pokyny pro farmakoterapii bolesti, speciální část. Bolest 2017; 20 (Suppl 1): 7.
- [5] Sláma O, Fricová J. Farmakoterapie nádorové bolesti. Metodické pokyny pro farmakoterapii bolesti. Bolest 2016; 19(Suppl 1): 25‒26.
- [6] Fricová J, Hakl M. Opioidy a průlomová bolest. In: Kozák J (ed.). Opioidy. Praha: Mladá fronta, 2018: 301‒309.
- [7] Mercadante S. Non‑pharmacological interventions and non‑fentanyl pharmacological treatments for breakthrough cancer pain: A systematic and critical review. Critical reviews in Oncology/Hematology 2018; 122: 60‒63.