Psoriáza a kardiovaskulární rizika
Souhrn:
Gibalová K. Psoriáza a kardiovaskulární rizika. Remedia 2021; 31: 348–352.
Psoriasis vulgaris je chronické zánětlivé onemocnění kůže asociované se systémovým zánětem. Na vývoj onemocnění mají vliv kromě genetiky také imunitní faktory, prostředí a stres. Psoriáza je často spojena s různými komorbiditami, včetně psoriatické artritidy, diabetes mellitus, obezity, nealkoholické steatózy jater a zánětlivých střevních onemocnění. Studie v posledních letech ukazují, že samotná psoriáza je nezávislým rizikovým faktorem vzniku aterosklerózy na podkladě systémového zánětu. Pacienti mají vyšší riziko vzniku infarktu myokardu a cévní mozkové příhody. Na patogenezi psoriázy a jejích komorbidit se podílejí jak genetické a predispoziční faktory, tak zánětlivé procesy, které zahrnují dráhy tumor nekrotizujícího faktoru alfa (TNFα) a interleukinů (IL) 23/17. Tyto cesty jsou cíleně blokovány pomocí biologické léčby, která podstatně změnila terapii psoriázy, a zdá se, že pozitivně ovlivňuje komorbidity včetně snížení kardiovaskulárního rizika.
Summary:
Gibalova K. Psoriasis and cardiovascular risks. Remedia 2021; 31: 348–352.
Psoriasis vulgaris is a chronic, recurrent inflammatory skin disease associated with a wide range of systemic manifestations. In addition to genetics, the development of the disease is also influenced by immune factors, the environment and stress. Psoriasis is often associated with comorbidities, such as psoriatic arthritis, diabetes mellitus, obesity, non‑alcoholic hepatic steatosis, and inflammatory bowel disease. Studies in recent years have shown that psoriasis itself is an independent risk factor for the development of atherosclerosis due to systemic inflammation. Patients have a higher risk of myocardial infarction and stroke. Genetic factors, predisposing factors and inflammatory processes, which involve the TNFα and IL‑23/IL‑17 pathways, are involved in the pathogenesis of psoriasis and its comorbidities. These pathways are selectively targeted by biological therapies that have significantly changed the results of psoriasis treatment and have a positive effect on comorbidities, including reduction in cardiovascular risk.
Key words: psoriasis, atherosclerosis, cardiovascular risk, therapy.
Úvod
Psoriáza je imunitně zprostředkované chronické zánětlivé neinfekční onemocnění kůže postihující téměř 2–3 % světové populace. Vyznačuje se změnou proliferace a diferenciací keratinocytů, vaskulární remodelací a zánětem v kůži. Přesná etiologie onemocnění není doposud známa. V rámci patogeneze psoriázy se uplatňují vlivy prostředí (stres, mechanické trauma, streptokokové infekce) a genetické faktory [1]. Studie v rámci genetiky prokázaly devět různých lokusů (známých jako psoriasis susceptibility, PSORS 1−9), které by měly přispívat ke vzniku onemocnění. Jako nejdůležitější lokus se jeví PSORS 1 na chromozomu 6p21 [2]. Klíčovou roli v celkové progresi onemocnění hraje imunitní systém, přičemž různé vrozené a získané imunitní buňky a prozánětlivé mediátory jsou zapojeny v různých stadiích choroby.
Etiopatogeneze
Stejně jako u jiných forem systémového zánětu je rovněž u psoriázy jedním z hlavních prozánětlivých cytokinů tumor nekrotizující faktor alfa (TNFα). Nejnovější studie navíc poukazují na to, že klíčovou roli v patogenezi onemocnění hraje osa interleukin (IL) 23/IL 17 [3].
Počátečním spouštěcím
mechanismem u psoriázy je aktivace plazmocytoidních
dendritických buněk stimulovaných komplexy hostitelské DNA
a antimikrobiálního peptidu LL 37 (katelicidin), které
jsou produkovány keratinocyty po drobných poraněních.
Aktivované dendritické buňky a poškozené keratinocyty
produkují interferon alfa (IFNα) a TNFα, což vede k následné
stimulaci plazmocytoidních dendritických buněk a k další
produkci TNFα, IL 12 a IL 23. Následně IL 12
podporuje funkční polarizaci CD4+ T lymfocytů na pomocné
lymfocyty subsetu Th1. Aktivovaný receptor IL 23 (IL 23R),
umístěný na paměťových T lymfocytech, podporuje vývoj
Th17 lymfocytů charakterizovaný produkcí IL 17A, IL 17F
a IL 22. Následná produkce četných prozánětlivých
cytokinů, chemokinů a antimikrobiálních peptidů řídí
zánětlivou odpověď u psoriatických lézí [4].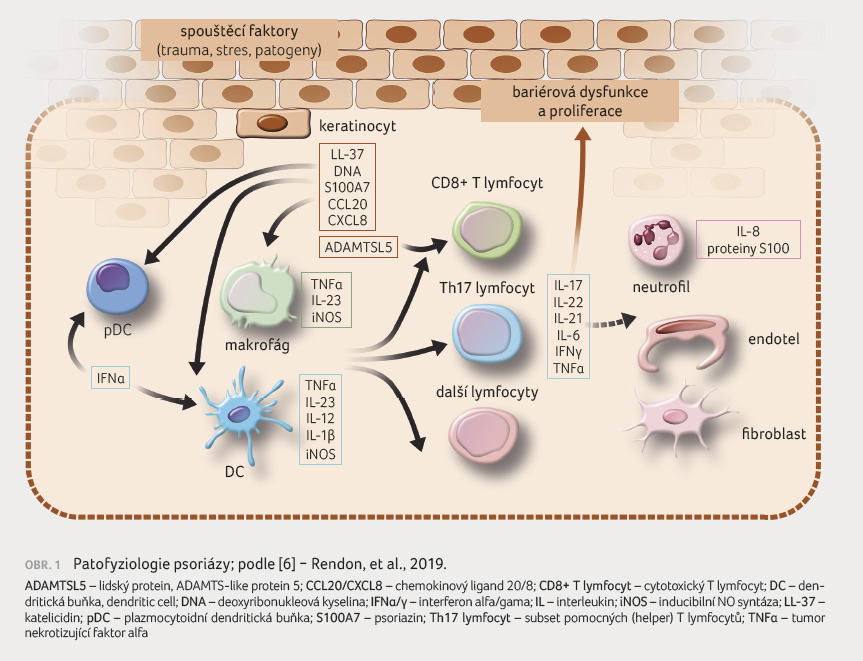
Zejména IL 17A zvyšuje proliferaci keratinocytů, snižuje jejich diferenciaci, zesiluje přestup neutrofilů a napomáhá při komunikaci mezi neutrofily a keratinocyty pomocí zvýšení regulace neutrofilů atraktivních chemokinů CXCL8 a CXCL1. Interleukin 17A podporuje expresi TNFα keratinocytů, což naznačuje, že výše uvedená osa TNFα/IL 23/IL 17 pravděpodobně vytvoří začarovanou smyčku ve vývoji psoriatických lézí [5], obrázek 1 [6].
Komorbidity spojené
s kardiovaskulárním rizikem a metabolickým syndromem
Epidemiologické studie ukazují, že u pacientů s těžkou formou psoriázy je až o 58 % zvýšené riziko rozvoje závažných kardiovaskulárních komplikací a o 57 % zvýšené riziko náhlé kardiální smrti. Navíc se předpokládá, že závažnost psoriázy může přímo souviset se stupněm systémového zánětu a s rozsahem kardiovaskulárních onemocnění [7].
Arteriální hypertenze je jedním z hlavních rizikových faktorů, jelikož představuje významný činitel při rozvoji aterosklerózy či metabolického syndromu. Podle výsledků nedávné studie se zvyšuje pravděpodobnost zvýšení krevního tlaku u pacientů s těžkou formou psoriázy i vzhledem k dalším rizikovým faktorům, jako jsou vysoký index tělesné hmotnosti (body mass index, BMI), diabetes mellitus a hypercholesterolemie [8].
Dále byl u rizikových pacientů prokázán zvýšený lipoproteinový profil se sníženou HDL (lipoproteiny s vysokou hustotou) efluxní kapacitou a rovněž to, že závažnost psoriázy přímo koreluje se stupněm obezity, inzulinové rezistence a následně se vznikem metabolického syndromu. Jde o protrombotický a prozánětlivý stav charakterizovaný zvýšenou produkcí prozánětlivých cytokinů, jako jsou TNFα a IL 1β. To má za následek vznik chronického systémového zánětu, který se jeví jako hlavní mechanismus patofyziologie metabolického syndromu [9−11].
Obezita a podíl tukové tkáně
výrazně ovlivňují i hormonální aktivitu adipocytů
a produkci adipokinů, jichž jsou dnes známy desítky, přičemž
nejdůležitějšími jsou rezistin, leptin a adiponektin.
Koncentrace adiponektinu negativně koreluje s podílem tukové
tkáně. Podílí se na zvyšování citlivosti na inzulin
a vykazuje antiaterogenní a protizánětlivé účinky.
Adiponektin zvyšuje senzibilizaci na inzulin vazbou
na receptory AdipoR1 a AdipoR2. Kromě metabolismu
sacharidů spočívá funkce adiponektinu i v ochraně
endotelu a zabránění rozvoji aterosklerózy − snižuje
produkci adhezních molekul, zpomaluje přeměnu makrofágů
na pěnové buňky a působí inhibičně i na proliferaci
a migraci hladkých svalových buněk. U jedinců
s normálním BMI byly plazmatické koncentrace tohoto hormonu
vyšší než u pacientů s metabolickým syndromem, což
koreluje s přítomností subklinické aterosklerózy
u psoriatických pacientů [12], obrázek 2 [13].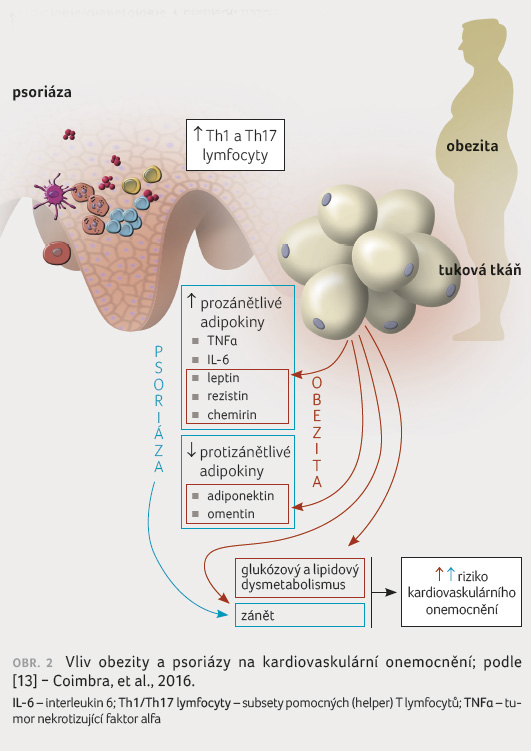
Dalším významným adipokinovým hormonem je leptin. Jeho hlavní rolí je bránit pocitu hladu, aktivovat termogenezi, zvýšit oxidaci mastných kyselin, snížit hyperglykemii, redukovat tělesnou hmotnost a tuk. Leptin také ovlivňuje imunitní buňky − včetně dendritických, neutrofilů, NK (natural killers) buněk, T a B lymfocytů − prostřednictvím leptinových receptorů umístěných na povrchu imunitních buněk a reguluje produkci různých cytokinů. Zejména leptinem indukované změny v různých imunitních buňkách a produkce různých cytokinů jsou považovány za hlavní faktor ve vývoji psoriázy [14]. Naopak pozitivní korelaci s podílem tukové tkáně vykazuje hormon rezistin. Jako prozánětlivý cytokin zvyšuje uvolňování TNFα a IL 12, které mají klíčovou roli v patogenezi psoriázy. Vědci zkoumali účinky lokální a systémové léčby na cirkulující koncentrace adipokinů u pacientů s psoriázou. Po léčbě byly koncentrace leptinu a adiponektinu podobné koncentracím před léčbou, zatímco hodnota rezistinu byla významně nižší. Tato zjištění naznačují, že změna snížení stupně obezity a koncentrace rezistinu má u psoriatických pacientů klinický význam [15].
Ateroskleróza
Primární základní příčinou kardiovaskulárních onemocnění je ateroskleróza. Jde o chronické zánětlivé onemocnění, které způsobuje změny uvnitř arteriální stěny. Mezi nejčastější rizikové faktory patří genetická predispozice, arteriální hypertenze, diabetes mellitus 2. typu, hypercholesterolemie, hypertriglyceridemie, nízká koncentrace HDL, abdominální obezita a nízká fyzická aktivita. Ateroskleróza vede k tvorbě plaků, což má za následek zúžení stěny a snížení pružnosti tepen. Aterosklerotické plaky jsou charakterizovány akumulací imunitních buněk, buněk hladkého svalstva a fibroblastů, lipidů a extracelulární matrix ve stěně tepny [16].
Ateroskleróza je jako proces iniciována hlavně v reakci na endogenně modifikované struktury, zejména oxidované lipoproteiny s nízkou hustotou (oxLDL), které stimulují vrozenou a získanou imunitní odpověď, protože mají charakter vzorů vnitřního poškození (damage associated molecular patterns, DAMP). Vrozená odpověď začíná aktivací endotelových buněk ve stěnách cév a aktivací monocytů/makrofágů. Následně rychle pokračuje získaná imunitní odpověď na řadu potenciálních antigenů prezentovaných efektorovým T lymfocytům buňkami prezentujícími antigeny (např. dendritickými buňkami). Vrozená i získaná imunitní odpověď hraje důležitou roli při iniciaci a vývoji aterosklerózy, což dokazuje přítomnost hlavního receptoru buněčného povrchu histokompatibilního komplexu (major histocompatibility complex, MHC) třídy II, HLA DR, a existence značného množství celkových CD3+, pomocných CD4+ a cytotoxických CD8+ T lymfocytů v aterosklerotických plátech.
Nejčastěji jsou v aterosklerotickém plaku akumulovány T lymfocyty. Jako odpověď na lokální prostředí cytokinů se CD4+ T lymfocyty dále funkčně polarizují do subsetů Th1, Th2 nebo Th17. Kromě produkce specifických cytokinů mohou T lymfocyty subsetu Th2 podporovat humorální imunitní odpověď na specifické antigeny stimulací produkce různých imunoglobulinových tříd a podtříd [17,18].
Lymfocyty subsetů Th17 spolu s Th22 produkují IL 22, který působí jak na buňky hladkého svalstva, tak na epiteliální buňky. Jejich přítomnost byla prokázána také v aterosklerotických placích. V rámci patogeneze psoriázy se IL 22 uplatňuje při inhibici terminální diferenciace keratinocytů a může vyvolat změny epidermis podobné psoriáze [19]. Bylo prokázáno, že proces aterosklerózy v endotelových buňkách je u chronických zánětlivých stavů zrychlen. Tato hypotéza je posílena nedávnými studiemi, které ukázaly, že zmírněním zánětu kůže byly redukovány vaskulární zánět a velikost koronárních plaků. Zvýšený výskyt kardiovaskulárních onemocnění včetně cévní mozkové příhody či akutního koronárního syndromu se potvrdil zejména u mladších pacientů s těžkou formou psoriázy. Toto zjištění vedlo ke klinickým sledováním zkoumajícím souvislost mezi psoriázou a subklinickou aterosklerózou pomocí speciálních zobrazovacích technik a laboratorních metod [20]. Mezi nejčastěji využívané techniky patří ultrazvukové měření tloušťky intimo mediálního spojení (IMT), CT angiografie či pozitronová emisní tomografie/výpočetní tomografie (PET/CT) pomocí radiofarmaka (18F) fludeoxyglukózy (FDG). Nejvíce využívanou technikou detekce aterosklerózy včetně časných stadií je B mode ultrasonografie (USG). Hlavní diagnostický ukazatel představuje IMT. Rozsah aterosklerózy může být rovněž kvantifikován měřením celkové plochy plaku. Měření se provádí nejčastěji v distální části a. carotis communis, v oblasti bifurkace nebo na proximálním úseku a. carotis interna [21].
Pokročilou zobrazovací technikou, která je mimořádně citlivá pro detekci aktivity makrofágů, je FDG PET/CT. Tato technika umožňuje vysoce přesné měření zánětu v aterosklerotických placích jak ve velkých, tak ve středních tepnách. Ve studii u 60 pacientů s psoriázou, kteří byli vyšetřeni FDG PET/CT, byla závažnost psoriázy spojena s aortálním vaskulárním zánětem nad rámec známých kardiovaskulárních rizikových faktorů, což naznačuje společné mechanismy mezi vzdáleným zánětem v kůži a přítomností vaskulárního onemocnění. Cévní zánět je navíc vysoce citlivý na modulaci rizikových faktorů v rámci preventivních opatření, jako je léčba statiny, a na změny životního stylu, o nichž je známo, že snižují kardiovaskulární riziko [22].
Další neinvazivní vyšetřovací metodou je koronární CT angiografie, která poskytuje přímou anatomickou vizualizaci stěny koronární arterie, velikost a závažnost stenózy lumenu a identifikuje rizikové plaky bohaté na lipidy s vysokou pravděpodobností ruptury vedoucí k akutnímu koronárnímu syndromu. Studie prokázaly vyšší prevalenci plaků karotických tepen a cévního zánětu u pacientů s psoriázou a rovněž to, že pacienti s psoriatickou artritidou trpí závažnější subklinickou aterosklerózou ve srovnání s pacienty s psoriázou samotnou. Rozdíl tedy nezávisí na tradičních rizikových kardiovaskulárních faktorech, ale koreluje se zvýšením hodnot zánětlivých markerů [23].
Hlavním zánětlivým markerem při chronickém systémovém zánětu, který se uplatňuje v rámci psoriázy a kardiovaskulárního onemocnění, je C reaktivní protein (CRP). Kromě primární syntézy v játrech je též produkován buňkami hladkého svalstva arterií v reakci na zánětlivé podněty. Ukázalo se, že hodnota CRP stoupá u chronických imunitně zprostředkovaných zánětlivých onemocnění, včetně psoriázy, a že koreluje s rizikem kardiovaskulárních příhod u pacientů. Některé studie naznačují, že koncentrace CRP mohou předpovědět prognózu u pacientů s kardiovaskulárními příhodami; vysoce senzitivní CRP (hsCRP) může predikovat kardiovaskulární příhody u asymptomatických zdravých jedinců. Jiné studie porovnávaly hodnotu skóre rozsahu a tíže postižení psoriázou PASI (Psoriasis Area and Severity Index) a hodnotu CRP. Bylo prokázáno, že při stoupající hodnotě PASI se zvyšuje rozdíl v průměrné hodnotě CRP mezi pacienty s psoriázou a kontrolní skupinou [24].
Dalším laboratorním parametrem, který byl zkoumán v různých studiích, je hodnota solubilní formy E selektinu. Tato adhezní molekula je exprimována na aktivovaných endotelových buňkách během zánětu. Umožňuje adhezi leukocytů do místa poškození endotelové výstelky. Jde o marker svědčící pro systémový zánět a rovněž riziko rozvoje aterosklerózy. Výsledky poukazují na to, že sérové koncentrace tohoto glykoproteinu mohou být až dvojnásobně vyšší u osob s psoriázou [25].
Společným článkem v patofyziologii psoriázy a aterosklerózy je IL 22, jehož koncentrace byly porovnávány u pacientů před zahájením systémové či biologické terapie nebo po ní. Výsledky ukázaly zvýšení koncentrace IL 22 jak v kožních lézích, tak v séru pacientů s psoriázou ve srovnání se zdravou populací. Také byla zjištěna pozitivní korelace mezi PASI a koncentrací IL 22 v séru. Na základě podobných imunologických procesů uplatňujících se v patofyziologii psoriázy a aterosklerózy můžeme předpokládat, že cílenou léčbou zaměřenou na specifické molekuly u psoriázy ovlivníme též chronický zánět hrající roli při vzniku aterosklerózy [26].
Terapie psoriázy a vliv
na aterosklerózu
V současné době se podle stupně závažnosti uplatňuje v léčbě psoriázy lokální terapie, fototerapie a systémová terapie. Základem je léčba kombinovaná, přičemž největší důraz je kladen na nastavení co nejnižší dávky systémové terapie zaručující co nejlepší terapeutický efekt. Pokud pacient dostatečně nereaguje na lokální terapii či fototerapii, je indikována systémová terapie (metotrexát, cyklosporin, acitretin) či biologická léčba [27].
Za poslední období došlo k rychlému vývoji nových biologických léčiv pro léčbu středně těžké až těžké psoriázy. Jde o látky, které selektivně na různé úrovni zasahují do patogeneze psoriázy.
Mezi první biologické přípravky patřily inhibitory TNFα, jako je fúzní protein etanercept, a monoklonální protilátky adalimumab, certolizumab a infliximab. Jednou z dalších možností je monoklonální protilátka ustekinumab, inhibitor podjednotky p40 sdílené cytokiny IL 12/23. Novější třídu monoklonálních protilátek představují inhibitory IL 17 sekukinumab a ixekizumab, které blokují IL 17A, a brodalumab, který blokuje receptor IL 17RA. Nejnovější třída biologických přípravků, jež se v současné době v léčbě psoriázy využívají, zahrnuje monoklonální protilátky proti unikátní podjednotce p19 IL 23 guselkumab a risankizumab [28].
Účinnost biologické léčby byla doposud prokázána nejen na základě klinického zlepšení kožních lézí, ale také na molekulární úrovni, což vedlo k poklesu hodnot markerů zánětu jak na kůži, tak v séru léčených pacientů. Snížením hodnot zánětlivých markerů došlo následně ke zmírnění celkového chronického zánětu, což mělo pozitivní vliv na rozvoj kardiovaskulárních rizikových faktorů včetně aterosklerózy. Výsledky nedávné studie o účinku TNFα na subklinické projevy aterosklerózy prokázaly zpomalenou progresi karotických plaků ultrazvukem a zmírnění vaskulárního zánětu pomocí FDG PET/CT, což naznačuje potenciálně ochranný účinek cílené biologické léčby na kardiovaskulární riziko u pacientů s psoriázou [29].
V jiném sledování pacientů s mírnou až středně těžkou psoriázou byla zkoumána souvislost mezi léčbou psoriázy a změnou vaskulárního zánětu aorty po jednom roce prostřednictvím FDG PET/CT. Studie sledovala 115 pacientů, z nichž 39 % dostávalo systémovou nebo biologickou léčbu. Zlepšení stavu pacienta s psoriázou bylo spojeno se zmírněním vaskulárního zánětu aorty nezávisle na rizikových kardiovaskulárních faktorech. Větší zmírnění vaskulárního zánětu bylo pozorováno u těch pacientů, u nichž došlo ke zmírnění závažnosti kožního nálezu o více než 75 %. Tato zjištění naznačují, že zmírnění zánětu kůže může mít po jednom roce pozitivní účinky na zánět cév [30].
Jiné studie zkoumaly účinek biologické léčby anti TNFα na hodnotu IL 22 u pacientů. Významné snížení sérové koncentrace IL 22 lze vysvětlit skutečností, že blokáda TNFα vede k inhibici sekrece IL 22 efektorovými T lymfocyty, a způsobuje tak snížení jeho koncentrace jak v kožních lézích, tak v séru pacientů [31].
Závěr
Psoriáza je systémové chronické zánětlivé onemocnění, o němž se předpokládá, že koreluje s řadou kardiovaskulárních rizikových faktorů včetně rozvoje aterosklerózy, arteriální hypertenze, dyslipidemie, diabetes mellitus a obezity. Vzhledem k tomu, že systémový zánět je v současné době považován za hlavní příčinu vzniku kardiovaskulárních onemocnění u psoriázy, je potřeba zahájit léčbu, která bude tlumit i systémový zánět. Právě biologická terapie zmírňuje nejen kožní projevy, ale může mít také pozitivní efekt na snížení rizika rozvoje aterosklerózy. Studie sledující aterosklerotické markery u pacientů léčených pro psoriázu dokazují, že podávání biologické terapie může nejen zmírnit klinické příznaky psoriázy, ale také přispět k poklesu hodnot sérových markerů spojených se systémovým zánětem u těchto pacientů.
Seznam použité literatury
- [1] Choudhary S, Patel R, Pradhan D, et al. Psoriasis and cardiovascular disorders: association or epiphenomenon? Meta‑analysis of observational studies. 3 Biotech 2020; 10: 104.
- [2] Capon F. The Genetic Basis of Psoriasis. Int J Mol Sci 2017; 18: 2526.
- [3] Piaserico S, Osto E, Famoso G, et al. Treatment with tumor necrosis factor inhibitors restores coronary microvascular function in young patients with severe psoriasis. Atherosclerosis 2016; 251: 25−30.
- [4] Lowes MA, Suárez‑Fariñas M, Krueger JG. Immunology of psoriasis. Ann Rev Immunol 2014; 32: 227−255.
- [5] Reich K, Papp KA, Matheson RT, et al. Evidence that a neutrophil‑keratinocyte crosstalk is an early target of IL‐17A inhibition in psoriasis. Exp Dermatol 2015; 24: 529−535.
- [6] Rendon A, Schäkel K. Psoriasis pathogenesis and treatment. Int J Mol Sci 2019; 20: 1475.
- [7] Sanda GE, Belur AD, Teague HL, Mehta NN. Emerging associations between neutrophils, atherosclerosis, and psoriasis. Curr Atheroscler Rep 2017; 19: 1−8.
- [8] Takeshita J, Wang S, Shin DB, et al. Effect of psoriasis severity on hypertension control: a population‑based study in the United Kingdom. JAMA Dermatol 2015; 151: 161−169.
- [9] Furue M, Tsuji G, Chiba T, Kadono T. Cardiovascular and metabolic diseases comorbid with psoriasis: beyond the skin. Internal Med 2017; 56: 1613−1619.
- [10] McCracken E, Monaghan M, Sreenivasan S. Pathophysiology of the metabolic syndrome. Clin Dermatol 2018; 36: 14−20.
- [11] Shiba M, Kato T, Funasako M, et al. Association between psoriasis vulgaris and coronary heart disease in a hospital‑based population in Japan. PLoS One 2016; 11: e0149316.
- [12] Peralta C, Hamid P, Batool H, et al. Psoriasis and metabolic syndrome: comorbidities and environmental and therapeutic implications. Cureus 2019; 11: e6369.
- [13] Coimbra S, Catarino C, Santos‐Silva A. The triad psoriasis–obesity–adipokine profile. J Eur Acad Dermatol Venereol 2016; 30: 1876−1885.
- [14] Scotece M, Conde J, López V, et al. Adiponectin and leptin: new targets in inflammation. Basic Clin Pharmacol Toxicol 2014; 114: 97−102.
- [15] Hwang J, Yoo JA, Yoon H, et al. The Role of Leptin in the Association between Obesity and Psoriasis. Biomol Ther 2021; 29: 11−21.
- [16] Souilhol C, Harmsen MC, Evans PC, Krenning G. Endothelial‑mesenchymal transition in atherosclerosis. Cardiovasc Res 2018; 114: 565−577.
- [17] Saigusa R, Winkels H, Ley K. T cell subsets and functions in atherosclerosis. Nature Rev Cardiol 2020; 17: 387−401.
- [18] Taleb S. Inflammation in atherosclerosis. Arch Cardiovasc Dis 2016; 109: 708−715.
- [19] Gkalpakiotis S, Arenbergerova M, Gkalpakioti P, et al. Impact of adalimumab treatment on cardiovascular risk biomarkers in psoriasis: results of a pilot study. J Dermatol 2017; 44: 363−369.
- [20] Gonzalez‐Juanatey C, Llorca J, Amigo‑Diaz E, et al. High prevalence of subclinical atherosclerosis in psoriatic arthritis patients without clinically evident cardiovascular disease or classic atherosclerosis risk factors. Arthritis Rheum 2007; 57: 1074−1080.
- [21] Stein JH, Korcarz CE, Hurst RT, et al. Use of carotid ultrasound to identify subclinical vascular disease and evaluate cardiovascular disease risk: a consensus statement from the American Society of Echocardiography Carotid Intima‑Media Thickness Task Force endorsed by the Society for Vascular Medicine. J Am Soc Echocardiogr 2008; 21: 93−111.
- [22] Naik HB, Natarajan B, Stansky E, et al. Severity of psoriasis associates with aortic vascular inflammation detected by FDG PET/CT and neutrophil activation in a prospective observational study. Arterioscler Thromb Vasc Biol 2015; 35: 2667−2676.
- [23] Kaiser H, Abdulla J, Henningsen KMA, et al. Coronary artery disease assessed by computed tomography in patients with psoriasis: a systematic review and meta‑analysis. Dermatology 2019; 235: 478−487.
- [24] Pirro M, Stingeni L, Vaudo G, et al. Systemic inflammation and imbalance between endothelial injury and repair in patients with psoriasis are associated with preclinical atherosclerosis. Eur J Prev Cardiol 2015; 22: 1027−1035.
- [25] Dowlatshahi EA, van der Voort EAM, Arends LR, Nijsten T. Markers of systemic inflammation in psoriasis: a systematic review and meta‐analysis. Brit J Dermatol 2013; 169: 266282.
- [26] Olejniczak‑Staruch I, Narbutt J, Bednarski I, et al. Interleukin 22 and 6 serum concentrations decrease under long‑term biologic therapy in psoriasis. Postepy Dermatol Alergol 2020; 37: 705−711.
- [27] Kim WB, Jerome D, Yeung J. Diagnosis and management of psoriasis. Can Fam Physician 2017; 63: 278−285.
- [28] Jeon C, Sekhon S, Yan D, et al. Monoclonal antibodies inhibiting IL‑12,‑23, and‑17 for the treatment of psoriasis. Hum Vaccin Immunother 2017; 13: 2247−2259.
- [29] Szentpetery A, Haroon M, FitzGerald O. Cardiovascular Comorbidities in Psoriatic Disease. Rheumatol Ther 2020; 7: 5−17.
- [30] Dey AK, Joshi AA, Chaturvedi A, et al. Association between skin and aortic vascular inflammation in patients with psoriasis: a case‑cohort study using positron emission tomography/computed tomography. JAMA Cardiol 2017; 29: 1013−1018.
- [31] Luan L, Ding Y, Han S, et al. An increased proportion of circulating Th22 and Tc22 cells in psoriasis. Cell Immunol 2014; 290: 196−200.