Rituximab v léčbě revmatoidní artritidy
Rituximab je monoklonální protilátka proti CD20 pozitivním B lymfocytům, které hrají důležitou úlohu v patogenezi revmatoidní artritidy. Po otevřených klinických studiích potvrzujících účinnost principu byly provedeny dvojitě slepé kontrolované studie fáze II a III klinického hodnocení. Potvrdily vysokou klinickou účinnost rituximabu podaného intravenózně dvěma infuzemi v dávkách 1000 mg (1. a 15. den terapie). Po odeznění efektu je nutné sérii 2 infuzí opakovat (tzv. retreatment). Účinnost opakovaných cyklů je nejméně tak dobrá jako u cyklu prvního. Medián času do nutnosti opakovat cyklus se pohybuje kolem 9 měsíců. Kromě klinické účinnosti byla potvrzena i schopnost rituximabu zpomalovat strukturální progresi RA. Klinická účinnost je spojena s hlubokou deplecí CD20 pozitivních buněk v periferní krvi a dřeni pacientů s RA. Tato deplece trvá nejméně 4–6 měsíců, během nichž nastává postupný návrat k normálním hladinám B lymfocytů. Na úvod infuze se podávají intravenózní kortikosteroidy (100 mg methylprednisolonu i.v.), ale původně navržená perorální aplikace kortikosteroidů (14 dní) není nutná. Rituximab se podává v kombinaci s methotrexátem pacientům s RA, u kterých selhala léčba alespoň jedním anti TNF léčivem. Aktivita RA by měla být vysoká (dle doporučení České revmatologické společnosti Disease Activity Score > 5,1). Efekt léčby (pokles Disease Activity Score > 1,2) by měl být průkazný do 16 týdnů. Indikací opakovaného podávání rituximabu po několika měsících je buď vzestup aktivity (Disease Activity Score > 0,6) nebo setrvávání ve stavu, který nelze označit za remisi či stav mírné aktivity, přestože iniciálně k odpovědi došlo. Léčba rituximabem je relativně bezpečná. Infuzní reakce se vyskytují až u 30 % pacientů, většinou jsou však mírné a nezávažné. Jejich výskyt snižuje současná i.v. aplikace kortikosteroidů; nižší výskyt nežádoucích účinků byl také zaznamenán při opakování léčby. Výskyt infekcí a závažných infekcí je jen mírně zvýšen. Nevyskytly se případy oportunních infekcí a TBC. U části pacientů dochází k poklesu hladiny imunoglobulinů, ale zůstávají v principu v mezích normy. Přesto se doporučuje hodnoty imunoglobulinů monitorovat před zahájením léčby a v jejím průběhu. Blokáda CD20 pozitivních B buněk představuje nový terapeutický princip v léčbě revmatoidní artritidy. Zatím je určena dle rozhodnutí regulačních orgánů (FDA, EMEA, SÚKL) pro léčbu refrakterní revmatoidní artritidy, u které selhala léčba nejméně jedním anti TNF přípravkem.
Úvod
Blokátory tumor nekrotizujícího faktoru alfa (TNF-a) přinesly novou kvalitu do léčby revmatoidní artritidy (RA). Působí u RA klinicky velmi mohutně, s rychlým nástupem účinku. Potlačují razantně aktivitu RA, snižují reaktanty akutní fáze, zlepšují kvalitu života a tím i sociální zařazení pacientů [1–3]. Navíc zpomalují až zastavují rentgenovou progresi onemocnění [4–6]. Nicméně u 30–40 % pacientů nedochází k dostatečné klinické odpovědi (tzv. primární non-respondéři), u části nemocných se pak po iniciální odpovědi odpověď ztratí (tzv. sekundární non-respondéři). Část pacientů přeruší léčbu pro nežádoucí účinky. Hledají se proto i další biologické léky s odlišným mechanismem účinku u RA. Z látek již registrovaných lze jmenovat antagonistu receptoru pro IL-1 (anakinra) [7], monoklonální protilátky proti receptoru pro interleukin 6 (MRA, tocilizumab) [8], kostimulační molekulu aktivace T buněk (CTL4Ig, abatacept) [9] či monoklonální protilátky proti CD20 pozitivním B buňkám (rituximab) [10]. V této chvíli je v České republice kategorizován pro použití v léčbě RA právě poslední jmenovaný preparát – rituximab (MabThera, Roche).
Důvody pro aplikaci cílené anti B-buněčné terapieu revmatoidní artritidy
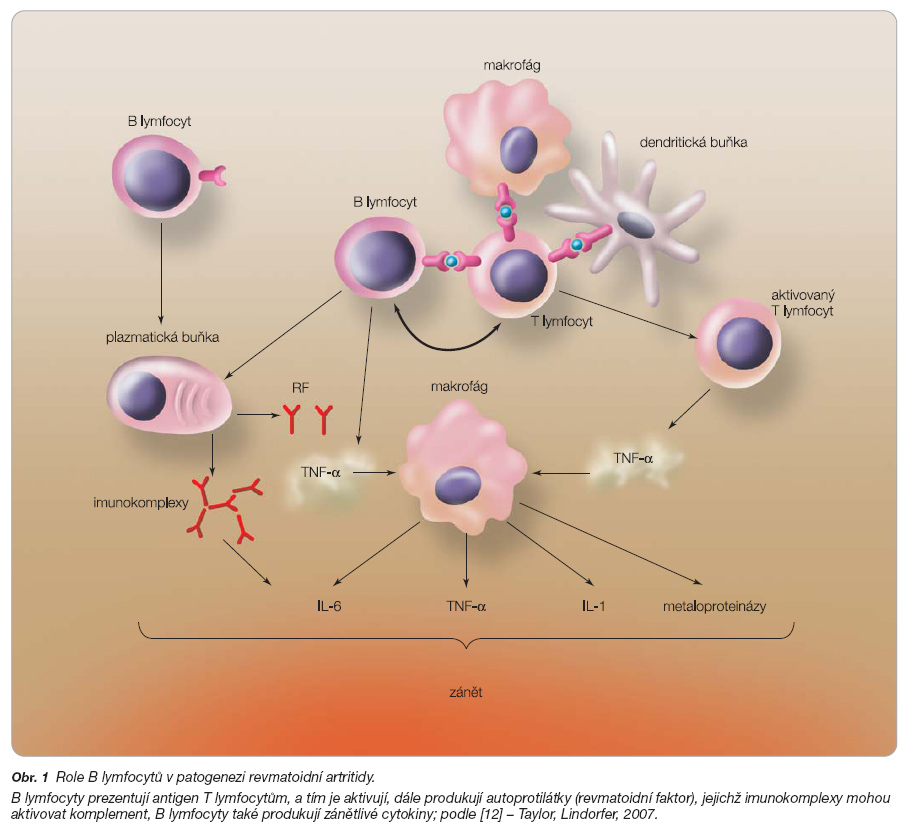
Naše znalosti o tom, že B lymfocyty hrají důležitou úlohu v patogenezi RA, se v posledních letech značně rozšířily (obr. 1). B buňky působí jednak jako antigen prezentující buňky, jednak poskytují důležitý kostimulační signál nutný pro klonální expanzi CD4+ T lymfocytů a jejich efektivní funkci [11]. B buňky v synoviální membráně také sekretují prozánětlivé cytokiny, jako je TNF-a a chemokiny. Revmatoidní synoviální membrána také obsahuje množství B buněk, které produkují revmatoidní faktor (RF) – protilátky proti Fc částem jiných protilátek. RF může vést k aktivaci Th buněk, které se zpětnou podporou B lymfocytů dále podílejí na produkci RF faktoru. Imunitní komplexy RF a protilátek mohou dohromady přispívat k aktivaci komplementu a tím k další propagaci zánětlivé reakce [12].
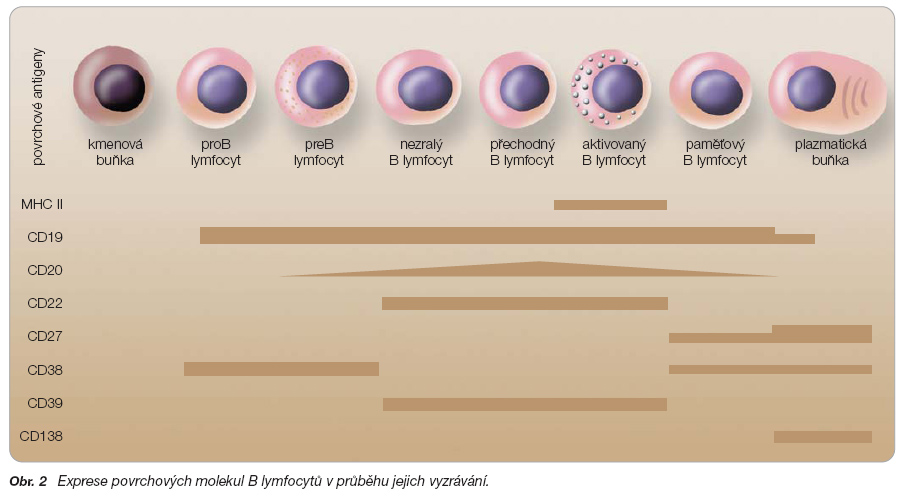
CD20 je téměř ideální cílovou terapeutickou strukturou. Jde o povrchový antigen, který je téměř výlučně a vysoce exprimován na B buňkách. CD20 je membránově vázaný fosfoprotein o molekulové hmotnosti 33–37 kDA. Nenachází se ve všech vývojových stadiích B buněk. Je přítomen na povrchu tzv. preB buněk a zralých B buněk (obr. 2). CD20 není přítomen na kmenových buňkách, dále na dendritických a plazmatických buňkách [13]. Tento fakt spolu s vysokou expresí na povrchu B lymfocytů činí antigen CD20 obzvláště atraktivním pro terapeutickou intervenci. Na jedné straně ani dlouhotrvající deplece B buněk nevedla k významnému poklesu produkce imunoglobulinů (protože plazmatické buňky přežívají), na druhé straně kmenové buňky zajistí po určité době (individuálně, ale převážně po 4–8 měsících) návrat periferních buněk.
Rituximab
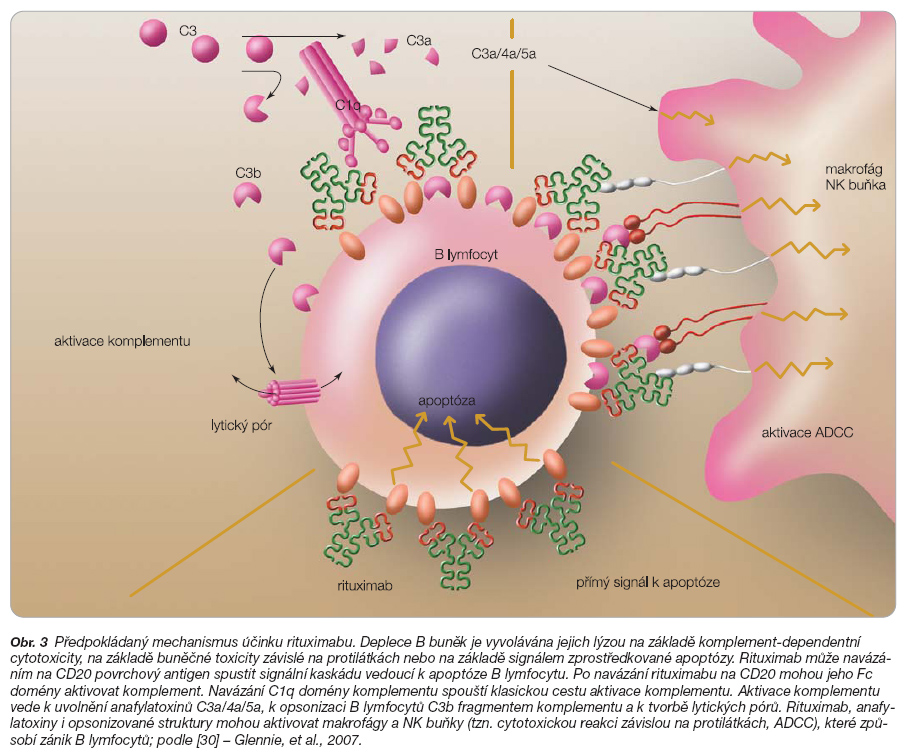
Rituximab je genetickým inženýrstvím připravená chimérická (část protilátky myší, část lidská) monoklonální protilátka proti antigenu CD20. Je složen z variabilních částí myších antihumánních protilátek CD20 B-buněčného hybridomu a lidské IgG1 konstantní oblasti. Deplece B buněk je vyvolávána jejich lýzou na základě komplement-dependentní cytotoxicity, na základě buněčné toxicity závislé na protilátkách nebo na základě signálem zprostředkované apoptózy (obr. 3) [14, 15, 30].
Rituximab v onkologické praxi
Rituximab byl první monoklonální protilátkou oficiálně schválenou pro léčbu onkologických onemocnění, konkrétně pro léčbu CD20+ B buněčných non-Hodgkinských lymfomů (NHL). V této indikaci je registrován v téměř 100 státech světa a počet léčených pacientů se blíží milionu. Pacienti dostávají 375 mg/m2 intravenózně týdně po dobu 4–8 týdnů. Rituximab efektivně snižuje množství B buněk v periferní krvi i v kostní dřeni po dobu 9–12 měsíců po aplikaci jedné léčebné série [16].
V onkologické praxi byly získány také zkušenosti s nežádoucími účinky při léčbě rituximabem. Většina nežádoucích účinků při léčbě rituximabem je asociována s aplikací rituximabu ve formě intravenózních infuzí [17]. Nejčastěji se vyskytují po první infuzi a dále jejich výskyt klesá. Vyskytují se během 30–120 minut a demonstrují se jako nauzea, zvracení, bolest hlavy, teplota či hypertenze. Jsou většinou mírné až střední intenzity. Řešením je zpomalení či zastavení infuze či aplikace léků. Výskyt těchto infuzních reakcí je nižší u autoimunitních než u onkologických onemocnění [18]. Velká databáze onkologických pacientů umožnila identifikaci několika vzácných závažných nežádoucích účinků a rizikových faktorů. Některé z nich byly specifické pro pacienty s lymfomem, např. tzv. syndrom lýzy tumoru. Další zřídka se vyskytující závažné nežádoucí účinky zahrnují fatální infuzní reakce, závažné slizničně-kožní reakce. Rizikovým faktorem pro reakci lýzy tumoru je vysoký počet cirkulujících maligních buněk (> 25 000/mm3). Byla již také analyzována celá řada pacientů, kteří byli léčeni dlouhodobě několika sériemi infuzí rituximabu, a žádný zvláštní bezpečnostní signál nebyl zaznamenán. Nevyskytovaly se žádné oportunní infekce ani tuberkulóza. Výskyt infekcí nebyl ani přes dlouhodobou depleci B buněk zvýšen [18].
Rituximab v léčbě revmatoidní artritidy
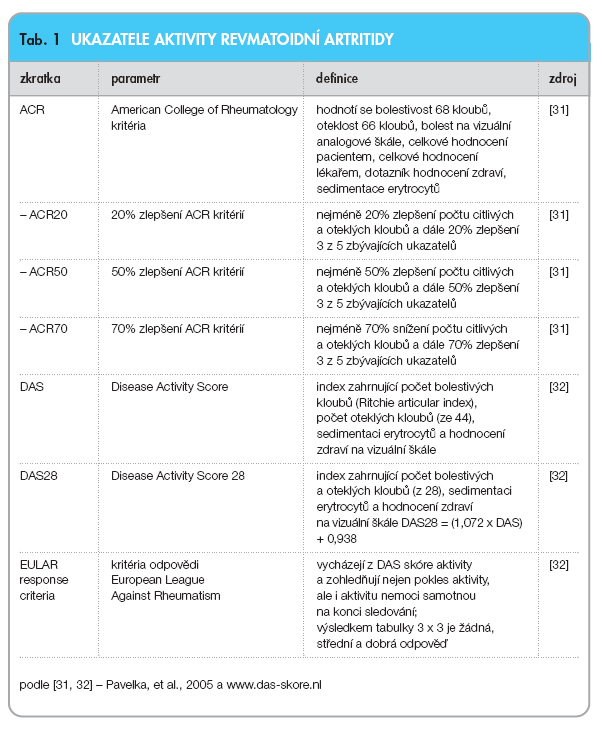
První zkušenosti s rituximabem u RA měly onkologický charakter a pocházely od pacientů s koexistencí revmatoidní artritidy a NHL. U těchto pacientů byla po aplikaci rituximabu pozorována remise revmatoidní artritidy [19]. Následovala malá exploratorní otevřená studie s 5 pacienty, kterou provedl Edwards ve Velké Británii [20]. Používal některé principy známé z léčby NHL. Pacienti dostávali 4 infuze (den 2, 8, 15, 22) rituximabu, cyklofosfamidu (750 mg, den 4 a 17), a dále vysoké dávky prednisolonu (60 mg s případným poklesem na 30 mg, den 1–22) perorálně. Všichni pacienti odpověděli na léčbu ve smyslu odpovědi ACR50 a tři z pěti pacientů měli dokonce ACR70 (tab. 1). Ačkoliv výsledky byly vysoce pozitivní, interpretace byla složitá, protože efekt mohl být přičítán efektu cyklofosfamidu nebo kortikosteroidů. Proto bylo nutné provést dvojitě slepou studii.
Do randomizované, kontrolované studie bylo zařazeno celkem 161 pacientů, kteří měli aktivní RA, pozitivní titr revmatoidního faktoru a byli refrakterní na předcházející léčbu včetně současně probíhající nedostatečně účinné léčby methotrexátem (MTX) [21]. Pacienti byli zařazeni do následujících skupin: a) monoterapie MTX, b) monoterapie rituximabem (1000 mg i.v., den 2 a 15), c) kombinace rituximab (1000 mg i.v., den 2 a 15) s cyklofosfamidem (2 x 750 mg), d) kombinace rituximab (2 x 1000 mg) a kontinuální MTX.
Pacienti dostávali také 17 dní kortikosteroidy p.o. (iniciálně 60 mg, celkový průměr 910 mg). Zásadními výsledky této studie fáze II bylo, že všechny režimy obsahující rituximab byly účinnější než monoterapie methotrexátem. Zároveň se ukázalo, že cyklofosfamid není esenciálně nutný a že kombinace rituximab + MTX je stejně účinná, při lepší toleranci. Tato studie také potvrdila očekávaný fakt, že došlo k hluboké depleci CD19 pozitivních B buněk. Přes tuto eliminaci B lymfocytů zůstávaly hladiny imunoglobulinů v mezích normy. Tolerance léčby rituximabem byla dobrá. Infuzní reakce se vyskytly v 36 % případů a většinou nevedly k přerušení léčby. Závažnější infuzní reakce se vyskytovaly v méně než 1 % a fatální reakce se nevyskytovaly vůbec. Výskyt běžných infekcí ve skupinách byl identický (29–31 %), závažné infekce se vyskytovaly ve skupinách s rituximabem ve 2,5 %, u MTX pak ve 3,3 %.
Další klíčovou studií fáze IIb byla studie DANCER [10]. Zásadní cíle studie byly dva: a) ověřit účinnost různých dávek rituximabu v léčbě RA, b) ověřit účinnost kortikosteroidů v průběhu léčebné série.
Do studie bylo zařazeno 465 pacientů se silně aktivní RA i přes léčbu DMARDs v minulosti, včetně podávání biologik. Všichni pacienti dostávali perorálně MTX (10–25 mg týdně). Design studie byl poměrně komplikovaný. V zásadě byli pacienti rozděleni do 3 skupin: rituximab 2 x 500 mg i.v. (den 1, 15), rituximab 2 x 1000 mg i.v. (den 1 a 15) a placebo i.v. (samotný MTX). Navíc byla každá z těchto skupin rozdělena na 3 části podle použití glukokortikoidů: buď bez glukokortikoidů, nebo pouze s i.v. premedikací před infuzí, anebo s premedikací kortikoidy i.v. a zároveň perorálními kortikosteroidy.
Signifikantně více pacientů, kteří obdrželi 2 x 500 mg nebo 2 x 1000 mg rituximabu v infuzi oproti placebu, docílilo odpovědi ACR20 (55 %, 54 % vs. 28 %, p < 0,001), přičemž nebyl rozdíl mezi oběma dávkami (graf 1).
V silnějším ukazateli ACR50 a ACR70 byl zřejmý trend pro vyšší účinnost dávky 1000 mg. Pokud se použil ukazatel DAS28, nastaly změny ve prospěch dávky 1000 mg (-1,79, -2,05 vs. -0,67, p < 0,0001). Perorální bolus kortikosteroidů neměl na výsledky ve 24. týdnu léčby žádný vliv. Naopak intravenózní kortikosteroidy podávané s infuzí se ukázaly jako výhodné, protože snižovaly výskyt infuzních reakcí. Závěry z této práce lze shrnout do několika bodů: 1. rituximab je účinný v léčbě RA v kombinaci s MTX; 2. dávka 1000 mg je účinnější v některých náročnějších kritériích než 500 mg; 3. 14denní perioda s perorálně podávanými kortikosteroidy není nutná.
Vedle účinnosti byla ve studii sledována též bezpečnost. Aktivní infuzní reakce byly zaznamenány u 31–38 % pacientů, kteří dostávali jednu z dávek rituximabu, a u 18 % pacientů po podávání placeba. Počet pacientů, u nichž byla zjištěna nežádoucí reakce na podání infuze, byl nižší při aplikaci 2. série infuzí. Infekce se vyskytly ve 28 % po podání placeba a v 35 % po podání rituximabu (v obou skupinách). Infekce se vyskytly v 1 % po podání placeba a ve 2 % po léčbě rituximabem. Ačkoliv B buňky byly efektivně odstraněny, hladiny IgG, IgA a IgM zůstaly nad dolním limitem normy.
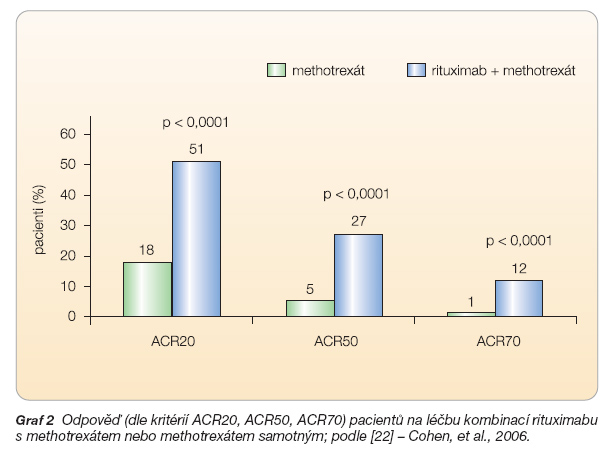
Účinnost rituximabu u pacientů, u kterých selhala léčba alespoň jedním biologickým lékem blokujícím prozánětlivý cytokin TNF-a, byla ověřena ve studii Reflex [22]. V této randomizované, dvojitě slepé, placebem kontrolované studii fáze III klinického zkoušení byli pacienti randomizováni do skupiny, která obdržela 2 infuze po 1000 mg rituximabu i.v. v den 1 a 15 a současně methotrexát, a do skupiny kontrolní, která dostávala pouze methotrexát. Všichni pacienti dále dostávali methylprednisolon (100 mg i.v. před infuzí) a dále perorálně prednison (60 mg den 2–7 a 30 mg den 8–14). Do studie bylo zařazeno celkem 311 pacientů do skupiny s rituximabem a 209 pacientů do skupiny s placebem. Primárním cílem byla odpověď podle ACR20 v týdnu 24. Na konci studie došlo k signifikantnímu zvýšení procenta pacientů s odpovědí ACR20 ve skupině rituximabu oproti placebu (51 % vs. 18 %). Rozdíl byl patrný i v silnější odpovědi ACR50 (27 % vs. 5 %) a v ACR70 (12 % vs. 1 %), a dále v odpovědi dle EULAR (DAS; 65 % vs. 22 %), graf 2.
Kromě toho byly zlepšeny signifikantně i ukazatele kvality života (SF-36, HAQ) a ukazatele únavnosti (FACIT). Dále byla hodnocena rentgenová progrese RA pomocí modifikovaného Sharpova skóre, které ukázalo signifikantní zpomalení progrese po léčbě rituximabem [23]. Léčba byla účinná u pacientů s pozitivním i negativním revmatoidním faktorem. Léčba byla spojena s rychlou a kompletní deplecí CD 19 pozitivních B buněk, přičemž návrat B buněk do periferie nastával mezi 16.–20. týdnem. U pacientů léčených rituximabem docházelo k poklesu RF (55 %). Přes selektivní B depleci zůstávaly průměrné hladiny imunoglobulinů v normě, IgM hladiny byly v rituximabové skupině sníženy u 5,5 % pacientů, hladiny IgG a IgM vykazovaly snížení v méně než 1 %. Bezpečnost léčby rituximabem v této studii byla dobrá. Infuzní reakce (v průběhu 24 hodin od podání) byly častější po aplikaci rituximabu než po podání placeba (2,3 % vs. 18 %). Většina z těchto reakcí byla mírné či lehké intenzity, závažnější reakce (považované za „závažné nežádoucí účinky" dle definice) se vyskytly ve dvou případech. Výskyt infuzních reakcí se snižoval v průběhu dalších infuzí. Infekce byly o něco častější po léčbě rituximabem než u placeba (samotný MTX), a to 41 % vs. 38 %. Frekvence závažných infekcí byla o málo vyšší ve skupině pacientů léčených rituximabem (5,2 případů na 100 pacientoroků) než ve skupině pacientů užívajících placebo (3,7 na 100 pacientoroků). Nevyskytly se žádné případy oportunních infekcí ani tuberkulózy.
Dlouhodobá účinnost a bezpečnost léčby rituximabem byla zkoušena v otevřených extenzích studií fáze II a III [24, 25]. Nejprve byla ověřena účinnost druhé infuzní série, která ukázala dokonce lepší efekt opakování léčby (72 % vs. 65 %) v odpovědi dle ACR. V letošním roce byly prezentovány již výsledky s pacienty, kteří absolvovali 7 infuzních sérií [25]. Účinek podaných infuzí zůstává na stejné úrovni, výskyt infuzních reakcí se snižuje. Otázkou zůstává, kdy se má nová série 2 infuzí aplikovat. Nemělo by to být dříve než ve 24. týdnu. Většina dosavadních prací ukazuje, že k opakované léčbě dochází ve 32.–35. týdnu, s poměrně širokým rozptylem. Indikací k nové léčbě je vzrůst klinické aktivity. Bylo sice prokázáno, že riziko vzplanutí je 2krát vyšší u pacientů, u kterých došlo k návratu B buněk do původních hodnot, ale zatím se nedoporučuje stav periferních buněk nutně monitorovat a toto používat jako rozhodovací kritérium pro opakování léčby [26].
Zajímavý příspěvek do diskuse o délce klinického efektu 1 série (2 infuze) rituximabu přinesli švýcarští autoři na základě analýzy švýcarského národního registru. Medián času do nutnosti započít léčbu 2. sérií byl 12,7 měsíců a po druhém cyklu 12,6 měsíců. Predikujícím faktorem pro délku odpovědi byla aktivita RA před zahájením léčby. Autoři upozorňují na fakt, že není účelné čekat s aplikací 2. cyklu do doby, než aktivita RA dosáhne úrovně před aplikací 1. cyklu rituximabu [27].
Důkaz o tom, že léčba rituximabem u pacientů s RA, u nichž selhala léčba lékem blokujícím TNF-a v běžné klinické praxi, může být účinnější než volba jiné anti TNF látky, přinesla kohortová studie ze švýcarského registru biologické léčby [28]. Pacienti se selháním biologické léčby blokující TNF byli v otevřené studii randomizováni k léčbě rituximabem nebo k léčbě jiným léčivem blokujícím TNF-a. Vývoj DAS byl příznivější ve skupině léčené rituximabem než ve skupině léčené druhým anti TNF léčivem, když po 6 měsících byl pokles DAS28 ve skupině s rituximabem -1,61 (95 % CI: -1,97 až -1,25) a ve skupině s dalším anti TNF léčivem -0,98 (95% CI: -1,33 – -0,62; p = 0,08).
Mezinárodní konsenzus o léčbě rituximabem
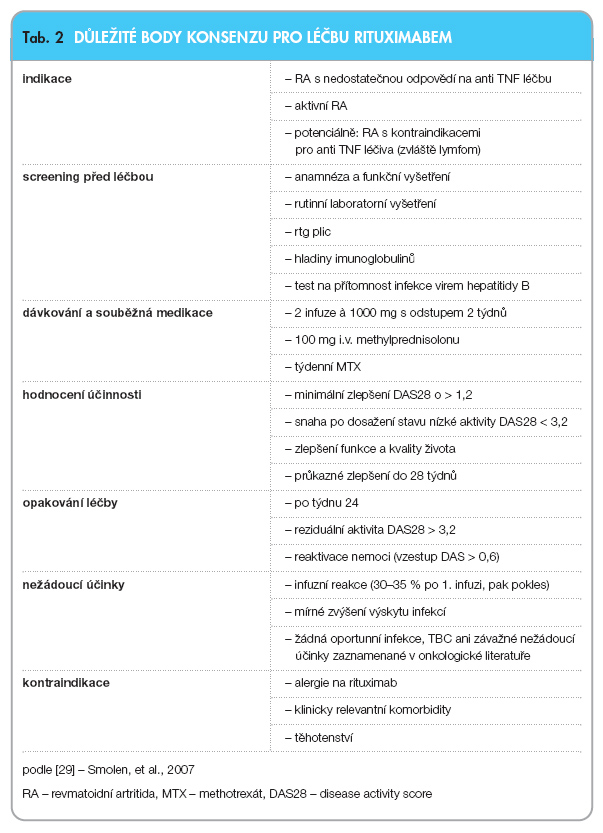
Skupina vedoucích akademických revmatologů nedávno publikovala Konsenzus o léčbě rituximabem u RA (tab. 2) [29].
Indikace
Indikací k léčbě je dle licence EU pacient, který je silně aktivní, aby splňoval indikační kritéria pro biologickou léčbu, který je současně léčen methotrexátem a u něhož v minulosti selhala anti TNF léčba. (Pozn. autora: Podle českých doporučení musí být aktivita vyšší než 5,1).
Screening
Screening před léčbou zahrnuje pečlivou anamnézu a rentgen plic, rutinní biochemické vyšetření včetně zjištění výše hladiny imunoglobulinů a vyloučení přítomnosti infekce virem hepatitidy B.
Vlastní léčba
Aplikují se dvě infuze rituximabu v dávce 1000 mg v intervalu 2 týdnů. Před infuzí se podává 100 mg i.v. methylprednisolonu. Methotrexát je aplikován první týden léčby.
Hodnocení odpovědi
Odpověď na léčbu je vyhodnocována podle DAS28 do dokončeného 16. týdne po léčbě.
Indikace k opakování léčby
Opakovaná léčba je indikována u pacientů, kteří měli v první sérii odpověď (pokles DAS28 > 1,2). Indikací opakování léčby rituximabem je dále reziduální vysoká/střední aktivita RA a reaktivace RA z nízké na vyšší aktivitu (DAS28 > 0,6).
Monitorování bezpečnosti
Monitorování bezpečnosti léčby rituximabem je obdobné jako u ostatních DMARDs/biologik. Navíc se doporučuje provádět vyšetření hladiny imunoglobulinů, a to v tříměsíčních intervalech. Monitorování B buněk není rutinně nutné.
Protože rituximab je chimérická monoklonální protilátka, byl popsán výskyt antichimérických protilátek (HACA), a to v 9,2 %. Ačkoliv jsou alergické nežádoucí příhody ve vztahu k HACA protilátkám vzácné, byl popsán případ závažné alergické reakce u pacienta, kde HACA protilátky evidentně bránily depleci B buněk.
V onkologické literatuře byla popsána pozdní neutrocytopenie až u 8 % pacientů v rámci kombinované léčby. Proto se doporučuje monitorování krevního obrazu.
Zatím nebyly získány žádné bezpečnostní signály týkající se malignit po léčbě rituximabem, ale je nutné získat další data z registrů biologické léčby.
Závěr
Rituximab, chimérická monoklonální protilátka proti CD20 pozitivním B lymfocytům, představuje nový terapeutický princip u RA. Je zatím indikován v kombinaci s methotrexátem u nemocných, kde selhala léčba minimálně jedním anti TNF léčivem (infliximabem, adalimumabem, etanerceptem). Jako ostatní biologika ani rituximab nevyléčí RA; po ukončení léčby rituximabem nastává u většiny nemocných relaps, který vyžaduje aplikaci další série. Přesný časový režim pro dlouhodobou léčbu zatím vypracován nebyl. Většina studií ukazuje medián doby do nutnosti aplikace rituximabu kolem 9 měsíců. Kromě klinické účinnosti byla potvrzena i účinnost rituximabu ve zpomalení rentgenové progrese RA a zlepšení kvality života. Otevřená kohortová studie naznačuje i větší účinnost změny léčby (switch) na rituximab než na druhé anti TNF léčivo v případě selhání první anti TNF terapie. Diskutována je výhodná farmakoekonomika léčby rituximabem.
Seznam použité literatury
- [1] Maini RN, Breedweld FC, Kalden JR, et al. Therapeutic efficacy of multiple intravenous infusions of anti-tumor necrosis factor alpha mono-clonal antibody combined with low-dose weekly methotrexate in rheumatoid arthritis. Arthritis Rheum 1998; 41: 1552–1563.
- [2] Weinblatt ME, Kremer JM, Bankhurst AD, et al. A trial of etanercept, a recombinant tumor necrosis factor receptor: Fc fusion protein, in patients with rheumatoid arthritis receiving metho-trexate. New Engl J Med 1999; 340: 253–259.
- [3] Weinblatt ME, Keystone EC, Furst D, et al. Adalimumab, a fully human anti-tumor necrosis factor monoclonal antibody, for the treatment of rheumatoid arthritis in patients taking concomitant methotrexate. The ARMADA trial. Arthritis Rheum 2003; 48: 33–45.
- [4] Lipsky PF, van der Heide, St. Clain EW, et al. Infliximab and methotrexate in the treatment of rheumatoid arthritis. Anti-Tumor Necrosis Factor Trial in RA with concomitant Therapy Study Group. N Engl J Med 2000; 343: 1594–1602.
- [5] Moreland LW, Schiff MH, Baumgartner SW, et al. Etanercept therapy in rheumatoid arthritis: a randomized, controlled trial. Ann Intern Med 1999; 130: 478–486.
- [6] Breedveld FC, Weisman MH, Kavanaugh AF, et al. The PREMIER Study. Arthritis Rheum 2006; 54: 26–37.
- [7] Breshniham B, Alvaro G, Cobby M, et al. Treatment of rheumatoid arthritis with recombinant human interleukin-1 receptor antagonist. Arthritis Rheum 1998; 12: 2196–2204.
- [8] Maini RN, Taylor PC, Schechinski J, et al. Double-blind, randomized controlled clinical trial of the interleukin-6 receptor antagonist, tocilizumab, in European patients with rheumatoid arthritis who had an incomplete response to methotrexate. Arthritis Rheum 2006; 54: 2817–2829.
- [9] Genovese MC, Becker JC, Schiff M, et al. Abatacept for rheumatoid arthritis refractory to tumor necrosis factor Ī inhibition. New Engl J Med 2005; 353: 1114–1123.
- [10] Emery P, Fleischmann R, Sosnowska A, et al. The efficacy and safety of rituximab in patients with active rheumatoid arthritis despite methotrexate treatment. Arthritis Rheum 2006; 54: 1390–1400.
- [11] Gause A, Bereck C. The role of B cells in the pathogenesis of rheumatoid arthritis. Potential implications for treatment. Bio Drugs 2001; 15: 73–79.
- [12] Taylor R, Lindorfer MA. Drug insight: the mechanism of action of rituximab in autoimmune disease – the immune complex decoy hypothesis. Nature Clin Pract Rheumatol 2007; 3: 86–95.
- [13] Keystone EC. B cells in rheumatoid arthritis: from hypothesis to the clinic. Rheumatology 2005; 44 (Suppl. 2): ii8–ii12.
- [14] Demidem A, Lam T, Alas S, et al. Chimeric anti CD 20 monoclonal antibody sensitises a B cell lymphome cell line to cell killing by cytotoxic drugs. Cancer Biother Radiopharm 1997; 12: 177–186.
- [15] Reff ME, Carner K, Chambers KS, et al. Depletion of B cells in vivo by a chimeric mouse human monoclonal antibody to CD 20. Blood 1994; 83: 435–445.
- [16] Leget GA, Czuczman MS. Use of rituximab, the new FDA – approved antibody. Curr Opin Oncol 1998; 10: 548–551.
- [17] Mc Langhlim P, Hagemeister FB, Grilo-Lopez AJ. Rituximab in indolent lymphome: the single agent pivotal trial. Semin Oncol 1999; 26: 79–87.
- [18] Shaw T, Quan J, Totoritis MC. B cell therapy for rheumatoid arthritis: the rituximab (anti CD 20) experience. Ann Rheum Dis 2003; 62 (Suppl. III.): ii55–ii59.
- [19] Protheroe A, Edwards JCW, Simmons A, et al. Remission of inflammatory arthropathy in association with anti CD 20 therapy for non-Hodgkin“s lymphoma. Rheumatology (Oxford) 1999; 38: 1150–1152.
- [20] Edwards JCW, Cambridge G. Sustained improvement in rheumatoid arthritis following a protocol designed to deplate B lymphocytes. Rheumatology (Oxford) 2001; 40: 205–211.
- [21] Edwards JCW, Szczepanski L, Szechinski J, et al. Efficacy of B-cell targeted therapy with rituximab in patients with rheumatoid arthritis. N Engl J Med 2004; 350: 2572–2581.
- [22] Cohen SB, Emery P, Greenwald MV, et al. Rituximab for rheumatoid arthritis refractory to anti-tumor necrosis factor therapy. Arthritis Rheum 2006; 54: 2793–2806.
- [23] Keystone E, Emery P, Peterfy CD, et al. Prevention of joint structural demage at 1 year with rheumatoid arthritis patients with inadequate response to one or more TNF inhibitors (Reflex study). Ann Rheum Dis 2006; 65: 58.
- [24] Pavelka K, Emery P, Filipowicz – Sosnowska A, et al. Efficacy and safety following repeated coarses of rituximab in patients with active rheumatoid arthritis. Ann Rheum Dis 2005; 64 (S3): 435.
- [25] van Vollenhoven R, Emery P, Binghem C, et al. Long-term safety data from extended follow up and repeat use of rituximab in rheumatoid arthritis. Ann Rheum Dis 2007; 66: (S88), Abstract EULAR 2007.
- [26] Emery P, Breedveld F, Martin-Mola M, et al. Relationship between peripheral B cell and loss of EULAR response in rheumatoid arthritis patients treated with rituximab. Ann Rheum Dis 2007; 66: (S124), Abstract EULAR 2007.
- [27] Finckh A, Ciurea A, Kyburz D. Rituximab in rheumatoid arthritis: duration of treatment response and predictors of retreatment in a population based-cohort. Ann Rheum Dis 2007; 66 (Suppl. 11): S123.
- [28] Finckh A, Ciurea A, Brulhart L, et al. B cell depletion may be more effective then switching to an alternative anti-tumor factor agent in rheumatoid arthritis patients with inadequate response to anti-tumor necrosis factor agents. Arthritis Rheum 2007; 56: 1417–1423.
- [29] Smolen J, Keystone EC, Emery P, et al. Consensus statement on the use of rituximab in patients with rheumatoid arthritis. Ann Rheum Dis 2007; 66: 143–150.
- [30] Glennie MJ, French RR, Cragg MS, Taylor RP. Mechanisms of killing by anti-CD20 monoclonal antibodies. Mol Immunol 2007; 44: 3823–3837.
- [31] Pavelka K, et al. Farmakoterapie revmatických onemocnění. Praha, Grada Publishing 2005.
- [32] DAS skóre [on-line] www.das-skore.nl, navštíveno 14. 9. 2007.